Способ получения днк-чипов
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и биоорганической химии и может быть использовано для создания ДНК-чипов. Для изготовления ДНК-чипа модифицируют поверхность полимера, содержащего электрофильные группы, соединением формулы H2N-X-Si(OR)3, где Х - пропил, R - этил, в газовой фазе, и раствором соединения формулы Y-X-Si(OR)3, где Y - функциональная группа, Х - пропил, R - этил или метил. Затем на модифицированную поверхность полимера ковалентно иммобилизуют олигонуклеотид. Применение изобретения позволяет снизить стоимость и повысить эффективность модификации подложки при производстве ДНК-чипов. 10 з.п. ф-лы, 10 ил., 2 табл.
Реферат
Область техники
Изобретение относится к области молекулярной биологии и биоорганической химии, а точнее, к способу ковалентной иммобилизации олигонуклеотидов на поверхности полимерных материалов, содержащих этерифицированные карбоксильные группы, и его применению для создания ДНК-чипов.
Уровень техники
В этой области известно большое число технических решений, однако в своей массе они направлены на решение задач по изготовлению дорогостоящих чипов с большим количеством детектируемых зон. В настоящее время существует большой интерес к созданию дешевых чипов для массовых диагностических процедур в медицинских целях, анализа пищи и воды на содержание токсинов, патогенных микроорганизмов и т.д.
Для решения этой задачи, в первую очередь, необходимо выбрать материал для изготовления чипа. В качестве твердой подложки могут быть использованы стекло, кремний, золото, мембранные фильтры, гидрогели на основе полиакриламида и т.д. Однако недостатками этих материалов является их высокая стоимость, а также технические трудности, возникающие при изготовлении подложки сложной геометрической формы, например, имеющей лунки, в которых иммобилизованы олигонуклеотиды (подобные конструкции крайне удобны, в частности, в клинических анализах для размещения на одном микрочипе нескольких образцов разных анализируемых жидкостей). Этих недостатков лишены подложки из пластмасс, легко подвергающихся термоформовке и производимых в больших объемах. Для обеспечения прочного (желательно, ковалентного) взаимодействия олигонуклеотидов с поверхностью при изготовлении подложки удобно использовать полимеры, содержащие активные функциональные группы. Данное изобретение направлено на создание более совершенных и дешевых способов иммобилизации олигонуклеотидов на поверхности полимерных подложек, в частности содержащих этерифицированные карбоксильные группы.
Известен способ модификации сложноэфирных групп на поверхности полимера, который заключается в их аминолизе под действием полиаминов [1-2], например, гексаметилендиамина [3], или моноаниона гексаметилендиамина [4]. На полученной таким образом аминированной поверхности проводят иммобилизацию зонда в присутствии подходящих кросс-линкеров или конденсирующих агентов.
Главным недостатком этого подхода является низкая плотность функциональных групп на поверхности подложки, что отмечают сами авторы и что может приводить к низкой чувствительности анализа. Это подтверждено экспериментально: анализ, проведенный на подложке, изготовленной методом [3] (см. фиг.3), показывает более низкую интенсивность сигнала по сравнению с подложками, изготовленными предлагаемым методом (фиг.3-10).
Хорошо известна модификация поверхности действием различных триалкоксисиланов [5] или их производных [6], применение которых позволяет получить требуемую плотность функциональных групп на поверхности подложки. Однако ковалентная модификация с их помощью описана только для стекла, являющегося дорогим и нетехнологичным материалом для изготовления подложек, для других материалов (в том числе, для полимеров) описана только нековалентная (протекающая за счет сорбционных процессов) модификация, о недостатках которой будет сказано ниже.
В некоторых случаях покрытие стеклянной подложки силанами осуществляют в газовой фазе [7]. Однако чтобы удалить воду с гидрофильной стеклянной поверхности, мешающей реакции силанов с гидроксильными группами стекла, авторы ввели стадию дегидратации, проводимую при высокой температуре в условиях вакуума, что сильно усложняет и удорожает процесс покрытия. Очевидно, что этого недостатка лишены гидрофобные полимерные подложки. Кроме того, для получения развитой модифицированной поверхности желательна поликонденсация силановых фрагментов, что требует проведения хотя бы одной из стадий модификации в растворе, содержащем некоторое количество воды.
Наиболее близким к заявляемому изобретению является изобретение [8], в котором описан способ модификации поверхности полимера действием золь-геля, получаемого при гидролизе несущего нужную функциональную группу триалкоксисилана совместно с тетраалкоксисиланом. Присутствие тетраалкоксисилана обеспечивает образование частиц золь-геля большого размера, способных с определенной эффективностью сорбироваться на подложке. Таким образом, модификация поверхности в этом случае реализуется за счет непрочных нековалентных взаимодействий, что не позволяет применять отмывки в жестких условиях (растворы высокой ионной силы, растворы поверхностно-активных веществ при повышенной температуре), которые часто бывают необходимы при проведении гибридизационного анализа, а также в случае применения такого перспективного метода анализа как m situ PCR, требующего нагревания подложки до 95°С. Применение способа [8] ограничивается также высокой стоимостью и низкой гидролитической устойчивостью тетраалкоксисиланов. Кроме того, нежелательным является предлагаемое в этом изобретении нанесение на поверхность подложки полимера, содержащего альдегидные группы: эта стадия является трудоемкой и дорогостоящей, и ее исключение из технологии, как показано, позволяет получать удовлетворительные результаты при снижении производственных затрат.
Целью настоящего изобретения является снижение стоимости и повышение эффективности модификации поверхности подложки для ее использования в производстве ДНК-чипов за счет применения двухстадийной обработки поверхности чипов и использования недорогих реактивов. Проведенный поиск показал, что в источниках информации отсутствуют технические решения, связанные со всей совокупностью отличительных признаков, изложенных в изобретении.
Краткое описание чертежей
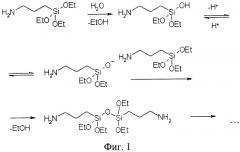
На фиг.1 представлена схема гидролиза триалкоксисиланов на примере аминопропилтриэтоксисилана.
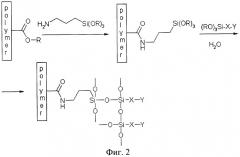
На фиг.2 представлена схема процессов, протекающих на первой и второй стадиях модификации.
На фиг.3 представлены результаты иммобилизации методом, описанным [3]. На фиг.4-10 представлены результаты иммобилизации описываемым методом. Условия приведены в примерах.
Раскрытие изобретения
Указанная техническая задача реализуется новым способом получения ДНК-чипов, который был разработан в процессе исследования разных способов модификации поверхности полимеров. Способ основан на неочевидном решении проведения модификации поверхности полимера посредством двухстадийной обработки, причем одна из стадий осуществляется в газовой фазе. Это позволило снизить вероятность отслаивания модифицирующего слоя от поверхности чипа и увеличить количество иммобилизированных олигонуклеотидов на поверхности чипа. Причем на первой стадии обработки поверхности чипа проводят аминолиз поверхностных сложноэфирных групп полимера, для чего подложку обрабатывают в газовой фазе соединением формулы H2N-X-Si(OR)3, где Х - алкильный, арильный или алкиларильный мостик, R - алкил или арил. На второй стадии модификации поверхности проводят поликонденсацию силановых фрагментов на модифицированной на первом этапе поверхности подложки. С этой целью подложку обрабатывают соединением формулы Y-X-Si(OR)3, где Y - требуемая функциональная группа, в растворе, содержащем не менее 1% воды, Х - алкильный, арильный или алкиларильный мостик, R - алкил или арил.
Осуществление изобретения
Способ получения ДНК-чипов, включает этап выбора типа подложки чипа из полимеров, содержащих электрофильные фрагменты (сложноэфирные группы, галогеналкановые фрагменты). В качестве подложки для ДНК-чипов используют полимеры, входящие в группу, состоящую из полиметилметакрилата, полибутилметакрилата, поливинилхлорида, поликарбоната, сополимеров метилметакрилата, и/или сополимеры бутилметакрилата с другими мономерами, такими как стирол, акрилонитрил.
Модификацию поверхности чипа осуществляют в две стадии. На первой стадии формируют ковалентно удерживаемый слой аминосилана за счет протекания аминолиза электрофильных фрагментов в составе полимера, чем обеспечивается прочное ковалентное связывание модифицирующего слоя с поверхностью. В качестве аминосиланов используют аминопропилтриэтоксисилан и/или аминопропилтриметоксисилан.
На второй стадии формируют большое количество функциональных групп, необходимых для иммобилизации фрагментов нуклеиновых кислот, путем проведения совместной поликонденсации соответствующего силана с триалкоксисилановыми фрагментами на поверхности, полученной на первой стадии.
На заключительном этапе формирования чипа выбирают способ нанесения и иммобилизации олигонуклеотидов на модифицированную поверхность подложки и проводят иммобилизацию.
На первой стадии модификации на поверхности полимера формируется достаточное количество триалкоксисилановых групп за счет реакции электрофильных фрагментов в составе полимера с аминогруппами силанов. Такими электрофильными фрагментами могут являться сложные эфиры карбоновых и угольной кислот или галогеналкановые фрагменты.
В качестве полимера, помимо полиметилметакрилата (ПММА), допустимо использование также поливинилхлорида, поликарбоната, полибутилметакрилата, сополимеров метилметакрилата и/или сополимеров бутилметакрилата с другими мономерами, такими как стирол, акрилонитрил. Помимо доступных аминопропилтриэтоксисилана и аминопрбпилтриметоксисилана, в качестве модифицирующего реагента можно использовать любые силаны формулы Н2N-Х-Si(OR)3, где Х - алкильный, арильный или алкиларильный мостик, R - алкил или арил. На фиг.2 представлена схема процесса модификации.
В ходе первой стадии модификации присутствие воды нежелательно (это приводит к посадке на поверхность олигомерных силанов и снижению эффективности второй стадии модификации), поэтому первая стадия проводится в газовой фазе, т.е. полимерная подложка обрабатывается парами, например, аминопропилтриалкоксисилана при повышенной температуре в герметичной камере. В некоторых случаях для повышения плотности паров сисиланов и снижения количества воды в реакторе процесс целесообразно проводить при пониженном давлении (до 1 мм рт. ст.), однако при отсутствии возможностей для вакуумирования реактора возможно проведение процесса при атмосферном давлении (760 мм рт. ст.) Процесс покрытия поверхности чипа парами силана может происходить при температуре от 20 до 110°С. Время обработки может составлять от 10 до 120 минут. Следует отметить, что после завершения первого этапа модификации возможность гидролиза триалкоксисилановых фрагментов на поверхности подложки непринципиальна и не оказывает существенного влияния на вторую стадию. Это обстоятельство позволяет изготавливать модифицированные по первому этапу подложки в больших количествах и хранить их длительное время. Следует отметить, что в случае протекания полного гидролиза алкоксисилановых фрагментов поверхность подложки становится близкой по химическим свойствам к поверхности стекла.
На второй стадии модификации на подложку действуют раствором соединения формулы Y-X-Si(OR)3, где Х - алкильный, арильный или алкиларильный мостик, R - алкил или арил Y - требуемая функциональная группа, в подходящем растворителе. В качестве модифицирующих агентов могут применяться триалкоксисиланы, содержащие функциональную группу, необходимую для дальнейшей иммобилизации биомолекул, например, эпокси-, меркапто-, амино-, акрилоил- и др. Соответственно, подходящими модифицирующими агентами на второй стадии могут быть 3-(глицидилокси)пропилтриэтоксисилан, 3-(глицидилокси)пропилтриметоксисилан, 3-меркаптопропилтриэтоксисилан, 3-меркаптопропилтриметоксисилан, 3-аминопропилтриэтоксисилан, 3-аминопропилтриметоксисилан, 3-(акрилоилокси)пропилтриэтоксисилан, 3-(акрилоилокси)пропилтриметоксисилан. В качестве растворителя можно использовать этанол, метанол, пропанол, воду или их смеси. Присутствие в растворе воды (не менее 0.1% по объему) необходимо для эффективного протекания второй стадии модификации. В ходе процесса вода вызывает гидролиз алкоксигрупп силанов, находящихся в растворе и на поверхности подложки, которые затем подвергаются самопроизвольной поликонденсации. В результате с поверхностью подложки силоксановыми мостиками оказываются связанными большое число молекул силана, несущие требуемые функциональные группы. Концентрация модифицирующего агента может варьировать в пределах от 3 до 20% по объему. Температура проведения второй стадии - комнатная, однако в некоторых случаях (например, для очень быстрого проведения модификации) может быть повышена и составлять от 15 до 50°С. Длительность второй стадии модификации - от 20 до 120 минут. На фиг.2 представлена схема процесса.
Выбор функциональной группы, которой модифицирован наносимый олигонуклеотид, и условия иммобилизации ведут стандартными, широко известными методами, учитывая природу функциональных групп на подложке [9]. Олигонуклеотиды, модифицированные по 5' или 3'-концу соответствующей функциональной группой, выбирают из группы состоящей из фосфато-, карбокси-, амино-, гидрокси-, тио-, гидразо-, гидразино-, аминоокси-. Концентрацию олигонуклеотидов выбирают в пределах от 0.5 до 100 мкмоль/л. Например, если подложка модифицирована эпокси-группами, то для иммобилизации используют раствор амино-модифицированного олигонуклеотида в концентрации от 1 до 20 мкМ, содержащий от 10 до 100 мМ NaOH, время реакции от 3 до 4 часов при температуре от 35 до 60°С
При необходимости (например, для иммобилизации олигонуклеотида, модифицированного фосфатом, на аминированную подложку) возможно применение конденсирующих агентов, входящих в группу, состоящую из гидрохлорида диметиламинопропилэтилкарбодиимида, карбонилдиимидазола, мезитиленсульфонилтетразола, мезитиленсульфонилнитротриазола, триизопропилфенилтетразола, триизопропилфенилнитротриазола в концентрации от 0.1 до 100 мМ. Также возможно использование бифункциональных кросс-линкеров, входящих в группу, состоящую из дитиобис(сукцинимидилпропионата), дисукцинимидилсуберата, дисукцинимидилтартрата, бис [(2-(сукцинимидооксикарбонилокси)этил]сульфоната, этиленгликольбис(сукцинимидилсукцината), дисукцинимидилглутарата, дисукцинимидилкарбоната, гидрохлорида диметиладипимидата, гидрохлорида диметилпимелимидата, диметил-3,3'-дитиобис(пропионимидата), 1,4-бис[3'-(2'-пиридилдитио)-пропионамидо] бутана, бисмалеимидогексана, гидрохлорида гидразида 4-(4-N-малеимидо-фенил)-бутановой кислоты, 1,5-дифтор-2,4 динитробензола, диглицидилового эфира 1,4-бутандиола, карбогидразида, дигидразида адипиновой кислоты, N-сукцинимидил-3-(2-пиридилдитио)-пропионата, сукцинимидил-4-(N-малеимидометил)- циклогексан-1-карбоксилата, N-м-малеимидобензоил-N-гидроксисукцинимида, дигидрохлорида диметилсуберимидата, сукцинимидил-(4-иодоацетил)-аминобензоата, сукцинимидил-4-(п-малеимидофенил)-бутирата, сукцинимидил-6-[(иодоацетил)амино]-гексаноата, сукцинимидил-4-[(иодоацетиламино)-метил]-циклогексан-1-карбоксилата, п-нитрофенилиодоацетата.
Примеры, подтверждающие возможность осуществления изобретения
Для проведения экспериментов использовались образцы литого полиметилметакрилата ("Дзержинское Оргстекло", Россия) и поликарбоната ("Казаньоргсинтез", Россия).
Примеры 1-3. Проведение первого этапа модификации ПММА при атмосферном давлении.
Образец ПММА помещали в камеру объемом 100 см3, на дне которой находилось 0.5 мл 3-аминопропилтриэтоксисилана. Условия (температура и время проведения процесса) приведены в таблице 1. После остывания образец отмывали этанолом 2 раза по 5 минут, высушивали на воздухе и использовали для проведения второй стадии модификации.
| Таблица 1.Примеры условий проведения первого этапа модификации ПММА при атмосферном давлении. | ||
| Пример | Температура °С | Время, мин |
| 1 | 70 | 90 |
| 2 | 90 | 40 |
| 3 | 110 | 20 |
Примеры 4-6. Проведение первого этапа модификации ПММА при пониженном давлении.
Образец ПММА помещали в герметичную камеру, на дне которой находилось 0.5 мл 3-аминопропилтриэтоксисилана. Из камеры при помощи водоструйного насоса откачивали воздух (р=20 мм рт.ст.). Условия (температура и время проведения процесса) приведены в таблице 2. После остывания образец отмывали этанолом 2 раза по 5 минут, высушивали на воздухе и использовали для проведения второй стадии модификации.
| Таблица 2.Примеры условий проведения первого этапа модификации ПММА в вакууме. | ||
| Пример | Температура °С | Время, мин |
| 4 | 50 | 60 |
| 5 | 70 | 30 |
| 6 | 90 | 10 |
Пример 7. Проведение первого этапа модификации поверхности поликарбоната.
Образец поликарбоната ("Казаньоргсинтез", Россия) помещали в камеру объемом 100 см3, на дне которой находилось 0.5 мл 3-аминопропилтриэтоксисилана, и выдерживали при 80°С в течение 30 минут. После остывания образец отмывали этанолом 2 раза по 5 минут, высушивали на воздухе и использовали для проведения второй стадии модификации согласно примеру 8.
Пример 8. Проведение второго этапа модификации полимеров: получение эпокси-модифицированной поверхности полиметилметакрилата или поликарбоната.
Образец полимера после проведения первой стадии модификации (согласно примерам 1-7) помещали в 10%-ный раствор 3-(глицидилокси)-пропилтриэтоксисилана в метаноле, содержащем 5% воды, и выдерживали при 20°С 2 часа, отмывали дистиллированной водой и использовали для нанесения олигонуклеотидов.
Пример 9. Проведение второго этапа модификации ПММА: получение меркапто-модифицированной поверхности полиметилметакрилата.
Образец полимера после проведения первой стадии модификации (согласно примерам 1-6) помещали в 20%-ный раствор 3-меркаптопропилтриэтоксисилана в 96%-этаноле, выдерживали при 20°С 2 часа, отмывали дистиллированной водой и использовали для нанесения олигонуклеотидов.
Пример 10. Проведение второго этапа модификации ПММА: получение амино-модифицированной поверхности полиметилметакрилата.
Образец полимера после проведения первой стадии модификации (согласно примерам 1-6) помещали в 5%-ный раствор 3-аминопропилтриэтоксисилана в воде, выдерживали при 45°С 1 час, отмывали дистиллированной водой и использовали для нанесения олигонуклеотидов.
Пример 11. Иммобилизация олигонуклеотидов на эпокси-модифицированной поверхности ПММА.
На поверхность эпокси-модифицированного (согласно примеру 8) ПММА и поликарбоната наносили 10 мкМ раствора амино-модифицированного олигонуклеотида PR1 с помощью робота для нанесения (Xpress Lane, США). Объем капель составлял от 10 до 200 нл. Подложку с нанесенными олигонуклеотидами выдерживали во влажной камере 4 часа при 45°С и отмывали дистиллированной водой. Последовательность олигонуклеотида PR1 SEQ ID No: 1: 5'-TCTCTTTAGGCATTGGTTTCGAAGCGGGCA-3'.
Данная последовательность приведена в качестве примера, она включает, но не ограничивает, последовательности других типов олигонуклеотидов, которые могут быть использованы при изготовлении чипов. Результаты иммобилизации представлены на фиг.4, фиг.5 и фиг.10. Причем условия проведения первого этапа модификации соответствуют параметрам, приведенным в примерах 1, 5 и 7 соответственно.
Пример 12. Иммобилизация олигонуклеотидов на меркапто-модифицированной поверхности ПММА в присутствии гетеробифункционального кросс-линкера.
На поверхность меркапто-модифицированного согласно примеру 9 ПММА наносили 10 мкМ раствор амино-модифицированного олигонуклеотида, содержащий 1 мМ N-м-малеимидобензоил-N-гидроксисукцинимида, с помощью робота для нанесения (Xpress Lane, США). Объем капель составлял от 10 до 200 нл. Подложку с нанесенными олигонуклеотидами выдерживали во влажной камере 4 часа при 45°С и отмывали дистиллированной водой. Последовательность олигонуклеотида PR1 соответствует SEQ ID No: 1. Результаты иммобилизации представлены на фиг.6 и фиг.7. Условия проведения первого этапа модификации соответствуют параметрам, приведенным в примерах 2 и 6 соответственно.
Пример 13. Иммобилизация олигонуклеотидов на амино-модифицированной поверхности ПММА в присутствии конденсирующего агента.
На поверхность амино-модифицированного, согласно примеру 10 ПММА, наносили 10 мкМ раствор фосфато-модифицированного олигонуклеотида, содержащий 10 мМ гидрохлорида диметиламинопропилэтилкарбодиимида, с помощью робота для нанесения (Xpress Lane, США). Объем капель составлял от 10 до 200 нл. Подложку с нанесенными олигонуклеотидами выдерживали во влажной камере 4 часа при 45°С и отмывали дистиллированной водой. Последовательность олигонуклеотида PR1 соответствует SEQ ID No: 1. Результаты иммобилизации представлены на фиг.8 и фиг.9. Условия проведения первого этапа модификации соответствуют параметрам, приведенным в примерах 6 и 3 соответственно.
Пример 14. Гибридизация меченного биотином олигонуклеотида и визуализация нанесенных точек.
На поверхность ДНК-чипа, полученного согласно примерам 11-13, наносили смесь продуктов ПЦР, меченных биотином, в концентрации 0.5 мкмоль/л в 10 мкл 1×SSC буфера (150 mM NaCl, 15 тМ цитрата натрия, рН 7.4) и накрывали покровным стеклом. Продукты ПЦР содержали последовательность, комплементарную последовательности иммобилизованного олигонуклеотида. Гибридизацию проводили при 45°С в течение часа. По окончании реакции подложку промывали на шейкере следующими растворами: 2×SSC, 0.1% SDS - 2 раза по 5 минут; 0.1×SSC, 0.1% SDS - 2 раза по 3 минуты; 0.1×SSC - 2 смены по 1 минуте. Исходный стрептавидин-пероксидазный конъюгат ("Имбио", Россия) разбавляли последовательно в 200 раз 1×SSC, содержащим 1% BSA (бычий сывороточный альбумин). Конъюгат наносили на рабочую зону подложки, накрывали покровным стеклом и выдерживали во влажной атмосфере при комнатной температуре в течение 30 минут. Отмывку несвязавшегося конъюгата проводили SSC буфером: 2×SSC в течение 5 минут, 1×SSC - 5 минут и 0.1×SSC в течение 1 минуты.
Рабочую зону подложки заливали свежеприготовленным раствором субстрата - диметиламинобензидина (1 мг субстрата растворяли в 1 мл 0.1×SSC и добавляли 20 мкл 3%-ного раствора пероксида водорода), накрывали покровным стеклом и выдерживали от 10 до 30 минут при комнатной температуре. В случае положительной реакции появлялись коричневые пятна окисленного субстрата.
Промышленная применимость
ДНК-чип можно формировать в виде слайдов, пластиковых планшетов, гранул, оптических волокон. Для предлагаемого способа производства ДНК-чипов характерны простота, низкая стоимость и воспроизводимость, что позволяет изготавливать ДНК-чипы в больших масштабах. Двухстадийная модификация поверхности полимера позволяет получить высокую плотность иммобилизированных олигонуклеотидов.
Литература:
1. О.Buchardt, H.F.Hansen Polymer modification. US Patent 5,077,344 (December 31, 1991).
2. R.M.Christenson, G.S.Porter Methacrylate polymer coating composition modified with an alkylenimine. US Patent 3290416 (December 6,1966).
3. F.Fixe et al. Functionalization of poly(methyl methacrylate) (PMMA) as a substrate for DNA microarrays, Nucleic Acids Research, 2004, Vol.32, No. 1 e9.
4. A.C. Henry et al. Surface modification of poly(methyl methacrylate) used in the fabrication of microanalytical devices. Anal. Chem., 72, 5331-5337(2000).
5. D.К.Hanzel Vapor phase method for producing silane coatings. US Appl. 20040069634 (April 15, 2004).
6. В.Laguitton, Silsesquioxane-coated substrates for immobilizing biomolecules. US Appl. 20020090739 (July 11, 2002).
7. W.A.Moffat et al. Silane coated substrate. US Appl. 20050089695 (April 28, 2005).
8. Chih-Wei Но et al. High-density functional slide and preparation method thereof. US Appl. 20020028506 (March 7, 2002).
9. И.Г.Шишкина, A.C.Левина, В.Ф.Зарытова. Аффинные сорбенты, содержащие нуклеиновые кислоты и их фрагменты. Успехи Химии, 70, 581 (2001).
1. Способ получения ДНК-чипов, включающий обеспечение полимера, содержащего электрофильные группы, выбранные из сложноэфирных и галогеналкильных групп, модификацию поверхности полимера с целью получения на его поверхности функциональных групп и ковалентную иммобилизацию олигонуклеотида на модифицированной поверхности полимера, отличающийся тем, что для модификации поверхности полимера ее обрабатывают соединением формулы H2N-X-Si(OR)3, где Х - пропил; R - этил, при температуре от 15 до 110°С и давлении от 0,1 до 760 мм рт.ст. в течение 20 до 120 мин в газовой фазе, а затем раствором соединения формулы Y-X-Si(OR)3, где Х - пропил; R - этил или метил; Y - функциональная группа, при температуре от 15 до 50°С в течение 10 до 120 мин.
2. Способ по п.1, отличающийся тем, что полимер выбирают из группы, состоящей из полиметилметакрилата, полибутилметакрилата, поливинилхлорида, поликарбоната, сополимеров метилметакрилата и/или сополимеров бутилметакрилата с другими мономерами, такими как стирол, акрилонитрил.
3. Способ по п.1, отличающийся тем, что соединение формулы H2N-X-Si(OR)3 выбирают из группы, состоящей из аминопропилтриэтоксисилана и аминопропилтриметоксисилана.
4. Способ по п.1, отличающийся тем, что соединение формулы Y-X-Si(OR)3 выбирают из группы, состоящей из 3-(глицидилокси)пропилтриэтоксисилана, 3-(глицидилокси)пропилтриметоксисилана, 3-аминопропилтриэтоксисилана, 3-аминопропилтриметоксисилана, 3-меркаптопропилтриэтоксисилана, 3-меркаптопропилтриметоксисилана, 3-(акрилоилокси)пропилтриэтоксисилана, 3-(акрилоилокси)пропилтриметоксисилана.
5. Способ по п.1, отличающийся тем, что используют раствор соединения формулы Y-X-Si(OR)3 в воде.
6. Способ по п.1, отличающийся тем, что используют раствор соединения формулы Y-X-Si(OR)3 в смеси воды со спиртом, который выбирают из группы, состоящей из метанола, этанола и пропанола.
7. Способ по п.1, отличающийся тем, что используют 3-20% по объему раствор соединения формулы Y-Х-Si(OR)3.
8. Способ по любому из пп.1-7, отличающийся тем, что используют олигонуклеотид в концентрации от 0,5 до 100 мкмоль/л, который на 5' или 3'-конце содержит функциональную группу, выбранную из фосфато-, карбокси-, амино-, гидрокси-, тио-, гидразо-, гидразино- и аминоокси-группы.
9. Способ по п.8, отличающийся тем, что иммобилизацию олигонуклеотида проводят в присутствии, по крайней мере, одного, конденсирующего агента, входящего в группу, состоящую из гидрохлорида диметиламинопропилэтилкарбодиимида, карбонилдиимидазола, мезитиленсульфонилтетразола, мезитиленсульфонилнитротриазола, триизопропилфенилтетразола, триизопропилфенилнитротриазола.
10. Способ по п.8, отличающийся тем, что иммобилизацию олигонуклеотида проводят в присутствии, по крайней мере, одного бифункционального кросс-линкера, входящего в группу, состоящую из дитиобис(сукцинимидилпропионата), дисукцинимидилсуберата, дисукцинимидилтартрата, бис[(2-(сукцинимидооксикарбонилокси)этил] сульфоната, этиленгликольбис(сукцинимидилсукцината), дисукцинимидилглутарата, дисукцинимидилкарбоната, гидрохлорида диметиладипимидата, гидрохлорида диметилпимелимидата, диметил-3,3'-дитиобис(пропионимидата), 1,4-бис[3'-(2'-пиридилдитио)-пропионамидо]бутана, бисмалеимидогексана, гидрохлорида гидразида 4-(4-N-малеимидо-фенил)-бутановой кислоты, 1,5-дифтор-2,4 динитробензола, диглицидилового эфира 1,4-бутандиола, карбогидразида, дигидразида адипиновой кислоты, N-сукцинимидил-3-(2-пиридилдитио)-пропионата, сукцинимидил-4-N-малеимидометил)-циклогексан-1-карбоксилата, N-м-малеимидобензоил-N-гидроксисукцинимида, дигидрохлорида диметилсуберимидата, сукцинимидил-(4-иодоацетил)-аминобензоата, сукцинимидил-4-(п-малеимидофенил)-бутирата, сукцинимидил-6-[(иодоацетил)амино]-гексаноата, сукцинимидил-4-[(иодоацетиламино)-метил]-циклогексан-1-карбоксилата, п-нитрофенилиодоацетата.
11. Способ по пп.1-7, отличающийся тем, что ДНК-чип формируют в виде слайдов, пластиковых планшетов, гранул, оптических волокон.