Способ получения витамин к-зависимых белков
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой эукариотическую клетку-хозяина (варианты), которая экспрессирует первый полинуклеотид, кодирующий первый пропептид и FVII или его функциональные варианты, в первой единице экспрессии и экспрессирует второй полинуклеотид, кодирующий второй свободный пропептид, во второй единице экспрессии, причем каждый из указанных первого и второго пропептидов содержит аминокислотную последовательность, независимо выбранную из группы, состоящей из SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 и 18. Изобретение относится также и к способу получения витамин К-зависимых белков, в том числе и FVII, с использованием вышеупомянутой клетки-хозяина, а также к способу получения самой клетки-хозяина. Изобретение позволяет получать витамин К-зависимые белки с высокой степенью эффективности. 14 н. и 24 з.п. ф-лы, 3 ил, 3 табл.
Реферат
Настоящее изобретение относится к новому способу получения витамин K-зависимых белков и, в частности фактора свертывания VII (FVII). Кроме того, настоящее изобретение относится к новым котрансфицируемым эукариотическим клеткам-хозяевам и рекомбинантным векторам, которые должны использоваться в этом усовершенствованном способе, для получения витамин K-зависимых белков.
Предпосылки изобретения
Биосинтез витамин K-зависимых белков включает в себя несколько стадий посттрансляционного процессинга до того, как будет получен зрелый функциональный белок.
Витамин K представляет собой необходимый кофактор для гамма-карбоксилирования остатков глутаминовой кислоты в этих витамин K-зависимых белках, включая прокоагулянтные факторы: тромбин, фактор VII, IX и X; антикоагулянты, белок C и белок S и другие белки, такие как остеокальцин (белок Gla костей), матриксный белок Gla и обогащенный пролином белок Gla 1. Это карбоксилирование является необходимым для нормального гемостаза, поскольку оно делает возможным связывания кальция и присоединение прокоагулянтов и антикоагулянтов к фосфолипидам.
Гамма-глутамилкарбоксилаза представляет собой интегрированный мембранный микросомальный фермент, находящийся в грубом эндоплазматическом ретикулуме. Она карбоксилирует глутаматные остатки, расположенные в домене Gla витамин K-зависимых белков. кДНК гамма-глутамилкарбоксилазы человека недавно выделена и секвенирована (Wu SM et al. Science 254:1634, 1991). Исследования биологического синтеза витамин K-зависимых белков в клетках BHK и CHO показали, что карбоксилаза присутствует как в эндоплазматическом ретикулуме (ER), так и в комплексе Гольджи и что пропептид, содержащий участок распознавания карбоксилазы, расщепляется после завершения гамма-карбоксилирования.
Обсуждалось, может ли пропептид стимулировать активность карбоксилазы (Sigiura, I. et al. (1997) Proc. Natl. Acad. Sci., 9, 9069-9074, Knobloch and Suttie (1987) J. Biol. Chem. 262, 15334-15337, Furie et al. (1999) Blood, 93, 1798-1808).
Свертывание крови представляет собой процесс, состоящий из сложного взаимодействия различных компонентов крови или факторов, которые, возможно, приводят к образованию фибринового тромба. В целом, компоненты крови, которые принимают в этом участие, упоминаются как "система" свертывания, представляют собой проферменты или зимогены, ферментативно неактивные белки, которые преобразуются в протеолитические ферменты под действием активатора, самого активированного фактора свертывания. Факторы свертывания, которые подвергаются такому преобразованию, в целом упоминаются как "активные факторы" и обозначаются путем добавления нижнего индекса "a" (например, активированный фактор VII (FVIIa)).
Активированный фактор X (FXa) является необходимым для преобразования протромбина в тромбин, который затем преобразует фибриноген в фибрин, в качестве конечной стадии при формировании фибринового тромба. Существуют две системы или два пути, которые способствуют активации FX. "Внутренний путь" относится к тем реакциям, которые приводят к образованию тромбина путем использования факторов, присутствующих только в плазме. В конце концов, ряд опосредованных протеазами процессов активирования генерирует фактор IXa, который в сочетании с фактором VIIIa расщепляет FX до FXa. Подобный же протеолиз осуществляется с помощью FVIIa и его кофактора, тканевого фактора, на "внешнем пути" свертывания крови. Тканевый фактор представляет собой связанный с мембраной белок и обычно не может циркулировать в плазме крови. Однако при разрушении сосуда он может образовывать комплекс с FVIIa с катализом активирования FX или активированием фактора IX в присутствии Ca++ и фосфолипида. Хотя относительная важность двух путей свертывания при гемостазе является неясной, в последние годы, как было обнаружено, FVII и тканевой фактор играют главную роль в регуляции свертывания крови.
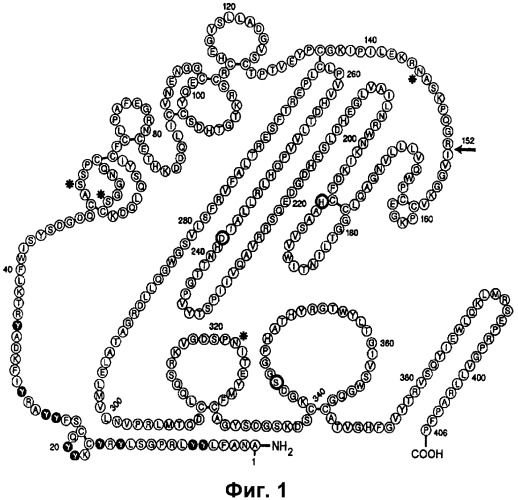
FVII представляет собой гликопротеин, присутствующий в малых количествах в плазме, который циркулирует в крови в виде одноцепочечного зимогена. Зимоген не является активным по отношению к свертыванию. Одноцепочечный FVII может быть преобразован в двухцепочечный FVIIa с помощью FXa, фактора XIIa, фактора IXa или тромбина in vitro. FXa, как предполагается, является главным физиологическим активатором FVII. Подобно нескольким другим белкам плазмы, вовлеченным в гемостаз, FVII зависит от витамина K при его биосинтезе, который является необходимым для гамма-карбоксилирования 10 остатков глутаминовой кислоты в аминоокончании белка. Внутриклеточная посттрансляционная обработка FVII имеет место в эндоплазматическом ретикулуме (ER) и в комплексе Гольджи. Наряду с витамин K-зависимым гамма-карбоксилированием FVII подвергается ограниченному протеолизу для удаления пропептида с N-окончанием и для гликозилирования аспарагина-145 и -322 и серина-52 и -60 (фиг.1).
Остатки гамма-карбоксилированной глутаминовой кислоты (Gla) являются необходимыми для связанного с металлом взаимодействия FVII с фосфолипидами.
В присутствии фактора тканей, фосфолипидов и ионов кальция двухцепочечный FVIIa быстро активирует FX или фактор IX с помощью ограниченного протеолиза.
Белок C представляет собой серинпротеазу и встречающийся в природе антикоагулянт, который играет определенную роль в регуляции гомеостаза путем инактивирования факторов Va и VIIIa в системе свертывания крови. Белок C человека in vivo производится, прежде всего, в печени в виде одного полипептида из 461 аминокислоты. Эта одноцепочечная молекула-предшественник подвергается множеству посттрансляционных модификаций, включая карбоксилирование девяти остатков глутаминовой кислоты, приводящее к возникновению девяти остатков Gla.
Белок S также демонстрирует антикоагулянтную активность в анализах свертывания in vitro. Белок S демонстрирует активность антикоагулянтного кофактора для активированного белка C. Также, как показано, белок S представляет собой антикоагулянтный фактор в отсутствие активированного белка C, поскольку он может ингибировать активность протромбиназы в анализах, не использующих активированный белок C, и связывается с фактором Va или фактором Xa и функционирует в качестве антикоагулянта без активированного белка C.
Белок S представляет собой физиологически очень важный противотромботический фактор, поскольку наследственные или приобретенные дефициты белка S ассоциируются с венозным и артериальным тромботическим заболеванием. Дефицит свободного белка S при нормальном уровне белка S, в целом, описан у некоторых пациентов с тромботическим заболеванием.
Часто является необходимым селективно блокировать систему свертывания крови у пациента. Антикоагулянты, такие как белок C или белок S, могут быть использованы, например, во время почечного диализа или для лечения глубокого тромбоза вен, диссеминированного внутрисосудистого свертывания (DIG), пациента с риском острого тромбоза, дефицита белка S, сепсиса, воспаления, рака пациентов, подвергающихся хирургической операции, и обладателей других медицинских расстройств.
Остеокальцин состоит из 49 аминокислотных остатков, которые включают в себя три остатка Gla. Функция этого белка, как предполагается, заключается в подавлении избыточной минерализации. Остеокальцин представляет собой специфический белок костей, который секретируется остеобластами. Фракция вновь синтезированного остеокальцина высвобождается в поток крови, где его концентрация коррелирует с показателями активности остеобластов и скорости формирования костей. У людей изменения в уровнях циркулирующего остеокальцина связываются с метаболическими заболеваниями костей, такими как остеопороз и гиперпаратироидизм.
Матриксный белок Gla (MGP) состоит из 79 аминокислот, включая 5 остатков Gla. Этот белок обычно обнаруживается в деминерализованном матриксе и, как предполагается, выполняет определенную функцию при инициации формирования костей.
В данной области продолжает существовать необходимость в усовершенствованных системах для получения рекомбинантных витамин K-зависимых белков и конкретных рекомбинантных факторов свертывания. Настоящее изобретение удовлетворяет эту необходимость путем создания способа, который дает более эффективное, быстрое получение и/или более высокий выход рекомбинантных витамин K-зависимых белков, в частности FVII.
Описание изобретения
Настоящее изобретение относится к новому способу для получения витамин K-зависимых белков и, в частности, фактора свертывания VII (FVII).
Стадии процессинга N-окончаний и, в частности, гамма-карбоксилирования остатков глутаминовой кислоты витамин K-зависимых белков, как показано, представляют собой лимитирующие стадии при биосинтезе этих белков, как показано авторами настоящего изобретения относительно FVII. Способ для увеличения гамма-карбоксилирования, как показано, увеличивает экспрессию рекомбинантных витамин K-зависимых белков.
Пропептид витамин K-зависимых белков является наиболее важным для связывания с карбоксилазой и он должно быть ковалентно присоединен к витамин K-зависимому белку в том же порядке, как для остатков Glu, где будет карбоксилироваться N-окончание будущего зрелого белка. Авторы предполагают, что свободный пропептид функционирует в качестве молекулы для аллостерической регуляции, в том смысле, что, когда концентрация свободного пропептида увеличивается, активность процесса гамма-карбоксилирования также увеличивается.
Прямое увеличение концентрации свободных пропептидов может быть получено путем совместной экспрессии свободного пропептида (свободных пропептидов) самого по себе. Это может быть проделано путем трансфицирования с помощью полинуклеотида, кодирующего свободный пропептид (свободные пропептиды), с мутациями и посттрансляционными модификациями или без них, в одной или нескольких копиях, и совместной экспрессии его вместе с полинуклеотидом, кодирующим витамин K-зависимый белок. Последний может содержать пропептидную последовательность, иную, чем та, которая обычно ассоциируется с витамин K-зависимым белком. Экспрессия полинуклеотида, кодирующего витамин K- зависимый белок, может быть получена либо путем трансфекции в клетку гена, представляющего интерес, либо путем активирования (то есть включения) эндогенного гена, кодирующего витамин K- зависимый белок, уже присутствующего в первичных, вторичных или иммортализованных клетках, взятых у позвоночных, который обычно не экспрессируется в клетках или не экспрессируется в клетках при физиологически значимых уровнях в том виде, в котором эти клетки получены. Для активирования генов, представляющих интерес, гомологичная рекомбинация может быть использована для замены или выключения регуляторной области, обычно ассоциируемой с геном, в клетках в том виде, как они получены, с помощью регуляторной последовательности, которая вызывает экспрессию гена при уровнях, более высоких, чем это проявляется в соответствующей нетрансфицированной клетке, или для проявления структуры регуляции или индукции, которая отличается от той, которую демонстрирует соответствующая нетрансфицированная клетка.
В первом аспекте настоящее изобретение относится к эукариотической клетке-хозяину, экспрессирующей первый полинуклеотид, кодирующий первый пропептид и FVII или его варианты, в первой единице экспрессии и экспрессирующей второй полинуклеотид, кодирующий второй свободный пропептид, во второй единице экспрессии. Необходимо понять, что первый полинуклеотид располагается в первой единице экспрессии и что второй полинуклеотид располагается во второй единице экспрессии, где первая и вторая единицы экспрессии являются различными.
Во втором аспекте настоящее изобретение относится к эукариотической клетке-хозяину, трансфицированной первым полинуклеотидом, кодирующим первый пропептид и FVII или его варианты, в первой единице экспрессии и трансфицированной вторым полинуклеотидом, кодирующим второй свободный пропептид во второй единице экспрессии. Необходимо понять, что первый полинуклеотид располагается в первой единице экспрессии и что второй полинуклеотид располагается во второй единице экспрессии, где первая и вторая единицы экспрессии являются различными. Реальный порядок трансфицирования является, разумеется, тривиальным и, таким образом, клетка-хозяин может трансфицироваться сначала вторым полинуклеотидом или наоборот. Использование терминов "первый пропептид" и "второй пропептид" производится исключительно для удобства, таким образом, первый и второй пропептиды могут быть одинаковыми или различными.
Термин "эукариотическая клетка-хозяин", как здесь используется, представляет любую клетку, включая гибридные клетки, в которые может экспрессироваться гетерологичная ДНК. Типичные клетки-хозяева включают в себя, но не ограничиваются этим, клетки насекомых, клетки дрожжей, клетки млекопитающих, включая клетки человека, такие как клетки BHK, CHO, HEK и COS. При осуществлении настоящего изобретения клетки-хозяева, которые культивируются, предпочтительно, представляют собой клетки млекопитающих, более предпочтительно, устоявшуюся линию клеток млекопитающего, включая, без ограничения, линии клеток CHO (например, ATCC CCL 61), COS-1 (например, ATCC CRL 1650), почек детеныша хомячка (BHK) и HEK 293 (например, ATCC CRL 1573; Graham et al., J. Gen. Virol. 36:59-72, 1977).
Предпочтительная линия клеток BHK представляет собой линию клеток BHK tk- ts13 (Waechter and Baserga, Proc. Natl. Acad. Sci. USA 79:1106-1110, 1982), далее упоминаемые как клетки BHK 570. Линия клеток BHK 570 является доступной от Американской коллекции типовых культур, 12301 Parklawn Dr., Rockville, MD 20852, под номером доступа ATCC CRL 10314. Линия клеток BHK tk- ts13 является также доступной от ATCC под номером доступа CRL 1632.
Другие пригодные для использования линии клеток включают в себя, без ограничения, Rat Hep I (гепатома крысы; ATCC CRL 1600), Rat Hep II (гепатома крысы; ATCC CRL 1548), TCMK (ATCC CCL 139), легкие человека (ATCC HB 8065), NCTC 1469 (ATCC CCL 9.1) и клетки DUKX (Urlaub and Chasin, Proc. Natl. Acad. Sci. USA 77:4216-4220, 1980). Также пригодными для использования являются клетки 3T3, клетки Namalwa, миеломы и продукты слияния миелом с другими клетками.
Термин "полинуклеотид" обозначает одно- или двухцепочечный полимер из деоксирибонуклеотидных или рибонуклеотидных оснований, отсчитываемых от 5' до конца 3'. Полинуклеотиды включают в себя РНК и ДНК и могут быть выделены из природных источников, синтезированы in vitro или получены из сочетания природных и синтетических молекул. Длина полинуклеотидной молекулы приводится здесь как число нуклеотидов (сокращенно "nt") или пар оснований (сокращенно "bp"). Термин "нуклеотиды" используется как для одно-, так и для двухцепочечных молекул, когда контекст это позволяет. Когда термин применяется к двухцепочечным молекулам, он используется для обозначения общей длины и понимается как эквивалент термина "пары оснований". Специалист в данной области заметит, что две цепочки двухцепочечного полинуклеотида могут слегка отличаться по длине и что их концы могут не совпадать друг с другом, как результат ферментативного расщепления; таким образом, не все нуклеотиды внутри двухцепочечной полинуклеотидной молекулы могут быть парными. Такие непарные концы, как правило, не превосходят в длину 20 nt.
Термин "пропептид", как используется здесь, представляет любую последовательность аминокислот, которая может связывать гамма-глутамилкарбоксилазу. Типичные пропептиды, которые управляют гамма-карбоксилированием витамин K-зависимых белков, обнаружены на N-окончании витамин K-зависимого белка и служат в качестве участка стыковки или распознающей последовательности для взаимодействия с гамма-глутамилкарбоксилазой, которая карбоксилирует глутаматные остатки, обычно расположенные в домене Gla витамин K-зависимых белков. В одном пропептиде может существовать более чем один участок связывания для гамма-глутамилкарбоксилазы, то есть распознающая последовательность гамма-глутамилкарбоксилазы. Один из примеров пропептида, попадающего под это определение, представляет собой таким образом последовательность природного пропептида FVII. Другой пример, попадающий под это определение, представляет собой последовательность природного пропептида FVII, соединенную с последовательностью природного пропептида фактора IX, внутри одной и той же аминокислотной последовательности.
Термин "свободный пропептид", как используется здесь, предназначается для обозначения пропептида, который не связан с витамин K-зависимым белком, который должен быть гамма-карбоксилирован. Пример свободного пропептида представляет собой таким образом пропептид FVII, который не связан с аминокислотной последовательностью FVII.
Термины "фактор VII" или "FVII", как используются здесь, обозначают продукт, состоящий из неактивированной формы (фактор VII). Термины "фактор VIIa" или "FVIIa", как используются здесь, обозначают продукт, состоящий из активированной формы (фактор VIIa). Это включает в себя белки, которые имеют аминокислотную последовательность 1-406 нативного фактора FVII или FVIIa человека. Это также включает в себя белки со слегка модифицированной аминокислотной последовательностью, например модифицированный конец с N-окончанием, включая добавления или устранение аминокислот N-окончания, постольку, поскольку эти белки, по существу, сохраняют активность FVIIa. "FVII" или "FVIIa", попадающие под это определение, также включают в себя природные аллельные вариации, которые могут существовать и переходить от одного индивидуума к другому. Кроме того, степень и расположение гликозилирования или других посттрансляционных модификаций может изменяться в зависимости от выбранных клеток-хозяев и природы окружающей среды для клеток-хозяев.
Термин "варианты", как используется здесь, предназначен для обозначения FVII, где один или несколько аминокислотных остатков исходного белка замещены другим аминокислотным остатком, и/или где один или несколько аминокислотных остатков исходного белка устранены, и/или где один или несколько аминокислотных остатков добавлены к исходному белку. Такое добавление может иметь место либо на N-окончании, либо на C-окончании исходного белка, либо на них обоих.
Термин "единица экспрессии", как используется здесь, обозначает полинуклеотид, содержащий следующие соединенные при их действии элементы: (a) промотор транскрипции; (b) полинуклеотидную последовательность, кодирующую аминокислотную последовательность; и (c) терминатор транскрипции. Пример единицы экспрессии, таким образом, представляет собой ДНК вектор, содержащий следующие связанные элементы: (a) промотор транскрипции, (b) последовательность кДНК, кодирующую свободный пропептид; и (c) терминатор транскрипции.
Термин "вектор", как используется здесь, обозначает любой объект из нуклеиновых кислот, способный к амплификации в клетке-хозяине. Таким образом, вектор может представлять собой автономно реплицирующийся вектор, то есть вектор, который существует в виде экстрахромосомального объекта, репликация которого является независимой от хромосомальной репликации, например плазмиду. Альтернативно, вектор может быть таким, который, когда он вводится в клетку-хозяина, интегрируется в геном клетки-хозяина и реплицируется вместе с хромосомой (хромосомами), в которые он интегрируется. Выбор вектора часто зависит от клетки-хозяина, в которую он должен вводиться. Векторы включают в себя, но не ограничиваются этим, плазмидные векторы, фаговые векторы, вирусные векторы или космиды. Векторы обычно содержат репликатор и, по меньшей мере, один селектируемый ген, то есть ген, который кодирует продукт, который является легкодетектируемым или присутствие которого является существенным для роста клеток.
Термин "промотор" обозначает часть гена, содержащую последовательности ДНК, которые обеспечивают связывание РНК полимеразы и инициацию транскрипции. Промоторные последовательности часто, но не всегда, находятся в 5' некодирующих областях генов.
В третьем аспекте настоящее изобретение относится к эукариотической клетке-хозяину, экспрессирующей первый полинуклеотид, кодирующий первый пропептид и витамин K-зависимый белок, в первой единице экспрессии и экспрессирующей второй полинуклеотид, кодирующий второй свободный пропептид, во второй единице экспрессии.
В дополнительном аспекте настоящее изобретение относится к эукариотической клетке-хозяину, трансфицированной первым полинуклеотидом, кодирующим первый пропептид и витамин K-зависимый белок, в первой единице экспрессии и трансфицированной вторым полинуклеотидом, кодирующим второй свободный пропептид, во второй единице экспрессии.
Термин "витамин K-зависимый белок", как используется здесь, обозначает любой белок, который является гамма-карбоксилированным по остаткам глутаминовой кислоты. Типичные витамин K-зависимые белки включают в себя, но не ограничиваются этим, прокоагулянтные факторы: тромбин, фактор VII, IX и X; антикоагулянты: белок C и белок S и другие белки, такие как остеокальцин (белок Gla костей), матричный белок Gla и обогащенный пролином белок Gla 1.
В дополнительном аспекте настоящее изобретение относится к способу получения FVII или его вариантов, включающему a) экспрессию в эукариотическую клетку первого полинуклеотида, кодирующего первый пропептид и FVII или его варианты, в первой единице экспрессии и экспрессию второго полинуклеотида, кодирующего второй свободный пропептид, во второй единице экспрессии с получением коэкспрессирующей эукариотической клетки-хозяина; b) культивирование в соответствующей культуральной среде коэкспрессирующей эукариотической клетки-хозяина при условиях, которые дают возможность для экспрессии первого полинуклеотида и второго полинуклеотида.
В дополнительном аспекте настоящее изобретение относится к способу получения FVII или его вариантов, включающему a) экспрессию в эукариотическую клетку первого полинуклеотида, кодирующего первый пропептид и FVII или его варианты, в первой единице экспрессии и экспрессию второго полинуклеотида, кодирующего второй свободный пропептид, во второй единице экспрессии с получением коэкспрессирующей эукариотической клетки-хозяина; b) культивирование в соответствующей культуральной среде коэкспрессирующей эукариотической клетки-хозяина при условиях, которые дают возможность для экспрессии первого полинуклеотида и второго полинуклеотида; и c) выделение FVII или его вариантов из среды.
В дополнительном аспекте настоящее изобретение относится к способу получения FVII или его вариантов, включающему a) трансфицирование эукариотической клетки-хозяина первым полинуклеотидом, кодирующим первый пропептид и FVII или его варианты, в первой единице экспрессии и трансфицирование вторым полинуклеотидом, кодирующим второй свободный пропептид, во второй единице экспрессии с получением котрансфицированной эукариотической клетки-хозяина; b) культивирование в соответствующей культуральной среде котрансфицированной эукариотической клетки-хозяина при условиях, которые дают возможность для экспрессии первого полинуклеотида и второго полинуклеотида.
В дополнительном аспекте настоящее изобретение относится к способу получения FVII или его вариантов, включающему a) трансфицирование эукариотической клетки-хозяина первым полинуклеотидом, кодирующим первый пропептид и FVII или его варианты, в первой единице экспрессии и трансфицирование вторым полинуклеотидом, кодирующим второй свободный пропептид, во второй единице экспрессии с получением котрансфицированной эукариотической клетки-хозяина; b) культивирование в соответствующей культуральной среде котрансфицированной эукариотической клетки-хозяина при условиях, которые дают возможность для экспрессии первого полинуклеотида и второго полинуклеотида; и c) выделение FVII или его вариантов из среды.
В дополнительном аспекте настоящее изобретение относится к способу получения FVIIa или его вариантов, включающему a) трансфицирование эукариотической клетки-хозяина первым полинуклеотидом, кодирующим первый пропептид и FVII или его варианты, в первой единице экспрессии и трансфицирование вторым полинуклеотидом, кодирующим второй свободный пропептид, во второй единице экспрессии с получением котрансфицированной эукариотической клетки-хозяина; b) культивирование в соответствующей культуральной среде котрансфицированной эукариотической клетки-хозяина при условиях, которые дают возможность для экспрессии первого полинуклеотида и второго полинуклеотида; и c) выделение и активирование FVII или его вариантов из среды.
В дополнительном аспекте настоящее изобретение относится к рекомбинантному вектору, где указанный вектор содержит полинуклеотид, кодирующий свободный пропептид, в единице экспрессии. Воплощения, описанные ниже по отношению ко второму полинуклеотиду, второму свободному пропептиду и второй единице экспрессии, являются предопределенными, индивидуально или в сочетании, также для представления воплощений полинуклеотида, свободного пропептида и единицы экспрессии, заключенных в рекомбинантном векторе.
В дополнительном аспекте настоящее изобретение относится к рекомбинантному вектору, где указанный вектор содержит первый полинуклеотид, кодирующий первый пропептид и FVII или его варианты, в первой единице экспрессии и второй полинуклеотид, кодирующий второй свободный пропептид, во второй единице экспрессии.
В дополнительном аспекте настоящее изобретение относится к рекомбинантному вектору, где указанный вектор содержит первый полинуклеотид, кодирующий первый пропептид и витамин K-зависимый белок, в первой единице экспрессии и второй полинуклеотид, кодирующий второй свободный пропептид, во второй единице экспрессии.
В дополнительном аспекте настоящее изобретение относится к способу получения эукариотической клетки-хозяина, продуцирующей FVII, включающему a) генную активацию в эукариотической клетке-хозяине первого полинуклеотида, кодирующего аминокислотную последовательность от -18 до 406, FVII и его пропептида, в первой единице экспрессии и b) трансфицирование вторым полинуклеотидом, кодирующим второй свободный пропептид, во второй единице экспрессии. В этой связи аминокислотная последовательность от -18 до -1 является идентичной пропептиду FVII, идентифицируемому как SEQ ID NO:7.
В дополнительном аспекте настоящее изобретение относится к способу получения эукариотической клетки-хозяина, продуцирующей FVII или его варианты, включающему a) трансфицирование эукариотической клетки-хозяина первым полинуклеотидом, кодирующим первый пропептид и FVII или его варианты, в первой единице экспрессии и b) трансфицирование вторым полинуклеотидом, кодирующим второй свободный пропептид, во второй единице экспрессии.
В дополнительном аспекте настоящее изобретение относится к способу получения витамин K-зависимого белка, включающему a) экспрессию в эукариотическую клетку-хозяина первого полинуклеотида, кодирующего первый пропептид и витамин K- зависимый белок, в первой единице экспрессии и экспрессию второго полинуклеотида, кодирующего второй свободный пропептид, во второй единице экспрессии с получением коэкспрессирующей эукариотической клетки-хозяина; b) культивирование в соответствующей культуральной среде коэкспрессирующей эукариотической клетки-хозяина при условиях, которые дают возможность для экспрессии первого полинуклеотида и второго полинуклеотида.
В дополнительном аспекте настоящее изобретение относится к способу получения витамин K-зависимого белка, включающему a) экспрессию в эукариотическую клетку-хозяина первого полинуклеотида, кодирующего первый пропептид и витамин K-зависимый белок, в первой единице экспрессии и экспрессию второго полинуклеотида, кодирующего второй свободный пропептид, во второй единице экспрессии с получением коэкспрессироующей эукариотической клетки-хозяина; b) культивирование в соответствующей культуральной среде коэкспрессирующей эукариотической клетки-хозяина при условиях, которые дают возможность для экспрессии первого полинуклеотида и второго полинуклеотида; и c) выделение витамин K-зависимого белка из среды.
В дополнительном аспекте настоящее изобретение относится к способу получения витамин K-зависимого белка, включающему a) трансфицирование эукариотической клетки-хозяина первым полинуклеотидом, кодирующим первый пропептид и витамин K-зависимый белок, в первой единице экспрессии и трансфицирование вторым полинуклеотидом, кодирующим второй свободный пропептид, во второй единице экспрессии с получением котрансфицированной эукариотической клетки-хозяина; b) культивирование в соответствующей культуральной среде котрансфицированной эукариотической клетки-хозяина при условиях, которые дают возможность для экспрессии первого полинуклеотида и второго полинуклеотида.
В дополнительном аспекте настоящее изобретение относится к способу получения витамин K-зависимого белка, включающему a) трансфицирование эукаротической клетки-хозяина первым полинуклеотидом, кодирующим первый пропептид и витамин K-зависимый белок, в первой единице экспрессии и трансфицирование вторым полинуклеотидом, кодирующим второй свободный пропептид, во второй единице экспрессии с получением котрансфицированной эукариотической клетки-хозяина; b) культивирование в соответствующей культуральной среде котрансфицированной эукариотической клетки-хозяина при условиях, которые дают возможность для экспрессии первого полинуклеотида и второго полинуклеотида; и c) выделение витамин K-зависимого белка из среды.
В дополнительном аспекте настоящее изобретение относится к рекомбинантному FVII или к его вариантам, получаемым с помощью способа, включающего a) трансфицирование эукаротической клетки-хозяина первым полинуклеотидом, кодирующим первый пропептид и FVII или его варианты, в первой единице экспрессии и трансфицирование вторым полинуклеотидом, кодирующим второй свободный пропептид, во второй единице экспрессии с получением котрансфицированной эукариотической клетки-хозяина; b) культивирование в соответствующей культуральной среде котрансфицированной эукариотической клетки-хозяина при условиях, которые дают возможность для экспрессии первого полинуклеотида и второго полинуклеотида.
В дополнительном аспекте настоящее изобретение относится к рекомбинантному FVII или к его вариантам, получаемым с помощью способа, включающего a) трансфицирование эукаротической клетки-хозяина первым полинуклеотидом, кодирующим первый пропептид и FVII или его варианты, в первой единице экспрессии и трансфицирование вторым полинуклеотидом, кодирующим второй свободный пропептид, во второй единице экспрессии с получением котрансфицированной эукариотической клетки-хозяина; b) культивирование в соответствующей культуральной среде котрансфицированной эукариотической клетки-хозяина при условиях, которые дают возможность для экспрессии первого полинуклеотида и второго полинуклеотида; и c) выделение FVII или его вариантов из среды.
В дополнительном аспекте настоящее изобретение относится к рекомбинантному FVIIa или его вариантам, получаемым с помощью способа, включающего a) трансфицирование эукаротической клетки-хозяина первым полинуклеотидом, кодирующим первый пропептид и FVII или его варианты, в первой единице экспрессии и трансфицирование вторым полинуклеотидом, кодирующим второй свободный пропептид, во второй единице экспрессии с получением котрансфицированной эукариотической клетки-хозяина; b) культивирование в соответствующей культуральной среде котрансфицированной эукариотической клетки-хозяина при условиях, которые дают возможность для экспрессии первого полинуклеотида и второго полинуклеотида; и c) выделение и активирование FVII или его вариантов из среды.
В дополнительном аспекте настоящее изобретение относится к рекомбинантному витамин K-зависимому белку, получаемому с помощью способа, включающего a) трансфицирование эукаротической клетки-хозяина первым полинуклеотидом, кодирующим первый пропептид и витамин K-зависимый белок, в первой единице экспрессии и трансфицирование вторым полинуклеотидом, кодирующим второй свободный пропептид, во второй единице экспрессии с получением котрансфицированной эукариотической клетки-хозяина; b) культивирование в соответствующей культуральной среде котрансфицированной эукариотической клетки-хозяина при условиях, которые дают возможность для экспрессии первого полинуклеотида и второго полинуклеотида.
В дополнительном аспекте настоящее изобретение относится к рекомбинантному витамин K-зависимому белку, получаемому с помощью способа, включающего a) трансфицирование эукаротической клетки-хозяина первым полинуклеотидом, кодирующим первый пропептид и витамин K-зависимый белок, в первой единице экспрессии и трансфицирование вторым полинуклеотидом, кодирующим второй свободный пропептид, во второй единице экспрессии с получением котрансфицированной эукариотической клетки-хозяина; b) культивирование в соответствующей культуральной среде котрансфицированной эукариотической клетки-хозяина при условиях, которые дают возможность для экспрессии первого полинуклеотида и второго полинуклеотида; и c) выделение витамин K-зависимого белка из среды.
Первый пропептид может быть таким пропептидом, обычно ассоциируемым с витамин K-зависимым белком, или он может быть любым другим пропептидом, таким как пропептид, обычно ассоциируемый с другим витамин K-зависимым белком.
В одном из воплощений первый пропептид содержит одну связывающую последовательность для гамма-глутамилкарбоксилазы. В другом воплощении первый пропептид содержит две или более связывающих последовательностей для гамма-глутамилкарбоксилазы. Пример первого пропептида представляет собой таким образом пропептиды, обычно ассоциируемые с FVII и с протромбином, ковалентно присоединенным к той же единице экспрессии.
В дополнительном воплощении второй свободный пропептид содержит одну связывающую последовательность для гамма-глутамилкарбоксилазы. В дополнительном воплощении второй свободный пропептид содержит две или более связывающих последовательностей для гамма-глутамилкарбоксилазы. Пример второго свободного пропептида представляет собой таким образом пропептиды, обычно ассоциируемые с FVII и протромбином, ковалентно присоединенным к той же единице экспрессии.
В дополнительном воплощении настоящего изобретения эукариотическая клетка-хозяин экспрессирует первый полинуклеотид, кодирующий первый пропептид и FVII, в первой единице экспрессии и экспрессирует второй полинуклеотид, кодирующий второй свободный пропептид, во второй единице экспрессии. В конкретном воплощении FVII представляет собой FVII человека.
В дополнительном воплощении настоящего изобретения эукариотическая клетка-хозяин трансфицируется первым полинуклеотидом, кодирующим первый пропептид и FVII, в первой единице экспрессии и трансфицируется вторым полинуклеотидом, кодирующим второй свободный пропептид, во второй единице экспрессии. В конкретном воплощении FVII представляет собой FVII человека.
В дополнительном воплощении настоящего изобретения витамин K-зависимый белок независимо выбирается из протромбина, фактора IX, FVII, фактора X, белка C, белка S, остеокальцина, обогащенного пролином белка Gla 1 или матриксного белка Gla. Необходимо понять, что любой из этих белков составляет альтернативное воплощение настоящего изобретения.
В дополнительном воплощении настоящего изобретения эукариотическая клетка-хозяин дополнительно трансфицируется полинуклеотидом, кодирующим гамма-глутамилкарбоксилазу, в единице экспрессии. Эта единица экспрессии может быть единицей экспрессии, отличной от первой или второй единицы экспрессии, или полинуклеотид, кодирующий гамма-глутамилкарбоксилазу, может быть расположен в первой или второй единице экспрессии. Примеры гамма-глутамилкарбоксилаз выбираются из рекомбинантной карбоксилазы человека, крысы, дрозофилы, гамма-глутамилкарбоксилазы мышц мыши или хомячка.
В дополнительном воплощении настоящего изобретения первый пропептид содержит аминокислотную последовательность формулы:
X1X2FX3X4X5X6X7X8X9X10X11X12X13X14X15X16X17,
где X1, X4, X5, X6, X7, X9