Способ лечения хронических заболеваний (варианты), способ получения биотрансплантата (варианты), биотрансплантат (варианты)
Иллюстрации
Показать всеПредложенная группа изобретений относится к медицине, а именно к терапии, и включает способ лечения хронических заболеваний (варианты) путем введения биотрансплантата (варианты) и способ получения биотрансплантата (варианты). Для получения биотрансплантата из клеточного материала больного выделяют аутологичные мононуклеарные клетки, содержащие стволовые клетки. Выделенные клетки культивируют в ростовой среде с добавлением тканеспецифического антигена, полученного из выделенной ткани органа, соответствующего поврежденному (вариант). В другом варианте в ростовую среду добавляют лимфоидные и/или дендритные клетки, предварительно культивированные с добавлением тканеспецифического антигена, полученного из выделенной ткани органа, соответствующего поврежденному. Введение биотрансплантата, полученного в соответствии с одним или другим вариантом способа его получения, обеспечивает эффективное лечение хронических заболеваний за счет повышения регенерационного потенциала биотрансплантата. 6 н. и 2 з.п. ф-лы, 5 табл., 8 ил.
Реферат
Уровень техники
Изобретение относится к медицине и может быть использовано для лечения хронических заболеваний.
Известны способы лечения заболеваний сердца (Шевченко Ю.Л. Клеточные технологии в кардиологии, №11, Вестник РАМН, 2003 г, стр.6-10), основанные на получении взвеси фетальных клеток из абортивного донорского материала, содержащих стволовые и прогениторные клетки, и введении их в миокард. Недостатками указанного аналога являются:
1. Нелегитивность использования фетального материала, который не может быть применен в клинике у больных.
2. Опасность заражения реципиента нераспознанными инфекциями, содержащимися в донорском материале.
3. Остальные клетки представляют собой аллогенный материал, эффективность применения которого постепенно снижается из-за иммунного отторжения.
Известен другой аналог (Bel A., Messas E., Agbulut О., et al. Transplantation of autologous fresh bone marrow into infarcted myocardium: A word of caution. // Circulation. - 2003. - 108. - P. II-247), предложенный для лечения заболеваний сердца методом клеточной терапии. Этот метод основан на получении аутологичного свежевыделенного костного мозга, содержащего клетки гемопоэтического и стромального ряда, и возвращении их в миокард или коронарное русло пациенту.
Преимущество этого метода перед известным заключается в отсутствии правовых и этических проблем; отсутствии риска привнесения инфекции в организм реципиента.
К недостаткам этого аналога, снижающим эффективность восстановительных процессов в поврежденном органе с помощью клеточной терапии относятся:
1. Развитие костной ткани в зоне введения клеток, из-за дифференцировки стромальных клеток по остеогенному пути (Sale G.E., Storb R. Bilateral diffuse pulmonary ectopic ossification after marrow allograft in a dog. Evidence for allotransplantation of hemopoietic and mesenchymal stem cells. Exp Hematol. - 1983. - 11. - №10. - Р.961-966).
2. Исходно сниженный регенерационный потенциал клеточной взвеси, т.к. источником клеток является сам больной, регенерационный потенциал клеток которого (в том числе и клеток костного мозга) снижен из-за болезни.
3. Отсутствие или резкое снижение в клеточной взвеси тканеспецифических клонов клеток (лимфоидных), способствующих регенерации соответствующего хронически поврежденного органа, и этот недостаток в еще большой степени снижает регенерационный потенциал используемой клеточной взвеси и тем самым существенно ослабляет эффективность метода.
Наиболее близким аналогом заявляемого изобретения является работа, проведенная в институте трансплантологии (Шумаков В.И. и соавт. Тезисы доклада на 11-м Всероссийском съезде сердечнососудистых хирургов. - Москва, 23-26 октября 2005 г., стр.296; Автореферат кандидатской диссертации Берсенева А.В. Трансплантация клеток эмбриональной печени и стволовых клеток костного мозга для коррекции дислипидемии и ранних стадий атерогенеза. М., 2003 г.), в которой для лечения хронических заболеваний внутренних органов используются культивируемые аутологичные мононуклеарные клетки, содержащие стволовые и прогениторные клетки, полученные из костного мозга больного.
Данный метод позволяет исключить возможность появления костной ткани в зоне введения клеток за счет культивирования. Однако использование клеток костного мозга, забираемых у больных с хроническими заболеваниями, не позволяет существенно повысить эффективность метода, т.к. используемая взвесь состоит из клеток со сниженным регенерационным потенциалом и почти не содержит клеток, имеющих тканеспецифицескую направленность регенерационного воздействия, на соответствующий поврежденный орган. Последнее обусловлено тем, что при хроническом повреждении органа в крови и костном мозге снижено содержание тканиспецифических клонов клеток из-за суммарного снижения в нем жизнеспособной функционирующей ткани, способной обеспечить выработку тканеспецифических клонов. Именно этим объясняется, что эффективность используемого метода не превышает 60-70% (Шумаков В.И. и др. ВестРАМН 2004 г., №9, стр44-47).
Заявляемые изобретения направлены на устранение перечисленных выше недостатков и достижение технического результата, заключающегося в повышении регенерационного потенциала аутологичных мононуклеарных клеток, что в свою очередь обеспечивает повышение эффективности лечения большого спектра хронических заболеваний.
Технический результат достигается за счет того, что в способе лечения хронических заболеваний, включающем забор у больного клеточного материала с последующим выделением из него мононуклеарных аутологичных клеток, содержащих стволовые клетки, культивирование мононуклеарных аутологичных клеток с получением биотрансплантата и последующую трансплантацию последнего больному, культивирование осуществляют с добавлением тканеспецифического антигена, соответствующего поврежденному органу.
А также тем, что в способе лечения хронических заболеваний, включающем забор у больного клеточного материала с последующим выделением из него мононуклеарных аутологичных клеток, содержащих стволовые клетки, культивирование мононуклеарных аутологичных клеток с получением биотрансплантата и последующую трансплантацию последнего больному к выделенным мононуклеарным аутологичным клеткам перед культивированием добавляют лимфоидные и/или дендритные клетки, предварительно культивированные с добавлением тканеспецифического антигена, соответствующего поврежденному органу.
А также за счет того, что в способе лечения хронических заболеваний предварительно, до забора клеточного материала, больному осуществляют иммуннокоррекцию.
А также за счет того, что в способе лечения хронических заболеваний для осуществления иммунокоррекции определяют индекс стимуляции как отношение суммарной продукции активных форм кислорода клетками крови, обработанными ингибитором цАМФ-фосфодиэстеразы к суммарной продукции активных форм кислорода интактными клетками.
А также за счет того, что в способе получения биотрансплантата, включающем забор у больного клеточного материала с последующим выделением из него мононуклеарных аутологичных клеток, содержащих стволовые клетки, культивирование мононуклеарных аутологичных клеток в ростовой среде, в ростовую среду при культивировании добавляют тканеспецифической антиген, соответствующий поврежденному органу.
А также за счет того, что в способе получения биотрансплантата, включающем забор у больного клеточного материала с последующим выделением из него мононуклеарных аутологичных клеток, содержащих стволовые клетки, культивирование мононуклеарных аутологичных клеток в ростовой среде к выделенным мононуклеарным аутологичным клеткам перед культивированием добавляются лимфоидные и/или дендритные клетки, предварительно культивированные с добавлением тканеспецифического антигена, соответствующего поврежденному органу.
А также за счет того, что биотрансплантат, включающий выделенные мононуклеарные аутологичные клетки, содержит в своем составе стволовые клетки, предварительно культивированные с тканеспецифическим антигеном, соответствующим поврежденному органу.
А также за счет того, что биотрансплантат, включающий выделенные мононуклеарные аутологичные клетки, содержит в своем составе лимфоидные и/или дендритные клетки, предварительно культивированные с добавлением тканеспецифического антигена, соответствующего поврежденному органу.
Заявляемые способы лечения хронических заболеваний устраняют перечисленные недостатки аналогов в силу того, что еще до забора аутологичных мононуклеарных клеток (АМК) у больного проводится исследование иммунного статуса и осуществляется иммунокоррекция под контролем «индекса стимуляции клеток крови», что позволяет существенно повысить регенерационный потенциал этих клеток. Для обеспечения формирования тканеспецифической направленности регенерационного потенциала клеток, предназначенных для клеточной терапии, на стадии их культивирования в ростовую среду вводится тканеспецифический антиген, идентичный тому органу, регенерацию которого необходимо восстановить в организме больного.
В результате использования заявляемых изобретений наступает быстрое и почти стопроцентное улучшение функционирования поврежденных органов при их хроническом повреждении (на примере миокарда).
Изобретения поясняются следующими чертежами.
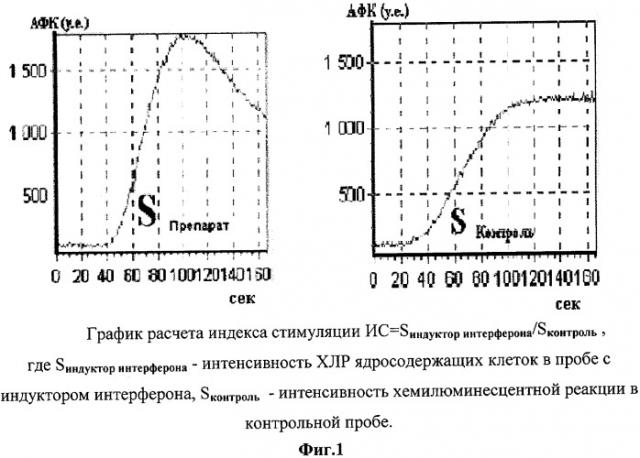
Фиг.1 - график расчета индекса стимуляции.
Фиг.2 - график прогноза благоприятного результата введения аутологичных клеток больному при индексе стимуляции >1.0.
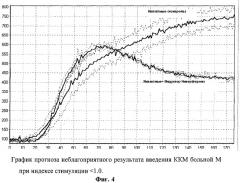
Фиг.3 - график прогноза неблагоприятного результата введения аутологичных клеток больному при индексе стимуляции <1.0.
Фиг.4 - график прогноза неблагоприятного результата введения АМК больной Л. при индексе стимуляции <1.0.
Фиг.5 - график индивидуального подбора иммунокорректоров методом хемилюминесценции.
Фиг.6 - график прогноза благоприятного результата введения АМК больной Л. при индексе стимуляции >1.0.
Фиг.7 - динамика изменения клеточного состава АМК в зависимости от условий культивирования (без и с добавлением тканеспецифического антигена (ТА)).
Фиг.8 - количественная оценка региональных изменений перфузии по стандартным проекциям статической сцинтиграфии миокарда с Тс-99м у больной Л. до и через 1 мес. после введения АМК (культивирование с ТА).
Сущность изобретения.
Предлагаемый способ включает: иммунологическое обследование больных и проведение иммунокорекции под контролем «индекса стимуляции» мононуклеарных клеток из крови больных (нормализация которого свидетельствует о восстановлении иммунологического гомеостаза); забор аутологичных клеток (костный мозг, кровь); выделение из них фракции ядросодержащих клеток, культивирование клеток в ростовой среде в присутствии тканеспецифического антигена (ТА), идентичного поврежденному органу, в течение 1-15 дней и трансплантацию подготовленной культуры клеток в организм больного с хроническим заболеванием внутренних органов.
Оценку иммунного статуса больных проводили на взвеси ядросодержащих клеток из крови до и после проведения иммунокоррекции.
Оценка индекса стимуляции клеток иммунной системы включает следующие этапы:
Для получения ядросодержащих клеток 2 мл гепаринизированной крови смешивали с 1 мл подогретого до 37°С 3% раствора желатина и инкубировали в термостате при 37°С в течение 30 мин. После оседания эритроцитов слой плазмы, обогащенный лейкоцитами, отбирали в пластиковые пробирки и отмывали 10-кратным объемом фосфатно-солевого буфера (рН 7,4). Затем лейкоциты центрифугированием в течение 10 мин при 1000 об/мин ресуспендировали в растворе Хенкса без Са2+ и Mg2+. После подсчета числа ядросодержащих клеток концентрацию последних доводили до 106 л/мл.
Определение индекса стимуляции осуществляли следующим образом.
В 2-е кюветы контрольную и опытную вносили по 40*103 клеток. В опытную кювету дополнительно вносили препарат индуктор интерферона, содержащий ингибитор цАМФ-фосфодиэстеразы производную акридонуксусной кислоты (10-карбоксиметил-9-акриданон) и N-метилглюкамин. В контрольную кювету вносили раствора Хэнкса. Контрольную и опытную кюветы инкубировали в термостате в течение 60 мин при 37°С. После инкубации клеток с проводили запись кривых хемилюминесцентной реакции (ХЛР) клеток в контрольной и опытной кюветах с использованием хемилюминометра «Хемилюм-2001 01/01» (Россия) в комплексе с компьютером IBM-PC при температуре счетной камеры 37°С, в течение 15 мин. В качестве усилителя свечения использовали люминол (5-амино-2,3-дигидро-1,4-фталазиндион, «Sigma») в конечной концентрации 10-3 М, а в качестве активатора образования активных форм кислорода - РМА (форбол-12-миристат-13-ацетат, «Sigma») в концентрации 10-6 М.
Затем вычисляли суммарную продукцию активных форм кислорода (АФК) как площадь под кривой хемилюминесцентной реакции. Рассчитывался индекс стимуляции (ИС) используемого препарата как отношение площади хемилюминесцентной реакции в контроле и опыте (фиг.1).
Индекс стимуляции >1.0 прогнозирует благоприятный результат введения аутологичных клеток данному больному (фиг.2), индекс стимуляции <1.0 прогнозирует неблагоприятный результат введения аутолбгйчных клеток данному больному (фиг.3).
Затем больному проводится иммунокоррекция одним из ниже перечисленных препаратов, используемых в терапевтических дозах.
Полиоксидоний
Имунофан
Неовир
Спленопид
Реаферон
Роферон
Ронколейкин
Т-активин
Тимоген
Циклоферон
Курс иммунокоррекции при индексе стимуляции ниже 1.0 составляет 14 дней. Для контроля эффективности иммунокоррекции у больных с исходным индексом стимуляции меньше 1.0 проводится повторное определение индекса стимуляции. Забор клеточного материала осуществляют у больных только с индексом стимуляции больше 1.0.
Получение аутологичных мононуклеарных клеток (АМК), содержащих стволовые и прогениторные клетки, из костного мозга (или периферической крови) для трансплантации больному осуществляют следующим образом.
Для забора костного мозга используют доступ из переднего гребня подвздошной кости. Забор костного мозга проводится в условиях операционной при соблюдении тех же правил асептики, как и при других оперативных вмешательствах. Болевые ощущения при заборе костного мозга главным образом связаны с высокой чувствительностью надкостницы при прокалывании иглой и требуют проведения адекватного обезболивания. Выбор между общей, спинальной, эпидуральной или местной анестезией для обезболивания зависит как от медицинских показаний, так и от предпочтений донора и анестезиолога. В 95% случаев возможно адекватное обезболивание методом местной анестезии. Донор госпитализируется утром накануне забора и при отсутствии осложнений может быть выписан во второй половине дня забора с назначением анальгетиков, рекомендациями смены повязки в местах инъекций.
После обработки кожи йодсодержащими растворами в области передних гребней делают прокол кожи и подкожно-жировой клетчатки, через который вставляют иглы для аспирации. После чего прокалывают кортикальную пластинку гребня подвздошной кости и аспирируют костный мозг из губчатого вещества кости. Для забора 50-150 мл костного мозга необходимо сделать несколько проколов кортикальной пластинки кости, для этого кожу и подкожно-жировую клетчатку перемещают аспирационной иглой. Классическая технология требует аспирировать костный мозга из каждого вкола малыми порциями (3-5) мл в 20-миллилитровый шприц. После наполнения шприца врач отсоединяет его от иглы и передает медсестре, которая переносит содержимое шприца в полимерный контейнер с антикоагулянтом.
После окончания забора в области прокола кожи накладывают повязку, а КМ сразу же отправляют в лабораторию для дальнейшей обработки в специальном контейнере с антикоагулянтом при +4С°. Объем забираемого КМ должен составлять 150-200 мл.
Аспират костномозговой взвеси клеток помещают в пробирки объемом 50 мл и центрифугируют. Плазму и интерфазу с ядросодержащими клетками собирают и осуществляют повторное центрифугирование. Плазму убирают, а к полученному осадку добавляют лизирующий раствор для элиминации эритроцитов. Пробирку закрывают и энергично встряхивают, затем центрифугируют. Осадок ресуспендируют в ростовой среде DMEM, содержащей эмбриональную сыворотку, инсулин, гентамицин и тканеспецифический антиген (получение см. ниже). Клетки высевают на чашки Петри и культивируют при 37°С в атмосфере, содержащей 5% СО2 и при 95% влажности, в течение 1-15 суток. Биотрансплантат представляет собой оставшиеся мононуклеарные клетки после культивирования и центрифугирования при 1500 об/мин в течении 5 мин. К полученному осадку добавляли р-р Хенкса (5 мл) и трансплантировали реципиенту.
Получение другого варианта биотрансплантата осуществляется следующим образом.
Из крови больного выделяется лейкоцитарная фракция клеток крови, содержащая лимфоциты и моноциты, которая затем культивируется с тканеспецифическим антигеном. После культивирования лейкоцитарная фракция, содержащая лимфоциты и моноциты, отмывается от тканеспецифического антигена методом центрифугирования. Полученные лейкоцитарные клетки добавляют к выделенным аутологичным мононуклеарным клеткам, содержащим стволовые клетки, и культивируют при 37°С в атмосфере, содержащей 5% СО2 и при 95% влажности, в течение 1-15 суток. Оставшиеся мононуклеарные клетки после культивирования центрифугировали при 1500 об/мин в течении 5 мин, добавляли р-р Хенкса (5 мл) и трансплантировали реципиенту.
Для получения тканеспецифичекого антигена брали свежевыделенную ткань органа, идентичного поврежденному. В качестве источника может быть использована аллогенная или ксеногенная ткань, при возможности используется биопсийный материал.
Ткань механически гомогенизируется на фрагменты не более 0,5 мм3. Полученный гомогенат заливается раствором Хенкса 1:1 и помещается в морозильную камеру на 1 час, затем ткань размораживают, данный цикл повторяют 3 раза. Затем гомогенат центрифугирую при 2000 об/мин 10 мин. Супернатант отбирают и фильтруют через фильтр с диаметром пор 0,22 мкм для обеспечения стерильности раствора. Концентрация белка в растворе определяется методом Лоури и должна находиться в диапазоне от 0,5 до 1 мг/мл.
Культивирование с добавлением тканеспецифического антигена проводят при добавлении, в частности супернатанта тканеспецифического антигена в культуральную среду в соотношении в среднем 1:30 (проверялся диапазон от 1:10 до 1:80).
Настоящее изобретение поясняется описанием конкретных, но не исчерпывающих его, примеров реализации.
Были проанализированы результаты лечения 80 больных, которым проводилась трансплантация аутологичных мононуклеарных клеток при лечении сердечно-сосудистой патологии.
Реципиенты аутологичных мононуклеарных клеток были разделены на 2 группы, в зависимости от исходного индекса стимуляции (ИС) аутологичных мононуклеарных клеток: группа пациентов с ИС>1.0 (n=40) и группа больных с ИС<1.0 (n=15). Группы больных не отличались между собой по медианам таких параметров, как возраст, длительность сердечной недостаточности, количество перенесенных инфарктов миокарда. У этих больных до и после трансплантации аутологичных мононуклеарных клеток определяли значения объемных характеристик левого желудочка (ЛЖ): конечный систолический объем левого желудочка (КСО ЛЖ), конечный диастолический объем левого желудочка (КДО ЛЖ), конечный систолический размер левого желудочка (КСР ЛЖ), конечный диастолический размер левого желудочка (КДР ЛЖ), фракция изгнания левого желудочка (ФИ ЛЖ) и рассчитывали прирост этих показателей, которые обозначали в виде (Δ = ((Показатель после лечения - Показатель до лечения)/Показатель до лечения)* 100%).
Были обнаружены статистически значимые различия в таких показателях, как дельта уменьшения КДО ЛЖ, КСО ЛЖ, КСР ЛЖ, КДР ЛЖ и ФИ через 1 мес. (табл.1) и 6 мес. (табл.2) после клеточной терапии по данным ЭхоКГ.
| Таблица 1 | |||
| Сравнение параметров объемных характеристик ЛЖ у пациентов с ИС<1.0 и ИС>1.0 через 1 месяц после клеточной терапии (по данным ЭхоКГ). | |||
| Параметры | ИС<1.0 | ИС>1.0 | p-level* |
| ΔКДО | 5.9±10.0 | -7.6±7.1* | 0.0006 |
| ΔКСО | 11.8±14,8 | -11.4±13.3* | 0.0001 |
| ΔКДР ЛЖ | 11.5±23.6 | -4.2±7.2* | 0,001 |
| ΔКСР ЛЖ | -1.6±16.6 | -3.3±9.7* | 0,021 |
| ΔФИ | -3.2±7.2 | 6.9±13.5* | 0.013 |
| * - достоверно по отношению к группе с ИС<1.0 (р<0.05) | |||
| Таблица 2 | |||
| Сравнение параметров объемных характеристик ЛЖ у пациентов с ИС<1.0 и ИС>1.0 через 6 месяцев после клеточной терапии (по данным ЭхоКГ). | |||
| Параметры | ИС<1.0 | ИС>1.0 | p-level* |
| ΔКДО | 4.8±9.3 | -5.3±7.7* | 0.044 |
| ΔКСО | 0.4±17.5 | -18.7±14.5* | 0.045 |
| ΔКДР ЛЖ | 20.2±32.4 | -2.1±3.5* | 0.004 |
| ΔКСР ЛЖ | -7.5±22.2 | -9.8±6.6 | |
| ΔФИ | -1.0±12.2 | 18.0±16.9* | 0.013 |
| * - достоверно по отношению к группе с ИС<1.0 (р<0.05) |
Как видно из таблицы 1, в группе где ИС>1,0 уже через месяц происходит достоверно выраженное благоприятное уменьшение КДО, КСО, КДР и КСР и увеличение ФИ по сравнению с группой реципиентов, у которых ИС<1,0. Эти данные свидетельствовали о позитивном изменение гемодинамике в группе с ИС>1.0 и об отсутствие позитивного клинического эффекта при использование клеток у больных с ИС<1.0.
Из таблицы 2 видно, через 6 месяцев наблюдения отмеченные позитивные тенденции при использовании клеток с ИС>1.0 не только сохраняются, но по некоторым показателям (КСО, КСР, ФИ) становятся более выраженными.
Таким образом, сравнительный анализ показал, что клинический эффект клеточной трансплантации напрямую зависит от исходного значения показателя индекса стимуляции.
Проводя иммунокоррекцию, перед забором костного мозга удалось повысить эффективность проводимой клеточной терапии, т.к у всех больных исходно перед забором АМК ИС стал >1.0. Группа без иммунокоррекции включала в себя пациентов с ИС>1,0 и ИС<1.0. Как видно из табл.3, в группе пациентов, которым проводили иммунокоррекцию до забора АМК через 6 месяцев после трансплантации клинический эффект был достоверно более выражен по сравнению с группой больных без иммунокоррекции.
| Таблица 3 | |||
| Сравнение параметров объемных характеристик ЛЖ у пациентов без и с предварительной иммунокоррекцией через 6 месяцев после клеточной терапии (по данным ЭхоКГ). | |||
| Параметры | Группа без иммунокоррекции | Группа с иммунокоррекцией | р-level * |
| ΔКДО | -1.7±9.4 | -15.4±8.7* | 0.044 |
| ΔКСО | -11.9±17.8 | -25.4±7.5* | 0.045 |
| ΔКДР ЛЖ | 3.8±18.4 | -2.4±3.6 | |
| ΔФИ | 11.2±17.7 | 25.0±6.9* | 0.013 |
| * - достоверно по отношению к группе без иммунокоррекции (р<0.05) |
Таким образом, предварительная иммунокоррекция повышает функциональную активность АМК и достоверно позитивно влияет на процессы ремоделирования ЛЖ у больных с сердечной недостаточностью (СН).
Необходимость добавления ТА была изучена в опытах с моделированием дислипидемического повреждения печени у морских свинок и криогенного повреждения миокарда крыс.
1. У морских свинок с хронической дислипидемией в течение 4 месяцев развивается жировая дистрофия печени и резко нарушается морфометрическая характеристика гепатоцитов (табл.4). Для ускорения восстановительных процессов в печени была проведена клеточная трансплантация с использованием АМК прокультивированных с и без добавления ТА. Тканеспецифический антиген получали из печени здоровых морских свинок по вышеописанной технологии. ТА добавляли к культуре мононуклеарных клеток костного мозга и проводили культивирование в среднем в течение 7 суток (от 1 до 15 суток). Затем клетки отмывали раствором Хенкса и трансплантировали животным. В качестве контролей использовали животных, которым трансплантировали аутологичный костный мозг, культивированный без ТА (контроль 2), и животных, которым проводили инъекцию р-ра Хенкса (Контроль 1).
| Таблица 4 | ||||||
| Влияние трансплантации АМК и АМК культивированных с ТА на регенерацию гепатоцитов поврежденной печени | ||||||
| Группа животных | Кол-во норм. Гепатоцитов (НГ) % | Кол-во дегенеративных Гепатотицов (ДГ) % | НГ/ДГ | Объемная доля ядер % | Двуядерные гепатоциты % | Ядра с двумя и более ядрышками % |
| Интактные (n=3) | 88 | 12 | 8 | 19 | 2 | 5 |
| Хр. дислипидемия (контроль 1) (n-10) | 63 | 37 | 1,8±0,2 | 12 | 2,1±0,5 | 14 |
| Хр. дислипидемия + АМК (контроль 2) (n=7) | 72 | 28 | 3,0±0,5 | 14 | 5,0±0,4 | 15 |
| Хр. дислипидемия + АМК + ТА (n=7) | 87 | 13 | 7,1±0,4 | 23 | 11,4±0,5 | 23 |
Как видно из представленных данных, трансплантация мононуклеарных стволовых клеток повышала регенерационную способность гепатоцитов при жировой дистрофии печени. Однако данный эффект был недостаточно выражен. Совместное культивирование аутологичных мононуклеарных клеток с ТА резко повышает эффект клеточной трансплантации и приводит к достоверному повышению процессов регенерации гепатоцитов в печени экспериментальных животных.
2. На модели повреждения миокарда методом криодеструкции (КД) крыс. На 30 сутки в зоне повреждения ЛЖ происходило формирование рубцовой ткани округлой формы диаметром 6-7 мм со стороны эпикарда и 3 мм со стороны эндокарда; толщина стенки ЛЖ в центре рубца не превышала 1 мм. Как видно из таблицы 7, убыль относительной массы ЛЖ (на единицу массы тела) после криодеструкции составила примерно 13%, а для свободной стенки ЛЖ этот показатель составил 17%.
Площадь некроза после криодеструкции по отношению к общей площади свободной стенки ЛЖ составила со стороны эпикарда 25.1±3.6%, со стороны эндокарда - 23.0±4.2%. Площадь трансмурального некроза после криодеструкции по отношению к общей площади свободной стенки ЛЖ составила со стороны эпикарда 11.4±0.7%, со стороны эндокарда - 6.4±2.5%.
Таким образом, проведенная морфометрия макропрепаратов поврежденного сердца позволила установить достоверное снижение мышечной массы ЛЖ, что неизбежно должно было бы привести к снижению его сократительной активности.
Тканеспецифичесий антиген (ТА) получали из сердца интактных крыс по выше описанной технологии. ТА добавляли к культуре мононуклеарных клеток костного мозга и проводили культивирование в среднем в течение 7 суток (от 3 до 15 суток). Затем клетки отмывали раствором Хенкса и трансплантировали животным. В качестве контролей использовали животных, которым трансплантировали аутологичный костный мозг, культивированный без ТА, и животных, которым проводили инъекцию физиологического раствора.
При введении в миокард животным с криодеструкцией (КД) аутологичных мононуклеарных клеток культивируемых в течение 3-10 дней нами было отмечено увеличение массы миокарда, улучшение сократительной способности сердца, однако ни в одном из проведенных опытов не было получено полного восстановления сердечной мышцы. В группе животных с КД, которым вводили АМК, прокультивирурованные с ТА, нами было отмечено достоверно более полная регенерация поврежденного органа. Следует отметить, что масса левого желудочка у крыс с КД, которым вводили АМК+ТА, достоверно не отличалась от массы миокарда интактных животных (табл.5).
| Таблица 5 | ||
| Сравнение массы интактных сердец и сердец после КД без и при введении АМК и АМК+ТА | ||
| Масса животного, г | Масса свободной стенки ЛЖ, (мг) / масса животного (г) | Масса ЛЖ (мг) / масса животного (г) |
| Интакные животные | ||
| 356.7±5. 8 | 1.701±0.031 | 2.298±0.062 |
| Животные после криодеструкции и введения физ. раствора | ||
| 366.7±28.9 | 1.395±0.125* | 2.004±0.066 * |
| Животные с криодеструкцией после введения АМК | ||
| 360.0±20.5 | 1.450±0.08* | 2.120±0.02* |
| Животные с криодеструкцией после введения АМК культивируемых с ТА | ||
| 352.3±12.2 | 1.650±0.02+ | 2.188±0.08+ |
| * - достоверны по отношению к группе интактных животных, р<0.05 | ||
| + - достоверно по отношению к группе с АМК, р<0.05 |
Проведенные нами эксперименты на животных продемонстрировали целесообразность предварительного культивирование АМК с ТА, в результате чего повышалась эффективность клеточной терапии.
Пример осуществления заявляемого способа лечения.
Клинический пример эффективности трансплантации аутологичных мононуклеарных клеток костного мозга (КМ).
Пациентка Л., 67 лет, ИБ № 1934/05 поступила в отделение коронарной хирургии и трансплантации сердца с жалобами на жгучие боли за грудиной при минимальной физической нагрузке, редко - в покое; одышку.
Из анамнеза: ангинозный анамнез более 3-х лет. Ухудшение состояния с июля 2005 года, когда был диагностирован острый не Q-образующий ИМ в области ПСЛЖ. Более 10-ти лет страдает артериальной гипертонией. Поступила для проведения коронарографии и определения дальнейшей тактики лечения.
Сопутствующие заболевания: Гипертоническая болезнь 2 ст.Сахарный диабет 2-го типа, средне-тяжелого течения. Состояние после холецистэктомии (февраль 2005 года). Мочекаменная болезнь. Эрозивный гастрит.
Аллергоанамнез - не отягощен.
При поступлении: общее состояние средней тяжести, повышенного питания, отеков нет. Над общими сонными и бедренными артериями шумов нет. В легких дыхание жесткое, проводится во все отделы, хрипов нет, ЧДД-16 в 1 мин. Границы сердца расширены влево, верхушечный толчок разлитой. Тоны сердца приглушены, ритм правильный, акцент 2-го тона на ЛА, ЧСС - 68 в 1 мин, АД-140/80 мм рт.ст. Живот при пальпации мягкий, б/б, печень не пальпируется. Дизурии нет, симптом поколачивания отрицательный с обеих сторон. Отеков нет. ЦНС - без грубой патологии.
Обследование в отделении: данные общеклинических анализов крови и мочи в пределах нормы. При R-графии органов гр.кл. патологии не выявлено.
АНАЛИЗЫ НА ВИЧ, РВ, ГЕПАТИТЫ В и С - отрицательные.
ЭКГ: ритм синусовый, ЧСС=69. Диффузное снижение амплитуды зубца «Т».
ЭХОКГ: Ао-3,4, ЛП-4,2, ПЖ-3,1, ЛЖ: КДР-4,6, КДО-95, КСР-3,1, КСО-36, УО-59, ФИ-62%. Объемные характеристики ЛЖ не увеличены. Клапанный аппарат интактен. ДЛА 12 мм рт.ст.
КГ: Тип коронарного кровоснабжения: правый тип. ЛЕВАЯ КОРОНАРНАЯ АРТЕРИЯ (ЛКА): Отмечаются выраженные диффузные изменения в виде неровности контуров. Ствол ЛКА: стеноз 3 степени в устье с сохранением просвета около 2 мм. Передняя межжелудочковая ветвь (ПМЖВ): протяженный стеноз 2-3 степени в проксимальной трети, субокклюзия в средней трети, стеноз 3 степени на границе средней и дистальной трети, два последовательных стеноза 1-2 степени в дистальной трети. Диагональная ветвь (ДВ): стеноз 3 степени в устье. Огибающая ветвь (ОВ): протяженный стеноз 2-3 степени от устья. ПРАВАЯ КОРОНАРНАЯ АРТЕРИЯ (ПКА): Два последовательных стеноза 3 степени в средней трети, стеноз 1 степени в дистальной трети.
На основании данных обследования больному определен диагноз: ИБС: нестабильная (прогрессирующая) стенокардия. Постинфарктный кардиосклероз. Недостаточность кровообращения 2а. Гипертоническая болезнь 2 ст. Сахарный диабет 2-го типа, среднетяжелого течения. Хронический эрозивный гастрит вне обострения.
В связи с тяжестью поражения коронарных артерий и клиникой нестабильной стенокардии, больной по жизненным показаниям 30 ноября 2005 года выполнена операция аортокоронарного шунтирования передней межжелудочковой ветви, диагональной ветви и правой коронарной артерии в условиях искусственного кровообращения и фармакохолодовой кардиоплегии. Во время операции перед искусственным кровообращением секционным методом взята биопсия ушка правого предсердия. Протокол операции №181 (0перировал д.м.н. Гуреев С.В.)
Ранний послеоперационный период протекал без осложнений. Экстубация в операционной. Пациентка переведена из реанимационного блока в отделение на следующие сутки. В отделении отмечались пароксизмы мерцательной аритмии (03.12.2005 и 23.12.2005), гемодинамически не значимые, купировавшиеся препаратами калия и кордароном. В связи с низким уровнем гемоглобина (до 7,8 г/дл) в послеоперационном периоде были проведены два переливания эр. массы (03.12.2005 и 05.12.2005).
Пациентка была включена в научно-клиническую программу трансплантации аутологичных стволовых клеток костного мозга в миокард. 16.12.2005 произведен забор костного мозга с дальнейшей сепарацией клеток костного мозга. Аутологичные мононуклеарные клетки в течение 5 дней культивировались с тканеспецифицеским антигеном, полученным из биопсийного материала во время операции. 22.12.2005 произведено их интракоронарное и системное (нисходящий отдел аорты) введение. Без осложнений.
При контрольной коронарошунтографии: в месте субокклюзии ПМЖВ зафиксирована окклюзия артерии. Шунт к ПМЖВ проходим, хорошо контрастируются дистальные и проксимальные участки ПМЖВ. Шунт в ДВ хорошо проходим, через шунт заполняется вся система ЛКА, за исключением ПМЖВ, окклюзированой в проксимальной трети. Шунт к ПКА хорошо проходим, заполнение всей ПКА и крупной ветви острого края.
В отделение состояние оставалось стабильным. На серии контрольных ЭКГ и ЭхоКГ без отрицательной динамики. Послеоперационные раны заживали первичным натяжением, швы внутрикожные.
Уровень глюкозы крови за все время наблюдения от 5,1 до 8,9 (26.12.2005: 9-7,5, 12-7,9, 15-8,1, 18-6,7, 21-7,5). Общий холестерин - 7,1. Гб - 9,3. В остальных анализах без особенностей.
В удовлетворительном состоянии пациентка выписывается под наблюдение кардиолога по месту жительства.
Диагноз заключительный: ИБС: состояние после АКШ ПМЖВ, ДВ и ПКА от 30.11.2005. ПИКС.НК 1. ГБ 2 ст. состояние после трансплантации аутологичных стволовых клеток костного мозга от 22.12.2005. Сахарный диабет 2-го типа, средне-тяжелого течения. Хронический эрозивный гастрит вне обострения.
До забора был определен индекс стимуляции, который был меньше 1.0 (фиг.4).
Для повышения клинического эффекта больной был проведен индивидуальный подбор иммунокорректоров (фиг.5.). Из представленного рисунка видно, что таким препаратом являлся полиоксидоний.
Данный препарат был назначен пациентке по схеме: 7 инъекций, 1-й день 12 мг в/м, затем через день по 6 мг в/м. По окончанию курса был повторно проведен анализ по определению индекса стимуляции (фиг.6), который показал восстановление ИС до нормальных значений.
Затем у больной был проведен забор костного мозга, выделены АМК и проведена сокультивация их с ТА полученным из биопсийного материала. При культивировании АМК с добавлением ТА в течение 5 суток происходит изменение фенотипического состава культивируемых клеток по сравнению с исходом и теми клетками, которые культивировались без ТА (фиг.7). Как видно из представленного чертежа, в культуре АМК после добавления антигена происходит увеличение доли Т-лимфоцитов, особенно Т-хелперов (CD4), которые, поданным литературы (Бабаева А.Г. Репаративные процессы и иммунитет. - Известия АН, серия «Биологическая» 1999, №3, стр.261-269), определяют эффективность регенерационных процессов в поврежденном органе.
На контрольном обследовании через 1 месяц после трансплантации клеток было установлено выраженное повышение показателей гемодинамики (ΔКДО - 10%, ΔКСО - 8,5%, ΔФИ 12%) и перфузии миокарда (фиг.8), что может быть обусловлено улучшением микроциркуляции за счет неоангиогенеза.
Где а - перфузия миокарда до введения АМК; б - через один месяц после введения АМК; в - исходные данные перфузии миокарда в % по сегментам левого желудочка; г - данные перфузии миокарда левого желудочка по сегментам в % через месяц после интракоронарного введения АМК. Стрелками указаны сегменты с приростом перфузии миокарда более чем на 5%
Заявляемые изобретения позволяют лечить любые хронические заболевания. Это обеспечивается формированием тканиспецифической направленности регенерационного потенциала клеток, предназначенных для клеточной терапии. Проведенные клинические и экспериментальные исследования подтверждают высокую эффективность клеточной трансплантации при введении на стадии культивирования в ростовую среду тканеспецифического антигена идентичного тому органу, регенерацию которого необходимо восстановить в организме больного.
1. Способ лечения хронических заболеваний, включающий забор у больного клеточного материала с последующим выделением из него мононуклеарных аутологичных клеток, содержащих стволовые клетки, культивирование мононуклеарных аутологичных клеток с получением биотрансплантата и последующую трансплантацию последнего больному, отличающийся тем, что культивирование осуществляют с добавлением тканеспецифического антигена, полученного из выделенной ткани органа, соответствующего поврежденному.
2. Способ лечения хронических заболеваний, включающий забор у больного клеточного материала с последующим выделением из него мононуклеарных аутологичных клеток, содержащих стволовые клетки, культивирование мононуклеарных аутологичных клеток с получением биотрансплантата и последующую трансплантацию последнего больном