Способ лечения заболеваний
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к методам лечения нарушений гемопоэза, связанных с дефектами хромосом и последующей гибелью стволовых клеток крови (СКК) при терапии цитостатиками или высокими дозами радиации, лечения заболеваний, связанных с нарушением механизмов дифференцировки СКК. Способ основан на введении в организм пациента фрагментированной ДНК, которая является аллогенной, получена от генетически и физиологически здоровых доноров и состоит из фрагментов, длина которых соответствует 1-10 нуклеосомным единицам, составляющих полный геном пациента, в ассоциации с белками ядерного матрикса. Вводят такое количество фрагментированной ДНК, чтобы достичь концентрации фрагментированной ДНК в плазме крови пациента, равной или превышающей концентрацию собственной ДНК плазмы крови, но не более 1500 нг/мл. Способ позволяет восстанавливать ДНК пациента путем замещения мутантных участков хромосом - гомологической рекомбинации и обеспечивает расширение области применения препарата фрагментированной ДНК. 4 ил., 7 табл.
Реферат
Изобретение относится к медицине, в частности к методам лечения пациентов препаратами, содержащими генетический материал, и может быть использовано для лечения нарушенного гемопоэза, связанного с дефектами хромосом и последующей гибелью стволовых клеток крови (СКК) при терапии цитостатиками или высокими дозами радиации, для лечения заболеваний, связанных с нарушением базовых механизмов дифференцировки СКК, без деления в сторону специфических гемопоэтических элементов, которые возникают при гемобластозах вследствие злокачественного изменения клеток гемопоэза, которые становятся не способными к нормальной дифференцировке, в результате чего наблюдается их неконтролируемая пролиферация, а также заболеваний, связанных с дефектами хромосом СК, вылечивание которых зависит от появления в организме генетически, фенотипически и физиологически здоровых стволовых клеток (СК).
Известен способ лечения, основанный на исправлении точечных мутаций в клетках [1].
Способ отличается относительно низкой эффективностью лечения и ограниченностью применения, поскольку согласно этому способу мутации должны быть точно определены еще до начала лечения.
Ввиду того, что ни для одной мутации нет достоверного доказательства того, что именно эта мутация привела к гибели СК или является причиной злокачественного перерождения клеток гемопоэза, развитие этого метода требует скрупулезных и длительных исследований по выявлению конкретных мутаций, требующих коррекции, а следовательно, существует необходимость в создании методов, которые могли бы применяться на основе уже имеющихся знаний о механизмах коррекции генома, не делая акцента на конкретных мутациях, приведших к гибели СКК или их злокачественному перерождению.
Известны также способы лечения, основанные на локальном применении ДНК (дезоксирибонуклеиновая кислота) фрагментов для лечения предраковых состояний в коже пациентов [2, 3].
Эти способы также имеет ограниченную применимость, поскольку ни конкретные последовательности, ни источники ДНК в указанных патентах не определены. В них предлагаются использовать как природную, так и синтетическую ДНК из «любых подходящих источников», например ДНК лосося длиной от 200 до мононуклеотидов и нуклеозидов, включая димеры, что в соответствии с тестами авторов является наиболее эффективным. Однако действие и последствия применения ДНК иной природы на человеческий организм пока не полностью изучены, что предопределяет определенную опасность применения способов.
Наиболее близким по своей сущности к предлагаемому является способ, основанный на применении препарата Полидан, представляющего собой высокоочищенную стандартизированную смесь натриевых солей полихлоргидратов дериватов ДНК (дезоксирибонуклеиновая кислота) и РНК (рибонуклеиновая кислота), получаемую из молок осетровых рыб, дозу которого вводят подкожно или внутримышечно медленно в течение 1,5-2 минут с предварительным согреванием флакона с препаратом в руке до температуры тела пациента [4].
Недостатком наиболее близкого технического решения является ограниченная область применения, поскольку активная субстанция препарата выделена из тканей ксеногенного организма и содержит как ДНК, так и РНК молекулы. Несмотря на то, что активная субстанция препарата Полидан действует на геном СКК схожим с ДНК человека образом, а именно мимикрирует наличие разрывов хромосом присутствием двуцепочечных концов, доставленных в ядро фрагментов ДНК, чем активирует СКК к терминальной дифференцировке, а также создает условия за счет нахождения частичной гомологии между ДНК препарата Полидан и ДНК хромосом человека для осуществления актов гомологической рекомбинации и сохранения физической длины и структуры хромосом, достаточных для цепи последовательных митозов, субстанция препарата Полидан при этом привносит в реципиентный геном чужеродные последовательности.
Такое действие препарата Полидан спасает гемопоэтичесую функцию СКК за счет восстановления и поддержания функционального размера хромосом этих клеток и, по-видимому, в целом не затрагивает высокоспециализированные свойства дифференцированных клеток крови, причем одновременно активируя их к терминальной дифференцировке своим мимикрирующим действием, тем не менее такие спасенные СКК нельзя считать в полной мере вернувшими свое исходное генетическое состояние, поскольку любое другое направление дифференцировки, где принимают участие задетые рекомбирнацией с чужеродным генетическим материалом хромосомные локусы, неизбежно приведет к дефектам этого пути развития СКК. Внутренняя структура хромосом при такой рекомбинации приобретает абсолютно непредсказуемые черты и до сих пор не исследован долгосрочный прогноз лейкостимуляции с использованием препаратов чужеродной ДНК.
Требуемая задача заключается в расширении области применения и лечения нарушенного гемопоэза, связанного с дефектами хромосом и последующей гибелью стволовых клеток крови (СКК), например, при терапии цитостатиками или высокими дозами радиации, для лечения пациентов с заболеваниями, связанными с нарушением базовых механизмов дифференцировки СКК без деления в сторону специфических гемопоэтических элементов, которые возникают при гемобластозах вследствие злокачественного изменения клеток гемопоэза, которые становятся не способными к нормальной дифференцировке, в результате чего наблюдается их неконтролируемая пролиферация, а также для лечения пациентов с заболеваниями, связанными с дефектами хромосом СК, вылечивание которых зависит от появления в организме генетически, фенотипически и физиологически здоровых стволовых клеток (СК).
Требуемый результат достигается тем, что в способе лечения заболеваний, основанном на введении в организм пациента фрагментированной ДНК, фрагментированная ДНК является аллогенной и состоит из фрагментов, длина которых соответствует 1-10 нуклеосомным единицам, составляющих полный геном пациента в ассоциации с белками ядерного матрикса, при этом количество фрагментированной ДНК принимают равным или превышающим количество собственно ДНК плазмы крови и тканевых жидкостей пациента, но не более 1500 нг/мл.
Способ основан на способности СКК отвечать на воздействие препаратов фрагментированной ДНК. Фрагменты ДНК, доставленные в ядерное пространство СКК, вследствие естественного механизма гомологической рекомбинации (ГР) замещают мутантные участки генов или восстанавливают исходную физическую длину хромосом, что явилось причиной утраты СК их жизнеспособности, и тем самым нежизнеспособная или мутантная СКК становится жизнеспособной. При этом хромосомы СКК приобретают физические параметры, позволяющие СКК осуществлять цепь последовательных митозов, а в оптимальном варианте геном обработанной СКК полностью исправляется и становится идентичным геному исходной здоровой СК. В тот же самый момент доставленные в ядерное пространство фрагменты экстраклеточной ДНК своими двуцепочечными концами создают иллюзию появления функциональных разрывов в хромосомах СКК, являющихся индуктором их терминальной дифференцировки. Это мимикрирующее действие экстраклеточных фрагментов ДНК, локализованных внутри ядра СКК, запускает механизмы клеточной дифференцировки, активирует и поддерживает в непрерывно активном состоянии кометированное деление СКК.
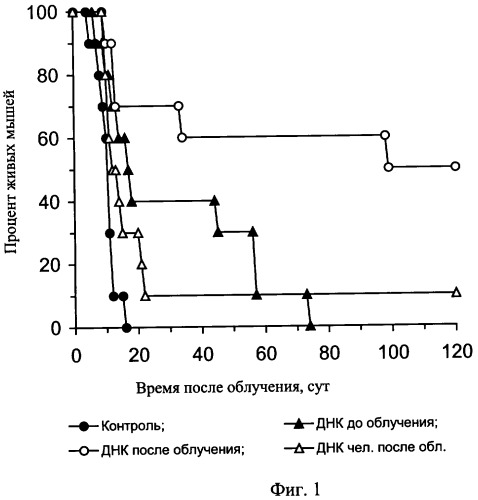
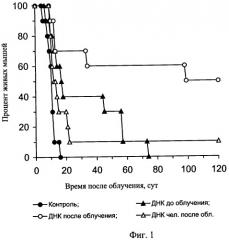
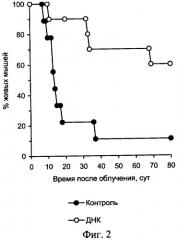
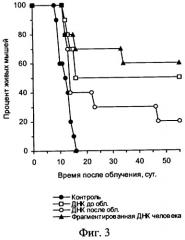
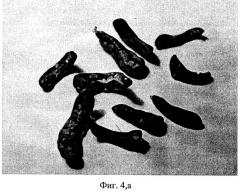
На чертеже представлены: на фиг.1 - характеристика влияния ДНК мыши и человека на выживаемость мышей после их γ-облучения в летальной дозе, на фиг.2 и фиг.3 - характеристика радиозащитного действия аллогенной ДНК при внутрибрюшинном введении мышам до и после летального γ-облучения, на фиг.4,а представлены дессектированные селезенки мышей после γ-облучения и терапии экстраклеточной фрагментированной ДНК человека и мыши. Наблюдается большое количество эндогенных селезеночных колоний (см. таблица 1), образованных потомками спасенных СКК. На фиг.4,б представлены дессектированные селезенки мышей после γ-облучения без терапии экстраклеточной фрагментированной ДНК человека и мыши. Наблюдается практическое отсутствие (см. таблица 1) колоний, что свидетельствует о разрушении механизмов восстановления СКК.
Предложенный способ лечения реализуется следующим образом.
Для его осуществления в организм пациента известными путями и способами (внутривенно, внутримышечно, путем внутрикожной инъекции, подкожно, внутрибрюшинно, нанесением на различные слизистые оболочки, приемом через рот (с или без предварительной нейтрализации кислой среды желудка либо с использованием специальной нерастворимой в желудке оболочки), через прямую кишку, интравагинально, интрокулярно, через нос, путем интроокулярной инъекции или ингаляцией вводятся специальным образом обработанные фрагменты аллогенной ДНК, полученной от генетически и физиологически здоровых доноров.
Количество вводимого препарата должно быть таким, что бы концентрация фрагментированной ДНК в крови и тканевых жидкостей пациента не превышала максимально допустимого количества, равного 1500 нг/мл.
В случае обработки СКК ex vivo для последующей автотрансплантации СКК должны быть обработаны препаратом фрагментированной ДНК в концентрации не превышающей 30 мкг/мл.
При этом фрагментированная ДНК, будучи введенная в организм пациента, доставляется в активно делящиеся клетки организма, в том числе и к СКК, при помощи естественного механизма доставки (кровоток, специфические рецепторы, расположенные на поверхности активно делящихся клеток).
Далее фрагментированная экстраклеточная ДНК, доставленная во внутриклеточное пространство, депонируется в межхромосомном компартменте ядра и подвергается внутриядерному процессингу.
В этом случае фрагменты ДНК, будучи депонированными в межхромосомном компартменте ядра, вследствие естественного механизма гомологической рекомбинации (ГР) замещают мутантные участки хромосом мутации, в которых привели к нежизнеспособности СКК. В результате указанных событий происходит реверсивное полое или частичное восстановление функций СКК, активация митотического процесса и вступление СКК на путь дифференцировки. В указанном процессе воздействия экзогенной фрагментированной ДНК на СКК важным является свойство СКК (и других типов СК, в том числе и ЭСК) в ходе нескольких (1-3) первых митозов полностью перестраивать свой геном, приводя его к кометированному состоянию. При этом в геноме СКК возникают многочисленные разрывы хроматина, являющиеся неотъемлемой частью процесса перестройки генома. Если в этот момент в ядре СК находится гомологичная ДНК требуемого размера в комплексе с белками ядерного матрикса, то она становится доступной для интеграции в геном по типу гомологической рекомбинации, при этом активность данного процесса за счет появлений в хроматине многочисленных физиологичных, функциональных разрывов многократно увеличивается. Кроме этого активирующее влияние фрагментов ДНК на дифференцировку СКК связано с их мимикрирующим действием. Доставленные в ядерное пространство фрагменты экстраклеточной ДНК привносят в ядро клетки большое количество двуцепочечных концов, которые клетка воспринимает как свои собственные функциональные разрывы хромосом, которые образуются и быстро репарируются в ходе их терминальной дифференцировки. Это мимикрирующее действие экстраклеточных фрагментов ДНК, локализованных внутри ядра СКК, запускает механизмы клеточной дифференцирвки, активирует и поддерживает в непрерывно активном состоянии кометированное деление СКК.
Таким образом, при введении в организм препарата фрагментированной аллогенной ДНК, полученной от физиологически и генетически здоровых доноров, происходит ее поглощение СКК в процессе деления посредством естественного механизма доставки, свойственного активно делящимся клеткам (рецептор-опосредованный пиноцитоз). Доставленная в ядерный компартмент - межхромосомное пространство - фрагментированная ДНК депонируется и вступает в процесс гомологического обмена с соответствующими локусами хромосом в момент перестройки генома СКК и связанного с этим временного появления в хроматине многочисленных разрывов. Вследствие естественного механизма гомологической рекомбинации депонированные в межхромосомном пространстве фрагменты ДНК замещают мутантные участки хроматина, мутации в которых привели к нежизнеспособности СКК, а также могут замещать любые мутантные локусы генов СК на немутантные. Вследствие указанных событий геном СКК претерпевает частичную или полную коррекцию, что приводит к восстановлению митотического потенциала СКК или же к полному восстановлению поврежденного генома СКК. В тот же самый момент доставленные в ядерное пространство фрагменты экстраклеточной ДНК привносят в ядро клетки большое количество двуцепочечных концов, которые клетка воспринимает как свои собственные функциональные разрывы хромосом, которые образуются и быстро репарируются в ходе их терминальной дифференцировки. Это мимикрирующее действие экстраклеточных фрагментов ДНК, локализованных внутри ядра СКК, запускает механизмы клеточной дифференцировки, активирует и поддерживает в непрерывно активном состоянии кометированное деление СКК.
Эффект, достигаемый при использовании предлагаемого изобретения, может быть обоснован следующими теоретическими данными.
Согласно современной классификации к стволовым клеткам относятся тотипотентные клетки морулы, плюрипотентные клетки бластоцисты, из которых в организме формируются все ткани организма, и мультипотентные региональные герминативные клетки [5]. Региональные или тканеспецифические стволовые клетки сохраняются в течение всей жизни организма, самоподдерживаются и обеспечивают постоянное пополнение утраченных клеточных популяций. Тканеспецифичекие СК вносят вклад в регенерацию и поддержание многочисленных, если не всех тканей млекопитающих, включая кровь, печень, кишечник, скелетную мускулатуру и центральную нервную систему. До последнего времени считалось, что тканеспецифические СК детерминируются в определенные типы клеток и распределяются в тканях, из которых они произошли. Тем не менее, в последнее время появилось большое количество работ, свидетельствующих о гораздо большей пластичности региональных СК [6, 7]. Например, подтверждено, что СК нейронов, выделенные из тканей мозга мышей, дифференцируются в клетки крови, скелетной мускулатуры и эндотелиальные клетки, что СК клетки жировой ткани человека дифференцируются в клетки кости, мышц и хряща и также что СК дермы кожи млекопитающих дифференцируются в клетки скелетных мышц, нейроны, глиальные и жировые клетки. Показано, что некоторые редкие популяции клеток, так называемые мультипотентные прогениторные клетки способны дифференцироваться в дериваты всех трех зародышевых листков. Также возможность дифференцироваться в клетки неродственных тканей были продемонстрированы для СК костного мозга, исходно участвующих в формировании и поддержании популяции клеток крови.
Открытие феномена пластичности стволовых клеток и возможности их дифференцировки в клетки тканей экто-, мезо- и эндодермального происхождения, а также способность СК мигрировать из костного мозга и пополнять пулы стволовых клеток различных тканей позволило сформулировать концепцию об общем регенеративном механизме тканей, где основную роль играют СК. Это послужило основой для возникновения и бурного развития нового направления - регенеративной медицины, основанного на применении СК клеток с целью восстановления клеточного состава органов и тканей, поврежденных вследствие заболеваний, воздействия химических агентов, травм или возрастных дегенеративных изменений.
Одним из основных и наиболее часто встречаемых негативных типов воздействия на регенеративные процессы организма является лучевая и химиотерапии, применяемые в онкологической практике. Вследствие применения жесткого излучения или цитостатиков различной природы наряду с раковыми клетками погибают все активно пролиферирующие клетки, в том числе и стволовые. В частности, следствием такого воздействия является частичное или полное нарушение гемопоэза, что приводит к негативному прогнозу. Как известно, постэмбриональный гемопоэз представляет собой процесс физиологической регенерации крови, который компенсирует физиологическое разрушение дифференцированных клеток.
Особенно сильнорегенерирующий потенциал крови затрагивает высокодозная химиотерапия, которая без компенсирующего воздействия дает высокий процент токсической смертности. В настоящее время получил широкое применение метод высокодозной химиотерапии (ВДХТ) совместно с трансплантацией аутологичных клеток-предшественников гемопоэза. Единственным источником восстановления кроветворения являются гемопоэтические СК, находящиеся в костном мозге. Для процедуры аутотрансплантации стволовые клетки (CD34+) выделяют из костного мозга или периферической крови, замораживают в присутствии криостабилизатора (DMSO) и используют для восстановления кроветворной функции костного мозга, поврежденной радиацией или высокими дозами цитостатиков [8].
Предлагаемый способ лечения принципиально отличается от способа, основанного на воздействии медиаторных, колониестимулирующих молекул, являющихся факторами роста, стимулирующими активность стволовых клеток. Под активностью СКК следует понимать увеличение пролиферативного потенциала СКК, сохранение способности к дифференцировки и развитию конкретных видов клеток, и именно эти качества СКК регулируют факторы роста. Факторы роста включают колониестимулирующие факторы (КСФ), интерлейкины и ингибирующие факторы. Все они являются гликопротеинами с молекулярной массой около 20 КД и действуют и как циркулирующие гормоны и как местные медиаторы, регулирующие гемопоэз и дифференцировку специфических типов клеток. Действие факторов роста распространяется на СКК, колониеобразующие единицы (КОЕ), кометированные и зрелые клетки. Так, например, при уменьшении количества эритроцитов и соответственно снижения парциального давления кислорода (Po2) является сигналом для продукции эритропоэтина. Эритропоэтин действует на чувствительные к нему КОЕ-Э, стимулируя из пролиферацию и дифференцировки. Интерлейкины действуют на полипотентную СК, большинство КОЕ и иногда на терминально дифференцирующиеся клетки. Ингибирующие факторы дают противоположный эффект - тормозят гемопоэз. Их недостаток может быть одной из причин лейкимии, характеризующейся значительным увеличением числа лейкоцитов в крови. Выделен ингибирующий лейкимию фактор, который тормозит пролиферацию и дифференцировку моноцитов-макрофагов. Все указанные воздействия являются регуляторными и определяются медиаторными молекулами факторов роста, которые воздействуют на различные клеточные механизмы, запускающие или регулирующие процессы репликации хроматина и транскрипции различных белков, опосредующих метаболизм пролиферирующей и дифференцирующейся СКК. При этом факторы роста используются для восстановления гемопоэтической функции крови.
В случае лечения по предлагаемому способу происходит восстановление поврежденного хроматина СК и тем самым стволовая клетка становится в состоянии осуществлять полноценный митоз и отвечать на воздействие факторов роста. Коротко можно сказать, что если нечего стимулировать, то не помогут никакие факторы роста. В тот же самый момент при лечении по предлагаемому способу доставленные в ядерное пространство фрагменты экстраклеточной ДНК своими двуцепочечными концами создают иллюзию появления функциональных разрывов в хромосомах СКК, являющихся индуктором их терминальной дифференцировки. Это мимикрирующее действие экстраклеточных фрагментов ДНК, локализованных внутри ядра СКК, запускает механизмы клеточной дифференцировки, активирует и поддерживает в непрерывно активном состоянии кометированное деление СКК.
Механизм возникновения и поддержания мутаций в СК, связанных с применением мутагенов, процессом старения, по нашему мнению, выглядит следующим образом.
Геномная ДНК любого организма подвержена мутагенному воздействию факторов внешней среды, таких как ионизирующее излучение, химические мутагены, так же как и внутренних факторов, включая ошибки репаративных систем клетки. Известный репаративный механизм клетки устраняет повреждения ДНК или неправильные замены нуклеотидов и ковалентно соединяет одноцепочечные и двуцепочечные разрывы (ОЦР, ДЦР) после мутационных событий [9]. В случае, когда повреждения затрагивают обе цепи ДНК и имеют заметную протяженность, репарация таких участков становится проблематичной и повреждения часто приводят к мутациям. ДЦР являются примером повреждений, которые практически невозможно исправить известным механизмом репарации, поскольку они затрагивают как хромосомную целостность, так и непосредственно целостность молекулы ДНК. Известен быстрый механизм репарации двухцепочечных разрывов, включающий использование клеткой белков KU70/KU-86 и ядерную ДНК зависимую протеинкиназу, которые объединяют концы ДНК и восстанавливают геномную целостность [10]. Невозможно восстановить нуклеотиды или короткие ДНК фрагменты, которые были утрачены при одновременных множественных разрывах молекулы ДНК. И как следствие таких потерь после восстановления целостности хромосомы возникают хромосомные аберрации, а ДЦР при этом выступают источником мутаций.
В современной онкологической практике широко применяются химические цитостатики и жесткое γ-облучение, нарушающие целостность двуцепочечной ДНК за счет алкилирующего воздействия в первом случае, и непосредственного воздействия лучей и действия возникающих при ионизации свободных радикалов - во втором. Множественные двуцепочечные разрывы, возникающие в ДНК при такого рода воздействиях, приводят к остановке синетических процессов в ядре и к нарушению клеточного цикла. В конечном счете включается программа самоуничтожения, и клетка либо подвергается апоптозу либо в ней возникают глубокие генетические изменения. Именно такие повреждения ДНК, возникающие во всех клетках организма и особенно в активно пролиферирующих приводят либо к гибели этих клеток либо к возникновению мутантных потомков.
К сожалению, вместе с раковыми клетками гибнут или мутируют и другие активно делящиеся клетки организма, такие как клетки эпителия, лейкоциты, стволовые клетки красного и белого кровяных ростков, клетки волосяных фолликул и другие. Наиболее опасным является уничтожение клеток крови, поддерживающих активный иммунный ответ организма. В ряде работ была высказана гипотеза о существовании естественного механизма, который может влиять на генетическую составляющую клетки многоклеточных организмов, используя внеклеточную геномную ДНК из биологических жидкостей как внешний геномный стандарт [11, 12]. Согласно предложенному механизму ДНК связывающие рецепторы, располагающиеся на клеточной поверхности, доставляют фрагменты геномной ДНК из внешней среды в ядро, где они замещают соответствующие гомологичные фрагменты в клеточной геномной ДНК через механизм гомологической рекомбинации.
Далее мы рассмотрим вопрос о том, каким образом могут быть использованы мутированные фрагменты ДНК из клеток, подверженных мутагенным воздействием в прогрессивном развитии мутационных изменений в организме.
Элементы оборота ДНК в организме, такие как внеклеточная ДНК кровяного русла, транспорт ДНК в ядро и соматическая гомологическая рекомбинация могут составлять суть механизма, способного удалять любые фиксированные или вновь образованные мутации из клеточного генома. Эффективность этого процесса в полной мере зависит от качества и свойств внешнего ДНК стандарта. С одной сторон, данный механизм может удалять мутации, замещая их экзогенными немутантными последовательностями; с другой стороны, указанный механизм может вводить мутации в клетку, замещая здоровые клеточные последовательности на мутантные экзогенные гомологичные фрагменты. Последние особенно применимо к ситуации, возникающей в организме сразу после воздействия сильного мутагенного агента. Известно, что химические мутагены так же как и жесткое облучение индуцируют апоптоз, вследствие чего идет выброс в кровь фрагментов ДНК с большим количеством разнообразных дефектов, включая летальные [13, 14].
Механизм транспорта ДНК доставляет все эти фрагменты в клетки, а ГР инкорпорирует их в клеточный геном. Далее, клетки, получившие ДНК фрагменты, несущие летальные мутации, погибают и последовательно выделяют свою геномную ДНК, содержащую мутантные последовательности, в окружающую среду. Клетки, которые получили ДНК, не несущие летальные мутации, выживают и далее могут составлять стартовую популяцию для селекции, например, ракового клона. Среди апоптозных фрагментов ДНК могут присутствовать такие, которые образовались в результате репарации без учета гомологии. Такие фрагменты будут содержать объединенные фрагменты ДНК из различных районов генома из одной или различных хромосом. Эти «химерные» фрагменты будут встроены в геном реципиентной клетки с учетом гомологии концевых участков фрагмента. Поскольку эти концы могут принадлежать разным участкам хромосомы или разным хромосомам, то рекомбинационные события могут привести к различным хромосомным аберрациям. Предполагается, что мутантные фрагменты ДНК клеток, подвергшихся воздействию сильного мутагена, будут повторно доставлены от погибших клеток к живым. Эти фрагменты будут индуцировать те же самые мутации и хромосомные аберрации в живых клетках и в ходе многочисленных раундов гибели клеток эти фрагменты будут распространять дефект, возникший при первичном воздействии мутагена.
Согласно существующих теоретических и экспериментальных предпосылок, на которых базируются наши рассуждения, если в кровяном русле организма, подвергающегося воздействию сильного мутагена или высокой дозы радиации, будут присутствовать здоровые фрагменты ДНК, составляющие весь геном, гомологичный геному реципиента, то они будут конкурировать системе оборота ДНК с фрагментами, выброшенными в кровь, в результате описанных выше событий после действие мутагена. Здоровые фрагменты будут являться субстратом для репаративной гомологической рекомбинации, протекающей в ядре, и их участие в репаративных процессах приведет к исправлению мутантных локусов и как следствие к появлению здоровой популяции соответствующей группы клеток. Препарат фрагментированной ДНК содержит в своем составе пул здоровых фрагментов специально обработанной ДНК человека, за счет которых идет прямое воздействие на поврежденный геном СК, приводящий с восстановлению целостности хромосом и восстановлению способности СКК осуществлять цепи последовательных митозов с последующей дифференцировкой.
Предлагаемый способ лечения, основанный на воздействии на СКК, можно применять при любом генетическом нарушении, исправляя его в пуле СКК, которые затем трансплантируются в тот же самый организм.
Эффект, достигаемый при использовании предлагаемого изобретения, может быть обоснован следующими теоретическими данными.
Каждая клетка организма имеет геномную ДНК, в которой закодирована информация как обо всех белках всех клеток организма, так и о пространственной организации генов в ядре, необходимой для корректной пространственно-временной экспрессии этих белков. В итоге геномная ДНК представляет собой матрицу жизни организма, включающую информацию как об организме в целом, так информацию о его развитии. Изначально геномная ДНК идентична во всех клетках организма. Однако по мере роста организма геномная ДНК каждой клетки подвергается мутационным воздействиям, вызванным факторами окружающей среды и ошибками, возникающими при клеточной репликации и репарации. Известно, что механизмы репарации замещают неправильные или ущербные основания ДНК и снова замыкают концы молекулы ДНК после одно- и двухзвенных разрывов (ДЦР) цепей сразу же после мутационных событий. Для этого в качестве матрицы они могут использовать вторую цепь ДНК. В случаях, когда участки поражения очень длинные и затрагивают обе цепи ДНК, репарация становиться проблематичной, а результатом нарушение может явиться мутация. Таким образом, мутагенные факторы окружающей среды и ошибки клеточной репарации и репликации являются источниками соматических мутаций в клетках. Наиболее важными для восстановительного потенциала организма являются плюрипотентные СК. Дефекты в структуре генома этих клеток влекут за собой возникновение дефектной ткани и формированию патологии. Единственным патогенетически обоснованным подходом к лечению заболеваний, связанных с генетическими нарушениями, в том числе и структуре генома СК, является изменение тем или иным способом генома этих клеток организма индивида и восстановления исходного, свойственного здоровой клетке генетического гомеостаза.
В современной экспериментальной медицине были разработаны многочисленные методы генной терапии, однако все они имеют серьезные недостатки и малоэффективны в рамках сложного эукариотического организма.
Классические методы генной терапии (gene-targeting, ген-таргетинг) направлены на исправление хромосомных мутаций, с использованием вирусных конструкций, способных эффективно ввести работающие копии генов в клеточный геном. Тем не менее, обеспечивая случайную встройку гена и регуляторных областей, эти подходы связаны с рядом проблем, включающих зависимость генной экспрессии от места интеграции, сайленсинг введенного вирусного генома и инсерционный мутагенез, ассоциированный с карциногенезом |15, 16]. Привлекательной альтернативой этим методам могла бы стать коррекция или замещение мутантного гена в составе хромосомы путем естественной гомологичной рекомбинации с доставленной в клетку ДНК матрицей, не содержащей мутации, если бы не чрезвычайно низкая эффективность метода, обнаруженная в ранних попытках его использования [17, 18] Исторически стратегия генного замещения (gene replacement), разработанная с целью преодоления проблемы инсерционного мутагенеза на дрожжах и позже на клетках млекопитающих, включала использование линейной рекомбинантной ДНК, в которой два конца гомологичны районам, фланкирующим замещаемый ген, а сам ген замещен селектируемым маркером [19]. Такой тип генного таргетинга называется «ends-out», поскольку концы конструкции соответствуют двум расходящимся (от целевого гена) последовательностям хромосомальной ДНК. При этом концы «ends-out» ген-таргетинг конструкции рекомбинагенны и облегчают замещение генной последовательности, заключенной между концевыми гомологиями. Недавно было показано, что у дрожжей при замещении целого гена гетерологичной последовательностью или замещении единственной мутантной пары оснований этим методом процесс инициируется двумя независимыми "strand invasions" (внедрение цепей), что подразумевает поиск гомологии и рекомбинационные события, осуществляемые двумя концевыми сегментами терапевтической конструкции [20]. Ранее подобный механизм был предложен для объяснения «ends-out» ген-таргетинга в клетках млекопитающих [21]. Соматическая ГР судя по тому, что она сохранилась в эволюции миллиарды лет от простейших до млекопитающих, должна очевидно выполнять абсолютно необходимую и универсальную во всех царствах живого функцию, и исполнять ее эффективно. Поскольку соматическая гомологическая рекомбинации (ГР) у одноклеточных дрожжей является основным механизмом прецизионной репарации ДЦР, ее эффективность должна быть очень высокой, чтобы обеспечить спасение индивида. Ранние эксперименты с микроинъекциями плазмид в клеточное ядро привели к открытию того, что плазмиды всегда интегрировали в клеточный геном в форме одного конкатемера, состоящего из всех (часто более ста) инъецированных плазмид, собранных в единую молекулу - хвост к голове, и что результатом этого была удивительно эффективная работа механизма ГР [22]. Причиной же низкой эффективности классического ген-таргетинга, предполагающего использование ГР в клетках млекопитающих, может служить несоответствие между задачей, ставящейся перед ГР, и ее свойствами и возможностями, отобранными эволюцией для исполнения ее собственной хотя и неизвестной функции. Данные, описанные в литературе, позволяют идентифицировать некоторые факторы, являющиеся критическими для работы ГР механизма.
Важным для эффективной работы механизма ГР является линейный размер доставленных к месту расположения рекомбинационного комплекса фрагментов ДНК. Так описан 100-кратный экспоненциальный рост эффективности ген-таргетинга при увеличении длины гомологии в корректирующей конструкции с 2 т.п.о до 14,5 т.п.о. и при этом достигнутая эффективность, 10-5 событий генной коррекции на клетку, оставалась все же недостаточной для применения метода без селекции [23]. Разительный контраст приведенным выше данным представляют результаты по использованию для коррекции мутантного гена коротких фрагментов гомологичной ДНК (SFHR, small fragments homologous replacement) с эффективностью исправления на клетку 1-20% [24]. Полученная в этих экспериментах эффективность ген-таргетинга может означать, что ГР предпочитает работать либо с короткими фрагментами либо формирует из коротких фрагментов при помощи лигирования фрагментов ДНК лигазой IV по типу голова-хвост мультимерные фрагменты, которые наиболее эффективны в использовании в рекомбинационных событиях.
Необходимым условием для получения рекомбинантного продукта в клетках млекопитающих является длина концевой гомологии фрагментов, которая составляет около 200 bp (пар оснований) [25, 26].
Принципиальным для осуществления ГР является линейная форма доставленных терапевтических ДНК как источника двуцепочечных концов. Кольцевые формы терапевтических плазмид практически не участвуют в гомологическом обмене. Генерация ДЦР и образование двуцепочечных концов молекулы ДНК локально активирует и усиливает хромосомальную и экстрахромосомальную рекомбинацию и ген-таргетинг [27]. Этот принцип был использован для индукции коррекции гена IL2R, точечная мутация в 5-ом экзоне которого вызывает смертельную наследственную болезнь, связанный с Х-хромосомой тяжелый комбинированный иммунодефицит (severe combined immunodeficiency, SCID). Путем трансфекции клетки генетическими конструкциями, экспрессирующими синтетические цинк-фингер нуклеазы, способные специфически расщепить последовательность вблизи мутации в гене IL2R в геномной ДНК клеток и плазмидой, содержащей немутантный фрагмент этого же гена, перекрывающий район SCID мутации, продемонстрировали высокий, до 20% уровень генной коррекции [28].
Можно полагать, что принципиально способность ГР очень эффективно осуществлять генную коррекцию связана с инициирующим началом появления в ядерном пространстве свободных двухцепочечных концов ДНК независимо будь то концы разорванной хромосомы, образовавшиеся в результате ДЦР, или двухцепочечные концы фрагментов ДНК, доставленных в ядро и являющихся типичными «ends-out» структурами. Любой немодифицированный фрагмент геномной ДНК, имея два конца, гомологичных двум последовательностям хромосомальной ДНК, и среднюю часть, способную заместить геномный фрагмент и соответственно исправить имеющуюся мутацию, представляет собой типичную «ends-out» конструкцию. Это означает, что концы фрагмента будут инициировать поиск гомологии и ГР с геномной ДНК, приводящую к замещению фрагмента геномной ДНК центральной частью фрагмента, доставленного из внешней по отношению к клетке среды. В условиях использования генетически корректной экзогенной ДНК эти события будут приводить к исправлению генетического дефекта [29].
Еще одним существенным моментом, по-видимому, влияющим на эффективность гомологической рекомбинации и исправления дефектных локусов хромосом, является обнаруженный несколькими группами ученых, но оставленный без достаточного внимания эффект "вскрытия генома", наблюдаемый в СК и других дифференцирующихся кл