Антитело против ccr5
Иллюстрации
Показать всеИзобретение относится к антителу против CCR5, содержащему (i) две легких цепи, где каждая легкая цепь содержит продукт экспрессии плазмиды, обозначенной pVK:HuPRO140-VK (АТСС - РТА-4097), и (ii) две тяжелых цепи, где каждая тяжелая цепь содержит продукт экспрессии плазмиды, обозначенной pVg4:HuPRO140 HG2-VH (АТСС - РТА-4098) или плазмиды, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH (АТСС - РТА-4099), или фрагменту такого антитела, связывающемуся с CCR5 на поверхности клетки человека. Изобретение охватывает нуклеиновые кислоты, кодирующие легкие и тяжелые цепи антитела, вектор экспрессии, клетку-хозаина, трансформированного, по меньшей мере, одним вектором, а также способ получения антитела. Антитело по изобретению используется в качестве активного компонента в композиции для ингибирования инфицирования клеток CD4+HIV-1, а также в фармацевтической композиции для лечения пациента с инфекцией HIV-1. Изобретение охватывает также конъюгат антитела против CCR5 и его применение. Использование антител позволит повысить эффективность профилактики и лечения инфекции HIV-1. 14 н. и 17 з.п. ф-лы, 23 ил.
Реферат
Данная заявка представляет собой частичное продолжение заявки на выдачу патента США с серийным № 10/081128, поданную 22 февраля 2002 года, содержание которой включено в качестве ссылки в данную заявку, и притязает на приоритет указанной заявки.
На всем протяжении данной заявки различные публикации обозначены арабскими цифрами. Полные ссылки для данных публикаций можно найти в конце данного описания непосредственно перед формулой изобретения. Описание данных публикаций включено в качестве ссылки в данную заявку для более полного описания области, к которой относится данное изобретение.
Предпосылки изобретения
Вирус иммунодефицита человека типа 1 (HIV-1) для проникновения в клетки-мишени вызывает слияние мембран вируса и клетки (8, 15, 66). Первое высокоаффинное взаимодействие между вирионом и клеточной поверхностью представляет собой связывание гликопротеина gp120 на вирусной поверхности с антигеном CD4 (13, 30, 41, 42). Это в свою очередь индуцирует конформационные изменения в gp120, позволяющие ему взаимодействовать с одним из нескольких рецепторов хемокинов (4, 5, 21, 36). Рецептор CC-хемокинов CCR5 представляет собой основной корецептор для тропных к макрофагам (R5) штаммов и играет ключевую роль в половом переносе HIV-1 (4, 5, 21, 36). Тропные к линиям T-клеток (X4) вирусы для проникновения в клетки-мишени используют CXCR4 и, как правило, но не всегда, появляются в ходе заболевания позднее или как результат размножения вируса в культуре ткани (4, 5, 21, 36). Некоторые первичные изоляты HIV-1 обладают двойной тропностью (R5X4), так как они могут использовать оба корецептора, хотя и не всегда с одинаковой эффективностью (11, 57). Исследования мутагенеза, сопряженные с разрешением кристаллической структуры белкового кора gp120, показали, что связывающий корецептор участок на gp120 содержит несколько консервативных остатков (32, 53, 65).
Показано, что тирозиновые остатки и остатки с отрицательным зарядом в N-концевом домене (Nt) CCR5 существенны для связывания gp120 с корецептором и для слияния с HIV-1 и проникновения HIV-1 (6, 18, 20, 22, 28, 31, 52, 54). Остатки во внеклеточных петлях (ECL) 1-3 CCR5 являлись несущественными для корецепторной функции, однако междоменная конфигурация CCR5 являлась необходимой для поддержания оптимального слияния и проникновения вируса (24). Это привело к заключению, что или gp120 взаимодействует с диффузной поверхностью на ECL, или что связи с остатками в ECL поддерживают Nt в функциональной конформации. Исследования с химерными корецепторами и моноклональными антителами против CCR5 также показали важность внеклеточных петель для проникновения вируса (5, 54, 64).
Молекулы, специфически связывающиеся с CCR5 и CXCR4 и блокирующие взаимодействие с их лигандами, представляют собой действенное средство для дальнейшего исследования структурных/функциональных связей корецепторов. Классификация таких соединений также может содействовать разработке эффективных терапевтических средств, мишенями которых являются опосредованные корецепторами стадии проникновения вируса. Ингибиторы корецепторных функций CCR5 или CXCR4, идентифицированные до настоящего времени, различаются по своей природе и включают низкомолекулярные соединения, пептиды, хемокины и их производные и моноклональные антитела (mAb). Механизмы действия низкомолекулярных соединений, блокирующих проникновение посредством ингибирования функции CXCR4 в качестве корецептора, не совсем понятны (17, 49, 55, 68). Один такой ингибитор, низкомолекулярное анионное соединение AMD3100, для того чтобы ингибировать проникновение вируса, зависит от остатков в ECL2 и четвертом трансмембранном домене (TM) CXCR4, но не ясно делает ли оно это посредством нарушения связывания gp120 с CXCR4 или посредством нарушения стадий после связывания, приводящих к слиянию мембран (16, 34, 55). До настоящего времени не сообщалось о низкомолекулярных соединениях, специфически блокирующих опосредованное CCR5 проникновение HIV-1. Хемокины опосредуют ингибирование проникновения HIV-1, по меньшей мере, двумя различными механизмами: блокирование взаимодействия gp120/корецептор и интернализация комплекса хемокин/рецептор (3, 26, 59, 63). Вариант AOP-RANTES также ингибирует рециркуляцию CCR5 к клеточной поверхности (40, 56). Такие варианты как RANTES 9-68 и Met-RANTES только предотвращают взаимодействие gp120/CCR5 и не супрессируют CCR5 (67). Варианты SDF-1 вероятно действуют, блокируя опосредованное CXCR4 проникновение вируса посредством сходного механизма (12, 27, 39). Только одно mAb против CXCR4, 12G5, охарактеризовано по его противовирусным свойствам. Сообщалось, что эффективность ингибирования проникновения вируса посредством 12G5 зависит и от клетки, и от изолята (43, 58). Данное mAb связывается в CXCR4 с ECL2, но механизм, по которому оно ингибирует проникновение, неизвестен (7). Некоторые охарактеризованные до настоящего времени mAb против CCR5 эффективно предотвращают проникновение HIV-1 (28, 64). Интересно, что mAb, эпитопы для которых лежат в Nt-домене CCR5, содержащем участок связывания gp120, ингибируют слияние с вирусом и проникновение вируса менее эффективно, чем mAb 2D7, эпитоп для которого лежит в ECL2. 2D7 также является антагонистом действия CC-хемокинов (64).
Выделили и охарактеризовали панель из шести мышиных mAb, обозначенных PA8, PA9, PA10, PA11, PA12 и PA14. Все шесть mAb специфически связывались с CCR5+-клетками, но с различными эффективностями, которые зависели от типа клеток. Исследования по картированию эпитопов идентифицировали остатки, важные для связывания mAb, а также предоставили информацию об укладке и взаимодействиях внеклеточных доменов CCR5. Все mAb ингибировали слияние и проникновение HIV-1, но корреляции между способностью mAb ингибировать слияние и проникновение и его способностью ингибировать связывание gp120/sCD4 с CCR5+-клетками не наблюдали.
Сущность изобретения
Данное изобретение относится к антителу против CCR5, содержащему (i) две легких цепи, где каждая легкая цепь содержит продукт экспрессии плазмиды, обозначенной pVK:HuPRO140-VK (инвентарный номер в ATCC - PTA-4097), и (ii) две тяжелых цепи, где каждая тяжелая цепь содержит продукт экспрессии или плазмиды, обозначенной pVg4:HuPRO140 HG2-VH (инвентарный номер в ATCC - PTA-4098), или плазмиды, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH (инвентарный номер в ATCC - PTA-4099), или фрагменту такого антитела, связывающемуся с CCR5 на поверхности клетки человека.
Данное изобретение также относится к антителу против CCR5, содержащему две легких цепи, где каждая цепь содержит последовательные аминокислоты, аминокислотная последовательность которых указана в SEQ ID № 6, и две тяжелых цепи, где каждая тяжелая цепь содержит последовательные аминокислоты, аминокислотная последовательность которых указана в SEQ ID № 9.
Данное изобретение также относится к антителу против CCR5, содержащему две легких цепи, где каждая цепь содержит последовательные аминокислоты, аминокислотная последовательность которых указана в SEQ ID № 6, и две тяжелых цепи, где каждая тяжелая цепь содержит последовательные аминокислоты, аминокислотная последовательность которых указана в SEQ ID № 12.
Данное изобретение также относится к изолированной нуклеиновой кислоте, кодирующей полипептид, содержащий последовательные аминокислоты, аминокислотная последовательность которых указана в SEQ ID № 6. В указанном осуществлении нуклеиновая кислота содержит последовательность, указанную в SEQ ID № 5.
Данное изобретение также относится к изолированной нуклеиновой кислоте, кодирующей полипептид, содержащий последовательные аминокислоты, аминокислотная последовательность которых указана в SEQ ID № 9. В указанном осуществлении нуклеиновая кислота содержит последовательность, указанную в SEQ ID № 8.
Данное изобретение также относится к изолированной нуклеиновой кислоте, кодирующей полипептид, содержащий последовательные аминокислоты, аминокислотная последовательность которых указана в SEQ ID № 12. В указанном осуществлении нуклеиновая кислота содержит последовательность, указанную в SEQ ID № 11.
Данное изобретение также относится к композиции, содержащей, по меньшей мере, одно антитело против CCR5 или его фрагмент, как описано выше, вместе с носителем.
Данное изобретение также относится к композиции, содержащей антитело против CCR5 или его фрагмент с присоединенным к нему веществом, таким как радиоизотоп, токсин, полиэтиленгликоль, цитотоксическое средство и/или детектируемая метка.
Данное изобретение также относится к способу ингибирования инфицирования CD4+-клеток, включающему контактирование CD4+-клеток с антителом, содержащим (i) две легких цепи, где каждая легкая цепь содержит продукт экспрессии плазмиды, обозначенной pVK:HuPRO140-VK (инвентарный номер в ATCC - PTA-4097), и (ii) две тяжелых цепи, где каждая тяжелая цепь содержит продукт экспрессии или плазмиды, обозначенной pVg4:HuPRO140 HG2-VH (инвентарный номер в ATCC - PTA-4098), или плазмиды, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH (инвентарный номер в ATCC - PTA-4099), или фрагментом такого антитела, связывающимся с CCR5 на поверхности CD4+-клетки, в таком количестве и в таких условиях, чтобы слияние HIV-1 или инфицированной HIV-1 клетки с CD4+-клеткой являлось подавленным, ингибируя таким образом инфицирование CD4+-клетки HIV-1.
Данное изобретение также относится к способу лечения пораженного HIV-1 субъекта, включающему введение субъекту эффективной для лечения HIV-1 дозы антитела против CCR5, содержащего (i) две легких цепи, где каждая легкая цепь содержит продукт экспрессии плазмиды, обозначенной pVK:HuPRO140-VK (инвентарный номер в ATCC - PTA-4097), и (ii) две тяжелых цепи, где каждая тяжелая цепь содержит продукт экспрессии или плазмиды, обозначенной pVg4:HuPRO140 HG2-VH (инвентарный номер в ATCC - PTA-4098), или плазмиды, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH (инвентарный номер в ATCC - PTA-4099), или фрагмента такого антитела, связывающегося с CCR5 на поверхности клетки человека, в условиях, эффективных для лечения инфицированного HIV-1 субъекта.
Данное изобретение также относится к способу профилактики субъекта от заражения HIV-1, включающему введение субъекту эффективной для профилактики инфицирования HIV-1 дозы антитела против CCR5, содержащего (i) две легких цепи, где каждая легкая цепь содержит продукт экспрессии плазмиды, обозначенной pVK:HuPRO140-VK (инвентарный номер в ATCC - PTA-4097), и (ii) две тяжелых цепи, где каждая тяжелая цепь содержит продукт экспрессии или плазмиды, обозначенной pVg4:HuPRO140 HG2-VH (инвентарный номер в ATCC - PTA-4098), или плазмиды, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH (инвентарный номер в ATCC - PTA-4099), или фрагмента такого антитела, связывающегося с CCR5 на поверхности клетки человека, в условиях, эффективных для профилактики инфицирования субъекта HIV-1.
Данное изобретение также относится к конъюгату антитела против CCR5, включающему антитело против CCR5, содержащее (i) две легких цепи, где каждая легкая цепь содержит продукт экспрессии плазмиды, обозначенной pVK:HuPRO140-VK (инвентарный номер в ATCC - PTA-4097), и (ii) две тяжелых цепи, где каждая тяжелая цепь содержит продукт экспрессии или плазмиды, обозначенной pVg4:HuPRO140 HG2-VH (инвентарный номер в ATCC - PTA-4098), или плазмиды, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH (инвентарный номер в ATCC - PTA-4099), или фрагмент такого антитела, связывающийся с CCR5 на поверхности клетки человека, конъюгированные, по меньшей мере, с одним полимером.
Данное изобретение также относится к способу ингибирования инфицирования CCR5+-клеток HIV-1, включающему введение субъекту с риском инфицирования HIV-1 описанного выше конъюгата в количестве и в условиях, эффективных для ингибирования инфицирования CCR5+-клеток субъекта HIV-1.
Данное изобретение также относится к способу лечения инфекции HIV-1 у субъекта, включающему введение описанного выше конъюгата инфицированному HIV-1 субъекту в количестве и в условиях, эффективных для лечения инфекции HIV-1 у субъекта.
Данное изобретение также относится к трансформированной клетке-хозяину, содержащей, по меньшей мере, два вектора, где, по меньшей мере, один вектор содержит последовательность нуклеиновой кислоты, кодирующую тяжелые цепи антитела против CCR5, и, по меньшей мере, один вектор содержит последовательность нуклеиновой кислоты, кодирующую легкие цепи антитела против CCR5, где антитело против CCR5 содержит две тяжелые цепи с аминокислотной последовательностью, указанной в SEQ ID № 9, и две легкие цепи с аминокислотной последовательностью, указанной в SEQ ID № 6.
Данное изобретение также относится к трансформированной клетке-хозяину, содержащей, по меньшей мере, два вектора, где, по меньшей мере, один вектор содержит последовательность нуклеиновой кислоты, кодирующую тяжелые цепи антитела против CCR5, и, по меньшей мере, один вектор содержит последовательность нуклеиновой кислоты, кодирующую легкие цепи антитела против CCR5, где антитело против CCR5 содержит две тяжелые цепи с аминокислотной последовательностью, указанной в SEQ ID № 12, и две легкие цепи с аминокислотной последовательностью, указанной в SEQ ID № 6.
Данное изобретение также относится к вектору, содержащему последовательность нуклеиновой кислоты, кодирующую тяжелую цепь антитела против CCR5, где тяжелая цепь содержит аминокислотную последовательность, указанную в SEQ ID № 9.
Данное изобретение также относится к вектору, содержащему последовательность нуклеиновой кислоты, кодирующую тяжелую цепь антитела против CCR5, где тяжелая цепь содержит аминокислотную последовательность, указанную в SEQ ID № 12.
Данное изобретение также относится к способу получения антитела против CCR5, включающему культивирование клетки-хозяина, содержащей (i) плазмиду, обозначенную pVK:HuPRO140-VK (инвентарный номер в ATCC - PTA-4097), и (ii) или плазмиду, обозначенную pVg4:HuPRO140 HG2-VH (инвентарный номер в ATCC - PTA-4098), или плазмиду, обозначенную pVg4:HuPRO140 (mut B+D+I)-VH (инвентарный номер в ATCC - PTA-4099), в условиях, позволяющих продукцию антитела, содержащего две легких цепи, кодируемых плазмидой, обозначенной pVK:HuPRO140-VK (инвентарный номер в ATCC - PTA-4097), и две тяжелых цепи, кодируемых или плазмидой, обозначенной pVg4:HuPRO140 HG2-VH (инвентарный номер в ATCC - PTA-4098), или плазмидой, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH (инвентарный номер в ATCC - PTA-4099), так что таким образом образуется антитело против CCR5.
Данное изобретение также относится к способу получения антитела против CCR5, включающему a) трансформацию клетки-хозяина (i) плазмидой, обозначенную pVK:HuPRO140-VK (инвентарный номер в ATCC - PTA-4097), и (ii) или плазмидой, обозначенной pVg4:HuPRO140 HG2-VH (инвентарный номер в ATCC - PTA-4098), или плазмидой, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH (инвентарный номер в ATCC - PTA-4099), и b) культивирование трансформированной клетки-хозяина в условиях, позволяющих продукцию антитела, содержащего две легких цепи, кодируемых плазмидой, обозначенной pVK:HuPRO140-VK (инвентарный номер в ATCC - PTA-4097), и две тяжелых цепи, кодируемых или плазмидой, обозначенной pVg4:HuPRO140 HG2-VH (инвентарный номер в ATCC - PTA-4098), или плазмидой, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH (инвентарный номер в ATCC - PTA-4099), так что таким образом образуется антитело против CCR5.
Данное изобретение также относится к набору для применения в способе получения антитела против CCR5. Набор включает a) вектор, содержащий последовательность нуклеиновой кислоты, кодирующую легкую цепь антитела против CCR5, где легкая цепь содержит аминокислотную последовательность, указанную в SEQ ID № 6, и b) вектор, содержащий последовательность нуклеиновой кислоты, кодирующую тяжелую цепь антитела против CCR5, где тяжелая цепь содержит аминокислотную последовательность, указанную в SEQ ID № 9, или вектор, содержащий последовательность нуклеиновой кислоты, кодирующую тяжелую цепь антитела против CCR5, где тяжелая цепь содержит аминокислотную последовательность, указанную в SEQ ID № 12.
Краткое описание чертежей:
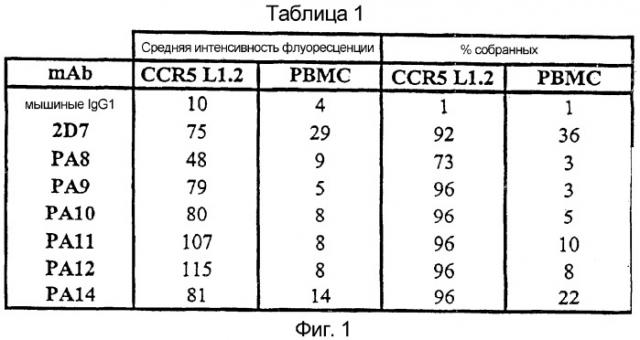
Фигура 1:
Связывание моноклональных антител против CCR5 с CCR5+-клетками
Для выявления экспрессии белка CCR5 на поверхности CCR5+-клеток L1.2 и только что выделенных, стимулированных PHA/IL-2 PBMC применяли проточную цитометрию. Клетки инкубировали с насыщающими концентрациями каждого mAb, которые выявляли меченным PE репортерным антителом против мышиных IgG. Представлены результаты типичного эксперимента. Результаты для каждого mAb выражены и как средние интенсивности флуоресценции (m.f.i.), и как % собранных клеток. Так как PA8-PA12 и PA14 все представляют собой подкласс IgG1, их m.f.i. сравнимы непосредственно. 2D7 представляет собой IgG2a.
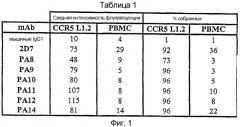
Фигура 2:
Значения CI для различных сочетаний mAb и вирусных ингибиторов:
Для различных сочетаний ингибиторов проникновения вирусов проводили эксперименты, подобные экспериментам, описанным в подписи к фигуре 7. mAb против CCR5 тестировали в сочетании с каждым из других, CC-хемокинами и CD4-IgG2, которые ингибируют присоединение HIV-1 к клетке-мишени. Диапазон концентраций PA11 и PA12 составлял 0-250 мкг/мл; диапазон концентраций 2D7 и PA14 составлял 0-25 мкг/мл; диапазон концентраций RANTES составлял 0-250 мкг/мл; диапазон концентраций CD4-IgG2 составлял 0-25 мкг/мл. Концентрации отдельных средств или их смесей, необходимые для получения 50% и 90% ингибирования слияния или проникновения, количественно сравнивали при помощи условия, известного как комбинационный индекс (CI).
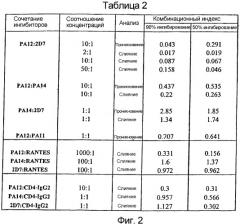
Фигура 3:
Значения IC50 для ингибирования слияния клетка-клетка, проникновения вируса и связывания gp120/sCD4 mAb против CCR5:
Для целей сравнения авторы настоящего изобретения суммировали значения IC50, полученные в различных анализах, где тестировали mAb против CCR5. Значения IC50 подсчитывали только для тех mAb, которые способны ингибировать >90% слияния, проникновения или связывания.
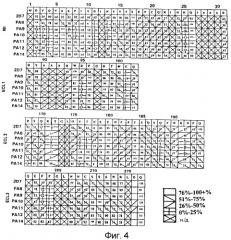
Фигура 4:
Картирование эпитопов mAb против CCR5:
Для оценки связывания mAb с мутантными белками CCR5, меченными на C-конце пептидом HA, применяли протокол окрашивания двумя красителями. Клетки HeLa, экспрессирующие точечные мутанты CCR5, инкубировали с насыщающими концентрациями каждого mAb с последующей детекцией меченными PE антителами против мышиных IgG. Экспрессию корецептора на поверхности клетки измеряли двойным окрашиванием клеток меченным FITC mAb против HA. Четыре сетки соответствуют четырем внеклеточным доменам CCR5. Первая строка каждой сетки обозначает аминокислотную последовательность соответствующего внеклеточного домена CCR5 (SEQ ID №№ 1-4). Связывание mAb против CCR5 с аланиновым мутантом по каждому из остатков выражено как процент от связывания с CCR5 дикого типа, как описано в "материалах и методах".
Фигура 5:
Ингибирование мобилизации кальция в CCR5+-клетках mAb против CCR5:
В CCR5+-клетки L1.2 вводили Indo-1AM и последовательно стимулировали mAb против CCR5 или PBS с последующим RANTES (a). Изменения в флуоресценции измеряли спектрофлуориметром, а кривая мониторинга представлена из типичного эксперимента. Ингибирование выхода кальция посредством PA14 и 2D7 тестировали для широкого диапазона концентраций mAb (b). Результаты представлены как % ингибирования выхода кальция = [1- (относительная флуоресценция в присутствии mAb ÷ относительная флуоресценция в отсутствии mAb)] × 100% и представляют собой средние значения трех независимых экспериментов.
Фигура 6:
Ингибирование корецепторной функции CCR5 посредством mAb против CCR5:
Ингибирование слияния клетка-клетка mAb против CCR5 тестировали в анализе RET (a). К смеси клеток HeLa-EnvJR-FL + и PM1, меченных F18 и R18 соответственно, добавляли 0-250 мкг/мл PA8-PA12 или 0-25 мкг/мл PA14 или 2D7. Флуоресценцию в RET измеряли после 4 часов инкубации. Результаты представляют собой средние значения из трех независимых экспериментов и представлены как % ингибирования слияния = [1-(% RET в присутствии mAb ÷ % RET в отсутствие mAb)] × 100%. Ингибирование проникновение HIV-1 посредством mAb против CCR5 тестировали в одном раунде основанного на репликации люциферазы анализа проникновения (b). Клетки U87-CD4+CCR5+ инфицировали несущим оболочку JR-FL репортерным вирусом NLluc+env+ в присутствии 0-250 мкг/мл PA8-PA12 или 0-25 мкг/мл PA14 или 2D7. Люциферазную активность (относительные световые единицы, r.l.u.) измеряли в клеточных лизатах через 72 часа после заражения. Результаты приведены из типичного эксперименты и представлены как % ингибирования проникновения = [1- (r.l.u. в присутствии mAb ÷ r.l.u. в отсутствие mAb)] × 100%. Связывание биотинилированных [b] gp120, sCD4 и комплексов b-gp120-CD4 с CCR5+-клетками L1.2 (c). Сильное связывание наблюдали, когда происходящий из вируса R5 HIV-1JR-FL gp120 образовывал комплекс с эквимолярным количеством sCD4. В отсутствие sCD4 или для происходящего из вируса HIV-1LAI X4 gp120 связывания не наблюдали. Из всех кривых вычли фоновое связывание с CCR5+-клетками L1.2. Ингибирование связывания gp120/sCD4 с CCR5+-клетками L1.2 тестировали в присутствии различных концентраций каждого антитела (d). Клетки предварительно инкубировали в 96-луночных планшетах с mAb против CCR5 с последующей инкубацией с насыщающими концентрациями биотинилированных gp120/sCD4. В заключение измеряли связывание меченного PE стрептавидина с клетками с применением устройства для считывания флуоресценции в планшетах. Результаты приведены из типичного эксперименты и представлены как % ингибирования связывания gp120/sCD4 = [1- (m.f.i. в присутствии mAb ÷ m.f.i. в отсутствие mAb)] × 100%.
Фигура 7:
Синергическое ингибирование слияния клетка-клетка посредством PA12 и 2D7:
Для mAb, применяемых отдельно или в сочетании, получены кривые доза-ответ. К смеси клеток HeLa-EnvJR-FL + и PM1, меченных R18 и F18, соответственно, добавляли 0-50 мкг/мл PA12, 0-25 мкг/мл 2D7 или их сочетание в соотношении 2:1. Флуоресценцию в RET измеряли после 4 часов инкубации. Результаты представлены как % ингибирования слияния и представляют собой средние значения из трех независимых экспериментов. Данные анализировали с применением принципа срединного эффекта, который можно записать как
f=1/[1+(K/c)m] (1)
где f представляет собой долю пораженных/ингибированных, c представляет собой концентрацию, K представляет собой концентрацию средства, необходимую для получения срединного эффекта, и m представляет собой эмпирический коэффициент, описывающий форму кривой доза-ответ. Уравнение (1) представляет собой обобщенную форму уравнений, описывающих ферментативную кинетику Михаэлиса-Ментен, изотермы адсорбции Лэнгмюра и ионизационные равновесия Гендерсона-Хассельбалха, для которых m=1. В настоящем случае K эквивалентно значению IC50. K и m определяли аппроксимацией по точкам кривых доза-ответ, а уравнение (1) меняли для обеспечения расчета c по данному f. Наиболее соответствующие параметры для K и c представляют собой 8,8 мкг/мл и 0,54 для PA12, 0,36 мкг/мл и 0,68 для 2D7 и 0,11 мкг/мл и 1,1 для их сочетания. Данные кривые изображены и указывают на приемлемую степень согласия между экспериментом и теорией.
Фигура 8:
На данной фигуре указаны аминокислотная последовательность вариабельной области легкой цепи гуманизированного варианта мышиного антитела против CCR5 PA14 (SEQ ID № 6) и последовательность нуклеиновой кислоты, кодирующая ее (SEQ ID № 5), по данному изобретению. SEQ ID № 7 идентифицирует область в SEQ ID № 5, кодирующую аминокислотную последовательность, указанную в SEQ ID № 6. Данная вариабельная область легкой цепи присутствует в антителе, обозначенном в настоящем описании как PRO140 № 1 и № 2. Определяющие комплементарность области ("CDR") подчеркнуты.
Фигура 9:
На данной фигуре указаны аминокислотная последовательность первой вариабельной области тяжелой цепи гуманизированного варианта мышиного антитела против CCR5 PA14 (SEQ ID № 9) и последовательность нуклеиновой кислоты, кодирующая ее (SEQ ID № 8), по данному изобретению. SEQ ID № 10 идентифицирует область в SEQ ID № 8, кодирующую аминокислотную последовательность, указанную в SEQ ID № 9. Данная вариабельная область тяжелой цепи присутствует в антителе, обозначенном в настоящем описании как PRO140 № 2. CDR подчеркнуты.
Фигура 10:
На данной фигуре указаны аминокислотная последовательность второй вариабельной области тяжелой цепи гуманизированного варианта мышиного антитела против CCR5 PA14 (SEQ ID № 12) и последовательность нуклеиновой кислоты, кодирующая ее (SEQ ID № 11), по данному изобретению. SEQ ID № 13 идентифицирует область в SEQ ID № 11, кодирующую аминокислотную последовательность, указанную в SEQ ID № 12. Данная вариабельная область тяжелой цепи присутствует в антителе, обозначенном в настоящем описании как PRO140 № 1. CDR подчеркнуты.
Фигура 11:
Однократная доза гуманизированного антитела против CCR5 эффективно уменьшает вирусные нагрузки in vivo:
Мышей SCID восстанавливали нормальными человеческими PBMC и инфицировали HIV-1JR-CSF. При достижении стационарного состояния вируса животных подвергали однократному воздействию 1 миллиграмма внутрибрюшинной дозы гуманизированного антитела против CCR5 (PRO140) или изотипического контрольного антитела и следили за плазматической РНК HIV (Roche Amplicor Assay).
Фигура 12:
Продолжительное уменьшение вирусной нагрузки:
Мышей SCID восстанавливали нормальными человеческими PBMC и инфицировали HIV-1JR-CSF. При достижении стационарного состояния вируса животных каждые трое суток подвергали воздействию 0,1 мг внутрибрюшинных доз гуманизированного антитела против CCR5 (PRO140) и следили за плазматической РНК HIV (Roche Amplicor Assay).
Фигура 13:
Демонстрирует, что при применении полученного по данному изобретению антитела против CCR5 (PRO140) уменьшения лимфоцитов не наблюдали.
Фигура 14:
Гуманизированное антитело против CCR5 (PRO140) эффективно блокирует опосредованное CCR5 слияние клетка с HIV-1-клетка.
Мышиное антитело против CCR5 гуманизировали с применением способа прививки определяющих комплементарность областей (CDR) и замен в каркасе. Гуманизированные антитела против CCR5 (PRO140 №1 и PRO140 №2) экспрессировали в клетках Sp2/0, очищали посредством хроматографии с белком A и тестировали на способность блокировать опосредованное репликацией env HIV-1JR-FL слияние мембран, как описано (Litwin, et al., J. Virol., 70:6437, 1996).
Фигура 15:
Гуманизированное антитело против CCR5 (PRO140) опосредует эффективное, независимое от подтипа ингибирование HIV-1.
Антитела против CCR5 (PRO140 №1 и №2) по данному изобретению тестировали на их способность блокировать репликацию HIV-1 дикого типа в мононуклеарных клетках периферической крови (PBMC), как описано (Trkola et al., J. Virol., 72:396, 1998). Степень репликации вируса измеряли посредством оценки содержания антигена p24 в супернатантах 7-дневных культур PBMC.
Фигура 16:
На данной фигуре представлена карта плазмиды pVK-HuPRO140, кодирующей вариабельную область легкой цепи, представленной на фигуре 8, а также константные области человеческой Каппа, как описано у Co et al., J. Immunol., 148:1149, 1992.
Фигура 17:
На данной фигуре представлена карта плазмиды pVg4-HuPRO140 HG2, кодирующей вариабельную область тяжелой цепи, представленной на фигуре 9, а также константные области человеческих тяжелых цепей человека, CH1, шарнирный участок, CH2 и CH3 IgG4, как описано у He et al., J. Immunol., 160:1029 (1998).
Фигура 18:
На данной фигуре представлена карта плазмиды pVg4-HuPRO140 (mut B+D+I), кодирующей вариабельную область тяжелой цепи, представленной на фигуре 10, а также константные области человеческих тяжелых цепей, CH1, шарнирный участок, CH2 и CH3 человеческого IgG4, как описано у He et al., J. Immunol., 160:1029 (1998).
Фигура 19:
Hu PRO140 блокирует HIV-1, но не передачу сигнала RANTES
Антитела PRO140 по данному изобретению тестировали на их способность блокировать индуцируемую RANTES мобилизацию кальция в CCR5+-клетках L1.2 (Olson, et al., J. Virol., 72:396, 1998). На данной фигуре показано, что гуманизированное антитело против CCR5 (PRO140) блокирует HIV-1, но не передачу сигнала RANTES.
Подробное описание изобретения
Плазмиды, обозначенные как HuPRO140-VK, HuPRO140 (mut+B+D+I)-VH и HuPRO140 HG2-VH, которые на фигурах 16, 18 и 17 обозначены как pVK-HuPRO140, pVg4-HuPRO140 (mut B+D+I) и pVg4-HuPRO140 HG2 соответственно, депонировали в Американской коллекции типовых культур (АТСС), Manassas, Va., U.S.A. 20108 22 февраля 2002 года под инвентарными номерами ATCC PTA 4097, PTA 4099 и PTA 4098 соответственно. Данные депонирования осуществлены в соответствии с условиями будапештского соглашения о международном признании депонирования микроорганизмов для цели процедуры выдачи патентов (будапештское соглашение).
Данное изобретение относится к композиции для ингибирования инфицирования HIV-1, содержащей, по меньшей мере, два соединения в обладающих синергическим эффектом для ингибирования инфицирования HIV-1 количествах, где, по меньшей мере, одно из двух соединений предотвращает продуктивное взаимодействие между HIV-1 и корецептором для слияния с HIV-1.
Как применяют в настоящем описании, "композиция" означает смесь. Композиции включают в качестве неограничивающих примеров композиции, пригодные для перорального, ректального, интравагинального, местного, назального, глазного или парентерального введения субъекту. Как применяют в настоящем описании "парентеральный" включает в качестве неограничивающих примеров подкожную, внутривенную, внутримышечную или интрастернальную инъекции или способы инфузии.
Как применяют в настоящем описании, "HIV-1" означает вирус иммунодефицита человека типа 1. HIV-1 включает в качестве неограничивающих примеров внеклеточные вирусные частицы и формы HIV-1, найденные в инфицированных HIV-1 клетках.
Как применяют в настоящем описании, "инфицирование HIV-1" означает введение генетической информации HIV-1 в клетку-мишень, например, посредством слияния мембраны клетки-мишени с HIV-1 или клетки, несущей гликопротеин оболочки HIV-1. Клетка-мишень может представлять собой клетку организма субъекта. В предпочтительном осуществлении клетка-мишень представляет собой клетку организма человека.
Как применяют в настоящем описании, "ингибирование инфекции HIV-1" означает уменьшение количества HIV-1 - генетической информации, вводимой в популяцию клеток-мишеней, по сравнению с количеством, которое могло бы вводиться без указанной композиции.
Как применяют в настоящем описании, "соединение" означает молекулу, включая в качестве неограничивающих примеров пептиды, полипептиды и другие органические и неорганические молекулы и их сочетания.
Как применяют в настоящем описании, "обладающие синергическим эффектом" означает, что совместный эффект соединений при применении в сочетании выше, чем их суммарные эффекты при применении отдельно.
Как применяют в настоящем описании, "продуктивное взаимодействие" означает, что взаимодействие HIV-1 и корецептора для HIV-1 может вести к слиянию указанного HIV-1 или клетки, несущей гликопротеин оболочки HIV-1, и несущей данный корецептор мембраны.
Как применяют в настоящем описании, "предотвращает продуктивное взаимодействие" означает, что степень взаимодействия снижена по сравнению с той степенью, которая могла бы иметь место без данного соединения. Взаимодействия можно предотвратить посредством маскировки или изменения взаимодействующих областей на корецепторе или HIV-1 или посредством изменения экспрессии, агрегации, конформации или состояния ассоциации корецептора.
Как применяют в настоящем описании, "корецептор для слияния с HIV-1" означает клеточный рецептор, опосредующий слияние экспрессирующей рецептор клетки-мишени и HIV-1 или клетки, несущей гликопротеин оболочки HIV-1. Корецепторы для слияния с HIV-1 включают в качестве неограничивающих примеров CCR5, CXCR4 и другие рецепторы хемокинов.
Данное изобретение также относится к ингибирующей слияние HIV-1 или клетки, несущей гликопротеин оболочки HIV-1, с клеткой-мишенью композиции, содержащей, по меньшей мере, два соединения в количествах, обладающих синергическим эффектом для ингибирования слияния HIV-1 или клетки, несущей гликопротеин оболочки HIV-1 с клеткой-мишенью, где, по меньшей мере, одно из соединений предотвращает продуктивное взаимодействие между HIV-1 и корецептором для слияния с HIV-1.
Как применяют в настоящем описании, "слияние" означает соединение или объединение липидных двухслойных мембран, находящихся на клетках млекопитающих или таких вирусах, как HIV-1. Данный процесс отличается от присоединения HIV-1 к клеткам-мишеням. Присоединение опосредуется связыванием наружного гликопротеина HIV-1 с человеческим рецептором CD4, не являющимся корецептором для слияния.
Как применяют в настоящем описании, "ингибирует" означает, что количество по сравнению с количеством, которое могло бы иметь место без композиции, уменьшено.
Как применяют в настоящем описании, "клетка-мишень" означает клетку, способную подвергаться заражению HIV-1 или инфицированной HIV-1 клеткой или слиянию с ними.
Как применяют в настоящем описании "хемокин" означает цитокин, который может стимулировать перемещение лейкоцитов. Их можно классифицировать или как cys-cys, или как cys-X-cys, в зависимости от того расположены ли два аминоконцевых остатка цистеина непосредственно рядом друг с другом или разделены одной аминокислотой. Они включают в качестве неограничивающих примеров RANTES, MIP-1α, MIP-1β, SDF-1 или другой хемокин, блокирующий инфицирование HIV-1.
В одном осуществлении указанных выше композиций корецептор представляет собой рецептор хемокинов. В предпочтительном осуществлении указанных выше композиций рецептор хемокинов представляет собой CCR5 или CXCR4. Известно, что некоторые другие хемокиновые и родственные им рецепторы функционируют в качестве корецепторов для HIV и включают в качестве неограничивающих примеров CCR2, CCR3, CCR8, STRL33, GPR-15, CX3CR1 и APJ (69).
Как применяют в настоящем описании, "рецептор хемокинов" означает представителя гомологичного семейства семь раз пронизывающих мембрану клеточных поверхностных белков, связывающих хемокины.
Как применяют в настоящем описании, "CCR5" представляет собой рецептор хемокинов, связывающий представителей C-C-группы хемокинов, и аминокислотная последовательность которого содержит аминокислотную последовательность, представленную под инвентарным номером 1705896 в GenBank, и родственные полиморфные варианты.
Как применяют в настоящем описании, "CXCR4" представляет собой рецептор хемокинов, связывающий представителей C-X-C-группы хемокинов, и аминокислотная последовательность которого содержит аминокислотную последовательность, представленную под инвентарным номером 400654 в GenBank, и родственные полиморфные варианты.
В одном осуществлении указанных выше композиций, по меньшей мере, одно из соединений представляет собой непептидную молекулу. В одном осуществлении непептидная молекула представляет собой бицикламное соединение AMD3100. (16).
Как применяют в настоящем описании, "непептидная молекула" означает молекулу, не целиком состоящую из линейной последовательности аминокислот, соединенных пептидными связями. Однако непептидная молекула может содержать одну или несколько пептидных связей.
В одном осуществлении указанных выше композиций, по меньшей мере, одно из соединений представляет собой антитело. В одном осуществлении антитело представляет собой моноклональное антитело. В другом осуществлении антитело представляет собой антитело против рецептора хемокинов. В одном осуществлении антитело представляет собой антитело против CXCR4. В дополнительном осуществлении антитело против CXCR4 представляет собой 12G5. (43). В предпочтительном осуществлении антитело представляет собой антитело против CCR5. Антитело против CCR5 включает в качестве неограничивающих примеров PA8, PA9, PA10, PA11, PA12, PA14 и 2D7. В данной композиции соединения находятся в подходящем соотношении. Соотношение находится в диапазоне от 1:1 до 1000:1.
Моноклональные антитела PA8, PA9, PA10, PA11, PA12 и PA14 депонированы в соответствии с условиями и в удовлетворение требований будапештского соглашения о международном признании депонирования микроорганизмов для целей процедуры патентования в Американской коллекции типовых культур (ATCC), 10801 University Boulevard, Manassas, Virginia 20110-2209 2 декабря 1998 года под следующими инвентарными №№: в ATCC: № HB-12605 (PA8), № HB-12606 (PA9), № HB-12607 (PA10), № HB-12608 (P11), № HB- 12609 (PA12), № HB-12610 (PA14).
В другом осуществлении указанных выше композиций два или более соединений представляют собой антитела. В одном осуществлении изобретения антитела включают в качестве неограничивающих примеров PA8, PA9, PA10, PA11, PA12, PA14 и 2D7. В данной композиции антитела находятся в подходящем соотношении. Соотношение находится в диапазоне от 1:1 до 50:1.
Как применяют в настоящем описании, "антитело" означает содержащую две тяжелые цепи и две легкие цепи иммуноглобулиновую молекулу, распознающую антиген. Иммуноглобулиновая молекула может происходить из любого из общеизвестных классов, включающих в качестве неограничивающих примеров IgA, секреторный IgA, IgG и IgM. Подкласс IgG также хорошо известен специалистам в данной области и включает в качестве неограничивающих примеров человеческие I