Комбинации для лечения иммуновоспалительных расстройств
Иллюстрации
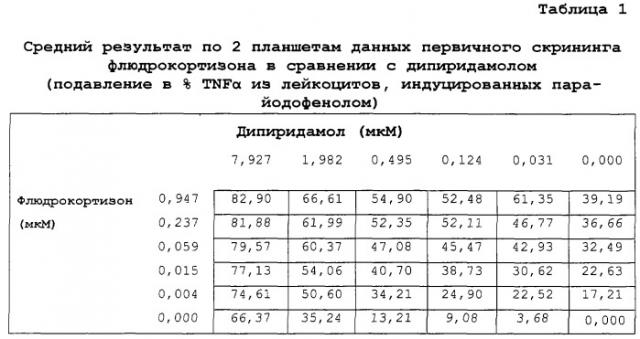
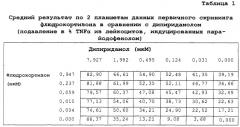
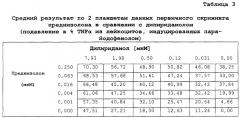
Показать всеПредложенная группа изобретений относится к медицине и касается композиций, наборов и их применения для производства лекарственных средств для лечения иммуновоспалительных расстройств из группы, состоящей из ревматоидного артрита, псориаза, язвенного колита, болезни Крона, анкилозирующего спондилита, рассеянного склероза, диабета I типа, системной красной волчанки, синдрома Шегрена, фибромиалгии и гибели клеток головного мозга, вызванной инсультом, а также для подавления продукции одного или более провоспалительных цитокинов. Предложенные композиции содержат комбинацию двух активных ингредиентов: (i) дипиридамола и (ii) кортикостероида. Такая комбинация обеспечивает подавление иммунного воспаления за счет снижения провоспалительных цитокинов, таких как TNFα, в сотни раз. 9 н. и 45 з.п. ф-лы, 3 табл.
Реферат
Изобретение относится к лечению иммуновоспалительных расстройств.
Предпосылки изобретения
Иммуновоспалительные расстройства (например, ревматоидный артрит, псориаз, язвенный колит, болезнь Крона, вызванная инсультом гибель клеток головного мозга, анкилозирующий спондилит, фибромиалгия и воспалительные дерматозы, астма, рассеянный склероз, диабет I типа, системная красная волчанка, склеродермия, прогрессирующий системный склероз и синдром Шегрена) характеризуются расстройством регуляции иммунной системы и неадекватной активацией защитных механизмов организма, что приводит к повреждению здоровой ткани.
1% людей во всем мире поражены ревматоидным артритом (RA), стойким прогрессирующим заболеванием, вызывающим тяжелый отек, боль и, в конечном счете, деформацию и разрушение суставов. В соответствии с данными Фонда артрита ревматоидный артрит в настоящее время поражает более двух миллионов американцев, среди которых вероятность заболевания женщин втрое выше, чем у мужчин. Ревматоидный артрит характеризуется воспалением выстилки суставов и/или других внутренних органов и присутствием возросших количеств лимфоцитов и высоких уровней провоспалительных цитокинов.
Диагностика RA в целом включает: (i) утреннюю тугоподвижность в суставах, продолжающуюся по меньшей мере 1 ч перед улучшением, (ii) артрит областей трех или более суставов, сопровождающийся одновременно отеком или разжижением мягких тканей; (iii) артрит по меньшей мере одного сустава кисти; (iv) системный артрит, т.е. одновременное поражение области одного и того же сустава с обеих сторон тела; (v) ревматоидные узелки; (vi) патологический сывороточный ревматоидный фактор и (vii) рентгенографические изменения, типичные для ревматоидного артрита на рентгенограммах кисти и запястья в заднепередней проекции, которые включают эрозии или отчетливую костную декальцификацию, локализующуюся или наиболее выраженную вблизи пораженных суставов. Пациентов классифицируют как имеющих RA, если имеются по меньшей мере 4 из указанных 7 критериев, и критерии с (i) по (iv) присутствовали по меньшей мере в течение 6 недель (American College of Rheumatology, 1987 Criteria for the Classification of Acute Arthritis of Rheumatoid Arthritis, based on Arnett FC et al., Arthritis Rheum. 1988; 31:315-324). Боль как таковая не является необходимым признаком для диагностики RA.
Лечение RA в целом включает противовоспалительные стратегии, направленные на подавление клинических проявлений воспаления суставов, включая утолщение синовиальной оболочки, болезненность суставов при пальпации и тугоподвижность суставов. Лекарственные препараты, используемые для воздействия на указанные признаки и симптомы, в целом включают (i) нестероидные противовоспалительные препараты (NSAID), например детопрофен, диклофенак, дифлунизал, этодолак, фенопрофен, флурбипрофен, ибупрофен, индометацин, кетопрофен, меклофенамеат, мефенамовую кислоту, мелоксикам, набумеон, напроксен натрий, оксапрозин, пироксикам, сулиндак, толметин, целекоксиб, рофекоксиб, аспирин, холинсалицилат, салсальте и салицилат натрия и магния) - указанные лекарственные препараты могут подходить для лечения легких форм RA, но, как оказывается, не изменяют долгосрочное течение заболевания; и (ii) стероиды (например, кортизон, дексаметазон, гидрокортизон, метилпреднизолон, преднизолон, преднизон, триамцинолон).
Лечение по поводу RA может также включать стратегии, направленные на ограничение долгосрочного поражения и деформации сустава, вызванных воспалением суставов. Такие способы лечения в целом описаны как DMARD, т.е. антиревматические лекарственные препараты, модифицирующие заболевание (например, циклоспорин, азатиоприн, метотрексат, лефлуномид, циклофосфамид, гидроксихлорохин, сульфасалазин, D-пеницилламин, миноциклин, золото, этанерцепт (растворимый рецептор фактора некроза опухолей, TNF) и инфликсимаб (химерное моноклональное антитело к TNF)).
Существует потребность в разработке новых схем для лечения иммуновоспалительных расстройств.
Сущность изобретения
Авторы изобретения обнаружили, что комбинация тетра-замещенных пиримидопиримидинов, таких как дипиридамол (также известный как 2,6-бис(диэтаноламино)-4,8-дипиперидинопиримидо(5,4-d)пиримидин), и кортикостероидов, таких как флюдрокортизон (также известный как ацетат 9-альфа-фтор-11-бета,17-альфа, 21-тригидрокси-4-прегнен-3,20-диона) или преднизолон (также известный как 1-дегидрокортизол; 1-дегидрогидрокортизон; 1,4-прегнадиен-11бета,17альфа,21-триол-3,20-дион; и 11бета,17альфа,21-тригидрокси-1,4-прегнадиен-3,20-дион), обеспечивает существенное подавление уровней TNFα, вызванных в мононуклеарных клетках периферической крови (PBMC).
Соответственно, изобретение относится к способу лечения пациента, имеющего иммуновоспалительное расстройство или риск его развития. Способ включает введение (i) кортикостероида и (ii) тетра-замещенного пиримидопиримидина, имеющего формулу (I):
в которой каждый Z и каждый Z' представляет собой независимо N, O, C, , или .
Когда Z или Z' представляет собой О или , то р=1, когда Z или Z' представляет собой N, , или , то р=2, а когда Z или Z' представляет собой С, то р=3. В формуле (I) каждый R1 представляет собой, независимо, Х; ОН; N-алкил (в котором алкильная группа имеет от 1 до 20 атомов углерода); разветвленную или неразветвленную алкильную группу, имеющую от 1 до 20 атомов углерода; или гетероцикл. Альтернативно, когда p>1, две группы R1 при общем атоме Z или Z' в комбинации друг с другом могут представлять -(CY2)k-, в которой k представляет собой целое число от 4 до 6 включительно. Каждый Х представляет собой независимо Y, CY3, C(CY3)3, CY2CY3, (CY2)1-5OY, замещенный или незамещенный циклоалкан структуры CnY2n-1, в которой n=3-7 включительно. Каждый Y представляет собой независимо H, F, Cl, Br или I. В одном варианте осуществления каждый Z представляет собой одну и ту же часть, каждый Z' представляет собой одну и ту же часть, а Z и Z' представляют собой различные части. Каждое из двух соединений вводят в количестве, которое при комбинации со вторым соединением достаточно для лечения или профилактики иммуновоспалительного расстройства.
В связанном аспекте изобретение относится к способу подавления продукции одного или более провоспалительных цитокинов у пациента путем введения (i) кортикостероида и (ii) тетра-замещенного пиримидопиримидина, имеющего формулу (I).
В особенно полезных тетра-замещенных пиримидопиримидинах R1 представляет собой замещенный или незамещенный фуран, пурин или пиримидин, (CH2CH2OY), (CH2CH(OH)CH2OY), (HCH2CH(OH)CX3), ((CH2)nOY), где n=2-5,
, или
В других полезных тетра-замещенных пиримидопиримидинах каждый Z представляет собой N, а комбинация двух ассоциированных групп R1 представляет собой -(CH2)5-, а каждый Z' представляет собой N, а каждая ассоциированная группа R1 представляет собой -CH2CH2OH.
Тетра-замещенный пиримидопиримидин и кортикостероид могут присутствовать в фармацевтических композициях, которые содержат фармацевтически приемлемый носитель, разбавитель или наполнитель и которые вводят в дозировках и с частотой, достаточных для подавления уровней TNFα, причем указанное подавление достаточно для того, чтобы принести терапевтическую пользу пациенту. Тетра-замещенный пиримидопиримидин и кортикостероид можно вводить в пределах интервала введения каждого соединения 14 дней (например, в пределах интервала введения каждого соединения 10 дней, в пределах 5 дней, 24 ч или 1 ч или даже одновременно). Введение каждого соединения может происходить, например, от 1 до 5 раз каждый день или сколько необходимо для облегчения симптомов.
Соответственно, настоящее изобретение также относится к фармацевтическим композициям, фармацевтическим упаковкам и наборам, содержащим один или более тетра-замещенных пиримидопиримидинов и один или более кортикостероидов. Способы и композиции (фармацевтические композиции и фармацевтические упаковки) по изобретению могут включать комбинации тетра-замещенных пиримидопиримидинов и кортикостероидов более высокого порядка. В частности, один, два, три или более тетра-замещенных пиримидопиримидинов можно комбинировать с одним, двумя, тремя или более кортикостероидов. В предпочтительных вариантах осуществления тетра-замещенный пиримидопиримидин, кортикостероид или оба соединения одобрены Администрацией лекарственных препаратов и пищевых продуктов США (USFDA) для введения человеку.
Иллюстративные тетра-замещенные пиримидопиримидины, которые можно использовать в способах и композициях согласно изобретению, включают, например, 2,6-двузамещенные 4,8-дибензиламинопиримидо[5,4-d]пиримидины. Особенно полезные тетра-замещенные пиримидопиримидины включают дипиридамол (также известный как 2,6-бис(диэтаноламино)-4,8-дипиперидинопиримидо(5,4-d)пиримидин), мопидамол, дипиридамол моноацетат, NU3026 (2,6-ди(2,2-диметил-1,3-диоксолан-4-ил)метокси-4,8-дипиперидинопиримидопиримидин), NU3059 (2,6-бис-(2,3-диметилоксипропокси)-4,8-дипиперидинопиримидопиримидин), NU3060 (2,6-бис[N,N-ди(2-метокси)этил]-4,6-дипиперидинопиримидопиримидин) и NU3076 (2,6-бис(диэтаноламино)-4,8-ди-4-метоксибензиламинопиримидопиримидин).
Описанное здесь изобретение было проиллюстрировано с использованием кортикостероидов флюдрокортизона (известного как ацетат 9-альфа-фтор-11-бета, 17-альфа, 21-тригидрокси-4-прегнен-3,20-диона) и преднизолона (также известного как 1-дегидрокортизол; 1-дегидрогидрокортизон; 1,4-прегнадиен-11бета, 17альфа, 21-триол-3,20-дион; и 11бета, 17альфа, 21-тригидрокси-1,4-прегнадиен-3,20-дион); однако специалисту в данной области будет понятно, что можно также использовать структурные и функциональные аналоги этих кортикостероидов в комбинации с тетра-замещенными пиримидопиримидинами в способах и композициях согласно изобретению. Другие полезные кортикостероиды можно идентифицировать на основании общих структурных признаков и видимого механизма действия среди семейства кортикостероидов.
Тетра-замещенный пиримидопиримидин и кортикостероид можно вводить в одной и той же или различных фармацевтических композициях. Фармацевтические композиции или компоненты фармацевтической упаковки можно вводить одним и тем же или различными путями и они включают пероральное, ректальное, внутривенное, внутримышечное, подкожное, внутрисуставное, ингаляционное, местное или трансдермальное, вагинальное и глазное введение.
Дозировки тетра-замещенного пиримидопиримидина и кортикостероида можно определить индивидуально; однако тетра-замещенный пиримидопиримидин обычно вводят людям-пациентам в дозе приблизительно 0,5-800 мг/сутки, 18-600 мг/сутки или 50-400 мг/сутки. Кортикостероиды обычно вводят в дозе приблизительно 0,1-1500 мг/сутки, 0,5-30 мг/сутки или 0,5-10 мг/сутки. Низкие дозы кортикостероидов (например, 10 мг/сутки или менее преднизолона или его эквивалента) являются предпочтительными. Общую суточную дозировку тетра-замещенного пиримидопиримидина и кортикостероида можно вводить в одной, двух, трех, четырех или более дозировках. Нет необходимости вводить тетра-замещенный пиримидопиримидин и кортикостероид в одинаковом количестве суточных доз. Кроме того, нет необходимости вводить тетра-замещенный пиримидопиримидин и/или кортикостероид каждый день или одинаковым путем введения. Например, тетра-замещенный пиримидопиримидин можно вводить внутривенной инъекцией через день, а кортикостероид можно вводить местным нанесением дважды в день. Соответственно, при введении в различных композициях фармацевтические композиции, упаковки и наборы готовят в форме и дозировке, подходящей для желаемой схемы лечения.
Заболевания или расстройства, подвергаемые лечению с использованием способов и композиций по изобретению, представляют собой иммуновоспалительные расстройства, включающие, например, ревматоидный артрит, псориаз, язвенный колит, болезнь Крона, вызванную инсультом гибель клеток головного мозга, анкилозирующий спондилит, фибромиалгию и воспалительные дерматозы, астму, рассеянный склероз, диабет I типа, системную красную волчанку, склеродермию, прогрессирующий системный склероз или синдром Шегрена.
Изобретение также относится к способу идентификации соединений, которые можно использовать для лечения пациента, имеющего иммуновоспалительное расстройство. Способ включает стадии: контакта клеток in vitro с (i) иммуномодуляторным соединением, выбранным из группы тетра-замещенного пиримидопиримидина, имеющего формулу (I), или кортикостероида; и (ii) соединением-кандидатом, и определения того, модулируется ли иммунный ответ относительно (а) иммунных клеток, вступивших в контакт с иммуномодуляторным соединением, но не вступивших в контакт с соединением-кандидатом, и (b) иммунных клеток, вступивших в контакт с соединением-кандидатом, но не с иммуномодуляторным соединением. Соединение-кандидат, которое при комбинации с иммуномодуляторным соединением модулирует иммунный ответ в большей степени, чем контроли, представляет собой соединение, которое потенциально можно использовать для лечения пациента, имеющего иммуновоспалительное расстройство.
Соединения, которые можно использовать в изобретении, включают описанные здесь соединения в любой из их фармацевтически приемлемых форм, включая изомеры, такие как диастереомеры и энантиомеры, соли, сольваты и их полиморфы, а также рацемические смеси описанных здесь соединений.
Под «гетероциклом» подразумевается любая циклическая молекула, в которой один или более кольцевых атомов представляют собой атом, отличный от углерода. Предпочтительные гетероциклы состоят из одной или двух кольцевых структур. Предпочтительные гетероатомы представляют собой N, O и S. Каждая кольцевая структура гетероцикла состоит из 3-10 атомов, предпочтительно из 4-8 атомов, а наиболее предпочтительно 5-7 атомов. Каждая кольцевая структура не обязательно содержит гетероатом при условии, что гетероатом присутствует по меньшей мере в одной кольцевой структуре. Предпочтительные гетероциклы представляют собой, например, бета-лактамы, фураны, тетрагидрофураны, пирролы, пирролидины, тиофены, тетрагидротиофены, оксазолы, имидазолидин, индол, гуанин и фенотиазин.
Под «лечением» подразумевается введение или назначение фармацевтической композиции для лечения или профилактики воспалительного заболевания.
Под «пациентом» подразумевается любое животное (например, человек).
Термин «иммуномодуляторное расстройство» охватывает разнообразные состояния, включающие аутоиммунные заболевания. Иммуномодуляторные расстройства приводят к разрушению здоровой ткани воспалительным процессом. Примеры иммуномодуляторных расстройств включают ревматоидный артрит, псориаз, язвенный колит, болезнь Крона, вызванную инсультом гибель клеток головного мозга, анкилозирующий спондилит, фибромиалгию и воспалительные дерматозы, астму, рассеянный склероз, диабет I типа, системную красную волчанку, склеродермию, прогрессирующий системный склероз, миастению или синдром Шегрена.
Под «кортикостероидом» подразумевается любой естественно встречающийся или синтетический стероидный гормон, который можно получить из холестерина и характеризующийся гидрированной циклопентанопергидрофенантреновой кольцевой системой. Естественно встречающиеся кортикостероиды в целом продуцируются корой надпочечников. Синтетические кортикостероиды могут быть галогенированными. Функциональные группы, требуемые для активности, включают двойную связь у Δ4, С3 кетон и С20 кетон. Кортикостероиды могут обладать глюкокортикоидной и/или минералокортикоидной активностью. В предпочтительных вариантах осуществления кортикостероид представляет собой или флюдрокортизон, или преднизолон.
Иллюстративные кортикостероиды включают альгестон, 6-альфа-фторпреднизолон, 6-альфа-метилпреднизолон, 6-альфа-метилпреднизолон-21-ацетат, натриевую соль 6-альфа-метилпреднизолон-21-гемисукцината, 6-альфа,9-альфа-дифторпреднизолон-21-ацетат-17-бутират, амцинафал, беклометазон, беклометазон дипропионат, беклометазон дипропионат моногидрат, 6-бета-гидроксикортизол, бетаметазон, бетаметазон-17-валерат, будезонид, клобетазол, клобетазол пропионат, клобетазон, клокортолон, клокортолон пивалат, кортизон, кортизон ацетат, кортодоксон, дефлазакорт, 21-дезоксикортизол, депродон, десцинолон, дезонид, дезоксиметазон, дексаметазон, дексаметазон-21-ацетат, дихлоризон, дифлоразон, дифлоразон диацетат, дифлюкортолон, доксибетазол, флюдрокортизон, флюметазон, флюметазон пивалат, флюмоксонид, флюнизолид, флюоцинонид, флюоцинолон ацетонид, 9-фторкортизон, фторгидроксиандростендион, фторметолон, фторметолон ацетат, флюоксиместерон, флюпредиден, флюпреднизолон, флюрандренолид, формокортал, гальцинонид, галометазон, галопредон, гирканозид, гидрокортизон, гидрокортизон ацетат, гидрокортизон бутират, гидрокортизон ципионат, гидрокортизон натрий фосфат, гидрокортизон натрий сукцинат, гидрокортизон пробутат, гидрокортизон валерат, 6-гидроксидексаметазон, изофлюпредон, изофлюпредон ацетат, изопредниден, меклоризон, метилпреднизолон, метилпреднизолон ацетат, метилпреднизолон натрий сукцинат, параметазон, параметазон ацетат, преднизолон, преднизолон ацетат, преднизолон метасульфобензоат, преднизолон натрий фосфат, преднизолон тебутат, преднизолон-21-гемисукцинат свободная кислота, преднизолон-21-ацетат, преднизолон-21(бета-D-глюкуронид), преднизон, преднилиден, процинонид, тралонид, триамцинолон, триамцинолонацетонид, триамцинолонацетонид-21-пальмитат, триамцинолон диацетат, триамцинолон гексацетонид и вортманнин. Желательно, чтобы кортикостероид представлял собой флюдрокортизон или преднизолон.
Под «эффективным количеством» продразумевается количество соединения в комбинации по изобретению, требуемое для лечения или профилактики иммуновоспалительного заболевания. Эффективное количество активного соединения (соединений), используемое для осуществления настоящего изобретения с целью терапевтического лечения состояний, вызванных воспалительным заболеванием или способствующих его развитию, варьирует в зависимости от способа введения, возраста, массы тела и общего состояния здоровья пациента. В конечном счете лечащий врач или ветеринар определит целесообразное количество и схему дозировки. Такое количество именуют эффективным количеством.
Под термином «количество, подавляющее цитокины», подразумевается количество комбинации, которое вызовет уменьшение присутствия или уровня провоспалительных цитокинов in vivo при введении пациенту для профилактики или терапевтического лечения иммуновоспалительного расстройства, которое обострено или вызвано избыточной или нерегулируемой продукцией провоспалительных цитокинов.
Другие признаки и преимущества изобретения будут очевидны из следующего подробного описания и из формулы изобретения.
Подробное описание
Авторы изобретения обнаружили, что комбинация тетра-замещенного пиримидопиримидина с кортикостероидом по существу обладает значительной подавляющей TNFα активностью в отношении стимулированных лейкоцитов. Комбинации дипиридамола с флюдрокортизоном и дипиридамола с преднизолоном были особенно эффективны. Таким образом, комбинацию тетра-замещенного пиримидопиримидина с кортикостероидом можно использовать для лечения иммуновоспалительных расстройств.
Дипиридамол
Дипиридамол (2,6-бис(диэтаноламино)-4,8-дипиперидинопиримидо(5,4-d)пиримидин) представляет собой тетра-замещенный пиримидопиримидин, который используют в качестве ингибиторов тромбоцитов, например, для предотвращения формирования сгустка крови после операций на сердечных клапанах и для уменьшения частоты осложнений, связанных с расстройствами свертывания, включая инфаркт миокарда и мозга. Обычно антикоагуляционную терапию (профилактику или лечение) осуществляют введением дипиридамола в дозировке приблизительно 75-200 мг 2 раза/сутки, 3 раза/сутки или 4 раза/сутки или отдельно, или в комбинации с аспирином.
Тетра-замещенные пиримидопиримидины
Тетра-замещенные пиримидопиримидины представляют собой структурные аналоги, которые могут заместить дипиридамол в способах и композициях по изобретению. Тетра-замещенные пиримидопиримидины имеют общую структуру:
в которой каждый Z и каждый Z' представляет собой независимо N, O, C, ,
,
или
.
Когда Z или Z' представляет собой О или , то р=1, когда Z или Z' представляет собой N, , или , то р=2, а когда Z или Z' представляет собой С, то р=3. Каждый R1 представляет собой, независимо, Х; ОН; N-алкил; разветвленную или неразветвленную алкильную группу, имеющую от 1 до 20 атомов углерода; гетероцикл. Альтернативно, когда p>1, две группы R1 при общем атоме Z или Z' в комбинации друг с другом могут представлять -(CY2)k-, в которой k представляет собой целое число от 4 до 6 включительно. Каждый Х представляет собой независимо Y, CY3, C(CY3)3, CY2CY3, (CY2)1-5OY, замещенный или незамещенный циклоалкан структуры CnY2n-1, в которой n=3-7 включительно. Каждый Y представляет собой независимо H, F, Cl, Br или I.
В особенно полезных тетра-замещенных пиримидопиримидинах R1 представляет собой замещенный или незамещенный фуран, пурин или пиримидин, (CH2CH2OY), (CH2CH(OH)CH2OY), (HCH2CH(OH)CX3), ((CH2)nOY), где n=2-5,
, или
В других полезных тетра-замещенных пиримидопиримидинах каждый Z представляет собой N, а комбинация двух ассоциированных групп R1 представляет собой -(CH2)5-, а каждый Z' представляет собой N, а каждая ассоциированная группа R1 представляет собой -CH2CH2OH.
Иллюстративные тетра-замещенные пиримидопиримидины представляют собой 2,6-двузамещенные 4,8-дибензиламинопиримидо[5,4-d]пиримидины, включая, например, мопидамол, дипиридамол моноацетат, NU3026 (2,6-ди(2,2-диметил-1,3-диоксолан-4-ил)-метокси-4,8-дипиперидинопиримидопиримидин), NU3059 (2,6-бис-(2,3-диметилоксипропокси)-4,8-дипиперидинопиримидопиримидин), NU3060 (2,6-бис[N,N-ди(2-метокси)этил]-4,6-дипиперидинопиримидопиримидин) и NU3076 (2,6-бис(диэтаноламино)-4,8-ди-4-метоксибензиламинопиримидопиримидин) (см., например, Curtin et al., Br.J.Cancer 80:1738-1746, 1999).
Лечение
Комбинированное лечение в соответствии с изобретением можно выполнять отдельно или в сочетании с другим лечением и его можно обеспечить на дому, в кабинете врача, в клинике, амбулаторном отделении больницы или в больнице. Лечение в целом начинается в больнице с тем, чтобы врач мог непосредственно наблюдать эффекты лечения и осуществлять необходимые коррекции. Длительность комбинированного лечения зависит от типа иммуновоспалительного расстройства, подвергаемого лечению, возраста и состояния пациента, стадии и типа заболевания пациента и от того, как пациент реагирует на лечение. Кроме того, лицо, имеющее больший риск развития иммуновоспалительного расстройства (например, лицо, которое генетически предрасположено или ранее имело иммуновоспалительное расстройство), может получать профилактическое лечение для ингибирования или задержки воспалительной реакции.
Дозировку, частоту и способ введения каждого компонента комбинации можно регулировать независимо. Например, одно соединение можно вводить перорально 3 раза/сутки, в то время как второе соединение можно вводить внутримышечно 1 раз/сутки. Комбинированную терапию можно проводить циклами введения и перерывов введения, которые включают периоды отдыха с тем, чтобы организм пациента имел возможность восстановиться от любых непредвиденных побочных эффектов. Соединения можно также включать в композиции вместе таким образом, что одно введение доставляет оба соединения.
Составление фармацевтических композиций
Введение каждого соединения комбинации можно осуществлять любым подходящим средством, которое приводит к концентрации соединения, которое в комбинации с другим компонентом является противовоспалительным по достижении области-мишени. Соединение может содержаться в любом целесообразном количестве в любом подходящем веществе-носителе и оно в целом присутствует в количестве от 1 до 95 мас.% общей массы композиции. Композицию можно предоставить в лекарственной форме, которая подходит для перорального, парентерального (например, внутривенного, внутримышечного), ректального, кожного, интраназального, вагинального, ингаляционного, накожного (пластырь) или глазного пути введения. Так, композиция может быть в форме, например, таблеток, капсул, пилюль, порошков, гранул, суспензий, эмульсий, растворов, гелей, включая гидрогели, паст, мазей, кремов, пластырей, вливаний, устройства осмотической доставки, суппозиториев, клизм, составов для инъекций, имплантатов, спреев или аэрозолей. Фармацевтические композиции можно составить в соответствии с обычной фармацевтической практикой (см., например, Remington: The Science and Practice of Pharmacy (20th ed.), ed. A.R.Gennaro, Lippincott Williams & Wilkins, 2000 and Encyclopedia of Pharmaceutical Technology, eds., J.Swarbrick and J.C.Boylan, 1988-1999, Marcel Dekker, New York).
Фармацевтические композиции в соответствии с изобретением можно составить для высвобождения активного соединения по существу сразу после введения, или в любое заданное время, или в период времени после введения. Последние из указанных типов композиций в целом известны как композиции контролируемого высвобождения, которые включают (i) композиции, которые создают по существу постоянную концентрацию препарата внутри организма в течение продолжительного периода времени; (ii) композиции, которые после заданного интервала времени создают по существу постоянную концентрацию препарата внутри организма в течение продолжительного периода времени; (iii) композиции, которые сохраняют действие препарата в течение заданного периода времени поддержанием относительно постоянного, эффективного уровня препарата в организме с сопутствующей минимизацией нежелательных побочных эффектов, связанных с колебаниями в плазме уровня активной лекарственной субстанции (кинетический тип в виде зубцов пилы); (iv) композиции, которые локализуют действие лекарственного препарата, например, пространственным размещением композиции контролируемого высвобождения, примыкающим к пораженной ткани или органу или находящимся в них; (v) композиции, которые нацеливают действие препарата использованием носителей или химических производных для доставки препарата к определенному типу клеток-мишеней.
Введение соединений в форме композиции контролируемого высвобождения особенно предпочтительно в случаях, при которых соединение, отдельно или в комбинации, имеет (i) узкий терапевтический индекс (т.е. разница между концентрацией в плазме, ведущей к вредным побочным эффектам или к токсическим реакциям, и концентрацией в плазме, ведущей к терапевтическому эффекту, мала; в целом терапевтический индекс TI определяют как соотношение между медианной летальной дозой (LD50) и медианной эффективной дозой (ED50)); (ii) узкое окно всасывания в желудочно-кишечном тракте или (iii) очень короткий период полувыведения, так что для поддержания уровня в плазме на терапевтическом уровне требуется частое введение в течение дня.
Можно следовать любой из ряда стратегий для получения контролируемого высвобождения, при котором скорость высвобождения перевешивает скорость метаболизма рассматриваемого соединения. В одном примере контролируемое высвобождение получают соответствующим отбором различных параметров и ингредиентов композиции, включая, например, различные типы композиций контролируемого высвобождения и покрытия. Таким образом, лекарственный препарат составляют в фармацевтическую композицию, которая после введения высвобождает лекарственный препарат контролируемым образом. Примеры включают композиции в виде стандартной лекарственной формы для однократного или множественного введения в таблетках или капсулах, масляных растворах, суспензиях, эмульсиях, микрокапсулах, микросферах, наночастицах, пластырях и липосомах.
Твердые лекарственные формы для перорального применения
Композиции для перорального применения включают таблетки, содержащие активный ингредиент (ингредиенты) в смеси с нетоксичными фармацевтически приемлемыми наполнителями. Эти данные наполнители могут представлять собой, например, инертные разбавители или наполнители (например, сахарозу, сорбит, сахар, маннит, микрокристаллическую целлюлозу, крахмалы, включая картофельный крахмал, карбонат кальция, хлорид натрия, лактозу, фосфат кальция, сульфат кальция или фосфат натрия); гранулирующие и разрыхляющие агенты (например, производные целлюлозы, включая микрокристаллическую целлюлозу, крахмалы, включая картофельный крахмал, кроскармеллозу натрий, альгинаты или альгиновую кислоту); связывающие агенты (например, сахарозу, глюкозу, сорбит, гуммиарабик, альгиновую кислоту, альгинат натрия, желатин, крахмал, предварительно желатинизированный крахмал, микрокристаллическую целлюлозу, магний алюминий силикат, карбоксиметилцеллюлозу натрия, метилцеллюлозу, гидроксипропилметилцеллюлозу, этилцеллюлозу, поливинилпирролидон или пропиленгликоль) и смазывающие агенты, глянцеватели и антиадгезивные агенты (например, стеарат магния, стеарат цинка, стеариновую кислоту, гидрированные растительные масла или тальк). Другие фармацевтически приемлемые носители могут представлять собой красящие агенты, ароматизирующие агенты, пластификаторы, смачивающие агенты, агенты, придающие буферные свойства и им подобные.
Таблетки могут быть непокрытыми или они могут быть покрыты известными методиками, в случае необходимости, для задержки распада и всасывания в желудочно-кишечном тракте, обеспечивая посредством этого длительное действие в течение более длительного периода. Покрытие можно приспособить для высвобождения активного лекарственного вещества заданным образом (например, для получения композиции контролируемого высвобождения) или оно может быть адаптировано таким образом, чтобы не высвобождать активное лекарственное вещество до тех пор, пока таблетка не пройдет через желудок (покрытие, растворимое в кишечнике). Покрытие может представлять собой сахарное покрытие, пленочное покрытие (например, на основе гидроксипропилметилцеллюлозы, метилцеллюлозы, метилгидроксиэтилцеллюлозы, гидроксипропилцеллюлозы, карбоксиметилцеллюлозы, акрилатных сополимеров, полиэтиленгликолей и/или поливинилпирролидона) или покрытие, растворимое в кишечнике (например, на основе сополимера метакриловой кислоты, ацетатфталата целлюлозы, фталата гидроксипропилметилцеллюлозы, ацетатсукцината гидроксипропилметилцеллюлозы, поливинилацетатфталата, шеллака и/или этилцеллюлозы). Кроме того, можно использовать материал для задержки времени, такой как, например, глицерилмоностеарат или глицерилдистеарат.
Композиции в виде твердых таблеток могут включать покрытие, приспособленное для защиты композиции от нежелательных химических изменений (например, химического распада перед высвобождением активного лекарственного вещества). Покрытие можно наносить на твердую лекарственную форму способом, подобным описанному в упомянутой выше Энциклопедии фармацевтической технологии.
Указанные оба препарата можно смешивать вместе в таблетку или они могут быть разделены. В одном примере первый препарат содержится на внутренней поверхности таблетки, а второй препарат находится на наружную поверхность, так что существенная часть второго препарата высвобождается перед высвобождением первого препарата.
Композиции для перорального применения могут быть также представлены в виде жевательных таблеток или в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем (например, картофельным крахмалом, лактозой, микрокристаллической целлюлозой, карбонатом кальция, фосфатом кальция или каолином), или в виде мягких капсул, в которых активный ингредиент смешан с водой или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом. Порошки и грануляты можно получить с использованием ингредиентов, упомянутых выше при описании таблеток и капсул, обычным способом с использованием, например, миксера, устройства с псевдоожиженным слоем или оборудования для сушки распылением.
Пероральные лекарственные формы контролируемого высвобождения
Композиции контролируемого высвобождения для перорального применения можно, например, составить таким образом, чтобы высвобождение активного препарата контролировалось через растворение и/или диффузию активного лекарственного вещества.
Высвобождение, контролируемое растворением или диффузией, можно достичь соответствующим покрытием таблетки, капсулы, пастилки или гранулированной композиции соединений или включением соединения в соответствующую матрицу. Покрытия контролируемого высвобождения могут включать одно или более упомянутых выше покрывающих веществ, например шеллак, пчелиный воск, гликовоск, касторовый воск, воск карнаубы, стеариловый спирт, глицерилмоностеарат, глицерилдистеарат, пальмитостеарат глицерина, этилцеллюлозу, акриловые смолы, d,l-полимолочную кислоту, ацетатбутират целлюлозы, поливинилхлорид, поливинилацетат, винилпирролидон, полиэтилен, полиметакрилат, метилметакрилат, 2-гидроксиметакрилат, метакрилатные гидрогели, 1,3-бутиленгликоль, этиленгликольметакрилат и/или полиэтиленгликоли. В матричной композиции контролируемого высвобождения материал матрицы может также включать, например, гидрированную метилцеллюлозу, воск карнаубы и стеариловый спирт, карбопол 934, силикон, глицерилтристеарат, метилакрилат-метилметакрилат, поливинилхлорид, полиэтилен и/или галогенированный фторуглерод.
Композиция контролируемого высвобождения, содержащая одно или более соединений заявленных комбинаций, может также быть в форме плавающей таблетки или капсулы (т.е. таблетки или капсулы, которая после введения плавает поверх содержимого желудка в течение определенного периода времени). Композицию соединения (соединений) в форме плавающей таблетки можно получить гранулированием смеси препарата (препаратов) с наполнителями и 20-75% масс./масс. гидроколлоидов, таких как гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза или гидроксипропилметилцеллюлоза. Полученные гранулы можно затем спрессовать в таблетки. При контакте с желудочным соком таблетка образует по существу не проницаемый для воды гелевый барьер вокруг ее поверхности. Данный гелевый барьер принимает участие в поддержании плотности менее единицы, обеспечивая посредством этого таблетке возможность оставаться на плаву в желудочном соке.
Жидкости для перорального введения
Порошки, диспергируемые порошки или гранулы, подходящие для получения водной суспензии добавлением воды, представляют собой удобные лекарственные формы для перорального введения. Композиция в виде суспензии представляет собой активный ингредиент в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом и одним или более консервантов. Подходящими диспергирующими или смачивающими агентами являются, например, естественно встречающиеся фосфатиды (например, лецитин или продукты конденсации оксида этилена с жирной кислотой, длинноцепочечным алифатическим спиртом или частичным сложным эфиром, полученным из жирных кислот) и гексит или ангидрид гексита (например, полиоксиэтиленстеарат, полиоксиэтиленсорбит