Аналоги тамандарина и дидемнина и способы их получения и применения
Иллюстрации
Показать всеИзобретение относится к области фармакологии и медицины и касается композиции для фотоафинного мечения белков, включающей аналог тамандарина формулы (1), или аналог дидемнина формулы (2), или фрагмент дидемнина формулы (3), способа получения аналогов дидемнина, фрагмента дидемнина, подложки, содержащей аналог тамандарина или дидемнина, способа ингибирования роста или пролиферации клетки и способа ингибирования онкогенеза и апоптоза в клетке. Изобретение обеспечивает снижение токсичности и повышение терапевтического индекса. 15 н. и 52 з.п. ф-лы, 51 ил., 3 табл.
Реферат
Дидемнин В представляет собой макроциклический депсипептид, выделенный из вида морского оболочника. Дидемнин В проявляет мощную противовирусную, иммуносупрессорную и противоопухолевую активность in vitro и in vivo и представляет собой первый морской натуральный продукт, который подвергался клиническому испытанию как средство борьбы с раком в организме человека (Li et al., 1992, Studies in Natural Products Chemistry, 10:241-302; Sakai et al., 1996, J. Med. Chem. 39:2819-2834; Wipf, 1995, Chem. Rev. 95:2115-2134). Дидемнин В относится к дидемнинам, представляющим собой семейство соединений, обладающих мощной способностью ингибировать синтез белка и прогрессирование клеточного цикла и индуцировать более быстрый апоптоз, чем любые другие натуральные продукты, выделенные к настоящему времени (Grubb et al., 1995, Biochem. Biophys. Res. Commun., 215:1130-1136; Johnson et al., 1996, FEBS Lett., 383:1-5; Johnson et al., 1999, Immunol. Cell Biol., 77:242-248; Johnson et al., 1999, J. Cell Biochem., 72:269-278). Другие представители указанного семейства соединений, включая дидемнин М и дегидродидемнин В, зтакже проявляют цитотоксический и цитостатический эффект.
Тамандарин А (называемый также {(2S)Hiv2}дидемнин В) представляет собой натуральное, близкое к дидемнину соединение, которое недавно было выделено из морского оболочника. Тамандарин А проявляет биологическую активность, аналогичную активности, демонстрируемой дидемнином В. Так, например, тамандарин А является мощным ингибитором синтеза белка, роста клеток и онкогенеза. Тамандарин А проявляет in vitro бульшую активность в отношении карциномы поджелудочной железы, чем дидемнин В (Liang et al., 1999, Org. Lett., 1:1319-1322). Серьезным ограничением в использовании тамандарина А как для исследовательских целей, так и для практического применения является ограниченность получения тамандарина А из натуральных источников, а также трудность и высокая стоимость выделения указанного продукта. Имеется потребность в способе синтеза тамандарина А и других аналогов дидемнина (включая аналоги дегидродидемнина).
Несмотря на активность дидемнина В в лабораторных исследованиях, его клиническая эффективность ослабляется наличием побочных эффектов, возникающих при использовании терапевтических доз данного соединения. Как и в случае многих антипролиферативных средств, дидемнин В проявляет относительно узкий терапевтический диапазон. Хотя дидемнин М и дегидродидемнин В обладают улучшенным терапевтическим потенциалом по сравнению с дидемнином В, все еще существует потребность в антипролиферативных средствах, которые бы проявляли меньшую токсичность в терапевтической дозе (например, аналогах дидемнина, обладающих большим терапевтическим индексом).
Настоящее изобретение удовлетворяет указанным выше потребностям.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
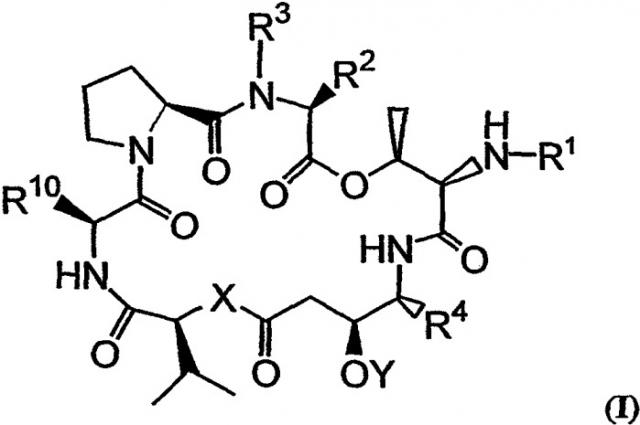
Настоящее изобретение относится к аналогам тамандарина и дидемнина, которые содержат в своей структуре остаток дезоксопролина или остаток дегидропролина. В одном варианте осуществления изобретения оно относится к композиции, включающей аналог тамандарина со структурой, описываемой формулой I:
В формуле I R1 выбирают из группы, состоящей из
-Н,
-(трет-бутилоксикарбонил)а,
-лейцина,
-(N-метил)лейцина,
-(N-метил)лейцин-(первый флуорофор)а,
-(N-метил)лейцин-пролина,
-(N-метил)лейцин-пролин-лактата,
-(N-метил)лейцин-пролин-пирувата,
-(N-метил)лейцин-пролин-лактат-(первый флуорофор)а,
-(N-метил)лейцин-пролин-лактат-глутамин-пироглутамата,
-(N-метил)лейцин-пролин-лактат-глутамин-циклопентаноата,
-(N-метил)лейцин-пролин-аланин-лейцин-пироглутамата,
-(N-метил)лейцин-пролин-(N-метил-аланин)-лейцин-пироглутамата,
-(N-метил)лейцин-дезоксопролина,
-(N-метил)лейцин-дезоксопролин-лактата,
-(N-метил)лейцин-дезоксопролин-пирувата,
-(N-метил)лейцин-дезоксопролин-лактат-(первый флуорофор)а,
-(N-метил)лейцин-дезоксопролин-лактат-глутамин-пироглутамата,
-(N-метил)лейцин-дезоксопролин-лактат-глутамин-циклопентаноата,
-(N-метил)лейцин-дезоксопролин-аланин-лейцин-пироглутамата,
-(N-метил)лейцин-дезоксопролин-(N-метил-аланин)-лейцин-пироглутамата,
-(N-метил)лейцин-дегидропролина,
-(N-метил)лейцин-дегидропролин-лактата,
-(N-метил)лейцин-дегидропролин-пирувата,
-(N-метил)лейцин-дегидропролин-лактат-(первый флуорофор)а,
-(N-метил)лейцин-дегидропролин-лактат-глутамин-пироглутамата,
-(N-метил)лейцин-дегидропролин-лактат-глутамин-циклопентаноата,
-(N-метил)лейцин-дегидропролин-аланин-лейцин-пироглутамата и
-(N-метил)лейцин-дегидропролин-(N-метил-аланин)-лейцин-пироглутамата.
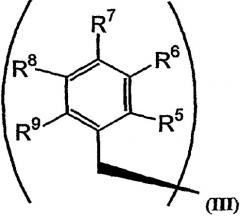
R2 и R3 в формуле I могут представлять собой отдельные группы или они могут вместе обозначать единую группу. В том случае, когда R2 и R3 обозначают отдельные группы, R3 представляет собой либо метильную группу, либо гидридный радикал и R2 выбирают из группы, состоящей из боковой цепи изолейцина, боковой цепи валина, боковой цепи аланина, боковой цепи норлейцина, боковой цепи норвалина, боковой цепи лейцина, боковой цепи гистидина, боковой цепи триптофана, боковой цепи аргинина, боковой цепи лизина, второго флуорофора и заместителя, имеющего структуру формулы III:
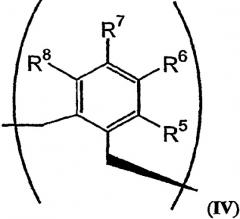
В том случае, когда R2 и R3 вместе обозначают единый заместитель, указанный заместитель имеет структуру формулы IV:
В формулах III и IV каждый из R5, R6, R7, R8 и R9 независимо выбирают из группы, состоящей из -H, -OH, -OCH3, -CO(C6H5), -Br, -I, -F, -Cl, -CH3 и -C2H5.
R4 в формуле I представляет собой либо боковую цепь изолейцина, либо боковую цепь валина. Также в формуле I Х обозначает либо -О-, либо -(NH)-, Y обозначает либо гидридный радикал, либо защитную группу для гидроксила и R10 обозначает либо боковую цепь лейцина, либо боковую цепь лизина. Аналог дидемнина представляет собой аналог, отличный от тамандарина А (то есть {(2S)Hiv2}дидемнина В). В одном варианте каждая группа пролина или лактата, которая присутствует в R1, имеет (S)-стереохимию. В другом варианте каждая группа, способная иметь стереохимические изомеры в R1, присутствует в своей природной форме (то есть в (S)-форме для аминокислотных остатков и лактата). Считается, что циклопентаноат встречается в природе в (S)-стереохимической конфигурации.
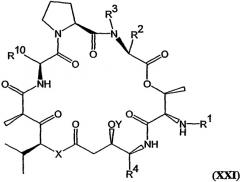
В другом варианте настоящее изобретение относится к композиции, включающей аналог дидемнина, имеющий структуру формулы XXI:
В формуле XXI каждый из R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 имеет то же значение, что было указано и для формулы I.
В предпочтительных классах дезоксопролиновых аналогов тамандарина и дидемнина, имеющих формулу I и XXI соответственно, R2 имеет структуру формулы III, R3 обозначает метил, R4 обозначает боковую цепь изолейцина, каждый из R5, R6, R8 и R9 обозначает гидридный радикал, R7 обозначает метоксигруппу, R10 обозначает боковую цепь лейцина, Х обозначает -О- и Y обозначает гидридный радикал. Примерами аналогов тамандарина и дидемнина, которые включены в рамки настоящего изобретения, являются соединения 103, 104, 105, 106, 107, 108, 109, 110, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 133, 134, 136, 137, 139, 141, 142, 143, 201, 202, 203 и 204, которые показаны на чертежах.
В одном варианте осуществления настоящего изобретения аналог тамандарина или дидемнина включает фотореактивный заместитель, такой как группа R2, имеющий структуру
Фотореактивный заместитель может быть непосредственно присоединен к аналогу, либо он может быть присоединен с помощью линкера, содержащего цепь, которая включает от 1 до примерно 13 или более атомов углерода, и необязательно имеющего в цепи вторичную аминную или амидную группу.
В другом варианте осуществления изобретения аналог тамандарина или дидемнина содержит присоединенный флуорофор, такой как аналог, в котором флуорофор присоединен к омега-аминогруппе боковой цепи лизина в R2 или R10. Пример структуры такого флуоресцентного аналога дидемнина показан на фиг.29. Альтернативно, аналог дидемнина может быть присоединен (например, ковалентно) к подложке. В большинстве вариантов осуществления изобретения Y в формулах I и XXI предпочтительно обозначает гидридный радикал.
Настоящее изобретение включает вариант его осуществления, в котором аналог тамандарина или дидемнина может быть активирован (или активность которого может быть повышена) посредством ферментативного расщепления группы, связанной с аналогом. Так, например, настоящее изобретение относится к композициям, которые включают аналог, имеющий структуру, выбираемую из группы, состоящей из приведенных ниже формул (a)-(d).
(a)
(b)
(c)
(d)
В формулах (a)-(d) R2, R3, R4, R10, X и Y имеют те же самые значения, что были указаны выше для формулы I. R13 обозначает расщепляемую ферментом группу, которая расщепляется ферментом, таким как фермент, выбираемый из группы, состоящей из карбоксипептидазы, бета-лактамазы, бета-галактозидазы, V-амидазы пенициллина, цитозиндезаминазы, нитроредуктазы, щелочной фосфатазы, бета-глюкуронидазы и каталитического антитела. В качестве возможного примера R13 может иметь структуру либо формулы V, либо формулы VI:
Примеры таких аналогов включают соединение 131 и соединение 132.
Настоящее изобретение также относится к композициям, которые включают фрагмент дидемнина, имеющий структуру формулы VII:
В формуле VII Y обозначает либо гидридный радикал, либо защитную группу для гидроксила, Х обозначает либо -О-, либо -(NH)-, R4 обозначает либо боковую цепь изолейцина, либо боковую цепь валина и APG обозначает защитную группу для амина. R11 может представлять собой любую из групп -OH, -NH2, -O(аллил), -О(пентафторфенил) и заместитель, имеющий структуру формулы VIII:
В формуле VIII R1, R2, R3 и R10 имеют те же значения, что были описаны выше для формулы I, и R12 может обозначать либо гидридный радикал, либо -2-(триметилсилил)этоксикарбонильную группу.
Описываемые аналоги тамандарина и дидемнина могут быть введены в композицию вместе с одним или более фармацевтически приемлемыми носителями с получением фармацевтических препаратов. Указанные препараты могут вводиться в клетки млекопитающих, например человека (либо in vitro, либо in vivo), для ингибирования синтеза белка, ингибирования роста, ингибирования пролиферации, ингибирования онкогенеза или усиления апоптоза в клетке, или в одну или более тканей млекопитающего.
Настоящее изобретение также относится к способу получения фрагмента дидемнина. Указанный способ включает связывание первого реагента, имеющего структуру:
и второго реагента, имеющего структуру:
с получением первого фрагмента дидемнина, имеющего структуру:
В указанной структуре Х обозначает либо -О-, либо -(NH)-, APG обозначает защитную группу для амина, Y обозначает защитную группу для гидроксила (например, триизопропилсилильную группу) и R4 может обозначать либо боковую группу изолейцина, либо боковую группу валина. Первый фрагмент дидемнина может быть гидролизован с получением второго фрагмента дидемнина, имеющего структуру:
Активатор (ACT) может быть добавлен к карбонильной группе второго фрагмента дидемнина с получением третьего фрагмента дидемнина, имеющего структуру:
Третий фрагмент дидемнина может быть связан с третьим реагентом, который имеет структуру:
с получением четвертого фрагмента дидемнина, имеющего структуру:
В указанной структуре R2 и R3 имеют те же значения, что были описаны выше для формулы I, APG обозначают защитную группу для амина, SEM обозначает 2-(триметилсилил)этоксикарбонильную группу и R10 обозначает либо боковую цепь лейцина, либо боковую цепь лизина.
Настоящее изобретение также относится к способу получения аналога дидемнина из четвертого фрагмента дидемнина. Указанный способ включает удаление групп SEM и CBZ из четвертого фрагмента дидемнина и циклизацию указанного фрагмента с получением первого аналога дидемнина, имеющего следующую структуру:
Группа APG (которая может, например, представлять собой карбобензилоксигруппу или трет-бутилкарбонильную группу) может быть удалена из первого аналога дидемнина с получением второго аналога дидемнина, имеющего структуру:
Указанный второй аналог дидемнина может быть связан с четвертым реагентом, имеющим структуру:
с получением третьего аналога дидемнина, имеющего структуру:
В указанных структурах R14 может представлять собой одну из следующих групп:
-(трет-бутилоксикарбонил),
-лейцин,
-(N-метил)лейцин,
-(N-метил)лейцин-(первый флуорофор),
-(N-метил)лейцин-пролин,
-(N-метил)лейцин-пролин-лактат,
-(N-метил)лейцин-пролин-пируват,
-(N-метил)лейцин-пролин-лактат-(первый флуорофор),
-(N-метил)лейцин-пролин-лактат-глутамин-пироглутамат,
-(N-метил)лейцин-пролин-лактат-глутамин-циклопентаноат,
-(N-метил)лейцин-пролин-аланин-лейцин-пироглутамат,
-(N-метил)лейцин-пролин-(N-метил-аланин)-лейцин-пироглутамат,
-(N-метил)лейцин-дезоксопролин,
-(N-метил)лейцин-дезоксопролин-лактат,
-(N-метил)лейцин-дезоксопролин-пируват,
-(N-метил)лейцин-дезоксопролин-лактат-(первый флуорофор),
-(N-метил)лейцин-дезоксопролин-лактат-глутамин-пироглутамат,
-(N-метил)лейцин-дезоксопролин-лактат-глутамин-циклопентаноат,
-(N-метил)лейцин-дезоксопролин-аланин-лейцин-пироглутамат,
-(N-метил)лейцин-дезоксопролин-(N-метил-аланин)-лейцин-пироглутамат,
-(N-метил)лейцин-дегидропролин,
-(N-метил)лейцин-дегидропролин-лактат,
-(N-метил)лейцин-дегидропролин-пируват,
-(N-метил)лейцин-дегидропролин-лактат-(первый флуорофор),
-(N-метил)лейцин-дегидропролин-лактат-глутамин-пироглутамат,
-(N-метил)лейцин-дегидропролин-лактат-глутамин-циклопентаноат,
-(N-метил)лейцин-дегидропролин-аланин-лейцин-пироглутамат и
-(N-метил)лейцин-дегидропролин-(N-метил-аланин)-лейцин-пироглутамат,
или он может представлять собой одну из указанных групп, соединенных с расщепляемой ферментом группой, которая расщеплена ферментом, таким как один из группы, включающей карбоксипептидазу, бета-лактамазу, бета-галактозидазу, V-амидазу пенициллина, цитозиндезаминазу, нитроредуктазу, щелочную фосфатазу, бета-глюкуронидазу и каталитическое антитело. Если Y обозначает защитную группу для гидроксила, то она в дальнейшем может быть удалена из третьего аналога дидемнина (либо перед, либо после добавления R14) с получением четвертого аналога дидемнина, имеющего структуру:
Настоящее изобретение также относится к способу получения дезоксопролинсодержащих аналогов тамандарина и дидемнина. Указанные способы используют известные методики получения аналогов тамандарина и дидемнина и далее они были модифицированы с целью включения дезоксопролинового остатка вместо пролинового остатка в аналог.
Кроме того, настоящее изобретение относится к способу получения дегидропролинсодержащих аналогов тамандарина и дидемнина. Указанные способы включают известные методики получения аналогов тамандарина и дидемнина, и они были модифицированы с целью включения дегидропролинового остатка вместо пролинового остатка в аналог.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1, включающая фиг.1А и 1В, изображает структуру тамандарина А (то есть {(2S)HIV2}дидемнина В). Фиг.1А иллюстрирует структуру (-)тамандарина А (соединение 101). Фиг.1В иллюстрирует структуру диастереомера (соединение 102) (-)тамандарина А. Хиральный центр, по которому различаются две указанные молекулы, обозначен стрелкой.
Фиг.2, включающая фиг.2А и 2В, изображает структуру тамандарина М (то есть {(2S)HIV2}дидемнина М). Фиг.2А иллюстрирует структуру (-)тамандарина М (соединение 103). Фиг.2В иллюстрирует структуру диастереомера (соединение 104) (-)тамандарина М. Хиральный центр, по которому различаются две указанные молекулы, обозначен стрелкой.
Фиг.3, включающая фиг.3А и 3В, изображает структуру тамандарина В (то есть {(2S)HIV2}дидемнина В). Фиг.3А иллюстрирует структуру (-)тамандарина В (соединение 105). Фиг.3В иллюстрирует структуру диастереомера (соединение 106) (-)тамандарина В. Хиральный центр, по которому различаются две указанные молекулы, обозначен стрелкой.
Фиг.4, включающая фиг. 4А, 4В, 4С и 4D, изображает структуру нескольких флуоресцентных аналогов дидемнина тамандаринового типа. Фиг.4А иллюстрирует структуру соединения 107. Фиг.4В иллюстрирует структуру соединения 108. Хиральный центр, по которому различаются соединения 107 и 108, обозначен стрелкой. Фиг.4С иллюстрирует структуру соединения 109. Фиг.4D иллюстрирует структуру соединения 110. Хиральный центр, по которому различаются соединения 109 и 110, обозначен стрелкой.
Фиг.5, включающая фиг. 5А и 5В, изображает класс иммобилизуемых аналогов дидемнина тамандаринового типа. Фиг.5А иллюстрирует структуру аналога дидемнина формулы I, где R10 обозначает боковую цепь лизина. Фиг.5В иллюстрирует структуру аналога дидемнина, представленного на фиг.5А, связанного с твердой подложкой (SS).
Фиг.6, включающая фиг.6А и 6В, изображает другой класс иммобилизуемых аналогов дидемнина тамандаринового типа. Фиг.6А иллюстрирует структуру аналога дидемнина формулы I, где R1 обозначает лейцин. Фиг.6В иллюстрирует структуру аналога дидемнина, представленного на фиг.6А, связанного с твердой подложкой (SS).
Фиг.7 иллюстрирует структуру соединения 115.
Фиг.8 иллюстрирует структуру соединения 116.
Фиг.9 иллюстрирует структуру соединения 117.
Фиг.10 иллюстрирует структуру соединения 118.
Фиг.11 иллюстрирует структуру соединения 119.
Фиг.12 иллюстрирует структуру соединения 120.
Фиг.13 иллюстрирует структуру соединения 121.
Фиг.14 иллюстрирует структуру соединения 122.
Фиг.15 иллюстрирует структуру соединения 123.
Фиг.16 иллюстрирует структуру соединения 124.
Фиг.17 иллюстрирует структуру соединения 125.
Фиг.18 иллюстрирует структуру соединения 126.
Фиг.19 иллюстрирует структуру соединения 127.
Фиг.20 иллюстрирует структуру соединения 128.
Фиг.21 иллюстрирует структуру соединения 129.
Фиг.22 иллюстрирует структуру соединения 130.
Фиг.23 изображает ферментативное расщепление цефалоспориновой группы аналога дидемнина 131 под действием бета-лактамазы с получением соединения 101.
Фиг.24 изображает ферментативное расщепление глюкозидной группы аналога дидемнина 132 под действием бета-глюкуронидазы с получением соединения 101.
Фиг.25, включающая фиг.25А и 25В, изображает пару структур, которые иллюстрируют структурное различие между тамандарином А (101; фиг.25А) и дидемнином В (201; фиг.25В). Макроциклическое ядро соединения 101 отличается от такового у соединения 201 тем, что у соединения 101 оно содержит альфа-гидроксиизовалерилгруппу (Hiv), а у соединения 201 оно содержит альфа-(альфа-гидроксиизовалерил)пропионилгруппу (Hip) в аналогичном положении, что обозначено скобками и пунктирной линией на каждом из чертежей.
Фиг.26, включающая фиг.26А-26Е, изображает способ синтеза с целью получения аналогов дидемнина, приведенных в настоящем описании.
Фиг.27 изображает структуру (-)тамандарина А (то есть {(2S)HIV2}дидемнина В), иллюстрирующую принятую нумерацию, используемую в настоящем описании и в работе Сакаи с соавт. (Sakai et al., 1996, J. Med. Chem., 39:2819-2834) для аналогов дидемнина.
Фиг.28, включающая фиг.28А и 28В, изображает структуру аналога дидемнина дегидротамандаринового типа (то есть {(2S)HIV2}дегидродидемнина В). Фиг.28А иллюстрирует структуру (-)дегидротамандарина (соединение 133). Фиг.28В иллюстрирует структуру диастереомера (-)дегидротамандарина (соединение 134). Хиральный центр, по которому различаются две указанные молекулы, обозначен стрелкой. Положение, по которому данные аналоги дидемнина дегидротамандаринового типа отличаются от аналогов дидемнина тамандаринового типа, обозначено звездочкой.
Фиг.29 иллюстрирует структуру флуоресцентного аналога дидемнина дегидротамандаринового типа. FL обозначает флуорофор.
Фиг.30 иллюстрирует структуру соединения 136.
Фиг.31 иллюстрирует структуру соединения 137.
Фиг.32 изображает аналог дидемнина дегидротамандаринового типа, связанный с твердой подложкой (SS).
Фиг.33 иллюстрирует структуру соединения 139.
Фиг.34 иллюстрирует структуру соединения 140.
Фиг.35, включающая фиг.35А и 35В, изображает структуру дегидротамандарина В, также обозначаемого как {(2S)HIV2, Norsta1}дидемнин В). Фиг.35А иллюстрирует структуру (-)дегидротамандарина В (соединение 141). Фиг.35В иллюстрирует структуру диастереомера (-)дегидротамандарина В (соединение 142). Хиральный центр, по которому различаются две указанные молекулы, обозначен стрелкой.
Фиг.36 иллюстрирует структуру соединения 143.
Фиг.37, включающая фиг.37А и 37В, изображает способ синтеза с целью получения (-)дегидротамандарина (то есть {(2S)HIV2}дегидродидемнина В, соединения 133).
Фиг.38, включающая фиг.38А, 38В и 38С, изображает способ синтеза с целью получения флуоресцентных аналогов дидемнина, приведенных в настоящем описании.
Фиг.39 иллюстрирует структуру предпочтительного дезоксопролинового аналога тамандарина, обозначенного как соединение 201.
Фиг.40 иллюстрирует структуру предпочтительного дезоксопролинового аналога дидемнина, обозначенного как соединение 202.
Каждая из фиг.41, фиг.42 и фиг.43 изображает способ получения групп с дезоксопролинсодержащей боковой цепью для аналогов тамандарина или дидемнина.
Фиг.44 изображает способ получения групп с дегидропролинсодержащей боковой цепью для аналогов тамандарина или дидемнина.
Фиг.45 иллюстрирует структуру предпочтительного дегидропролинового аналога тамандарина, обозначенного как соединение 203.
Фиг.46 иллюстрирует структуру предпочтительного дегидропролинового аналога дидемнина, обозначенного как соединение 204.
Каждая из фиг.47, фиг.48, фиг.49 и фиг.50 изображает способ получения аналогов дидемнина, содержащих фотореактивные группы в боковой цепи.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к аналогам тамандарина и дидемнина, включая аналоги, которые содержат в своей структуре дезоксопролиновый остаток или дегидропролиновый остаток. Настоящее изобретение относится к композициям, включающим такие аналоги, а также способы получения и использования таких аналогов. Указанные аналоги полезны, в том числе для ингибирования синтеза белка, клеточного роста, клеточной пролиферации и онкогенеза. Аналоги согласно настоящему изобретению могут также проявлять противовирусную, противоопухолевую, апоптозиндуцирующую и иммуносупрессорную активность у животных, включая людей.
Настоящее изобретение охватывает композиции, включающие аналог тамандарина, имеющий структуру:
где R1, R2, R3, R4, R10, X и Y имеют значения, приведенные в настоящем описании. Примеры аналогов указанной формулы показаны на чертежах.
Настоящее изобретение также относится к композициям, включающим аналог дидемнина, имеющий структуру:
где R1, R2, R3, R4, R10, X и Y имеют значения, приведенные в настоящем описании.
Определения
В контексте настоящего описания каждый из следующих терминов имеет значение, указанное в данном разделе.
В контексте настоящего описания аминокислотные остатки обозначаются полным наименованием, трехбуквенным кодом, соответствующим ему, или однобуквенным кодом, соответствующим ему, как указано ниже:
| Полное наименование | Трехбуквенный код | Однобуквенный код |
| Аспарагиновая кислотаГлутаминовая кислота | AspGlu | DE |
| Лизин | Lys | K |
| Аргинин | Arg | R |
| Гистидин | His | H |
| Тирозин | Tyr | Y |
| Цистеин | Cys | C |
| Аспарагин | Asn | N |
| Глутамин | Gln | Q |
| Серин | Ser | S |
| Треонин | Thr | T |
| Глицин | Gly | G |
| Аланин | Ala | A |
| Валин | Val | V |
| Лейцин | Leu | L |
| Изолейцин | Ile | I |
| Метионин | Met | M |
| Пролин | Pro | P |
| Фенилаланин | Phe | F |
| Триптофан | Trp | W |
В контексте настоящего описания термин "боковая цепь аминокислоты" относится к группе, включающей все атомы аминокислоты, за исключением атома альфа-углерода, атома водорода, связанного с альфа-углеродом, атомов альфа-карбоксильной группы и альфа-аминогруппы. Так, например, определение "боковая цепь аланина" относится к метильной группе, а определение "боковая цепь валина" относится к 2-пропильной группе.
"Ингибирование" процессов в клетке (например, ингибирование синтеза белка, ингибирование клеточного роста, ингибирование прогрессии клеточного цикла, ингибирование пролиферации клеток или ингибирование онкогенеза) означает снижение (например, по меньшей мере на 10%, 25%, 50%, 75%, 90%, 95% или даже на 100%) скорости осуществления процесса, снижение (например, по меньшей мере на 10%, 25%, 50%, 75%, 90%, 95% или даже на 100%) скорости, с которой процесс инициируется, или того и другого вместе.
"Усиление" процессов в клетке (например, усиление апоптоза) обозначает увеличение (например, по меньшей мере на 10%, 25%, 50%, 75%, 90%, 95% или даже на 100%) скорости, с которой процесс протекает, увеличение (например, по меньшей мере на 10%, 25%, 50%, 75%, 90%, 95% или даже на 100%) скорости, с которой процесс инициируется, или того и другого вместе.
В контексте настоящего описания термин "фармацевтически приемлемый носитель" означает химическую композицию, с которой аналог или фрагмент дидемнина согласно настоящему изобретению может быть объединен, и которая после такого объединения может быть введена субъекту (например, человеку или другому животному).
В контексте настоящего описания термин "физиологически приемлемый(ая)" сложный эфир или соль обозначает форму сложного эфира или соли аналога дидемнина или фрагмента дидемнина согласно настоящему описанию, которая совместима с другими ингредиентами фармацевтической композиции и которая не оказывает вредного воздействия на субъект, которому данная композиция вводится.
В контексте настоящего описания термин "парентеральное введение" фармацевтической композиции включает любой способ введения, который отличается физическим разрывом ткани субъекта и введением фармацевтической композиции через указанный разрыв в ткани. Парентеральное введение, таким образом, включает, не ограничиваясь приведенным списком, введение фармацевтической композиции посредством инъекции композиции, посредством нанесения композиции через хирургический разрез, посредством нанесения композиции через нехирургическую рану, проникающую через ткань, и др. В частности, парентеральное введение может включать, не ограничиваясь приведенным перечнем, подкожную, внутрибрюшинную, внутримышечную, внутригрудинную инъекцию и методику инфузии почечным диализом.
В контексте настоящего описания термин "противовирусная активность" обозначает предупреждение репликации вируса в клетке, предупреждение инфекции клетки вирусом или реверсирование физиологического эффекта инфицирования клетки вирусом. Противовирусный агент в рассматриваемой композиции представляет собой такой агент, который при доставке в клетку проявляет противовирусную активность. Противовирусные агенты хорошо известны и описаны в литературе. В качестве примера можно привести AZT (зидовудин, ретровир® Glaxo Wellcome Inc., Research Triangle Park, NC), представляющий собой противовирусный агент, который, как считается, препятствует репликации ВИЧ в клетках человека.
В контексте настоящего описания группа или остаток "дезоксопролина" представляет собой химическую группу, которая имеет следующую структуру:
В контексте настоящего описания группа или остаток "дегидропролина" представляет собой химическую группу, которая имеет следующую структуру:
Описание
Настоящее изобретение относится к аналогам тамандарина и дидемнина, включая те из них, которые содержат в своей структуре дезоксопролиновую или дегидропролиновую группу (и, конечно, те, которые не имеют в своей структуре дезоксопролиновой или дегидропролиновой группы). Указанные аналоги проявляют мощные фармакологические свойства при введении в организм человека и других млекопитающих. В качестве примера следует отметить, что указанные соединения могут ингибировать синтез белка и рост и пролиферацию клеток. Указанные соединения могут также усиливать апоптоз в клетках. Приведенные свойства делают данные соединения полезными при лечении множества заболеваний, которые характеризуются одним или несколькими показателями, такими как аберрантный синтез белка, аберрантный клеточный рост, аберрантная пролиферация клеток и аберрантный апоптоз. Примеры таких заболеваний включают онкогенез, рост опухоли, метастазирование опухоли, инфицирование клетки вирусом и репликацию вируса внутри клетки.
В число композиций согласно настоящему изобретению входят те, которые включают аналог тамандарина, имеющий структуру формулы I, или аналог дидемнина, имеющий структуру формулы XXI:
Заместитель R1 в формулах I и XXI может содержать в своей структуре дезоксопролиновую группу и может, например, представлять собой атом водорода или защитную группу для аминогруппы, подходящую для защиты аминокислот. Такие защитные группы известны в технике и в тексте настоящего описания приведены ссылки на них. Примеры подходящих защитных групп можно найти в монографиях: Green and Wutz, 1999, Protecting Groups in Organic Synthesis, Wiley, New York, и Bodansky, 1993, Principles of Peptide Synthesis, Springer, Berlin. Альтернативно, R1 заместитель может представлять собой аминокислотный остаток (например, остаток лейцина) или полипептид, включающий один или более аминокислотных остатков. Примеры таких остатков и полипептидов включают
-(N-метил)лейцин,
-(N-метил)лейцин-(первый флуорофор),
-(N-метил)лейцин-пролин,
-(N-метил)лейцин-пролин-лактат,
-(N-метил)лейцин-пролин-пируват,
-(N-метил)лейцин-пролин-лактат-глутамин-пироглутамат,
-(N-метил)лейцин-пролин-лактат-глутамин-циклопентаноат,
-(N-метил)лейцин-пролин-лактат-лейцин-пироглутамат,
-(N-метил)лейцин-пролин-аланин-лейцин-пироглутамат,
-(N-метил)лейцин-пролин-(N-метил)аланин-лейцин-пироглутамат,
-(N-метил)лейцин-дезоксопролин,
-(N-метил)лейцин-дезоксопролин-лактат,
-(N-метил)лейцин-дезоксопролин-пируват,
-(N-метил)лейцин-дезоксопролин-лактат-глутамин-пироглутамат,
-(N-метил)лейцин-дезоксопролин-лактат-глутамин-циклопентаноат,
-(N-метил)лейцин-дезоксопролин-лактат-лейцин-пироглутамат,
-(N-метил)лейцин-дезоксопролин-аланин-лейцин-пироглутамат,
-(N-метил)лейцин-дезоксопролин-(N-метил)аланин-лейцин-пироглутамат,
-(N-метил)лейцин-дегидропролин,
-(N-метил)лейцин-дегидропролин-лактат,
-(N-метил)лейцин-дегидропролин-пируват,
-(N-метил)лейцин-дегидропролин-лактат-(первый флуорофор),
-(N-метил)лейцин-дегидропролин-лактат-глутамин-пироглутамат,
-(N-метил)лейцин-дегидропролин-лактат-глутамин-циклопентаноат,
-(N-метил)лейцин-дегидропролин-аланин-лейцин-пироглутамат и
-(N-метил)лейцин-дегидропролин-(N-метил-аланин)-лейцин-пироглутамат.
Дополнительные примеры альтернативного заместителя R1 включают пептиды, которые содержат флуорофор (например, родамин или кумарин), аминокислотный остаток, полипептид, ферментативно расщепляемую группу или другую химическую группу, связанную (например, ковалентно соединенную) с подложкой (например, со стеклянной или силикагелевой пластиной, агаровыми или другими полимерными шариками и др.). Флуорофор или ферментативно расщепляемая группа может быть непосредственно связана с аналогом или указанный аналог может быть связан с ними через линкер, включающий от 1 до примерно 13 или более атомов углерода (необязательно включающих одну или более вторичных аминных или амидных групп). В том случае, когда R1 включает N-метил-лейциновый остаток, альфа-атом углерода в указанном остатке может иметь либо (R), либо (S) стереохимическую конфигурацию. Другие аминокислотные остатки в области определения R1 могут иметь либо (R), либо (S) стереохимическую конфигурацию, но они предпочтительно имеют (S) стереохимическую конфигурацию относительно их альфа-углеродного атома. В том случае, когда R1 включает остаток лактата, указанный остаток лактата представляет собой предпочтительно (S)-лактатный остаток. В предпочтительном варианте осуществления изобретения каждый аминокислотный остаток в рамках определения R1, отличный от остатка лейцина (или N-метил-лейцина) (если он присутствует), непосредственно присоединенный к атому азота в кольце формулы I или XXI, имеет (S) стереохимическую конфигурацию.
R3 может представлять собой либо -CH3, либо -Н. Альтернативно, R3 может вместе с R2 образовывать единый заместитель.
Заместитель R2 может представлять собой боковую цепь аминокислоты, такую как боковая цепь изолейцина (то есть 2-бутильная группа, предпочтительно имеющая (R) стереохимическую конфигурацию), боковая цепь валина (то есть 2-пропильная группа), боковая цепь аланина (то есть метильная группа), боковая цепь норлейцина (то есть 1-бутильная группа), боковая цепь норвалина (то есть 1-пропильная группа), боковая цепь лейцина (то есть изобутильная группа, предпочтительно имеющая (S) стереохимическую конфигурацию), боковая цепь фенилаланина (то есть фенилметильная группа), боковая цепь гистидина (то есть 4-метилимидазольная группа), боковая цепь триптофана (то есть 3-метилиндольная группа), боковая цепь тирозина (то есть 4-гидроксифенилметильная группа), боковая цепь аргинина (то есть 4-гуанидинилбутильная группа) и боковая цепь лизина (то есть 4-аминобутильная группа).
Заместитель R2 может включать флуорофор (например, флуорофор, соединенный с одной из боковых цепей аминокислот из числа описанных выше). Кроме того, заместитель R2 может иметь структуру формулы III:
В альтернативном варианте осуществления изобретения R2 и R3 совместно образуют заместитель, имеющий структуру формулы IV:
В формулах III и IV каждый из R5, R6, R7, R8 и R9 может независимо представлять собой заместитель, выбранный из группы, состоящей из -H, -OH, -OCH3, -CO(C6H5), -Br, -I, -F, -Cl, -CH3 и -CH2CH3.
R4 может представлять собой боковую цепь изолейцина или боковую цепь валина.
X мож