Получение замещенных инденов
Иллюстрации
Показать всеНастоящее изобретение относится к способу получения замещенных инденов формул (I) или (Ia), которые являются промежуточными соединениями, имеющими большое значение при получении эффективно действующих соединений в областях фармацеи, защиты сельскохозяйственных культур, химических продуктов тонкого химического синтеза, жидких кристаллов, и металлоценовых катализаторов, используемых при полимеризации α-олефинов. Кроме того, изобретение относится к новым соединениям формулы (II) и к их применению в качестве исходных веществ для синтеза замещенных инденов формул (I) или (Ia). Способ включает превращение соединения формулы (II) в бис(металло)органическое соединение формулы (III) и взаимодействие этого соединения с соединением формулы R1COY (IV), с получением инданола формулы (V) и превращение его в инден формулы (I) или (Ia) посредством элиминирования воды в присутствии кислотного катализатора. При этом соединение формулы (II) получают сочетанием соединения формулы (VI) с соединением формулы R2-X2 (VII) в присутствии переходного металла, в качестве катализатора, при том, что или соединение формулы (VI), или соединение формулы (VII) сначала превращают в соответствующее металлоорганическое соединение, и продукт сочетания формулы (VIII) подвергают взаимодействию с бромирующим агентом и атомы брома, введенные таким образом, затем заменяют атомами хлора с получением соединения формулы (II). Значение заместителей
R1-R5, X, М, Y, Х1, X2 указаны в формуле изобретения. 3 н.п. ф-лы.
Реферат
Настоящее изобретение относится к простому и эффективному способу получения определенным образом замещенных инденов формулы (I) или их изомеров формулы (Ia), отличающихся положением двойной связи,
а также к соединениям формулы (II), служащим в качестве исходных веществ
где
R1 представляет собой C1-C40 углеводородный радикал,
R2 представляет собой замещенный или незамещенный C6-C40 арильный радикал, где заместители этого арильного радикала представляют собой углеводородные радикалы, которые не содержат водородных атомов в α-положениях по отношению к ароматическим радикалам или виниловым группам,
R3-R5 идентичны или различны и каждый представляет собой, атом водорода или C1-C40 углеводородный радикал, который не содержит водородных атомов в α-положениях по отношению к ароматическим радикалам или виниловым группам, или R2 вместе с R3 образуют циклическую систему, а
X представляет собой атом галогена,
а также относится к применению соединения формулы (II) в качестве исходного вещества для синтеза замещенных инденов.
Замещенные индены являются промежуточными соединениями, имеющими большое значение при получении эффективно действующих соединений в областях фармацеи (Negwer, VCH 1987, p. 1703 ff.), защиты сельскохозяйственных культур, химических продуктов тонкого органического синтеза, жидких кристаллов, и металлоценовых катализаторовиспользуемых, при полимеризации α-олефинов (Chem. Rev. 2000, number 4).
Замещенные индены могут быть использованы для получения хиральных анса-металлоценов, которые имеют большое значение как компоненты переходных металлов в высокоэффективных катализаторах стереоспецифической полимеризации олефинов.
Варьирование системы лигандов, например, посредством замещения, дает возможность воздействовать на свойства катализатора запрограммированным образом. Это дает возможность изменять до желаемого уровня выход полимера, молекулярно-массовое распределение, регулярность молекулярной структуры и точку плавления полимеров. (Chem. Rev. 2000, number 4). Как было обнаружено, соединенные мостиковой связью цирконоцены, содержащие, в качестве π-лигандов, инденильные радикалы, которые присоединяют мостик в положение 1, предпочтительно, углеводородный радикал, в частности алкильный радикал, в положение 2, и дополнительный углеводородный радикал, в частности замещенный или незамещенный ароматический радикал, в положение 4, оказываются чрезвычайно высокоэффективными и стереоселективными каталитическими системами, как описано в US 5770753 и US 5723640. Системы лигандов, используемые для этих высокоэффективных металлоценов, получают из соответствующих замещенных инденов.
Стоимость получения инденов, необходимых для синтеза металлоценов, представляет собой существенную часть общей стоимости синтеза металлоценов. Различные способы получения 2-алкил-4-арил-замещенных инденов были описаны, например, в US 5770753, US 5723640, WO 98/40331 и US 5789634. Арильный радикал обычно вводят в положение 4 путем арил-арильногосочетания, катализируемого переходными металлами, или непосредственно в начале последовательности реакций синтеза, или только после того как структура инданона или инденила будет образована. В вышеупомянутых способах алкильный радикал, в положение 2 инденильной структуры, всегда вводят до того, как система 1-инданона будет образована. В Organometallics 1993, 12, 4391-4401, описывают синтез бис(инденил)металлоценов, которые соединены мостиковой связью в положении 2 и являются незамещенными по шестичленному кольцу, и в которых два инденильных лиганда, связанные мостиком в положении 2, получают непосредственно реакцией бис-Гриньяра между α,α-дихлор-o-ксилолом и соответствующим, образующим мостиковую связь, реагентом. Organometallics 1999, 18, 4147-4155, описывает синтез инденов, замещенных у положения 2 объемными арильными радикалами и незамещеных по шестичленному кольцу, которые также синтезируют, посредством реакции бис-Гриньяра между α,α-дихлор-o-ксилолом и соответственно замещенным метилбензоатом.
Известные до настоящего времени синтезы, направленные на получение 2-алкил-4-арил- или 2-алкил-7-арил-замещенных инденов, в которых при изменениях в положении 2 инденильной системы анса-металлоценов, фиксируют заместители в положениях 4 или 7 инденильной системы, требуют слишком больших затрат времени и, таким образом, слишком дороги.
Задачей настоящего исследования является поиск простого, гибкого, быстрого и недорогого способа получения замещенных 2-алкил-4-арилинденов или 2-алкил-7-арилинденов, который лишен недостатков известных способов получения, и, в частности, позволяет легко менять радикалы в положении 2 инденильной системы.
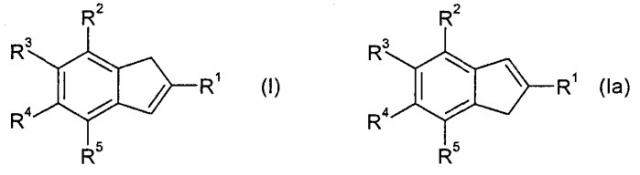
Поставленная задача достигается способом получения замещенных инденов формулы (I)
и их изомеров формулы (Ia), отличающихся положением двойной связи
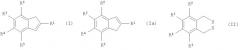
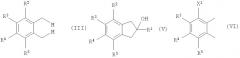
который включает превращение соединения формулы (II)
в бис(металло)органическое соединение формулы (III)
и взаимодействие его с соединением формулы (IV)
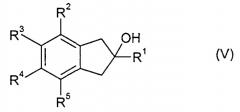
с получением инданола формулы (V)
и превращение его в инден формулы (I) или (Ia), посредством элиминирования воды, где
R1 представляет собой C1-C40 углеводородный радикал,
R2 представляет собой замещенный или незамещенный C6-C40 арильный радикал, где заместители указанного арильного радикала представляют собой углеводородные радикалы, которые не содержат водородных атомов в α-положениях по отношению к ароматическим радикалам или виниловым группам,
R3-R5 идентичны или различны и каждый представляет собой водородный атом или C1-C40 углеводородный радикал, который не содержит водородных атомов в α-положениях по отношению к ароматическим радикалам или виниловым группам, или R2 и R3 вместе образуют циклическую систему, которая не содержит водородных атомов в α-положениях по отношению к ароматическим радикалам или виниловым группам, или R2 вместе с R3 образуют циклическую систему,
X представляет собой атом галогена,
M представляет собой моногалогенид лития, натрия, калия или магния, или два радикала M вместе представляют один атом магния, и
Y представляет собой нуклеофильную отщепляемую группу.
Более того, получены соединения формулы (II)
где R2, R3, R4, R5 и X, каждый, представляет собой соответствующий заместитель, как было определено выше, а также обнаружили возможность использования этих соединений в качестве исходных веществ для синтеза замещенных инденов.
R1 представляет собой, например, C1-C20 алкильный радикал, C6-C18 арильный радикал, C7-C40 арилалкильный радикал или C7-C40 алкиларильный радикал. Предпочтительно, когда R1 представляет собой С1-C20 алкильный радикал, в частности, нормальный, разветвленный или циклический С1-C10 алкильный радикал.
R2 представляет собой замещенный или незамещенный C6-C40 арильный радикал, где заместители указанного арильного радикала представляют собой углеводородные радикалы, которые не содержат водородных атомов в α-положениях по отношению к ароматическим радикалам или виниловым группам. R2, предпочтительно, представляет собой замещенный или незамещенный C6-C18 арильный радикал, такой как фенил, 1-нафтил, фенантрил, 3-трет-бутилфенил, 4-трет-бутилфенил, 3,5-ди(трет-бутил)фенил, 4,4'-бифенил или 3,5-ди(фенил)фенил.
R3-R5 идентичны или различны и каждый представляет собой водородный атом или C1-C40 углеводородный радикал, который не содержит водородных атомов в α-положениях по отношению к ароматическим радикалам или виниловым группам. Примерами таких углеводородных радикалов могут служить трет-бутил, трет-пентил, 1-адамантил, фенил, 1-нафтил, фенантрил, 3-трет-бутилфенил, 4-трет-бутилфенил, 3,5-ди(трет-бутил)фенил, 4,4'-дифенил и 3,5-ди(фенил)фенил. R3-R5, предпочтительно, представляют собой водородный атом.
Радикалы R2 и R3 могут вместе образовывать циклическую систему, которая не содержит водородных атомов в α-положениях по отношению к ароматическим радикалам или виниловым группам, при этом R2 и R3, вместе со связывающими их атомами, в частности, предпочтительно, образуют замещенную или незамещенную 1,3-бутадиен-1,4-диильную группу. Особенно предпочтительно, когда R2 и R3, вместе со связывающими их атомами, образуют незамещенную 1,3-бутадиен-1,4-диильную группу.
X представляют собой атом галогена, такой как хлор, бром или иод, предпочтительно, хлор.
M, предпочтительно, представляют собой, монохлорид магния.
Y представляют собой нуклеофильную отщепляемуюгруппу, такую как галоген, радикал R6CO2 или радикал OR6. Y, предпочтительно, представляют собой радикал OR6, где R6 представляют собой С1-C40 углеводородный радикал, такой как С1-C20 алкильный радикал, С6-C18 арильный радикал, C7-C40-арилалкильный радикал или C7-C40 алкиларильный радикал. R6, предпочтительно, представляет собой С1-C10 алкильный радикал.
Водородные атомы, присутствующие в α-положении по отношению к ароматическим радикалам или виниловым группам, представляют собой, например, бензиловые водородные атомы, как в метильной группе толуола, (CH3-C6H5), или в метиновой группе кумола, ((СН3)2СН-C6H5), или аллильные водородные атомы, как в метиленовой группе 1-бутена, (CH2=CH-CH2-СН3).
Если далее отсутствуют ограничения, тогда алкил представляет собой нормальный, разветвленный или циклический радикал, такой как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, н-гексил, циклогексил, н-гептил или н-октил.
Описанный выше способ по настоящему изобретению предпочтительно, используют для получения замещенных инденов формулы (I) или (Ia), в которых
R1 представляет собой нормальный, разветвленный или циклический C1-C10 алкильный радикал,
R2 представляет собой замещенный или незамещенный С6-C18 арильный радикал, выбранный из группы, состоящей из фенила, 1-нафтила, фенантрила, 3-трет-бутилфенила, 4-трет-бутилфенила, 3,5-ди(трет-бутил)фенила, 4,4'-бифенила и 3,5-ди(фенил)фенила,
R3-R5, каждый, представляет собой водород,
X представляет собой атом хлора,
M представляет собой монохлорид магния и
Y представляет собой OR6, где R6 является нормальным, разветвленным или циклическим C1-C10 алкильным радикалом.
В предпочтительном варианте осуществления радикалы и заместители могут быть описаны более подробно нижеследующим образом:
R1 представляет собой нормальный, разветвленный или циклический C1-C10 алкильный радикал. Примерами радикалов R1 являются метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, н-пентил, циклопентил, н-гексил, циклогексил, н-гептил, н-октил и н-децил.
R2 представляет собой замещенный или незамещенный C6-C18 арильный радикал, выбранный из группы, состоящей из фенила, 1-нафтила, фенантрила, 3-трет-бутилфенила, 4-трет-бутилфенила, 3,5-ди(трет-бутил)фенила, 4,4'-бифенила и 3,5-ди(фенил)фенила. R2, в частности, предпочтительно, является фенилом, 1-нафтилом, 4-трет-бутилфенилом или 3,5-ди(трет-бутил)фенилом.
Y представляет собой OR6, где R6 является нормальным, разветвленным или циклическим C1-C10 алкильным радикалом, например метилом, этилом, н-пропилом, изопропилом, н-бутилом, втор-бутилом, изобутилом, н-пентилом, циклопентилом, н-гексилом, циклогексилом, н-гептилом, н-октилом или н-децилом. R6, предпочтительно, является метилом или этилом.
Особо предпочтителен способ по настоящему изобретению, в котором соединение формулы (II)
в котором радикалы X, R2, R3, R4 и R5 являются такими, как было определено выше, получают путем сочетания соединения формулы (VI)
с соединением формулы (VII)
R2-X2 (VII)
в присутствии переходного металла, в качестве катализатора, при этом сначала или соединение формулы (VI), или соединение формулы (VII) превращают в соответствующее металлоорганическое соединение, в частности соединение лития или соединение Гриньяра, и продукт сочетанияформулы (VIII)
подвергают воздействию галогенирующего агента, далее атомы галогенов, введенные указанным способом, при желании, замещают другими атомами галогенов, получая соединение формулы (II),
где
X1 представляет собой галоген, в частности хлор, бром или иод, предпочтительно хлор, и
X2 представляет собой галоген, в частности хлор, бром или иод, предпочтительно бром.
Соединения формул (VI) и (VII) выпускаются промышленностью и доступны. Соединения формулы (VI) или (VII), с помощью способов, известных из литературных источников, могут быть превращены в соответствующие литийорганические соединения или соединения Гриньяра; или, в отдельных случаях, металлоорганические соединения также являются промышленно доступными. Синтез таких реактивов Гриньяра описан, например, в Holm, Torkil, J. Chem. Soc. Perkin Trans. 2. 1981, 464-467. Синтез дополнительных металлоорганических реактивов, исходя из соединений формул (VI) и (VII) может быть осуществлен посредством стандартных методик металлоорганической химии, которые можно найти, например, в March, Advanced Organic Chemistry, 4th edition, 1992 и приведенных там ссылках.
Арил-арильное сочетание, осуществляемое в присутствии переходного металла, в качестве катализатора, с целью синтезирования соединения формулы (VIII), известно и может быть выполнено с помощью методик, приведенных в литературных источниках, описанных, например, в Synthesis, 1990, 147-148. Катализаторы, представляющие собой переходные металлы, предпочтительно, используемые в реакциях сочетания, также известны из литературных источников и, как правило, доступны и выпускаются промышленностью.
В принципе, в качестве катализаторов, представляющих собой переходные металлы, можно использовать комплексы переходных металлов, относящиеся к 8-10 группам Периодической таблицы элементов, в частности к 10 группе. Особенно подходящими катализаторами оказываются комплексы никеля или палладия, в частности комплексы никеля, например никель(ll)хлорид, [1,3-бис(дифенилфосфино)пропан]никель(ll)хлорид (NiCI2[dppe]2), [1,2-бис(дифенилфосфино)этан]никель(ll)хлорид(NiCI2[dppe]2), бис(трифенилфосфин)никель(ll)хлорид, аддукт [1,1'-бис(дифенилфосфино)ферроцен]никель(ll)хлорида и метиленхлорида. В случае использования присочетании арилбороновой кислоты, вместо соединений ариллития или арилмагния, особое предпочтение отдают использованию комплексов палладия, в качестве катализаторов, как описано в WO 98/40331 и приведенных там ссылках.
Сочетание, при получении соединения формулы (VIII), осуществляют в пригодных инертных растворителях или смеси растворителей, подходящих для конкретных реагентов, например в диэтиловом эфире, тетрагидрофуране, толуоле и так далее, в защитной газовой атмосфере.
Превращение двух метильных групп в соединениях формулы (VIII) в две галометильные группы (формулы (II)), в принципе, известно из литературных источников, и обычно его осуществляют путем свободнорадикального галогенирования боковой цепи, используя такие бромирующие агенты, как элементарный бром или N-бромсукцинимид или используя такие хлорирующие реагенты, как элементарный хлор или сульфурилхлорид (cf. March, Advanced Organic Chemistry, 4th edition, 1992 и приведенные там ссылки).
Замещение галогеновых радикалов X в соединениях формулы (II) другими галогеновыми радикалами X аналогично способу, известному из литературных источников и описанному, например, в March, Advanced Organic Chemistry, 4th edition, 1992 и в приведенных там ссылках.
Получение соединения формулы (III) может быть осуществлено посредством способов, основанных на методиках, известных из литературных источников, как описано в Organometallics 1993, 12, 4398. Для получения соединений формулы (III) из соединений формулы (II), кроме магния, в форме мелких стружек или порошка, поверхность которого, при необходимости, может быть корродирована, то есть активирована, 1,2-дибромэтаном, возможно также использование других источников высокоактивного магния, таких как магнийантрацен.
Реакция соединения формулы (III) с соединениями формулы (IV) с образованием соединений формулы (V), в принципе, представляет собой способ, известный из литературных источников, и может быть осуществлена при использовании методик, которые основываются на методиках, приведенных в Organometallics 1993, 12, 4398 или в Organometallics 1999, 18, 4147-4155. Образованный индан-2-ол может быть дегидратирован с помощью стандартных процедур, например, в соответствии с тем, как описано в US 5770753, с образованием индена формулы (I) или (Ia). В качестве кислотных катализаторов можно использовать, например, п-толуолсульфокислоту, серную кислоту, хлористоводородную кислоту или сильный кислотный ионит.
Изобретение проиллюстрировано нижеследующими неограничивающими примерами.
ОБЩИЕ МЕТОДИКИ:
Получение и обработку металлоорганических соединений, если не оговорено иначе, выполняли, для исключения влаги и воздуха, в атмосфере аргона, в качестве защитного газа, (применяя способ Schlenk, или в боксе с перчатками). Все необходимые безводные растворители продували аргоном и перед использованием сушили над молекулярными ситами. 1H ЯМР спектры измеряли при 400 МГц в CDCI3. Хроматографическую очистку осуществляли, используя Fluka Silica 60 (230-400 меш).
ПРИМЕР 1
4-трет-бутил-2',3'-диметилбифенил
23,8 г (1,1 экв.) магния (для реакций Гриньяра, отфирмы Aldrich) суспендировали в 95 мл тетрагидрофурана (ТГФ) и активировали добавлением небольшого количества иода. После чего добавляли 62,7 г (0,45 моль) 2,3-диметилхлорбензола. Реакцию Гриньяра активируют путем осторожного добавления нескольких капель 1,2-дибромэтана. После того как реакция успешно началась, остающиеся 62,7 г (0,45 моль) 2,3-диметилхлорбензола, разбавленного 380 мл ТГФ, добавляли по каплям с такой скоростью, чтобы реакционный раствор слабо кипел. После чего реакционную смесь кипятили с обратным холодильником до тех пор, пока большая часть магния не прореагировала (в течение 2 часов). После того как реакционная смесь остыла до комнатной температуры, к вязкой смеси добавляли следующие 95 мл ТГФ. 190,0 г (0,89 моль) п-трет-бутилбромбензола, разбавленного 190 мл ТГФ, помещали в дополнительную реакционную колбу. В нее добавляли 1,0 г (1 моль%) никель(ll)хлорида, с последующим осторожным добавлением раствора Гриньяра. Температура резко поднималась до 80°C. Реакционную смесь перемешивали при 50-55°C, в течение 2 часов. После охлаждения до комнатной температуры осторожно добавляли 190 мл 2 молярной хлористоводородной кислоты. Водную фазу экстрагировали диэтиловым эфиром (3×200 мл), объединенные органические фазы сушили над сульфатом магния и удаляли растворитель при пониженном давлении. Осадок перекристаллизовывали из кипящего этанола и получали две кристаллические фракции (1ая фракция: 139,3 г, согласно ГХ, 100% /2ая фракция: 20,5 г, согласно ГХ, 96,2%). Совместный выход составлял: 159,8 г (0,67 моль/75%). 1H ЯМР (400 МГц, CDCl3): δ=7,41 ("д", 2H, ароматический), 7,21 ("д"<2H, аромат.), 7,14-7,07 (м, 3H, аромат.), 2,33 (с, 3H, CH3), 2,16 (с, 3H, CH3), 1,36 (с, 9H, трет-бутил) м.д.
ПРИМЕР 2
4-трет-бутил-2',3'-бис(бромметил)бифенил
137,2 г (0,58 моль) 4-трет-бутил-2',3'-диметилбифенила растворяли в 576 мл четыреххлористого углерода. Добавляли 205,1 г (1,15 моль) N-бромсукцинимида и 1,37 г (8,3 ммоль) AlBN, и смесь быстро нагревали до температуры перегонки. После завершения реакции (3 часа, согласно данным тонкослойной хроматографии), реакционную смесь охлаждали до комнатной температуры, и сукцинимид, который выпадал в осадок, удаляли фильтрованием. Фильтровальный осадок промывали дополнительной порцией четыреххлористого углерода. Объединенные фильтраты упаривали при пониженном давлении, для удаления растворителя. Получали 259,5 г неочищенного продукта. Добавляли 550 мл этанола и смесь оставляли на ночь для кристаллизации. Так как осаждение кристаллов не происходило, то к раствору добавляли небольшой кристаллик продукта, полученного в предыдущем эксперименте. Продукт быстро выкристаллизовывался, кристаллы отделяли фильтрованием и промывали этанолом. Выход составлял: 179,8 г (0,45 моль/79%/согласно ГХ, 84,%). 1H ЯМР (400 МГц, CDCl3): δ=7,45, 7,38, 7,31, 7,21 (4 × м, 7H, аромат.), 4,78, 4,61 (2 × с, 2 × 2H, CH2Br), 1,36 (с, 9H, трет-бутил) м.д.
ПРИМЕР 3
4-трет-бутил-2',3'-бис(хлорметил)бифенил
40,0 г (101,0 ммоль) трет-бутил-2,3-бис(бромметил)бифенила растворяли в 660 мл ДМФА. Добавляли 25,7 г (6 экв.) хлорида лития и реакционную смесь перемешивали при комнатной температуре, в течение 24 часов. После чего добавляли 500 мл воды и 300 мл диэтилового эфира, и водную фазу экстрагировали диэтиловым эфиром (2×200 мл). Объединенные органические фазы промывали водой (3×150 мл), насыщенным раствором хлорида натрия (1×100 мл) и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении до получения желтого масла. Кристаллизация из 200 мл этанола дала 17,9 г белых кристаллов. Маточный раствор концентрировали при пониженном давлении и оставляли для кристаллизации. Получали дополнительные 5,5 г 2ой кристаллической фракции. Объединенный выход составлял: 23,4 г (76 ммоль/75%/согласно ГХ, 89,5%). 1H ЯМР (400 МГц, CDCl3): δ=7,46-7,26 (м, 7H, аромат.), 4,86, 4,67 (2 × с, 2 x 2H, CH2Cl), 1,36 (с, 9H, трет-бутил).
ПРИМЕР 4
4-(4-трет-бутилфенил)-2-метил-1H-инден и 7-(4-трет-бутилфенил)-2-метил-1H-инден
8,4 г (20,0 ммоль) магнийантрацена3 ТГФ растворяли в 100 мл ТГФ. В течение 30 минут, по каплям, при температуре 0°C, добавляли раствор 3,07 г (10,0 ммоль) трет-бутил-2,3-бис(хлорметил)бифенила в 20 мл ТГФ. Реакционную смесь перемешивали при комнатной температуре еще 30 минут. Отбирали пробу и подвергали гидролизу (ГХ анализ показал: происходит образование на 60% реактива бис-Гриньяра,и образование олигомеров). При температуре 0°C, в течение 30 минут, по каплям, добавляли раствор 741 мг (1 экв.) метилацетата в 30 мл ТГФ, и реакционную смесь перемешивали при комнатной температуре, в течение ночи. После этого реакционную смесь добавляли к насыщенному раствору хлорида аммония. Водную фазу экстрагировали диэтиловым эфиром (3×100 мл). Объединенные органические фазы сушили над хлоридом магния и растворитель выпаривали при пониженном давлении. ГХ анализ неочищенного продукта (7,28 г) показал присутствие 15% требуемого инданола, вместе с антраценом и дополнительными побочными продуктами. Антрацен удаляли колоночной хроматографией, используя гептан в качестве элюента, а инданол элюировали, используя смесь 1:1 метиленхлорид/этанол. Желтое масло, полученное после удаления растворителей (2,3 г, согласно ГХ, 64,4% инданола), растворяли в 40 мл толуола и кипятили с обратным холодильником на водоотделителе, в присутствии 5 моль% п-толуолсульфокислоты, в течение 1,5 часов. Органическую фазу промывали насыщенным раствором (1×40 мл) гидрокарбоната натрия и сушили над сульфатом магния. Удаление растворителя и очистка колоночной хроматографией давали 0,72 г (2,8 ммоль/ 28%) смеси 1:1 требуемых инденов (согласно ГХ, 93%). 1H ЯМР (400 МГц, CDCl3): δ=7,48-7,14 (м, аромат.), 6,72, 6,54 (2 × с, =C-H), 3,42, 3,38 (2 × с, CH3), 2,16 ("с", CH2), 1,39 ("с", трет-бутил) м.д.
ПРИМЕР 5
4-(4-трет-бутилфенил)-2-метилиндан-2-ол
633 мг (26 ммоль, 4 экв.) порошка Mg (50 mesh/Aldrich) сушили при пониженном давлении с помощью фена. Добавляли 10 мл ТГФ и 10 капель 1,2-дибромэтана. Смесь нагревали с обратным холодильником до тех пор, пока не начиналось выделение газа, и активация была полной. Растворитель удаляли при пониженном давлении и добавляли 10 мл свежей порции ТГФ. Добавляли раствор 2,0 г (6,5 ммоль) трет-бутил-2,3-бис(хлорметил)бифенила в 120 мл ТГФ и суспензию энергично перемешивали при комнатной температуре в течение 3 часов. Перемешивание продолжали в течение ночи и полученный слегка зеленоватый мутный раствор фильтровали для удаления избытка магния. Фильтрат охлаждали до температуры -78°C и в течение 1 часа, по каплям, добавляли раствор 482 мг (6,51 моль) метилацетата в 60 мл ТГФ. Реакционный раствор в течение 2 часов нагревали до температуры 0°C. После чего добавляли 80 мл воды и раствор концентрировали при пониженном давлении. Для растворения солей магния добавляли 3 мл концентрированной хлористоводородной кислоты и водную фазу экстрагировали метиленхлоридом (3×50 мл). Объединенные органические фазы сушили над сульфатом магния, после чего при пониженном давлении удаляли растворитель. Продукт очищали колоночной хроматографией, при этом неполярные побочные продукты удаляли, используя смесь гептан/дихлорметан, и продукт элюировали чистым дихлорметаном, получая желтый продукт. Выход составлял: 0,64 г (2,28 ммоль / 35% / согласно ГХ, 94,5%). 1H ЯМР (400 МГц, CDCl3): δ=7,43-7,22 (м, 7H, аромат.), 3,08 (м, 4H, CH2), 1,48 (с, 3H, CH3), 1,35 (с, 9H, трет-бутил) м.д.
ПРИМЕР 6
4-(4-трет-бутилфенил)-2-изопропилиндан-2-ол
633 мг (26 ммоль, 4 экв.) порошка Mg (50 меш/Aldrich) сушили при пониженном давлении с помощью фена. Добавляли 10 мл ТГФ и 10 капель 1,2-дибромэтана. Смесь нагревали с обратным холодильником до тех пор, пока не начиналось выделение газа и активирование было полным. Растворитель удаляли при пониженном давлении и добавляли 10 мл свежей порции ТГФ. Добавляли раствор 2,0 г (6,5 ммоль) трет-бутил-2,3-бис(хлорметил)бифенила в 120 мл ТГФ и суспензию энергично перемешивали в течение 3 часов при комнатной температуре. Перемешивание продолжали в течение ночи и полученный слегка зеленоватый мутный раствор фильтровали, чтобы удалить избыток магния. Фильтрат охлаждали до температуры -78°C и в течение 1 часа, по каплям, добавляли раствор 665 мг (6,51 моль) метилизобутирата в 60 мл ТГФ. Реакционный раствор в течение 2 часов нагревали до температуры 0°C. После чего добавляли 80 мл воды и раствор концентрировали при пониженном давлении. Для растворения солей магния добавляли 3 мл концентрированной хлористоводородной кислоты и водную фазу экстрагировали метиленхлоридом (3×50 мл). Объединенные органические фазы сушили над сульфатом магния, после чего растворитель удаляли при пониженном давлении. Продукт очищали колоночной хроматографией, при этом неполярные побочные продукты удаляли, используя смесь гептан/дихлорметан, и продукт элюировали чистым дихлорметаном, получая желтый продукт. Выход составлял: 0,66 г (2,14 ммоль / 33%/ согласно ГХ, 96%). 1H ЯМР (400 МГц, CDCl3): δ=7,41-7,21 (м, 7H, аромат.), 3,18-2,91 (м, 4H, CH2), 1,92 (м, 1H, CH), 1,36 (с, 9H, трет-бутил), 1,02 (т, 6H, CH3) м.д.
1. Способ получения замещенных инденов формулы (I)
и их изомеров, отличающихся положением двойной связи, формулы (Ia),
который включает превращение соединения формулы (II)
в бис(металло)органическое соединение формулы (III)
и взаимодействие этого соединения с соединением формулы (IV)
с получением инданола формулы (V)
и превращение его в инден формулы (I) или (Ia) посредством элиминирования воды в присутствии кислотного катализатора, причем соединение формулы (II)
получают сочетанием соединения формулы (VI)
с соединением формулы (VII)
в присутствии переходного металла в качестве катализатора, при том, что или соединение формулы (VI), или соединение формулы (VII) сначала превращают в соответствующее металлоорганическое соединение, и продукт сочетания формулы (VIII)
подвергают взаимодействию с бромирующим агентом и атомы брома, введенные таким образом, затем заменяют атомами хлора с получением соединения формулы (II),
где
R1 представляет собой нормальный, разветвленный или циклический C1-С10 алкильный радикал,
R2 представляет собой замещенный или незамещенный С6-C18 арильный радикал, выбранный из группы, состоящей из фенила, 1-нафтила, фенантрила, 3-трет-бутилфенила, 4-трет-бутилфенила, 3,5-ди(трет-бутил)фенила, 4,4'-бифенила и 3,5-ди(фенил)фенила, R3-R5 каждый является атомом водорода,
X представляет собой атом хлора,
М представляет собой монохлорид магния и
Y представляет собой OR6, где R6 является нормальным, разветвленным или циклическим C1-С10 алкильным радикалом, X1 представляет собой галоген и X2 представляет собой галоген.
2. Соединение формулы (II)
где R2, R3, R4, R5 и Х представляют собой соединения по п.1.
3. Применение соединения формулы (II) по п.2 в качестве исходного вещества для синтеза замещенных инденов (I) или (Ia) по п.1.