Средство против аллергии
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, в частности к средству против аллергии. Средство против аллергии, полученное путем толуольной экстракции бересты, содержащее в качестве активных компонентов бетулин, лупеол и О-кофеат бетулина, а также сопутствующие вещества, взятые в определенном количестве. Вышеописанное средство эффективно против аллергии, не обладает побочными эффектами. 11 табл., 1 ил.
Реферат
Область техники
Изобретение относится к области медицины, а более конкретно к поиску новых средств противоаллергенного действия.
Уровень техники
По социально-экономическому ущербу, влиянию на уровень здоровья и качество жизни, аллергические болезни занимают одно из ведущих мест в структуре патологии человека и представляют глобальную медико-социальную проблему. Согласно данным литературы, в настоящее время проблема аллергии - проблема национальной безопасности, 25-40% населения России имеют различные аллергические заболевания, за последние 30 лет в экономически развитых странах количество аллергических осложнений увеличивается вдвое каждые десять лет. Социально-экономический ущерб от аллергических заболеваний в России составляет 2,6 млдр.$ в год.
Существует достаточно большое число широко известных антигистаминных препаратов, используемых в современной медицине, однако проблема поиска новых эффективных средств против различных заболеваний аллергического происхождения продолжает оставаться актуальной. Особенно важной является задача определения новых противоаллергеных средств природного, в частности растительного происхождения, с минимальным количеством побочных эффектов при применении.
В народной медицине целый ряд растений обладает противовоспалительными и антиаллергенными свойствами [http://eastbook.by.ru/minaeva/g14/d24.htm], в том числе фигурирует и береза бородавчатая, с указанием на возможность использования для приготовления антиаллергенов из листьев березы и березового сока.
Противовоспалительными свойствами кора березы обладает за счет входящих в ее состав пентациклических тритерпеноидов: бетулина, а также лупеола, увеола, бетулиновой и олеаноловой кислот и других минорных компонентов. Противоаллергенная активность продуктов, полученных из данного растения, связывается с содержанием в них бетулина (см. патент RU 2254032), а также другого тритерпеноида - олеаноловой кислоты.
Антиаллергенная активность тритерпеноидов (как блокаторов H1 рецепторов гистамина) раскрывается японскими авторами (JP 10-287582), которые исследовали в этом направлении экстракт бересты, состоящий из тритерпеноидов, с преобладанием среди них бетулина. Однако в указанной работе не раскрывается состав исследовавшихся экстрактов и указывается другой механизм действия.
Сущность изобретения
Задачей настоящего изобретения является получение противоаллергенного средства на основе композиции тритерпеноидов, обладающих другим механизмом действия, чем известные противоаллергенные антигистаминные препараты, и исследовавшиеся композиции в указанных выше патентах.
Другой задачей настоящего изобретения является получение такого противоаллергенного средства, который, не уступая по определенным показателям таким наиболее эффективным препаратам, как супрастин и кларитин (лоратадин), не дает свойственных им побочных эффектов и более активен, чем бетулин.
Решаются указанные задачи настоящим изобретением благодаря получению композиции тритерпенов определенного состава, а именно (мас.%):
| бетулин | 65-71 |
| лупеол | 12-16 |
| 3-О- кофеат бетулина | 5-15 |
| сопутствующие вещества до | 100% |
Композиция получается экстракцией бересты - верхней части коры березы способом по патенту RU №2192879, принадлежащему заявителю данной заявки.
Пример 1.
Экстракцию измельченной бересты осуществляли толуолом в течение около 1,5 часов при постоянном перемешивании и температуре 90-110°С. После завершения процесса экстракции осуществляли фильтрацию массы через ткань, при температуре 40-50°С.
Из шрота был частично отогнан толуол, а оставшуюся массу охлаждали в течение 6-10 часов до температуры 15-5°С, после чего проводили повторную тканевую фильтрацию и промывку массы на фильтре толуолом. Затем осуществляли вакуумную отгонку толуола и получали конечный продукт в виде кристаллов желтоватого цвета. Полученный экстракт подвергли высокоэффективной жидкостной хроматографии (ВЭЖХ) при следующих условиях: колонка Separon S 6×C18 (3,3·150 мм), элюент: ацетонитрил/метанол/ вода+фосфорная кислота 40/40/20+0,6 мл на 100 мл смеси, расход элюента 0,5 мл/мин.
Детекция осуществлялась с помощью УФ-детектора при 210 нм. Состав экстракта по результатам ВЭЖХ (%):
бетулин - 65
лупеол - 12
3-О-кофеат бетулин - 15
сопутствующие вещества - остальное до 100%
Пример 2.
Получали экстракт по примеру 1 и подвергали его дополнительной очистке этиловым спиртом, затем промывке водой и сушке. При этом получали кристаллы от кремового до белого цвета. (При дополнительной очистке увеличивалось содержание бетулина и лупеола и уменьшалось содержание кофеата бетулина, придававшего кристаллам желтый цвет). По результатам ВЭЖХ экстракт имел следующий состав (%):
бетулин - 71
лупеол - 16
3-О-кофеат бетулина - 5
сопутствующие вещества - остальное до 100%
Примеры исследования антиаллергенной активности
Оценку специфического противоаллергенного действия композиции согласно изобретению проводили согласно методическим рекомендациям, утвержденным Фармакологическим комитетом РФ "Методические указания по оценке аллергизирующих свойств фармакологических веществ" и «Методические указания по изучению иммунотропной активности фармакологических веществ" (2000 г.). В работе использовали самцов морских свинок альбиносов из питомника Российской Академии медицинских наук (РАМН) «Центральный» массой 250-300 г и мышей самцов линии СВА массой 18-20 г из питомника РАМН «Столбовая», после двухнедельного карантина в виварии Научно-исследовательского института фармакологии РАМН. Животных содержали в стандартных условиях со свободным доступом к корму и воде. В качестве основного корма были использованы брикетированные гранулированные корма. Препаратами сравнения были выбраны два эффективных препарата с различными механизмами противоаллергенного фармакологического действия: кларитин (лоратадин) и супрастин (хлоропирамин).
Методы исследования
Реакция общей анафилаксии на морских свинках-альбиносах
Учитывая современные представления о том, что аллергическая сенсибилизация, стимуляция продукции IgE антител вызывается селективным развитием Th2-хелперов, а также экспериментальное доказательство аллергизирующих свойств овальбумина (13), была выбрана модель сенсибилизации интактных морских свинок 0,6% раствором белка куриного яйца (БКЯ), основным аллергенным компонентом которого является овальбумин.
Для получения реакции анафилаксии животных контрольной и опытных групп иммунизировали перорально 0,6% раствором белка куриного яйца (БКЯ) в дозе 1 мл на 250 г массы тела в течение трех дней (растворенный в физиологическом растворе БКЯ морским свинкам вводили перорально через мягкий пластмассовый зонд) (6).
В первой серии экспериментов через 12 дней после начала иммунизации БКЯ животным опытных групп в течение трех дней в/б вводили 1-й опытной группе морских свинок исследуемую композицию в дозе 50 мг/кг, 2-й опытной группе животных вводили препарат сравнения, супрастин, в дозе 50 мг/кг, контрольным животным вводили 1% крахмальный гель. На следующие сутки 1-й опытной группе морских свинок вводили исследуемую композицию в дозе 50 мг/кг, 2-й опытной группе - супрастин, в дозе 50 мг/кг, контрольным животным вводили аналогичный объем растворителя. Через 2 часа животным всех групп внутрисердечно вводили БКЯ в дозе 1 мг на 300 г массы тела, после чего регистрировали развитие анафилактической реакции.
Во второй серии экспериментов через 12 дней после начала иммунизации БКЯ животным опытных групп в течение трех дней в/б вводили 1-й опытной группе морских свинок исследуемую композицию в дозе 50 мг/кг, 2-й опытной группе животных вводили бетулин в дозе 50 мг/кг, контрольным животным вводили 1% крахмальный гель. На следующие сутки 1-й опытной группе морских свинок вводили в/б исследуемую композицию в дозе 50 мг/кг, 2-й опытной группе - бетулин в дозе 50 мг/кг, контрольным животным вводили аналогичный объем растворителя. Через 2 часа животным всех групп внутрисердечно вводили БКЯ в дозе 1 мг на 300 г массы тела, после чего регистрировали развитие анафилактической реакции.
Дополнительно было изучено действие в/б введения препарата сравнения, кларитина, в дозе 30 мг/кг, на анафилактическую реакцию морских свинок, иммунизированных 6% раствором БКЯ.
Вычисление анафилактического индекса по Weigle проводили по следующей формуле:
,
где N - число морских свинок, у которых наступила смерть;
N1 - число морских свинок, у которых развился тяжелый шок;
N2 - число морских свинок, у которых развился умеренный шок;
N3 - число морских свинок, у которых развился слабый шок;
N4 - морские свинки, у которых не наступило шока.
При гибели всех животных в группе индекс Weigle составляет 4(++++). При тяжелом шоке - 3(+++), при умеренном шоке - 2(++), при слабом шоке - 1(+), при отсутствии анафилактоидных реакций у морских свинок - индекс равен 0 (3).
Реакция воспаления на конканавалин А
Реакция воспаления на Кон А (псевдоаллергическая реакция) основана на способности Кон А неспецифически, т.е. без участия реагинов с аллергенами на мембранах клеток-мишеней, в результате прямого действия на рецепторы мембран тучных клеток и базофильных лейкоцитов высвобождать медиаторы воспаления (гистамин, серотонин, лейкотриены и др.).
Опыты были проведены на мышах самцах линии СВА массой 18-20 г. Использовались два пути введения испытуемых веществ - внутрибрюшинный и пероральный, введение осуществляли в 1% крахмальном геле. При внутрибрюшинном введении исследуемую композицию вводили в дозах 5 мг/кг, 50 мг/кг и 100 мг/кг, бетулин вводили в дозах 10 мг/кг и 100 мг/кг, препараты сравнения, супрастин и кларитин, вводили в дозах 5 мг/кг и 50 мг/кг. При пероральном пути введения исследуемую композицию вводили в дозах 5 мг/кг, 50 мг/кг и 100 мг/кг, бетулин вводили в дозах 50 мг/кг и 100 мг/кг, супрастин и кларитин - в дозах 5 мг/кг и 50 мг/кг. Животным контрольной группы аналогичным способом вводили соответствующий объем крахмального геля. Учитывая данные по фармакокинетике изучаемых фармакологически эффективных соединений, Кон А (20 мкл раствора в концентрации 5 мг/мл) вводили мышам подопытных и контрольной групп через 2 часа субплантарно (в подушечку задней стопы), в контрлатеральную конечность - тот же объем физиологического раствора. Через час мышей забивали, определяли массу лап и подсчитывали индекс реакции воспаления (Ир) по формуле:
,
где Роп - масса стопы, в подушечку которой вводили Кон А;
Pк - масса стопы, в подушечку которой вводили физиологический раствор.
Результаты исследований противоаллергенного действия композиции согласно изобретению показал наличие у него противоаллергенной биологической активности, что подтверждается следующими примерами.
Влияние композиции по изобретению и бетулина на экссудативный отек стопы крыс на каррагенан в сравнении с дексаметазоном
В опытах использовали беспородных белых крыс самцов массой 170-200 г. Животным трех опытных групп за 60 мин до введения каррагенана в/б вводили композицию в дозе 50 мг/кг, бетулин в дозе 50 мг/кг или дексаметазон в дозе 1,4 мг/кг, что при перерасчете для крыс по E.J.Freirech et al. (5) соответствует суточной дозе для человека - 15 мг. Контрольным животным аналогично вводили 1% раствор крахмала. Затем животным опытных и контрольной групп в правую подушечку задней стопы вводили 0,1 мл 1% раствора каррагенана (Sigma), в левую контрольную лапу - 0,1 мл растворителя (физиологический раствор). Далее в течение 4 часов животным контрольной и опытных групп каждый час микрометром измеряли отек стоп задних конечностей. Кроме того, через 4 часа опыта, сразу после забоя животных обе задние лапы отрезали по выступу костей ниже сочленения мало- и большеберцовой кости и выше пяточного сустава. Выраженность острого экссудативного воспаления оценивали в конце опыта по разнице массы опытной (Роп) и контрольной (Рк) лап по общепринятому методу.
Изучение влияния композиции по изобретению на анафилаксию изолированных органов на модели анафилактической контрактуры гладких мышц изолированного препарата подвздошной кишки (ileum) морской свинки
Морских свинок альбиносов массой 250-300 г сенсибилизировали трижды перекристаллизованным овальбумином (Sigma). Овальбумин вводили трехкратно через день в виде смеси, состоящей из 0,25 мл физиологического раствора, содержащего 5 мг овальбумина и 0,25 мл полного адъюванта Фрейнда (Difco). Первую инъекцию производили подкожно в область задней конечности; две последующие внутримышечно в область бедра. Опыты ставили через 4 недели после последней сенсибилизирующей инъекции.
Для подготовки отрезков кишечника животных забивали цервикальной дислокацией, вскрывали брюшную полость и выделяли подвздошную кишку, которую помещали в раствор Кребса. Затем вырезали отрезки подвздошной кишки длиной около 2 см, промывали содержимое кишечника раствором Кребса и выделяли верхний слой продольной мускулатуры. Полученный таким образом образец продольной мускулатуры подвздошной кишки фиксировали за один конец на держатель с платиновыми электродами, переносили в рабочую камеру с раствором Кребса, с температурой 37°С и постоянным пропусканием через раствор карбогена (95-96% O2, 5-4% CO2). Второй конец образца закрепляли на чувствительном элементе механотрона. После 20-минутного периода стабилизации, при периодическом обновлении раствора Кребса в рабочей камере, для подтверждения жизнеспособности образца на электроды подавались импульсы прямоугольной формы с частотой 0,1 Гц, длительностью 1 мс и напряжением 60 В. Затем регистрировали сокращения образца продольной мускулатуры подвздошной кишки морской свинки, вызванные раствором гистамина (10-7 М) (7) в отсутствие или присутствии исследуемых соединений. Сокращения препарата регистрировались с помощью механотрона, преобразованные электрические сигналы записывались на ленту самописца. По окончании регистрации эффекта инкубационный раствор в кювете заменялся с помощью проточной системы. Измерения проводились не менее чем на трех отрезках подвздошной кишки каждого животного.
В первой серии опытов, исследуемые препараты, композиция, супрастин и лоратадин, вносили в раствор после получения стабильных реакций на гистамин за 5-15 минут до очередного введения агониста. Композицию растворяли в 96,6% этиловом спирте и добавляли таким образом, что конечная концентрация препарата составляла 2×10-3 мг/мл. В промежутке между добавлением исследуемого вещества смена раствора Кребса в камере производилась каждые 5 мин.
Во второй серии опытов композицию инкубировали с подвздошной кишкой в течение часа и в течение суток (в растворе Кребса, концентрация изучаемого препарата составляла 4×10-2 мг/мл) при комнатной температуре, к контрольным образцам подвздошной кишки добавляли соответствующий объем растворителя. Далее проводили определение сократительной активности продольной мускулатуры подвздошной кишки, вызванной гистамином.
Определение активности NF-kB
Клетки линии U937 культивировали в клеточной среде DMEM с содержанием бычьей сыворотки 10% и перед экспериментом рассаживали в 24-луночные платы по 200 кл/лунка. Используя TransFast transfection reagent (Promega, USA) в соответствии с протоколом фирмы-производителя клетки трансфецировали репортерным геном люциферазы, находящимся под промотором, содержащим NF-kB-связывающие элементы (pNF-KB-LUC; Stratagene, USA), и вектором, содержащим ген β-галактозидазы (pSV-β-galactosidase control vector; Promega, USA; для оценки эффективности трансфекции).
Через 48 часов после трансфекции вектором pSV-β-galactosidase клетки промывали PBS и фиксировали в 2% формальдегид/0.2% глютардегид растворе, приготовленном на фосватно-солевом буфере (рН 7.4), в течение 5 мин при 4°С. Для анализа активности β-галактозидазы клетки промывали PBS и инкубировали с субстратом для β-галактозидазы o-nitrophenyl-β-D-galactopyranoside при 37°С до развития желтой окраски. Степень окраски, определяющая эффективность трансфекции, обсчитывалась на микропланшеточном ридере (PerkinElmer Wallac 1420 VICTOR2 Multilabel Counter) при длине волны 420 нм. После трансфекции плазмиды pNF-kB-LUC к клеткам добавляли заявляемую композицию в конечной концентрации 50 мкг/мл, 10 мкг/мл, 5 мкг/мл и 1 мкг/мл и инкубировали с ним при 37С и 5% CO2. Через 1 час к клеткам добавляли TNFα (100 нг/мл) и инкубировали с ним еще 3 часа в тех же условиях. По истечении этого срока клетки промывали PBS, разрушали лизирующим буфером (Promega, USA) и центрифугировали при 12000g (1 мин, 4°С). Супернатант собирался в стерильные 0.5-мл микропробирки и замораживался до -70°С. Для оценки активности люциферазы супернатант (5 μg растворенного белка) вносился в 96-луночный полистериновый планшет (PerkinElmer Wallac) с содержанием 10 μl/лунка репортерного лизирующего буфера. Люменометр (PerkinElmer Wallac 1420 VICTOR2 Multilabel Counter) программировали для внесения в каждую лунку 50 μl Luciferase Assay Reagent (Promega) и измерения интенсивности свечения через 2 секунды после внесения. Все пробы были поставлены в трех параллелях. Активность ядерного фактора кВ выражали в отношении активности β-галактозидазы (определяющей эффективность трансфекции) к количеству условных световых единиц, полученных при оценке активности люциферазы. С целью корректной оценки результатов эксперимента были поставлены два контроля: клетки, трансфецированные плазмидой pFC-MEKK с конститутивно активным геном люциферазы (позитивный контроль), и клетки, трансфецированные плазмидой pCIS-CK (Staratagene, USA) с отсутствием NF-kB-связывающих элементов в гене люциферазы (негативный контроль).
Статистическая обработка данных
Подготовка к работе первичных данных и расчеты проводились в среде пакета статистических программ (PSP) STATISTICA (версия 6.0) для WINDOWS. Результаты представлены в виде средней арифметической и ее средней ошибки. Достоверность различий - по t-критерию Стьюдента.
Пример 3.
Данные, представленные в таблице 1, показывают, что в/б введение композиции в дозе 50 мг/кг в 2 раза подавляло интенсивность системной реакции анафилаксии у животных опытных групп по сравнению с контролем. Индекс реакции у контрольной группы животных составил 2,1 (у 4-х морских свинок определили тяжелый анафилактический шок, у 3-х - умеренный шок, у 3-х - слабый шок). При введении дозы 50 мг/кг у 3-х свинок развился умеренный шок, у 4-х слабый шок, у 3-х - анафилактической реакции не выявили (индекс реакции по Weigle составил 1,0). При в/б введении препарата сравнения, в данном случае супрастина (наиболее эффективного препарата при лечении тяжелых форм анафилаксии), в дозе 50 мг/кг у 2-х животных определили умеренный анафилактический шок, у 2-х свинок развился слабый шок, у 6-ти - анафилактической реакции не выявили (индекс реакции по Weigle составил 0,6).
Пример 4.
В повторном эксперименте также установлено, что в/б введение композиции по изобретению в дозе 50 мг/кг (таблица 2) в 2 раза подавляло интенсивность системной реакции анафилаксии у морских свинок. Индекс реакции при введении дозы 50 мг/кг составил 0,8 (у 1-х морских свинок определили тяжелый анафилактический шок, у 2-х - умеренный шок, у 1-й - слабый шок, у 6-ти анафилактическая реакция отсутствовала). При в/б введении бетулина в дозе 50 мг/кг у 2-х свинок развился тяжелый шок, у 2-х - слабый шок, у 5-ти - анафилактической реакции не выявили (индекс реакции по Weigle составил 0,9). В контрольной группе животных 1-а морская свинка погибла, у 2-х - тяжелый шок, у 2-х животных определили умеренный анафилактический шок, у 5-ти свинок развился слабый шок (индекс реакции по Weigle составил 1,9).
При изучении влияния в/б введения кларитина в дозе 30 мг/кг на интенсивность анафилактического шока у морских свинок, иммунизированных 6% БКЯ, установили, что в опытной группе из 7-ми животных 2 морские свинки погибли, у 2-х развился тяжелый шок, у 3-х свинок определили умеренный шок, индекс реакции составил 2,9. В контрольной группе 7 из 11 животных погибли, у 2-х животных развился сильный шок, у 2-х - умеренный шок, индекс реакции - 3,5 (таблица 3).
Таким образом, во всех вышеприведенных экспериментах композиция по изобретению в 2 раза уменьшает выраженность системной реакции общей анафилаксии по сравнению с данными контрольных групп. Подавление анафилактического шока при введении композиции более выражено, чем при введении бетулина и препарата сравнения кларитина, широко применяемого при различных аллергических заболеваниях.
Пример 5.
Из данных, представленных в таблице 4, следует, что однократное внутрибрюшинное введение композиции по изобретению в дозах 5 мг/кг, 50 мг/кг и 100 мг/кг мышам линии СВА вызывало значимое подавление реакции псевдоаллергии на Кон А на 45,3%, 56,0% и 71,7%, соответственно. При однократном в/б введении бетулина в дозах 5 мг/кг и 50 мг/кг наблюдалось подавление реакции псевдоаллергии на Кон А на 50,3% (р<0,01) и 39,0% (р<0,01), соответственно. Введение аналогичным образом препаратов сравнения, кларитина и супрастина, статистически достоверно подавляло реакцию воспаления на Кон А. При введении кларитина в дозах 5 мг/кг и 50 мг/кг разница с контрольными значениями достигала 79,9% и 90,6%, при введении супрастина в тех же дозах - 78,6% и 66,0%.
Пример 6.
Однократное пероральное введение композиции по изобретению в дозе 50 мг/кг мышам линии СВА приводило к выраженному подавлению реакции воспаления на Кон А на 72,7% (таблица 5). Однократное введение per os бетулина в дозах 50 мг/кг и 100 мг/кг и супрастина в дозах 5 мг/кг и 50 мг/кг не вызывало подавления реакции воспаления на Кон А. Препарат сравнения, кларитин, вводимый перорально в дозах 5 мг/кг и 50 мг/кг, также вызывал дозозависимое подавление реакции воспаления на Кон А на 45,5% и 83,2%, соответственно.
Таким образом, установленные данные позволяют указать на наличие у композиции по изобретению противоаллергенного противовоспалительного действия при внутрибрюшинном и пероральном введении, бетулин и супрастин при пероральном введении не обладали противовоспалительным действием.
Пример 7.
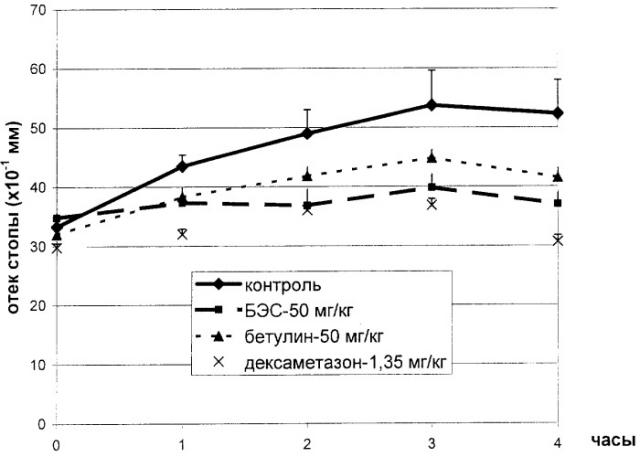
Однократное внутрибрюшинное введение композиции по изобретению в дозе 50 мг/кг белым беспородным крысам-самцам приводило к достоверному подавлению экссудативного отека, вызванного каррагенаном на всем протяжении опыта (таблица 6, см. чертеж). У крыс контрольной группы местная воспалительная реакция максимально увеличивалась через 3 часа после введения каррагенана, к этому времени у животных, которым вводили композицию по изобретению, происходило значимое подавление экссудативного отека на 25,9%. Внутрибрюшинное введение препарата сравнения дексаметазона приводило к уменьшению отека на 31,5% по сравнению с данными контрольной группы через 3 часа после введения каррагенана. При введении бетулина достоверное уменьшение выраженности экссудативного отека на 12,0% наблюдалось только через 2 часа после введения каррагенана. Полученные данные указывают на наличие у композиции более выраженного по сравнению с бетулином противовоспалительного действия, сопоставимого с действием одного из самых эффективных противовоспалительных средств - дексаметазона.
Пример 8.
Не обнаружено значимого изменения сократительной активности подвздошной кишки морских свинок при экспозиции композиции по изобретению в различных концентрациях с образцами продольной мускулатуры ileum в течение 5 мин, 1 часа и 1 суток, что свидетельствует об отсутствии прямого действия композиции на Н1-рецепторы (таблица 8). Блокаторы H1-рецепторов, супрастин и лоратадин, использованные в различных концентрациях, вызывали выраженное подавление спазмогенного действия гистамина на подвздошную кишку морских свинок.
Пример 9.
В таблице 9 приведены исходные данные, полученные при постановке эксперимента.
Из данных таблицы видно, что композиция по изобретению подавляет как спонтанную, так и индуцированную активность ядерного фактора kB. Достоверное снижение активности NF-kB наблюдается при добавлении к клеткам 5 мкг/мл и более, при этом дозы 5 и 10 мкг/мл обладают сходной биологической активностью и снижают активность NF-kB в 2-2.5 раза, в то время как 50 мкг/мл доводят ее, практически, до нуля. При пересчете тестируемых доз заявляемой композиции на бетулин, видно, что 50 мкг/мл композиции - это 80 мкМ бетулина, то есть доза не достижимая in vivo. Более приемлемой является доза 5 мкг/мл, то есть 8 мкМ бетулина. Она в 2 раза подавляет базальную активность ядерного фактора kB и в 2.5 раза TNFa-индуцированную. Полученные результаты говорят о высокой активности заявляемой композиции в отношении ядерного фактора kB.
Представленные данные позволяют сделать вывод об эффективности композиции по настоящему изобретению в качестве средства противоаллергенного действия, сопоставимой с действием таких препаратов, как супрастин, кларитин и дексаметазон и тем самым о возможности применения ее в качестве противоаллергенного средства и для изготовления средств противоаллергенного действия. Важно отметить, что антиаллергенная активность композиции в опытах была выше по сравнению с таковой у основного ее ингредиента - бетулина, что свидетельствует о совместном действии ингредиентов композиции.
Механизм действия заявляемого антиаллергенного средства
В основе патогенеза аллергических заболеваний, развивающихся по 1 типу гиперчувствительности, лежит активация Th2 хелперов и продукция цитокинов IL-4, IL-5 и IL-13, с последующим синтезом IgE-антител, имеющих высокое сродство к тучным клеткам и базофилам. Антиген вступает во взаимодействие с фиксированными на тучных клетках IgE-антителами, что приводит к активации клеток и секреции медиаторов аллергии (гистамина, серотонина и др.). Однако согласно классификации P.G.H.Gell и P.R.A.Coombs имеется еще 4 типа гиперчувствительности, в основе которых лежат другие механизмы. Механизм действия классических антигистаминных противоаллергенных препаратов основан прежде всего на блокаде связывания гистамина с рецептором H1, экспрессированным на поверхности клеток. Антигистаминные лекарственные средств имеют более высокое сродство с H1 рецептором, что приводит к преимущественному связыванию рецептора с препаратом, а не с гистамином (1,4).
Экспериментально установлено, что механизм действия антиаллергенной композиции по изобретению иной, чем у классических антигистаминных препаратов и указанных в ранее опубликованных патентах, и авторы высказывают определенные предположения о фактическом механизме действия.
При изучении действия композиции по изобретению на анафилаксию изолированных органов на модели анафилактической контрактуры гладких мышц подвздошной кишки (ileum) морских свинок не обнаружено значимого изменения сократительной активности, вызванной гистамином, подвздошной кишки морских свинок при различной временной экспозиции композиции в разных концентрациях с образцами продольной мускулатуры ileum, что свидетельствует об отсутствии прямого действия заявляемой композиции на Н1 рецепторы (15).
В соответствии с различными механизмами патогенеза аллергических заболеваний одним из основных классов при лечении аллергии кроме антигистаминных средств являются кортикостероиды. Стероиды доказали свою высокую эффективность против аллергического и других типов воспаления, угнетая как ранние, так и поздние его проявления. Для противовоспалительных эффектов кортикостероидов наиболее важна их способность угнетать синтез провоспалительных цитокинов, простагландинов, клеточных фосфолипаз и адгезионных молекул (1,4). В частности, при активации фосфолипазы А2 отщепление арахидоновой кислоты от фосфолипидов клеточных мембран посредством циклооксигеназы приводит к синтезу простагландинов, липооксигеназы - к синтезу семейства лейкотриенов, часть из которых ранее называлась медленно действующей субстанцией анафилаксии (1). В настоящее время ведется поиск стероидно-подобных соединений со способностью подавлять активность фосфолипазы А2, уменьшая тем самым наличие субстрата для развития различных форм воспаления и обладающих меньшей токсичностью по сравнению с классическими кортикостероидами (4, 7, 9, 14). Ряд авторов относят тритерпеноиды лупанового ряда к так называемым фитоэкдистероидам (phytoecdysteroids) в связи с тем, что механизм действия и химическая структура тритерпеноидов и стероидов достаточно близки (15, 16). Кортикостероидные противоаллергенные препараты при хроническом применении понижают резистентность к инфекциям, нарушают метаболизм, в частности обмен углеводов, жиров и белков, подавляют активность системы гипоталамус-гипофиз-надпочечники, вызывают поражение печени, неврологические расстройства и обладают целым рядом других побочных эффектов. Стероидно-подобные соединения растительного происхождения не имеют таких выраженных побочных эффектов (16).
Противовоспалительная активность композиции по изобретению прежде всего обусловлена тем, что по данным литературы бетулин как и кортикостероиды является ингибитором фосфолипазы А2 (7). Кроме того, по данным литературы бетулин и бетулиновая кислота имеют аффинитет к рецепторам глюкортикостероидов, обладают противовоспалительной активностью, сравнимой с дексаметазоном, причем противовоспалительная активность бетулиновой кислоты на модели отека на каррагенан более выражена, чем у бетулина (17). В представленных экспериментах композиция по изобретению обладала более выраженным по сравнению с бетулином противовоспалительным действием, сопоставимым с гомологом гидрокортизона - дексаметазоном.
В составе представленной композиции по изобретению имеется большое количество тритерпеноидов кофеатов, которые обладают антиоксидантными, проивоопухолевыми, антималярийными и другими свойствами (8, 10, 16, 19). В частности, антиоксидантные свойства экстрактов коры берез объясняют наличием в их составе кофеатов бетулина, олеановой и бетулиновой кислот (5). Доказано, что группа кофеола (caffeoyl group) усиливает биологическую активность (18), в данном случае противоаллергенную.
Согласно современным представлениям, селективная стимуляция Th1 хелперов, вырабатывающих интерферон γ (IFN-γ), задерживает выработку Th2 клеток, секретирующих интерлейкин IL 4, стимулирующий синтез IgE антител (13). Возможно, что подавление системной реакции анафилаксии связано также и с выявленной у композиции по изобретению способностью селективно индуцировать γ-интерферон и таким образом тормозить выработку Th2 хелперов и синтез IgE антител (18). В настоящее время это является одним из перспективных направлений иммунотерапии аллергических заболеваний.
Возможно предположить еще один механизм действия, основанный на результатах исследования по выявлению у композиции согласно настоящему изобретению способности подавлять как спонтанную, так и индуцированную активность ядерного фактора kB. Добавление к клеткам линии U937 композиции в количестве 5,10 мкг/мл снижало активность NF-kB в 2-2,5 раза. Высокая активность в отношении ядерного фактора kB может служить объяснением выраженного противовоспалительного и некоторых форм противоаллергенного эффекта.
На следующем этапе исследований проводилось изучение клинической эффективности и безопасности применения композиции согласно изобретению. Для этой цели использовались средства «Суперантитокс 50» и «Суперантитокс 25» при бронхиальной астме (БА). Оба БАДа в своей основе содержат композицию согласно настоящему изобретению. БАД «Суперантитокс 50» содержит 50 мг композиции и фруктозу, «Суперантитокс 25» - 25 мг композиции и фруктозу.
Методы и объем исследований
Клиническая апробация БАД «Суперантитокс 25» и «Суперантитокс 50» проведена на базе 5 терапевтического (аллергологического) отделения МУЗ ГКБ №57 г.Москвы.
Критериями включения пациентов в исследование были:
возраст от 18 до 60 лет,
подтверждение диагноза «Бронхиальная астма» клиническими и инструментальными методами обследования, согласие на лечение и обследование,
отсутствие сопутствующих заболеваний, оказывающих существенное влияние на течение основной патологии и требующих дополнительных назначений (сахарный диабет, туберкулез, злокачественные опухоли).
Под наблюдением находилось 39 больных бронхиальной астмой.
С целью оценки клинической эффективности использования препаратов в комплексном лечении больных разработаны оригинальные схемы дневников врачебного наблюдения и анкеты для пациентов, в которых клинические проявления заболевания оценивались в баллах.
Применение препаратов согласовано со всеми пациентами, получено информированное согласие каждого больного.
В соответствии с Протоколом проведено обследование пациентов:
Лабораторное:
1. Стандартный клинический анализ крови (общий).
2. Определение иммуноглобулинов класса Е.
3. Цитологическое исследование индуцированной мокроты и назального секрета (при бронхиальной астме и аллергическом рините).
Инструментальное:
- Спирография, в т.ч. проведение теста с использованием бронходилататоров.
- Пикфлуометрия.
- Определение содержания оксида азота в выдыхаемом воздухе.
Исследования проводились перед началом и после окончания лечения.
Краткая характеристика больных бронхиальной астмой
Под наблюдением находилось 39 больных бронхиальной астмой различной степени тяжести в стадии обострения.
При поступлении в стационар у всех больных наблюдалась типичная клиника бронхиальной астмы (БА) с нарушением общего состояния (до состояния средней тяжести), возрастанием частоты дыхания (от 21 до 30 в мин), изменением перкуторного звука (с коробочным оттенком, коробочный) и появлением аускультативных изменений (дыхание ослабленное, жесткое; свистящие хрипы с различными количественными характеристиками).
Лабораторное обследование больных проведено в соответствии с общими стандартами и протоколом исследования. В общем анализе крови в 10 случаях (по 5 в каждой группе) выявлено повышение уровня лейкоцитов до 12,9-13,4·106, преимущественно - у получавших глюкокортикостероиды, реже (4 случая) - умеренная эозинофилия - до 8%.
Количество иммуноглобулинов Е при поступлении было повышенным у 25 из 39 больных; уровень повышения был различным - от 187 ЕД до превышающего 1000 ЕД (порог метода).
Пациенты разделены на две подгруппы в зависимости от планируемого лечения исследуемыми БАД: «Суперантитокс 50» (21 больной) или «Суперантитокс 25» (18 больных). Затем каждая подгруппа разделена с учетом получения по клиническим показаниям системных глюкокортикостероидов (сГКС).
В одном случае у больного на 6-й день приема «Суперантитокса 50» появилась уртикарная сыпь, угасшая после отмены препарата. Точную взаимосвязь с приемом препарата установить сложно, поскольку в те же дни пациент употреблял различную пищу, в т.ч. и аллергенного характера. Этот пациент в группы наблюдения не включался.
Таким образом, выделены следующие наблюдаемые группы:
I гр. (10 пациентов) получала «Суперантитокс 50» на фоне сГКС,
II гр. (10 пациентов) получала «Суперантитокс 50» без сГКС,
III гр. (9 пациентов) получала «Суперантитокс 25» на фоне сГКС,
IV гр. (9 пациентов) получала «Суперантитокс 25» без сГКС.
Больным I и II групп с первого дня пребывания в стационаре назначался «Суперантитокс 50»: по 1 капсуле 2 раза в день, за 15-20 минут до еды; суточная доза - 100 мг. Курс лечения составил от 15 до 20 дней в зависимости от сроков пребывания в стационаре.
Больным III и IV группы с первого дня пребывания в стационаре назначался «Суперантитокс 25»: по 1 капсуле 2 раза в день, за 15-20 минут до еды; суточная доза - 50 мг. Курс лечения составил от 15 до 20 дней.
В качестве базисной терапии больные получали, в зависимости от тяжести течения заболевания, бронхолитики и ингаляционные глюкокортикостероиды (иГКС) (бекламетазона дипропионат, флутиказона пропионат в дозах, рекомендованных GINA 2002). На фоне обострения и госпитализации в стационар 19 пациентов получали сГКС.
В группе II 8 пациентов из 10 получали только «Суперантитокс 50», двое больных кроме того ингалировали бронхолитики; иГКС не назначались. Таким образом, данную группу можно считать группой монотерапии.
В группе IV только «Суперантитокс 25» получала 1 пациентка, с