Средство для профилактики и лечения болезни паркинсона
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, в частности к средству для профилактики и лечения болезни Паркинсона. Применение экстракта бересты с определенным содержанием бетулина для профилактики и лечения болезни Паркинсона. Вышеописанный экстракт бересты эффективен для профилактики и лечения болезни Паркинсона. 19 ил., 7 табл.
Реферат
Область техники
Изобретение относится к области медицины. Более конкретно оно относится к изысканию новых средств для профилактики и лечения болезни Паркинсона.
Уровень техники
Болезнь Паркинсона - хроническое прогрессирующее дегенеративное заболевание центральной нервной системы, клинически проявляющееся нарушением произвольных движений.
Болезнь Паркинсона относится к первичному, или идиопатическому, паркинсонизму. Различают также вторичный паркинсонизм, который может быть обусловлен различными причинами, например энцефалитом, избыточным приемом лекарственных препаратов, атеросклерозом сосудов головного мозга. Понятие "паркинсонизм" применяется к любому синдрому, при котором наблюдаются характерные для болезни Паркинсона неврологические нарушения.
В России, по разным данным, насчитывается от 117000 до 338000 больных болезнью Паркинсона. После деменции, эпилепсии и церебрососудистых заболеваний болезнь Паркинсона является наиболее частой проблемой пожилых людей, о чем свидетельствует ее распространенность в России (1996 год):
- 1.8:1000 в общей популяции
- 1.0:100 в популяции тех, кому за 70
- 1.0:50 в популяции тех, кому за 80
Происхождение болезни Паркинсона остается до конца не изученным, тем не менее в качестве причины заболевания рассматривается сочетание нескольких факторов:
- старение
- наследственность
- некоторые токсины и вещества.
Средний возраст начала болезни Паркинсона - 55 лет. В то же время у 10% больных заболевание наступает в молодом возрасте, до 40 лет. Заболеваемость паркинсонизмом не зависит от половой и расовой принадлежности, социального положения и места проживания. Предполагают, что с увеличением среднего возраста населения в ближайшие годы распространенность болезни Паркинсона в популяции будет увеличиваться.
Лекарственная терапия болезни Паркинсона направлена на восполнение дефицита дофамина, развивающегося при болезни Паркинсона в результате гибели клеток мозга, а также на затормаживание прогрессирования болезни, или гибели нейронов мозга - нейропротекторная терапия.
Для фармакотерапии паркинсонизма применяют холинолитические средства, производные аминоадамантана, ДОФА-содержащие средства, ингибиторы моноаминоксидазы (МАО) типа В, ингибиторы катехол-О-метилтрансферазы (КОМТ) и агонисты дофаминовых рецепторов.
Холинолитики
Эта группа препаратов начала применяться для лечения болезни Паркинсона более 100 лет назад, но и в настоящее время полностью не утратила свое значение. В клинической практике холинолитические препараты используют как изолированно, так и в сочетании с другими антипаркинсоническими средствами, однако в последние годы преобладает достаточно сдержанное отношение к их применению вследствие относительно низкой эффективности и широкого круга побочных эффектов. Холинолитические препараты не восполняют дефицита дофамина и не останавливают прогрессирование заболевания, а лишь угнетают повышение активности холинергических систем. Применение этих препаратов показано в начальных стадиях заболевания и при индивидуальной клинически выявляемой положительной динамике. Препараты этой группы противопоказаны при глаукоме, аденоме предстательной железы, интеллектуально-мнестических нарушениях.
Холинолитические препараты оказывают наибольшее влияние на ригидность и вегетативные проявления паркинсонизма. Лишь некоторые из них эффективны в отношении тремора.
К числу широко используемых холинолитических препаратов относят циклодол, бипериден.
Производные амантадина
Существует несколько предположений относительно механизма действия амантадина и его аналогов. Препараты этой группы оказывают мягкое антихолинергическое действие и угнетают обратный захват дофамина, а также дают амфетаминоподобный эффект, способствуя высвобождению дофамина из пресинаптических терминалей. В последние годы было установлено, что амантадин действует как антагонист NMDA-рецепторов, что с учетом доказанных нарушений глутаматергической нейротрансмиссии при болезни Паркинсона и ее значении в изменении кортикостриарных, таламокортикальных и других взаимосвязей также является одним из возможных механизмов действия препаратов этой группы.
Амантадины достаточно эффективны при ригидных и акинетических формах меньшее влияние оказывают на тремор. Отличительной их особенностью являются малая токсичность, редкие побочные эффекты, практически отсутствие противопоказаний, однако в целом эффективность этих препаратов невысока и улучшение состояния наблюдается не более чем у половины больных (Walker и соавт., 1972). К числу побочных эффектов обычно относят головокружение, сухость во рту, беспокойство, зрительные галлюцинации. Препараты этой группы не следует применять больным пожилого возраста с интеллектуально-мнестическими нарушениями.
К числу препаратов этой группы относят амантадина гидрохлорид и сульфат.
Дофа - содержащие препараты
Роль дофамина, как возможного основного терапевтического средства при лечении болезни Паркинсона, изучается с 50-х годов, когда Carlsson отметил, что симптомы паркинсонизма вызываются резерпином. В последующие годы было установлено уменьшение содержания дофамина в стриатуме при болезни Паркинсона (Ehringer, Hornykiewicz, 1960), что привело к появлению значительного количества дофаминсодержащих препаратов, составляющих и сейчас "золотой стандарт" терапии болезни Паркинсона.
Дофамин не проходит через гематоэнцефалический барьер. Поэтому для заместительной терапии применяют метаболический предшественник дофамина леводопу (L-диоксифенилаланин), которая проходит через гематоэнцефалический барьер и в дофаминергических нейронах под действием церебральной ДОФА-декарбоксилазы (ДДК) превращается в дофамин (N.Quin, 1987).
Одна таблетка "чистой" леводопы содержит 250 или 500 мг активного вещества; максимальная суточная доза 3 г. Однако в силу особенностей метаболизма L-ДОФА, который подвергается "преждевременным" биохимическим превращениям вне мозга посредством декарбоксилирования, трансаминирования и метилирования, чистую леводопу в настоящее время практически не применяют.
Патогенетически оправданной и поэтому широко распространенной в мире является комбинация леводопы с ингибиторами периферической L-ДДК карбидопой или бензеразидом. Это позволяет уменьшить дозу и увеличить длительность действия препарата (В.Н.Шток, 1995; В.Н.Голубев и соавт., 1999, N.Quinn, C.Olanow, 1996). Наиболее часто применяемые препараты этой группы - мадопар (леводопа / бензеразид в соотношении 4:1), наком (леводопа / карбидопа - 10:1), синемет (леводопа / карбидопа - 10:1).
Побочные эффекты леводопы проявляются в трех сферах: в вегетативной нервной системе (тошнота, рвота, ортостатическая гипотония, тахикардия), моторной системе (дискинезии, клинические флюктуации), психической сфере (беспокойство, возбуждение, галлюцинации, депрессии с опасностью суицида), кроме того, отмечено тератогенное действие препарата. Необходимо соблюдать осторожность при одновременном применении других лекарственных средств, которые могут усилить лечебные и побочные эффекты леводопы (агонисты адренорецепторов, трициклические антидепрессанты) или, наоборот, ослабить их (витамин В6, нейролептики, резерпин, метилдофа).
Ингибиторы МАО (В)
Ингибиторы МАО (В) по своему фармакологическому действию препятствуют метаболизму образовавшегося дофамина по пути окислительного дезаминирования с превращением его в конечном итоге в гомованилиновую кислоту. Показано, что селегилин также ингибирует обратный захват дофамина. Ингибиторы МАО увеличивают, таким образом, содержание дофамина в мозговой ткани, предотвращая его распад. Кроме того, имеются данные об антиоксидантном действии ингибиторов МАО (В), их нейропротекторной способности, что оправдывает применение селегилина на ранних стадиях паркинсонизма (J.Knoll, 1996; Myllyla и соавт., 1992).
Более эффективной по действию, особенно на поздних стадиях, является комбинация ингибиторов МАО (В) с ДОФА-содержащими препаратами, что позволяет существенно уменьшить дозу L-ДОФА, а значит и выраженность побочных эффектов.
Агонисты дофаминовых рецепторов
Важным и перспективным направлением стал поиск лекарственных средств, способных действовать "в обход" дегенерирующего нейрона, минуя пресинаптическую его часть, непосредственно на дофаминовые рецепторы. Так появился новый класс противопаркинсонических препаратов - агонисты дофаминовых рецепторов.
Агонисты дофаминовых рецепторов показаны как монотерапия на ранних стадиях болезни и в более поздние сроки в сочетании с препаратами леводопы. На ранних стадиях заболевания эффективность агонистов дофамина сравнима с таковой препаратами леводопы. Однако через несколько лет эффективность лечения агонистами дофамина уменьшается и появляется необходимость присоединения препаратов леводопы. В литературе широко обсуждается вопрос о том, насколько применение агонистов дофаминовых рецепторов позволяет отсрочить развитие осложнений при применении препаратов L-DOPA.
У больных с умеренно или значительно выраженными признаками заболевания присоединение агонистов дофамина к препаратам леводопы позволяет во многих случаях увеличить эффективность лечения и снизить выраженность моторных флюктуаций. (A.Lieberman и соавт., 1983; C.Goetz и соавт., 1985; R.McDonald, R.Horowski, 1983; Y.Mizuno и соавт., 1995).
Побочными эффектами агонистов дофамина являются тошнота, рвота, ортостатическая гипотензия, что вызвано стимуляцией периферических дофаминергических рецепторов. К числу побочных эффектов, обусловленных влиянием на центральные дофаминергические рецепторы, относят галлюцинации, ночные кошмары, изменения высших психических функций. У части больных наблюдаются запоры.
В настоящее время накоплен значительный опыт по применению эрголиновых агонистов дофаминовых рецепторов (бромокриптина, перголида, лизурида).
Ингибиторы КОМТ
Одним из перспективных и значительных достижений за последние годы стало открытие принципиально нового, высокоэффективного класса антипаркинсонических препаратов - ингибиторов КОМТ. КОМТ - один из основных ферментов, обеспечивающих метаболизм леводопы, дофамина, других катехоламинов и их метаболитов. КОМТ является достаточно распространенным ферментом, присутствует в различных отделах организма, включая нейроны и глию, за исключением нигростриарных дофаминергических нейронов (A.Kastner и соавт., 1994). Периферические ингибиторы КОМТ снижают метаболизм леводопы и увеличивают тем самым ее содержание в стриатуме.
Следует отметить, что препараты, являющиеся как центральными, так и периферическими ингибиторами КОМТ (толкапон), по мнению большинства авторов, дают значительно более выраженные побочные эффекты (K.Holm, С.Spencer, 1999). В настоящее время целесообразность применения толкапона обсуждается.
Сущность изобретения
Несмотря на достаточно широкий спектр реально применяемых и находящихся в стадии исследования препаратов для терапии болезни Паркинсона, продолжает оставаться актуальной задача отыскания новых средств этого назначения, что обусловлено не только недостаточной эффективностью известных средств, но и их побочными эффектами. Именно на решение этой задачи и направлено настоящее изобретение.
Сущность его заключается в неожиданно обнаруженной авторами изобретения возможности применения для профилактики и лечения болезни Паркинсона и, соответственно, для изготовления лекарственных средств данного назначения экстракта бересты верхней белой части коры березы. Экстракт представляет собой совокупность соединений тритерпенового ряда, с преобладанием (до 70%) бетулина (бетулинола).
Раскрытие изобретения
В ранее проведенных авторами настоящего изобретения исследованиях экстракта бересты (заявка на изобретение РФ №2005138574) было обнаружено, что в поведенческих тестах общего и направленного скрининга на мышах препарат демонстрирует психотропное действие, профиль которого можно охарактеризовать как проявление дофамин-позитивной активности, в частности, в связи с тем, что:
1. экстракт в дозе 50 мг/кг увеличивает горизонтальную двигательную активность в актометре Ugo Basile;
2. экстракт усиливает тимолептический эффект антидепрессанта Пиразидола при сочетанном введении в тесте «отчаяния»;
3. экстракт вызывает ноотропный эффект в тестах «крестообразный лабиринт» и «условный рефлекс пассивного избегания».
Кроме того, другими исследователями были получены экспериментальные свидетельства в пользу антиоксидантных свойств экстракта бересты.
Совокупность вышеупомянутых экспериментальных данных позволила выдвинуть предположение, что сочетание описанных свойств соответствует требованиям, которые можно предъявить к препарату с противопаркинсоническим потенциалом (Tillerson J.L, Caudle W.M., Reveron M.E., Miller G.W. Detection of behavioral impairments correlated to neurochemical deficits in mice treated with moderate doses of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine. Exp. Neurol., 2002, 178:80-90).
Дальнейшие исследования, проведение комплекса экспериментов с применением стандартных поведенческих и фармакологических тестов, рекомендованных для обнаружения противопаркинсонической активности (Воронина Т.А., Вальдман Е.А., Неробкова Л.Н. Методические указания по изучению антипаркинсонической активности фармакологических веществ. В кн.: «Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ», Москва, 2000, 147-152), сущность и результаты которых изложены далее, подтвердили это предположение.
Исследования проводились с использованием «Бересты экстракта сухого» (БЭС), производимого ООО «Березовый мир», Россия, г.Москва и используемого для изготовления биологически активных добавок. Опыты были проведены на 196 мышах-самцах линии C57/BI с массой 20-25 г, содержащихся в условиях лабораторного вивария на стандартной диете.
БЭС вводили мышам за 1,5 часа до тестирования с помощью зонда внутрижелудочно в форме суспензии в 1%-ном растворе картофельного крахмала в дозе 50 мг/кг веса животных. Мышам контрольных групп вводили эквивалентные объемы 1%-ного крахмала.
Результаты исследований отражены на чертежах, на которых изображены:
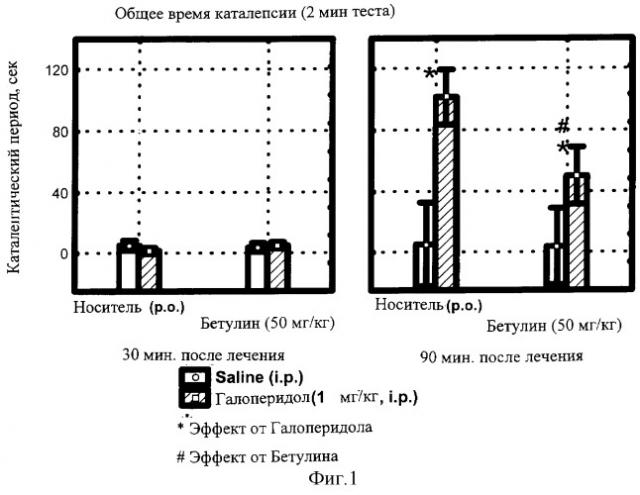
фиг.1 - Влияние БЭС на общее время каталепсии, вызванной галоперидолом.
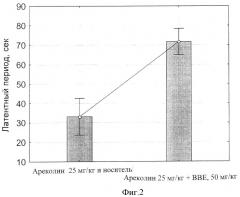
фиг.2 - Влияние БЭС на латентный период тремора, вызванного Ареколином, через 90 мин после приема внутрь.
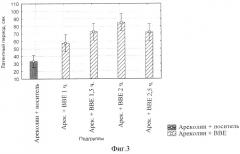
фиг.3 - Динамика влияния БЭС на латентный период начала тремора у мышей.
фиг.4 - Влияние БЭС на продолжительность ареколинового тремора у мышей.
фиг.5 - Влияние БЭС на продолжительность у мышей, вызванного Ареколином, через 90 мин после приема внутрь.
фиг.6 - Влияние 5-кратного предварительного введения БЭС (50 мг/кг/день) на олигокинетический эффект МФТП (24 мг/кг) в актометре (**/* - достоверное отличие от гр.2).
фиг.7 - Влияние однократного введения БЭС (50 мг/кг, внутрь), Мидантана (20 мг/кг, в, б) и их комбинации на горизонтальную двигательную активность мышей C57BI/6 в тесте «открытое поле» (среднее арифметическое ± ошибка среднеквадратичного отклонения).
Фиг. 8 - Влияние однократного введения БЭС (50 мг/кг, внутрь), Мидантана (20 мг/кг, в, б) и их комбинации на двигательную активность мышей C57BI/6 в актометре Ugo Basile (среднее арифметическое ± ошибка среднеквадратичного отклонения).
Определение способности экстракта бересты (БЭС) изменять каталепсию, вызванную у мышей галоперидолом
Галоперидол является типичным нейролептиком - производным бутирофенона. Действие его наступает быстро и продолжается длительное время. Механизм действия галоперидола связывают с блокадой дофаминовых рецепторов, центральным альфа-адреноблокирующим действием и нарушением процесса обратного нейронального захвата и депонирования катехоламинов. Наиболее частым побочным эффектом галоперидола являются экстрапирамидные расстройства.
В эксперименте было использовано 48 самцов мышей линии C57BL/6 в возрасте около 2-х месяцев (масса тела 18-23 г), распределенных случайным образом на 4 экспериментальные группы:
1. Перорально - 1% крахмал; в/б - физраствор (ФР);
2. Перорально - БЭС; в/б - ФР;
3. Перорально - 1% крахмал; в/б - 1 мг/кг галоперидол;
4. Перорально - БЭС; в/б - 1 мг/кг галоперидол.
Длительность каталептического состояния каждой мыши фиксировали в течение 2 мин сессий через 30, 60 и 90 мин после введения галоперидола. Суспензию БЭС вводили с помощью внутрижелудочного зонда внутрь за 1,5 часа до инъекции нейролептика. Результаты статистической обработки данных по группам представлены на фиг.1.
Статистически значимый эффект каталепсии развивался к 90 минуте после введения нейролептика (диаграмма справа), занимая 112 секунд из 120-секундной сессии (р<0.02). Действие самого БЭС после приема внутрь в дозе 50 мг/кг не отличалось от эффекта плацебо, однако существенно (более чем вдвое, р<0.05) снижало продолжительность каталепсии, индуцированной галоперидолом.
Следовательно, БЭС в данных условиях эксперимента проявляет дофамин-позитивную активность, противодействуя эффекту блокатора ДА-рецепторов галоперидола.
Определение способности экстракта бересты (БЭС) влиять на тремор, вызванный ареколином у мышей.
Ацетилхолин (АХ) является нейромедиатором многочисленных интернейронов хвостатого ядра, и именно в этой структуре наблюдается наибольшая концентрация AX (Guttman M., Kish S.J., Furukawa Y. Current concepts in the diagnosis and management of Parkinson's disease. CMAJ, 2003, 168 (3), 293-301). Холинергическая модель паркинсонического синдрома воспроизводится первичной активацией холинергических нейронов хвостатого ядра системным введением ареколина или оксотреморина. В данном опыте использовали агонист м-холинорецепторов ареколин в стандартной треморогенной дозе 25 мг/кг, подкожно.
В эксперименте было использовано 24 самца мышей линии C57BL/6 в возрасте около 2-х месяцев (масса тела 18-23 г), распределенных случайным образом на 2 экспериментальные группы:
1. Перорально - 1% крахмал; п/к - 25 мг/кг ареколин;
2. Перорально - БЭС; п/к - 25 мг/кг ареколин.
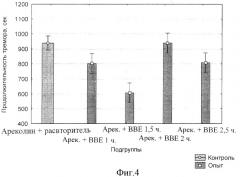
Суспензию БЭС (50 мг/кг) вводили в соответствии с протоколом, представленным выше. Через 30, 60, 90, 120 и 150 минут после введения ареколина у мышей регистрировали: а), латентный период начала тремора (сек); б), продолжительность тремора (сек).
Результаты статистической обработки данных представлены на фиг.2, 3, 4 и 5. Обнаружено, что введение ареколина на фоне плацебо приводит к началу тремора на 33 сек, тогда как то же на фоне 50 мг/кг БЭС отставляет начало тремора до 73 сек (фиг.2; р<0.00000).
Причем величина латентного периода под действием БЭС возрастает в течение 2-х часов после введения ареколина, после чего начинает снижаться (фиг.3).
Динамика продолжительности ареколинового тремора после введения БЭС представлена на фиг.4, из которого следует, что действие экстракта приводит к уменьшению длительности вплоть до полутора часов после введения ареколина. В более поздние периоды наблюдения (2 и 2,5 ч) эффективность БЭС исчезает.
Таким образом, максимум эффективности действия на продолжительность тремора, вызванного ареколином, приходится на 90 мин (F(1, 22)=4.9959 при р=0.03588) (фиг.5).
Таким образом, БЭС демонстрирует наличие холинолитических свойств, проявляющихся в снижении латентного периода и длительности ареколинового тремора.
Определение способности экстракта бересты (БЭС) влиять на снижение двигательной активности мышей в актометре Ugo Basils и «открытом поле», на модели паркинсонического синдрома, вызванного системным введением нейротоксина МФТП в режиме профилактического применения БЭС
Модель паркинсонического синдрома, вызванного введением нейротоксина МФТП (4-фенил-1,2,3,6-тетрагидропиридина), является наиболее адекватной моделью паркинсонизма, поскольку МФТП избирательно повреждает дофаминергические нейроны черной субстанции. Токсин под действием МАО-В в астроцитах превращается в 1-метил-4-фенилпиридиний (МФП+), который с помощью дофаминового транспортера захватывается ДА-ергическими нейронами. Эффекты МФТП обусловлены токсическим действием МФП+, вызывающим энергетическую недостаточность за счет ингибирования комплекса-1 митохондриальной дыхательной цепи. Этот эффект наиболее выражен у приматов, а у мышей - в линии C57BI/6 (Feldman R.S., Meyer J.S., Quenzer L.F. Parkinson's disease and Alzheimer's disease. In: Principles of Neuropsychopharmacology, Sinauer Associates, Inc., Publishers, Massachusetts, 1997, 861-909).
Настоящий эксперимент был направлен на обнаружение предполагаемой анти-токсиновой активности БЭС, когда МФТП вводили однократно на фоне предварительного 5-кратного применения суспензии экстракта. В данном варианте опыта предполагалось оценить возможную «профилактическую» значимость БЭС.
В эксперименте было использовано 36 самцов мышей линии C57BI/6. Суспензию БЭС вводили внутрь ежедневно в дозе 50 мг/кг /день в течение 5 суток. Токсин в дозе 25 мг/кг или плацебо вводили за 30 мин до начала 10-мин наблюдения за двигательной активностью в актометре Ugo Basile.
Животных случайным образом распределяли на 3 экспериментальные группы:
1. Внутрь - 1% крахмал 5-кратно; в/б - физраствор (ФР) 1-кратно;
2. Внутрь - 1% крахмал 5-кратно; в/б - МФТП 1-кратно;
3. Внутрь - БЭС 5-кратно; в/б - МФТП 1-кратно.
Общее поведение животных после введения БЭС или плацебо не обнаруживало существенных отличий от привычного. Однако после введения токсина у мышей наблюдались отклонения от нормальных вегетативных и поведенческих признаков: пилоэрекция, слюнотечение, ретропульсия, нарушение дыхания.
Статистически обработанные показатели горизонтальной двигательной активности, автоматически измеренной в актометре Ugo Basile за 10-мин сессию, представлены на фиг.6.
Полученные данные свидетельствуют, что введение БЭС мышам C57BI/6 в течение 5 суток по 50 мг/кг в день приводит к восстановлению общего числа горизонтальных перемещений в актометре Ugo Basile за 10-мин сессию на 50% (р<0.01), сниженного однократной инъекцией МФТП на 5-й день эксперимента.
Результат свидетельствует о наличии у экстракта защитных свойств против олигокинезии, вызываемой токсическим действием МФТП на ДА-ергические нейроны.
Определение способности экстракта бересты (БЭС) влиять на снижение двигательной активности мышей в актометре и «открытом поле», на модели паркинсонического синдрома, вызванного системным введением нейротоксина МФТП в режиме лечебного действия БЭС
Настоящий эксперимент был направлен на обнаружение предполагаемой антитоксиновой активности БЭС на фоне двукратного предварительного применения МФТП. В данном варианте опыта предполагалось: а) оценить собственную антитоксиновую активность БЭС; б) оценить способность экстракта модулировать эффект известного противопаркинсонического препарата Мидантана (Морозов И.С., Петров В.И., Сергеева С.А. Фармакология адамантанов, Волгоград, 2001).
В эксперименте было использовано 88 самцов мышей линии C57BI/6. Токсин в дозе 30 мг/кг или плацебо вводили внутрибрюшинно один раз в день в течение 2-х суток подряд. БЭС вводили на вторые сутки однократно в дозе 50 мг/кг за 1,5 часа до инъекции МФТП. Мидантан вводили однократно в дозе 20 мг/кг, в/б за 30 мин до введения токсина. Предварительно животных случайным образом распределяли на 5 экспериментальных групп:
| Таблица 1 | ||
| Протокол эксперимента | ||
| № группы | 1-й день | 2-й день |
| 1 (n=12) | Физраствор, в/б | Плацебо, внутрьФизраствор, в/б |
| 2 (n=19) | МФТП, в/б | Плацебо, внутрьМФТП, в/б |
| 3 (n=19) | МФТП, в/б | Мидантан, в/бМФТП, в/б |
| 4 (n=19) | МФТП, в/б | БЭС, внутрьМФТП, в/б |
| 5 (n=19) | МФТП, в/б | БЭС, внутрьМидантан, в/бМФТП, в/б |
Через 30 мин после второй инъекции МФТП у мышей последовательно оценивали поведение в актометре (5 мин) и в «открытом поле» (3 мин).
Через 30-40 мин после введения МФТП на второй день горизонтальная двигательная активность (число пересеченных квадратов) существенно уменьшалось с 101,17±6,74 в группе 1 до 4,58±1,21 в группе 2 (р=0,000000, t-критерий Стьюдента).
Результаты введения БЭС, мидантана и их комбинации на горизонтальную активность представлены на фиг.7. Видно, что острый эффект 50 мг/кг БЭС почти эквипотенциален действию препарата сравнения Мидантана (20 мг/кг): первый увеличивал число перемещений до 331% (р=0,021, t-критерий Стьюдента), а второй - до 327% (р=0,008, t-критерий Стьюдента) относительно этого показателя в группе с МФТП.
Эффективность использования их комбинации также отличалась от эффекта токсина - 413% (р=0,007, t-критерий Стьюдента), но статистической значимости от результатов влияния препаратов в отдельности на отмечено.
Аналогичные результаты были получены в случае измерения двигательной активности этих же групп мышей с использованием актометра (фиг.8):
Двукратное введение токсина приводило к падению числа перемещений с 234,8±32,2 в группе 1 до 11,2±3,2 в группе 2 (р=0,000; t-критерий Стьюдента). В свою очередь, острое применение БЭС, Мидантана и их комбинации частично восстанавливало индуцированный двигательный дефицит до 265% (р=0,013; t-критерий Стьюдента), 275% (р=0,033; t-критерий Стьюдента) и 311% (р=0,040; t-критерий Стьюдента) соответственно относительно значений группы 2, принятых за 100%.
Следует отметить, что под влиянием МФТП и препаратов изменялись не только количество перемещений, но и качественный состав двигательной активности: введение токсина также приводило к снижению вертикальной активности (стойки) и поисковой активности (заглядывание в отверстия) в тесте «открытое поле» с 31:1:1,7 в группе 1 до 0,11±0,11 в группе 2 (р=0,000; t-критерий Стьюдента) и с 5,3±0,1 до 0,6±0,2 (р=0,000; t-критерий Стьюдента) соответственно.
Введение БЭС и его комбинации с Мидантаном частично, но статистически достоверно восстанавливало эти параметры локомоторной активности избирательно. Так, экстракт и комбинация увеличивали сниженный показатель «вертикальная активность» со статистической достоверностью 0,04 и 0,03 по критерию Манна-Уитни соответственно.
Таким образом, экспериментально подобранные условия позволили обнаружить в двух вариантах тестирования («открытое поле» и автоматический актометр Ugo Basile), что экстракт бересты в дозе 50 мг/кг при однократном введении внутрь обладает способностью частично, но статистически достоверно компенсировать локомоторный дефицит у самцов мышей C57BI/6, вызванный двукратным введением токсина МФТП.
Данный эффект был количественно сопоставим с острым действием клинически распространенного противопаркинсонического препарата Мидантана (Амантадина), использованного во внутрибрюшинной дозе 20 мг/кг.
Комбинация упомянутых веществ также приводила к увеличению количества и улучшению структуры двигательной активности у мышей с МФТП-индуцированным паркинсоническим синдромом, несколько лучшими в сравнении с эффектами обоих препаратов в отдельности.
Целью дальнейшего исследования являлось проведение дальнейшего комплекса экспериментов in vitro и ex vivo, направленных на изучение предполагаемых дофамин-позитивных свойств БЭС с применением общепринятых нейрохимических подходов, характеризующих фармакодинамику специфических эффектов БЭС.
Для достижения цели были поставлены следующие задачи:
1. Оценить возможность взаимодействия БЭС с рецепторами дофамина, серотонина, глутамата и ацетилхолина с использованием мембранных препаратов и меченных по тритию лигандов названных рецепторов.
2. Изучить влияние БЭС на функциональные показатели пресинаптической активности: синаптосомальный захват, биосинтез и секрецию дофамина, а также метаболизм дофамина и серотонина в гомогенатах компетентных структур мозга мышей и крыс.
Материалы и животные
Опыты были проведены на мышах-самцах линии C57/BI с массой 20-25 г и крысах-самцах Вистар с массой 180-200 г, содержащихся в условиях лабораторного вивария на стандартной диете.
В экспериментах ех vivo БЭС вводили животным за 1,5-2 часа до декапитации с помощью зонда внутрь в форме суспензии в 1%-ном растворе картофельного крахмала в дозе 50 мг/кг. Особям контрольных групп вводили эквивалентные объемы 1%-ного крахмала.
Результаты исследований
Эксперимент 1. Изучение влияния БЭС на специфическое связывание с рецепторами нейромедиаторов в структурах мозга крыс
Постановка данной серии экспериментов преследовала 2 цели: (1) изучить, не являются ли рецепторы основных нейромедиаторов мозга возможными молекулярными мишенями для первичного (прямого) фармакологического действия БЭС - в условиях in vitro; и (2) изучить, не оказывает ли системное введение БЭС существенного косвенного воздействия на рецепторные характеристики через 2 и 24 часа - в условиях ex vivo.
Степень возможного сродства экстракта к рецепторам в экспериментах in vitro оценивали величиной IC50, равной концентрации БЭС, ингибирующей связывание радиолиганда на 50%.
Возможные динамические изменения рецепторов под влиянием БЭС в экспериментах ех vivo выражали в величинах Втах и Kd, отражающими количество связывающих мест и степень сродства к рецептору соответственно.
При изучении рецепторного связывания использовали следующие лиганды: для дофаминовых D1-, D2- и D3-подтипов в стриатуме - [G-3H]-SCH-23390, [G-3H]-спиперон, 7-OH-[G-3H]-DPAT соответственно; для серотониновых 5-НТ2-подтипа во фронтальной коре - [G-3H]-кетансерин; для глутаматных NMDA-подтипа в гиппокампе - [3H-G](+)MK-801; для холинорецепторов никотинового подтипа в целом мозге - [3Н-G]-(±)Никотин. Все меченые лиганды были получены методом твердофазного катализа в ОХВАВ ИМГ РАН (зав. - академик РАН Н.Ф.Мясоедов). Подбор конкретных лигандов осуществляли в соответствии с рекомендациями IUPHAR ("Guide to Receptors and Channels", S.P.H.AIexander, A.Mathie and J.A.Peters, BJP, v.147, Suppl.3, 2006).
1.1. Связывание с рецепторами дофамина in vitro.
а) Методика
Изучение радиорецепторного связывания с ДА-рецепторами проводили по методу Sun et al. (2003) с модификациями. Стриатумы крыс гомогенизировали в 10 мл ледяного (0-4°С) 50 мМ Tris-HCl буфера (рН 7,4 при 4°С), используя гомогенизатор «тефлон-стекло». Полученную суспензию центрифугировали при 40000 g в течение 20 мин в ультрацентрифуге «Optima L-70K» (Beckman Coulter). После центрифугирования супернатант сливали, осадок ресуспендировали повторной гомогенизацией в том же объеме буфера, затем вновь центрифугировали. Процедуру отмывки проводили трижды, полученный осадок ресуспендировали в 10 мл 50 мМ Tris-HCl инкубационного буфера (рН 7,4 при 37°С) с добавлением солей (120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2-2H2O, 1 мМ MgCl2-6Н2О) [11] и использовали по 250 мкл в процедуре связывания [G-3H]-лигандов дофаминовых рецепторов. Полученную мембранную фракцию инкубировали с [G-3H]-SCH23390 (удельная активность 60 Ки/ммоль), [G-3H]-спипероном (95 Ки/ммоль), 7-OH-[G-3H]-DPAT (120 Ки/ммоль). При связывании 7-OH-[G-3H]-DPAT, с целью увеличения селективности к D3-рецепторам, из реакционной смеси исключали двухвалентные катионы и добавляли 1 мМ Na4EDTA.
[G-3H]-лиганд добавляли в инкубационную смесь в объеме 50 мкл в конечной концентрации 0.1 нМ и инкубировали в течение 20 мин при температуре 37°С с использованием твердотельного термостата «Термит» (НПО «ДНК-технология»). Неспецифическое связывание определяли в присутствии 50 мкл немеченого лиганда (20 мкМ), которое составляло 12-14% от общего. Специфическое связывание рассчитывали как разницу между общим и неспецифическим связыванием.
IC50 по отношению к связыванию [G-3H]-лигандов определяли при добавлении в инкубационную среду 50 мкл исследуемых соединений в конечных концентрациях в диапазоне 10-3-10-8 М. Объем инкубационной смеси составлял 500 мкл. Процесс связывания останавливали путем добавления 2 мл ледяного 50 мМ Tris-HCl буфера и быстрой фильтрации через стекловолокнистые фильтры типа GF/B (Whatman) с последующей промывкой ледяным буфером общим объемом 14 мл. Фильтры предварительно смачивали перед экспериментом в ледяном 50 мМ Tris-HCl буфере в течение 3 часов.
Фильтры высушивали в течение 12 часов при комнатной температуре, затем помещали в сцинтилляционную жидкость (реактив Брея) объемом 4 мл и использовали для сцинтилляционного счета. Радиоактивность каждой пробы измеряли в течение 2 мин на сцинтилляционном счетчике Wallac 1411. Эффективность счета составляла 40-45%.
б) Результаты
D1-дофаминовые рецепторы. Концентрационная зависимость влияния БЭС на дофаминовые рецепторы D1-типа представлена на фиг.9.
Вывод: БЭС не обладает сродством к дофаминовым рецепторам D1-типа.
D2-дофаминовые рецепторы. Концентрационная зависимость влияния БЭС на дофаминовые рецепторы D2-типа представлена на фиг.10.
Показано, что влияние общепринятого антагониста этого типа рецептора Галоперидола описывается классической кривой (пунктир) и характеризуется величиной IC50=0,57 мкмоль/л. Внесение БЭС не обнаруживает эффекта конкуренции за рецепторные места связывания вплоть до максимальной использованной концентрации 1 мМ (сплошная кривая).
Вывод: БЭС не обладает сродством к дофаминовым рецепторам D2-типа.
D3-дофаминовые рецепторы. Концентрационная зависимость влияния БЭС (Бетулина) на дофаминовые рецепторы DS-типа представлена на фиг.11.
Влияние стандартного антагониста этого типа рецептора (+)-7-OH-DPAT описывается классической кривой (пунктир) и характеризуется величиной IC50=14,6 нмоль/л. Внесение БЭС не обнаружило эффекта конкуренции за рецепторные места связывания вплоть до максимальной использованной концентрации 1 мМ (сплошная кривая).
Вывод: БЭС не обладает сродством к дофаминовым рецепторам D3-типа.
1.2. Связывание с рецепторами серотонина in vitro
а) Методика
Изучение радиорецепторного связывания с СТ-рецепторами проводили по методу Sun et al. (2003), описанному для изучения Д2-рецепторов дофамина (см 1.1.) с тем исключением, что в исследование брали мембранные препараты фронтальной коры мозга, а в качестве специфического лиганда использовали [G-3Н]-кетансерин с удельной радиоактивностью 60 кюри/ммоль.
б) Результаты
Серотониновые 5-НТ2-рецепторы
Концентрационная зависимость влияния БЭС на серотониновые рецепторы 5-НТ2-типа представлена на фиг.12.
Видно, что влияние стандартного антагониста этого типа рецептора кетансерина описывается классической кривой (пунктир) и характеризуется величиной IC50=0,70 мкмоль/л. Внесение БЭС не обнаружило эффекта конкуренции за рецепторные места связывания вплоть до максимальной использованной концентрации 1 мМ (сплошная кривая).
Вывод: БЭС не обладает сродством к серотониновым рецепторам 5-НТ2-типа.
1.3. Связывание с NMDA-рецепторами in vitro.
а) Методика
Изучение связывания на NMDA-подтипах рецепторов производили согласно методу L.-M.Zhou et al. (1996) с модификациями. Использовали меченный тритием МК-801 (дизоцилпин) с удельной активностью 210 Кюри/моль. Ткань гиппокампа или мозжечка гомогенизировали в гомогенизаторе Поттера («тефлон-стекло») в 10 объемах 5 мМ HEPES/4.5 мМ Трис буфера (рН 7.6), содержащего 0.32 М сахарозу (буфер №1). Гомогенат разбавляли до 50 объемов буфера для исследования №2 (5 мМ HEPES/4.5 мМ Трис буфера (рН 7.6) и центрифугировали 10 мин при 1000 g. Супернатант отбирали и вновь центрифугировали 20 мин при 25000 g. Осадок гомогенизировали в 50 объемах буфера №2 и центрифугировали 20 мин при 8000 g. Супернатант и его мягкий, зыбкий надслой отбирали и центрифугировали 20 мин при 25000 g. Полученный осадок суспендировали в буфере №3 (5 мМ HEPES/4.5 мМ Трис буфера, содержащем 1 мМ Na4EDTA (рН 7.6), и суспензию вновь центрифугировали. Такую процедуру отмывки проводили четырежды, причем при последней отмывке EDTA был исключен из состава. Конечный осадок ресуспендировали в 5 объемах буфера №2 и сохраняли в жидком азоте. Реакционная смесь (конечный объем 0.5 мл) содержала 200 мкл буфера №2, 50 мкл меченого лиганда (50 нМ p.p.) и 250 мкл белковой суспензии. Неспецифическое связывание определяли в присутствии 50 мкл немеченого лиганда.
Реакционную смесь инкубировали при комнатной температуре в течение 2 часов. По окончании инкубации пробы фильтровали через стекловолокнистые фильтры GF/B (Whatman), предварительно смоченные в 0.3% полиэтиленимине в течение 2 часов при 4°С. Каждую пробирку промывали один раз холодным буфером №2, затем фильтры промывали три раза тем же объемом буфера. Фильтры сушили на воздухе, до полного высыхания, и переносили в сцинтилляционные флаконы. Фильтры заливали 5 мл сцинтилляционной смеси, содержащей 4 г РРО, 0.2 г РОРОР на 1 л толуола. Радиоактивность определяли на сцинтилляционном счетчике Wallac 1411, с эффективностью счета около 45%.
б) Результаты
Глутаматные NMDA-рецепторы
Концентрац