Способ профилактики развития гнойных процессов в области послеоперационных костных дефектов
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к травматологии и ортопедии, и может быть использовано для профилактики развития гнойных процессов в области послеоперационных костных дефектов. Сущность: при заполнении дефектов в состав биоактивного стеклокристаллического пористого имплантата из биоситалла при температуре 18°±3°С с помощью электрофореза вводят 3% раствор повиаргола в течение 30 минут при силе тока 50 мА, причем насыщение имплантатов антисептиком проводят под грузом до плотного прилегания гидрофильных прокладок к имплантатам, что позволяют создавать внутри инфицированной костной раны длительный антибактериальный эффект в течение 22 суток. 2 ил., 3 табл., 1 диаграмма.
Реферат
Изобретение относится к медицине, а именно к травматологии и ортопедии, и может быть использовано для профилактики развития гнойных процессов в области послеоперационных костных дефектов.
Патоморфологическую основу хронической гнойной инфекции костной ткани составляют секвестры, патологические грануляции, костные очаги некроза и остеомиелитический дефект костной ткани (полость) [2]. Наиболее трудным и до конца не решенным остается вопрос о лечении полостных форм хронического остеомиелита [6, 11].
В соответствии с современными взглядами, антимикробные препараты могут быть эффективны и способствовать излечению лишь на фоне радикального оперативного вмешательства, ликвидирующего костный дефект [3, 4, 5]. Хорошие отдаленные результаты получены хирургами, использовавшими для пластического заполнения полостей такие биологические материалы, как мышечные и костные аутотрансплантаты, а также деминерализованный костный матрикс [8, 7]. Однако, отдавая должное данным методикам, можно отметить, что пластика собственными кровоснабжаемыми тканями не всегда применима в связи с размером и формой костного дефекта или в связи с его локализацией. Это утверждение становится особенно актуальным в случаях значительного рубцового перерождения мягких тканей. В этих случаях, по нашему мнению, обосновано использование различных альтернативных остеозамещающих материалов синтетической природы.
Простота использования подобных методов, неограниченное количество пластического материала, различные типы и размеры имплантатов, возможность замещения костных дефектов при любой локализации и форме остеомиелитической полости позволяют использовать эти способы во всех хирургических стационарах. Кроме того, в последнее время создан ряд принципиально новых биокерамических материалов, способных оптимизировать условия остеорегенерации в области костного дефекта [9, 10].
Предлагаемый нами способ профилактики рецидивов развития гнойных процессов в области послеоперационных костных дефектов сочетает в себе применение остеозамещающих стеклокристаллических имплантатов в качестве заполнителя костных полостей с местным антибактериальным эффектом, достигаемым за счет введения в состав биоситалла антисептика (повиаргола).
К аналогам предлагаемой нами методики можно отнести способы заполнения костных дефектов синтетическими полимерными материалами на основе керамики. В Западных странах начато промышленное производство и широко используются биодеградирующие материалы на основе природных полимеров, такие как "Bioos", "Interpor", "OsteoSet". Уже создан и апробирован на животных ряд синтетических биокерамических материалов, способных не только заполнять дефекты костей, но и обладающих выраженными остеоиндуктивными свойствами. Однако высокая коммерческая стоимость данных препаратов, отсутствие у этих материалов антисептических свойств не позволяет использовать их для пластики костных дефектов в условиях гнойной инфекции. Перечисленные недостатки частично решены применением препарата «Septopal», выпускаемого фирмой Biomet Merck (Германия). Имплантаты из цепочек «Septopal» применяются для заполнения инфицированных костных дефектов в травматологии и ортопедии, поскольку в состав имплантатов входит антибиотик (гентамицин).
Однако и данная методика имеет ряд недостатков. В первую очередь к ним можно отнести тот факт, что основной химической составляющей «Septopal» является кополимер метилметакрилата, метилакрилата и аминоацетоновой кислоты, являющихся цитотоксичными препаратами. В связи с этим имплантированные в костные дефекты цепочки из «Septopal» обычно удаляются через 2 недели после операции, то есть по окончании действия антибиотика, введенного в состав имплантатов. Отсутствие у «Septopal» остеоиндуктивных свойств, цитотоксичность метилметакрилатных соединений, необходимость удаления имплантатов в ранние послеоперационные сроки существенно ограничивает область применения данного препарата в хирургической практике.
Эти недостатки частично решаются при применении для пластики костных полостей деминерализованных костных трансплантатов (ДКТ). Они являются ценным биологическим материалом, однако, обладая остеоиндуктивными свойствами, эти трансплантаты сами по себе не обладают антимикробными свойствами.
Наиболее близким изобретением (прототипом) к предлагаемой нами методике является способ стерилизации ДКТ трубчатой формы [1]. По предложенной авторами методике стерилизацию таких трансплантатов осуществляют путем электрофореза антисептиков (3% раствором нитрата серебра в течение 2 часов при силе тока 50 мА). При изучении антимикробной активности установлено, что у ДКТ, насыщенных нитратом серебра по данному способу, она оказалась значительно выше, чем в контроле. Авторы сделали вывод о большой перспективности этого метода, в том числе и для гнойной остеологии, в связи с тем, что костный трансплантат, приобретая выраженные антимикробные свойства, не теряет своих остеоиндуктивных свойств. Однако применение ДКТ ограничено в связи с сенсибилизацией части больных к костному антигену, вызывающей отторжение, а в конечном итоге - нагноение трансплантата.
В отличие от ДКТ, биоситалл инертен по отношению к окружающим тканям организма. В доступной литературе нами не обнаружено сведений об аллергических реакциях на имплантацию синтетических стеклокристаллических материалов. В то же время заслуживают внимания доказанная положительная остеогенная активность биоситалла, позволяющая широко использовать материал в травматологии и ортопедии, а также в челюстно-лицевой хирургии. Однако отсутствие у биоситалла антимикробных свойств не позволяют применять данный материал в условиях раневой инфекции. Предлагаемый нами способ позволяет не только стерилизовать пористые имплантаты из биоситалла, но и придавать им выраженные антибактериальные свойства и тем самым осуществлять длительный местный антимикробный эффект в области костной раны.
Техническим результатом изобретения является длительный местный антибактериальный эффект в области костной раны (22 и более суток), отсутствие аллергических реакций на имплантаты, уменьшение сроков насыщения имплантатов антисептиками (до 30 минут), неограниченная область применения в хирургической практике, общедоступность метода, меньшая коммерческая стоимость предлагаемого способа.
Результат изобретения достигается тем, что в состав биоактивного стеклокристаллического пористого имплантата (биоситалла) при температуре 18°±3°С с помощью электрофореза вводят 3% раствор повиаргола в течение 30 минут при силе тока 50 мА, причем насыщение имплантатов антисептиком проводят под грузом 5 кг.
На чертежах изображены:
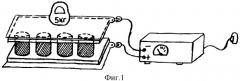
фиг.1 - схема метода насыщения цилиндрических имплантатов из биоситалла с помощью электрофореза;
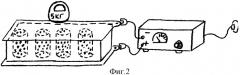
фиг.2 - схема метода электрофоретического насыщения гранулята биоситалла раствором повиаргола.
В таблицах приведены:
Таблица 1. Величины зон задержки роста микроорганизмов в зависимости от концентрации повиаргола (в контрольной и основной группах), где * - р<0,05;
Таблица 2. Величины зон задержки роста микроорганизмов в зависимости от времени экспозиции (в контрольной и основной группах), где * - р<0,05;
Таблица 3. Уровень остаточной антибактериальной активности имплантатов, в зависимости от сроков элиминации (по величине зоны задержки роста на чашках Петри), где * - р<0,05.
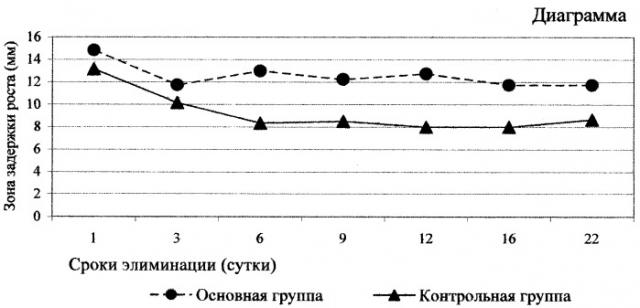
На диаграмме приведено графическое изображение данных таблицы 3.
Способ осуществляют следующим образом. Пористые стеклокристаллические имплантаты из биоситалла в виде цилиндров и гранулята насыщают путем электрофореза 3% раствором повиаргола (высокодисперсного металлического серебра, стабилизированного гюливинилпирролидоном низкомолекулярным медицинским, рег. № МЗ РФ: 97/167/7). Насыщение проводят в нестерильных условиях при комнатной температуре (18°±3°С) с помощью широко используемых в физиотерапии гальванических аппаратов («Поток-1», «Элфор-проф» и др.). Время экспозиции электрофореза 30 минут.
Цилиндры из биоситалла (фиг.1), обычно по 4-5 штук, располагают вертикально между прокладками электродов. Прокладку на нижнем электроде пропитывают 3% раствором повиаргола и соединяют с положительным полюсом (анодом) гальванического аппарата. Верхнюю прокладку смачивают дистиллированной водой, плотно прижимают к имплантатам с помощью груза весом 5 кг и соединяют с отрицательным полюсом (катодом). Подобное расположение электродов обеспечивает равномерное распределение силовых линий электрического поля по всей площади имплантатов, что обеспечивает равномерное пропитывание антисептиком всей толщи пористого стеклокристаллического имплантата из биоситалла. Применение груза (5 кг) обеспечивает плотное прилегание гидрофильных прокладок к имплантатам, что позволяет за счет уменьшения сопротивления между ними повысить скорость насыщения имплантатов ионами антисептика и тем самым сократить время насыщения (до 30 минут).
Для электрофоретического насыщения гранулята используют особое приспособление (фиг.2). Из диэлектрика изготавливают пластину прямоугольной формы. В разных частях ее выполняют сквозные отверстия диаметром 1 см. Пластину укладывают поверх прокладки, смоченной 3% раствором повиаргола. В отверстия засыпают гранулы биоситалла. Сверху на пластину укладывают прокладку, смоченную в дистиллированной воде. Созданную таким образом систему укладывают под пресс (5 кг). Повиаргол вводят с положительного полюса (анода).
Имплантаты из стеклокристаллического материала электрический ток не проводят, так как являются диэлектриком. После пропитывания имплантатов раствором повиаргола, являющегося электролитом, биоситалл приобретает способность пропускать через себя электрический ток. Благодаря своей пористой структуре, имплантаты из биоситалла способны легко насыщаться любыми жидкими препаратами. Нами определено, что ток в электрической сети появляется при пропитывании биоситалла 0,3% раствором повиаргола. По мере возрастания концентрации раствора повиаргола пропорционально возрастает и сила тока, проходящего через материал. Вероятно, данное явление напрямую связано с количеством частиц ионизированного серебра, осмолярностью раствора повиаргола. Внутри пор керамического изделия возникает ионный ток, способствующий более быстрому и глубокому насыщению имплантатов ионами серебра.
Значительная сорбционная емкость и объем порового пространства костнозамещающего стеклокристаллического материала позволяют вводить в его состав большие количества активно действующего антисептика. Кроме того, по нашему мнению, при электрокинетических воздействиях проявляется способность к изменению величины поверхностного дзетопотенциала за счет перезарядки групп SiO- и SiOH-, всегда присутствующих на поверхности биоситалла. Эта способность удерживать на себе сорбированные соединения и комплексы, образуемые поливинилпирролидоном и Ag+, обеспечивает длительность выделения препарата во времени и динамику процесса, отличную от динамики выведения повиаргола из керамических имплантатов, насыщенных методом простой диффузии. Таким образом, при пропитывании пористых имплантатов из биоситалла растворами повиаргола в концентрации более 0,3% стеклокристаллический материал приобретает относительные электропроводные свойства, что позволяет применять электрофорез для стерилизации материала и придания данным остеозамещающим стеклокристаллическим пористым имплантатам антимикробных свойств. В ходе микробиологических серий опытов получены результаты, которые приведены в таблицах 1 и 2.
Как видно из данных таблиц, с увеличением времени экспозиции электрофореза (опытная группа) биоситалл приобретает максимальный бактериостатический эффект значительно быстрее, чем при диффузионном способе насыщения (контрольная группа).
Наиболее эффективным способом придания антимикробных свойств имплантатам из биоситалла является электрофоретический метод насыщения 3% раствором повиаргола в течение 30 минут. При дальнейшем увеличении времени экспозиции сила антибактериального эффекта практически не меняется.
Нами также изучена динамика элиминации антисептика из пористых стеклокристаллических имплантатов (таблица 3 и диаграмма). В опытной серии изучена остаточная антибактериальная активность гранул биоситалла, насыщенных антисептиком методом электрофореза. В контрольной группе изучены свойства гранул, насыщенных диффузионным методом.
Из таблицы 3 и диаграммы видно, что в контрольной группе отмечается гораздо более резкое снижение антибактериальной активности в сроки от первых до шестых суток. В опытной группе этот показатель снижался более плавно и к 22 суткам оставался на уровне достоверно большем (в 1,4 раза), чем в контрольной группе.
По окончании эксперимента все имплантаты, использованные в исследовании, проверены на остаточную бактерицидность и бактериостатичность. Нами определено, что даже в эти сроки имплантаты из опытной группы сохраняют выраженную антибактериальную активность и полностью подавляют рост микробов при микробной нагрузке 1×105 КОЕ/см2.
Таким образом, нами доказана эффективность насыщения пористых стеклокристаллических имплантатов повиарголом с использованием метода электрофореза. При изучении антимикробной активности установлено, что у биоситалла, насыщенного повиарголом по предлагаемому способу, она оказалась значительно выше, чем в контроле, то есть у имплантатов, насыщенных методом инфузии.
Наиболее эффективным является применение 3% раствора повиаргола при экспозиции электрофореза 30 и более минут. Применение имплантатов из биоситалла, насыщенных повиарголом с помощью электрофореза, позволяют создавать внутри инфицированной костной раны длительный антибактериальный эффект в течение 22 суток и более, что позволяет рассматривать предлагаемую нами методику как способ профилактики гнойных процессов внутри инфицированных костных дефектов.
| Таблица 1 | ||||
| № п/п | Концентрация повиаргола (%) | Время экспозиции (мин) | Величина зоны задержки роста микроорганизмов (мм) | |
| Опыт | Контроль | |||
| 1 | 1 | 30 | 13,10±0,48* | 8,30±0,42 |
| 2 | 60 | 13,00±0,58* | 11,40±0,60 | |
| 3 | 120 | 13,30±0,17* | 12,20±0,45 | |
| 4 | 3 | 30 | 15,80±1,04* | 9,30±0,38 |
| 5 | 60 | 14,30±0,62* | 11,70±0,50 | |
| 6 | 120 | 13,60±0,85 | 13,00±0,33 | |
| 7 | 5 | 30 | 12,00±0,44 | 10,70±0,50 |
| 8 | 60 | 14,10±0,46 | 13,20±0,37 | |
| 9 | 120 | 13,70±0,37 | 13,80±0,45 | |
| Таблица 2 | ||||
| № п/п | Время экспозиции (мин) | Концентрация повиаргола (%) | Величина зоны задержки роста микроорганизмов (мм) | |
| Опыт | Контроль | |||
| 1 | 30 | 1 | 13,10±0,48* | 8,30±0,42 |
| 2 | 3 | 15,80±1,04* | 9,30±0,38 | |
| 3 | 5 | 12,00±0,44 | 10,70±0,50 | |
| 4 | 60 | 1 | 13,00±0,58* | 11,40±0,60 |
| 5 | 3 | 14,30±0,62* | 11,70±0,50 | |
| 6 | 5 | 14,10±0,45 | 13,20±0,37 | |
| 7 | 120 | 1 | 13,30±0,17* | 12,20±0,45 |
| 8 | 3 | 13,60±0,85 | 13,00±0,33 | |
| 9 | 5 | 13,70±0,37 | 13,80±0,45 |
| Таблица 3 | |||
| № п/п | Сроки элиминации (сутки) | Величина зоны задержки роста микроорганизмов (мм) | |
| Опыт | Контроль | ||
| 1 | 1 | 14,83±0,44* | 13,17±0,65 |
| 2 | 3 | 11,75±0,36* | 10,17±0,28 |
| 3 | 6 | 13,00±0,31* | 8,33±0,46 |
| 4 | 9 | 12,25±0,19* | 8,50±0,52 |
| 5 | 12 | 12,75±0,19* | 8,00±0,34 |
| 6 | 16 | 11,75±0,19* | 8,00±0,48 |
| 7 | 22 | 11,75±0,19* | 8,67±0,39 |
Источники информации
1. Жирнов В.А., Савельев В.И., Афиногенов Г.Е. Способ стерилизации деминерализованного костного трансплантата трубчатой формы // А.с. СССР №1701324. - Открытия, изобретения. - 1991. - №48. - С.33.
2. Канорский И.Д. Принципы патогенетического лечения хронического остеомиелита: Автореф. дисс... д-ра наук. - М., 1983. - 36 с.
3. Кузин М.И., Костюченок Б.М. Раны и раневая инфекция. - М-: Медицина. - 1990. - 592 с.
4. Кулик В.И., Мамонтов В.Д., Афиногенов Г.Е., Грязнухин Э.Г. Лечение осложнений открытых диафизарных переломов костей голени // Диагностика, профилактика и лечение раневой инфекции в травматологии и ортопедии. - СПб., - 1994. - С.68-76.
5. Мамонтов В.Д., Кулик В.И., Афиногенов Г.Е. Раннее хирургическое лечение "малых форм" нагноения в травматологии и ортопедии как метод профилактики послеоперационного остеомиелита: Методич. рекоменд. - СПб. - 1993. - 10 с.
6. Марков Б.И. Выбор способа оперативного лечения хронического остеомиелита трубчатых костей: Автореф. дисс... канд. наук. - Саратов, 1987. - 21 с.
7. Рак А.В., Линник С.А., Никитин Г.Д., Павлов О.А. Остеомиелит плечевой кости и особенности его лечения // Сб. науч. работ "Диагностика, профилактика и лечение раневой инфекции в травматологии и ортопедии". - 1994. - С.132-135.
8. Савельев В.И. Трансплантация костной ткани: достижения и перспективы // Актуальные вопросы ортопедии. - Л., 1987. - С.131-154.
9. Щепеткин И.А. Кальцийфосфатные материалы в биологических средах // Успехи современной биологии. - 1995. - Т. 115 №1 - С.58-73.
10. Hench L.L. Bioceramics: From Concept to clinic. // J.Amer. Ceramic. Soc. - 1991, vol. 74, №7, - P.1487-1510.
11. Kiene S., Lenz P., Brinckman W., Weichteilplastiken im operativen Behand lungsprogram der ostemyelitis // Lbl. Chir. - 1978. - Bd.103, M.13. - S.854-865.
Способ профилактики развития гнойных процессов в области послеоперационных костных дефектов путем заполнения их остеозамещающими имплантатами, отличающийся тем, что в состав биоактивного стеклокристаллического пористого имплантата из биоситалла при температуре 18°±3°С с помощью электрофореза вводят 3%-ный раствор повиаргола в течение 30 мин при силе тока 50 мА, причем насыщение имплантатов антисептиком проводят под грузом до плотного прилегания гидрофильных прокладок к имплантатам.