6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолин в качестве компонента, повышающего стойкость углеводородных топлив к детонации
Иллюстрации
Показать всеОписывается 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолин из общей формулы (I)
где пунктирной линией обозначена двойная связь в положении 3-4, R является радикалом СН3, в качестве компонента, повышающего стойкость углеводородных топлив к детонации. Также описывается применение 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина, 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолина и 6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолина, и их смесей в качестве компонентов, повышающих стойкость углеводородных топлив к детонации и топливная композиция, включающая углеводородное топливо и добавку, повышающую его стойкость к детонации. Технический результат - получено новое соединение, обладающее полезными свойствами. 3 н. и 1 з.п. ф-лы, 10 ил.
Реферат
Предлагаемое изобретение относится к веществам, повышающим антидетонационную стойкость углеводородных горючих (топлив) и может быть использовано в области нефтепереработки, переработке газа для создания высокооктановых топлив.
Известно, что бензины прямой гонки состоят из устойчивых углеводородов, которые могут храниться в бензохранилищах без заметного смолообразования [1, 4]. Однако использование таких бензинов в двигателях внутреннего сгорания вызывает детонацию, которая способствует преждевременному его износу, уменьшению мощности, увеличению расхода топлива и неполному его сгоранию, что приводит к образованию окиси углерода и водорода, при этом происходит большое выделение дыма [1, 2, 4]. С появлением двигателей внутреннего сгорания, работающих на повышенных степенях сжатия, возникла проблема повышения октанового числа углеводородных горючих (топлив) [1, 2, 4]. Известно, что октановое число топлив возрастает с увеличением в топливе содержания разветвленных и ненасыщенных углеводородов и углеводородов ароматического ряда [1-7]. Так как бензины прямой гонки, или рифайнинг-бензины, сильно обогащены парафиновыми углеводородами нормального строения, их октановые числа обычно не превышают 60 [1-4]. В настоящее время возрос спрос на высокооктановые (высококачественные) углеводородные горючие (топлива) и продолжает расти [1-8]. Термический крекинг позволил резко поднять производство бензина и улучшить его качество [1, 4]. Уменьшение тенденций крекинг-бензинов к детонации обусловлено примесью в них олефиновых углеводородов, образующихся при термическом распаде больших молекул [1-7]. Постоянное развитие и совершенствование авиационной и автомобильной техники требует создания новых высокооктановых (высококачественных) видов топлив [1-7]. Эту задачу можно решить созданием новых химических процессов риформинга бензинов прямой гонки, каталитического крекинга и каталитического риформинга или добавлением к углеводородным горючим (топливам) специальных антидетонационных добавок и высокооктановых компонентов [1, 4]. При этом может возникнуть эффект синергизма [1-7]. Хотя и считается перспективным получение высококачественных (высокооктановых) углеводородных горючих (топлив, бензинов) технологическим путем, однако разработка самих методов и тем более создание и строительство новых технологических установок для получения высококачественных (высокооктановых) топлив требует огромных капитальных затрат, что не всегда приемлемо для многих стран. Поэтому самым технологически и экономически выгодным является использование для получения высокооктановых углеводородных горючих (топлив, бензинов) антидетонационных добавок. Известно, что для увеличения октанового числа топлив используют (применяют) как зольные, так и беззольные антидетонационные добавки (присадки) [1-15].
Известными, но мало применяемыми в настоящее время зольными антидетонационными добавками (присадками) являются органические соединения марганца, железа, меди, хрома, кобальта, никеля, редкоземельных элементов, свинца [1, 4, 5] и др., однако все они обладают высокой токсичностью, особенно органические соединения свинца, как сами, так и продукты их горения и оказывают отрицательное воздействие на работу двигателей внутреннего сгорания, накапливаясь на электродах свечей зажигания, поршнях и стенках камеры сгорания, значительно сокращая его ресурс [1, 4, 5, 10-17].
Беззольные антидетонационные добавки (присадки) хотя и менее эффективны, чем зольные, но находят более широкое распространение и применение, особенно в сочетании с другими компонентами [1-15]. Наиболее известными и распространенными беззольными антидетонационными добавками (присадками) являются: низкомолекулярные ароматические амины [N-метиланилин (ММА), ксилидин, толуидин]. Так, известна присадка экстралин ТУ 6.02.571-90, содержащая в процентных весовых соотношениях диметиланилин до 4,5%, анилин до 6% и N-метиланилин до 100% [14]. Другой известной присадкой аналогичного типа является присадка АДА ТУ 38-401-58-61-93, которая дополнительно содержит в своем составе антиокислительную добавку типа ионола [14]. Недостатками такого типа присадок является относительно невысокий прирост октанового числа топлив и ограничение их по содержанию, в связи с увеличением окислительных процессов в бензине, смолообразования и нагарообразования в двигателе при повышенной концентрации [14, 17]. В качестве антидетонаторов известны также гомологи бензола: ксилол, этилбензол, толуол [14], которые весьма незначительно повышают октановое число топлив. Известно использование в качестве антидетонаторов оксигенатов и их смеси этилового или метилового спирта с более высокомолекулярными спиртами: метил-трет-бутилового эфира и его смесь с изобутиловым спиртом в соотношениях 60-80% и 40-20% соответственно [14]. Недостатками таких добавок (присадок) является незначительное поднятие октанового числа бензинов при высоком до 25% их содержании.
До настоящего времени имеется весьма ограниченный ассортимент беззольных антидетонационных добавок (присадок) в виде индивидуальных соединений (веществ), что не позволяет создавать на их основе новые виды высокооктановых углеводородных горючих (топлив) с требуемыми свойствами для каждого конкретного случая в зависимости от поставленных целей или универсальными свойствами.
Нами впервые для повышения октанового числа углеводородных горючих (топлив) была подтверждена возможность использования (применения) соединений (веществ) из ряда (класса) гидрохинолинов.
Прототипами в данном случае могут быть выбраны как оксигенаты этил- или метил-трет-бутиловый эфир, так и N-метиланилин, который является вторичным амином.
Недостатками оксигенатовых антидетонаторов является необходимость их добавления в бензин в больших количествах 10-25%, для поднятия октанового числа на 3-8 единиц при снижении энергетики топлив и отрицательном влиянии на резинотехнические детали автомобилей [14, 16].
Недостатками N-метиланилиновых присадок является их нестабильность, повышение смолообразования, вследствие чего их допустимые концентрации ограничены 1-1,3% (мас.), невысокое поднятие октанового числа топлив.
Эта задача решается использованием (применением) в качестве компонентов (или в качестве добавок), повышающих стойкость углеводородных горючих (топлив) к детонации, 6-этоксизамещенных 2,2,4-три- и новые 1,2,2,4-тетраметил 1,2-ди и 1,2,3,4-тетрагидрохинолинов, их смесей и в сочетании с оксигенатами.
Известен 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолин (патент RU №2252215, кл. С07D 215/20, 2005 год), его высокая антиокислительная активность [Нефтехимия, М.: Наука, 2004, том 44, №3, с.226-231]. Однако проведенные исследования и эксперименты доказывают его эффективность не только как антиоксиданта, повышающего стабильность углеводородных горючих (топлив) к окислительным процессам, но и как антидетонатора.
Также для решения поставленных задач нами получены новые вещества 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолин и 6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолин и доказана их эффективность в повышении детонационной стойкости углеводородных топлив.
Получение 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолина.
В колбу объемом 1 л, снабженную обратным холодильником, термометром, капельной воронкой, мешалкой с затвором, помещают 400 мл (352 г) (4,5 М) абсолютного бензола или 400 мл (347 г) (3,77 М) абсолютного толуола, 217 г (1 М) 6-этокси-2,2,4-триметил-1,2-дигидрохинолина и при перемешивании медленно прикапывают 79,73 мл (181,7 г) (1,28 М) йодистого метила в 200 мл (176 г) (2,25 М) абсолютного бензола или 200 мл (173,5 г) (1,9 М) абсолютного толуола так, чтобы температура реакционной смеси не поднималась выше 42°С, затем реакционную массу нагревают до 55°С и при этой температуре перемешивают реакционную массу еще два часа. Затем реакционную массу охлаждают до комнатной температуры. Выпавший осадок йодисто-водородной соли 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолина отфильтровывают, промывают абсолютным бензолом или абсолютным толуолом и подсушивают. Затем, при охлаждении, к ней добавляют небольшими порциями (частями) раствор 61,6 г (1,54 М) едкого натра в 185,26 мл дистиллированной воды.
Образовавшийся 6-этокси-1,2,3,4-тетраметил-1,2-дигидрохинолин отделяют в делительной воронке, извлекая его из массы 280 мл (184,8 г) (2,144 М) гексана. Гексан отгоняют, а остаток подвергают дробной, фракционной перегонке (разгонке), отбирая фракцию с температурой кипения 131-132°С при 2 мм рт.ст.
Выход 150,15 г (65% от теор.) жидкого желтоватого вещества; d=0,990 г/см3.
Найдено С 77,90; Н 9,18: N 6,01%, М+231 (масс-спектром). C15H21NO.
Вычислено С 77,88; Н 9,15: N 6,05, О 6,92% М+231,34.
Получение 6-этокси-1,2,3,4-тетраметил-1,2,3,4-тетрагидрохинолина.
В колбу объемом 1 л, снабженную обратным холодильником, термометром, капельной воронкой, мешалкой с затвором, помещают 400 мл (352 г) (4,5 М) абсолютного бензола или 400 мл (347 г) (3,77 М) абсолютного толуола, 219 г (1 М) 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина и при перемешивании медленно прикапывают 79,73 мл (181,7 г) (1,28 М) йодистого метила в 200 мл (176 г.) (2,25 М) абсолютного бензола или 200 мл (173,5 г) (1,9 М) абсолютного толуола так, чтобы температура реакционной смеси не поднималась выше 42°С, затем реакционную массу нагревают до 55°С и при этой температуре перемешивают реакционную массу еще два часа. Затем реакционную массу охлаждают до комнатной температуры. Выпавший осадок йодисто-водородной соли 6-этокси-1,2,3,4-тетраметил-1,2,3,4-тетрагидрохинолина отфильтровывают, промывают абсолютным бензолом или абсолютным толуолом и подсушивают. Затем при охлаждении к ней добавляют небольшими порциями (частями) раствор 61,6 г (1,54 М) едкого натра в 185,26 мл дистиллированной воды.
Образовавшийся 6-этокси-1,2,3,4-тетраметил-1,2,3,4-тетрагидрохинолин отделяют в делительной воронке, извлекая его из массы 280 мл (184,8 г) (2,144 М) гексана. Гексан отгоняют, а остаток подвергают дробной, фракционной перегонке (разгонке), отбирая фракцию с температурой кипения 162-164°С при 5 мм рт.ст.
Выход 163 г (70% от теор.) жидкого желтоватого вещества; d=1,003 г/см3.
Найдено С 77,24; Н 9,95: N 6,02%, М+233 (масс-спектром). C15H23NO.
Вычислено С 77,21; Н 9,93: N 6,00, O 6,86% М+233,356.
Получение 6-этокси-1,2,2,4-тетраметил-1,2-ди- и 1,2,3,4-тетрагидрохинолина.
6-этокси-1,2,2,4-тетраметил-1,2-ди- и 1,2,3,4-тетрагидрохинолин были получены также с использованием диметилсульфата, бикарбоната натрия, едкого натра или калия по методике, описанной в [Вейганд-Хильгетаг. Методы эксперимента в органической химии. - М.: Химия, 1964. - 944 с] и 6-этокси-1,2,2,4-тетраметил-1,2-ди- или 1,2,3,4-тетрагидрохинолина с выходом 50 и 65% от теоретического соответственно.
Показатели преломления, плотности (удельные веса), УФ-, ИК-, ЯМР -, масс-спектры полностью идентичны со спектрами этих же веществ (соединений), полученных другими способами [Ю.К.Юрьев. Практические работы по органической химии. Выпуск первый и второй. 2-ое дополненное издание. - М.: Издательство Московского университета. 1961. - 420 с].
Физико-химические исследования полученных веществ (соединений) полностью подтвердили их строение и идентичность.
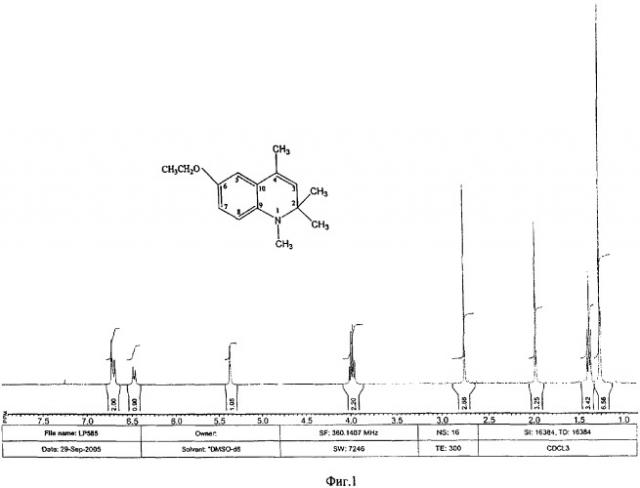
Исследование 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолина методом ЯМР.
Спектры ЯМР 1Н и 13С раствора 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолина в CDCl3 измерены на спектрометре Bruker AM-360 на частотах 360 и 90 МГц соответственно.
В спектре ЯМР 1Н 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолина (Фиг.1) наблюдаются следующие сигналы резонансов протонов молекулы:
синглет протонов двух метальных групп при атоме С2 в области 1.27 м.д.;
триплет метильных протонов этоксигруппы при 1.39 м.д. с J(H-H)=6.7 Гц;
синглет протонов метильной группы при атоме С4 в области 1.98 м.д.;
синглет протонов метильной группы при атоме N при 2.76 м.д.;
квадруплет протонов метиленовой компоненты этоксигруппы при 3.98 м.д. с J(H-H)=67 Гц;
синглет протона двойной связи С=С при атоме С3 в районе 5.37 м.д.;
дублет протона при атоме С7 при 6.46 м.д. с J(H-H)=8.28 Гц;
дублет протона при атоме С8 при 6.68 м.д. с J(H-H)=3.24 Гц;
дублет протона при атоме С5 при 6.72 м.д. с J(H-H)=2.52 Гц.
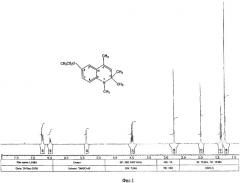
В спектре ЯМР 13С 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолина (Фиг.2) наблюдаются следующие сигналы резонансов углеродных атомов молекулы:
при 14.92 м.д. - сигнал метильного углерода этоксигруппы;
при 18.4 м.д. - сигнал углерода метильной группы при атоме С4;
при 25.89 м.д. - двух углеродов двух метильных групп при атоме С2;
при 30.62 м.д. - сигнал углерода метильной группы при атоме N;
при 55.64 м.д. - сигнал атома углерода С2;
при 63.91 м.д. - сигнал метиленового атома углерода этоксигруппы;
при 111.2, 111.4 и 113.5 м.д. - сигналы протонированных атомов углерода С5, С7 и С8 ароматического кольца;
при 124.94 м.д. - сигнал атома С10;
при 128.12 м.д. - сигнал атома С9;
при 131.56 м.д. - сигнал атома С3;
при 139.7 м.д. - сигнал атома С4;
при 150.6 м.д. - сигнал атома С6.
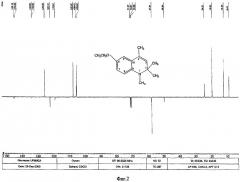
Исследования 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолина методом ИК спектрофотометрии.
ИК-спектр измерен в капиллярном слое в KBr на спектрофотометре Bruker IFS-113.
Спектр 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолина (Фиг.3) содержит полосы поглощения с максимумами при 489, 523, 628, 710, 729, 926, 960, 1089, 1117, 1164, 1265, 1288, 1305, 1354 см-1 (все слабой интенсивности), 798, 1052 см-1 (сильной интенсивности), 869, 1026, 1385 (средней интенсивности), а также характеристические полосы поглощения валентных колебаний связи С=С при 1495 (сильная), 1611 и 1661 см-1 (слабые) и связи С-Н при 2810 (слабая), 2872, 2900 и 2973 см-1 (сильные).
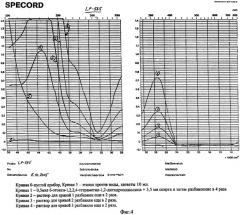
Исследования 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолина методом УФ спектрофотометрии.
УФ-спектры измерены в растворе этанола на приборе SPECORD UV VIS (Carl Zeiss, Jena).
УФ-спектр 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолина (Фиг.4) с характерной концентрационной зависимостью интенсивности полос поглощения отмечаются максимумы при 231 и 365 нм, плечо при 270 нм и минимум при 307 нм.
Масс-спектрометрические исследования 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолина
Масс-спектр измерен на масс-спектрометре Finnigan MAT 95 XL пропусканием через капиллярную колонку (фаза - полидиметилсилоксан, содержащий 5% фенильных групп) при энергии ионизирующих электронов 70 эВ.
В спектре 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолина (Фиг.5) наблюдается пик молекулярного иона [М]+ с m/z 231 (относительная интенсивность 12%), а также пики ионов [М-СН3]+ с m/z 216 (100%), [М-С2Н5]+ с m/z 202 (2%), [M-N(CH3)2+Н]+ с m/z 188 (23%) и пики его фрагментации с отщеплением СН3 и СН2-групп с m/z 173 (5%), 159 (10%), 144 (4%), 130 (1%) и 115 (1%).
Исследование 6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолина методом ЯМР.
Спектры ЯМР 1Н и 13С раствора 6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолина в CDCl3 измерены на спектрометре Bruker AM-360 на частотах 360 и 90 МГц соответственно.
В спектре ЯМР 1Н 6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолина (Фиг.6) наблюдаются следующие сигналы резонансов протонов молекулы:
два синглета протонов двух метильных групп при атоме С2 при 1.19 и 1.27 м.д.;
дублет протонов метильной группы при атоме С4 при 1.34 м.д. с J(H-H)=6.84 Гц;
триплет метильных протонов этоксигруппы при 1.41 м.д. с J(H-H)=6.9 Гц;
триплет протона СН2-группы в цикле при 1.53 м.д.;
квадруплет второго протона СН2-группы при 1.78 м.д.
синглет протонов метильной группы при атоме N при 2.78 м.д.;
мультиплет протона СН-группы в цикле при атоме С4 при 2.86 м.д.;
квадруплет протонов метиленовой компоненты этоксигруппы при 4.0 м.д. с J(H-H)=6.84 Гц;
дублет протона при атоме С7 при 6.54 м.д. с J(H-H)=8.28 Гц;
дублет дублетов протона при атоме С8 при 6.70 м.д. с J3(H-H)=2.88 Гц, J1(Н-Н)=9 Гц;
дублет протона при атоме С5 при 6.80 м.д. с J3(H-H)=2.46 Гц.
В спектре ЯМР 13С 6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолина (Фиг.7) наблюдаются следующие сигналы резонансов углеродных атомов молекулы:
при 14.96 м.д. - сигнал метильного углерода этоксигруппы;
при 19.57 м.д. - сигнал углерода метильной группы при атоме С4;
при 23.7 м.д. - сигнал атома углерода С4;
при 27.69 и 28.51 м.д. - сигналы двух углеродов двух метильных групп при атоме С2;
при 31.64 м.д. - сигнал углерода метильной группы при атоме N;
при 47.14 м.д. - сигнал атома углерода С3;
при 53.68 м.д. - сигнал атома углерода С2;
при 63.84 м.д. - сигнал метиленового атома углерода этоксигруппы;
при 111.88, 111.92 и 113.17 м.д. - сигналы протонированных атомов углерода С5, С7 и С8 ароматического кольца;
при 130.6 м.д. - сигнал атома С10;
при 140.6 м.д. - сигнал атома С9;
при 150.1 м.д. - сигнал атома С6.
Исследования 6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолина методом ИК спектрофотометрии.
ИК-спектр измерен в капиллярном слое в KBr на спектрофотометре Braker IFS-113.
Спектр 6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолина (Фиг.8) содержит полосы поглощения с максимумами при 455, 539, 628, 715, 729, 1087, 1164, 1195, 1222, 1259, 1305, 1362, 1420 см-1 (все слабой интенсивности), 796, 1057, 1125, 1293 см-1 (сильной интенсивности), 870, 958, 1386 (средней интенсивности), а также характеристические полосы поглощения валентных колебаний связи С=С при 1500 (сильная) и 1616 см-1 (слабая) и связи С-Н при 2810 (слабая), 2871, 2929 и 2973 см-1 (сильные).
Исследования 6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолина методом УФ спектрофотометрии.
УФ-спектры измерены в растворе этанола на приборе SPECORD UV VIS (Carl Zeiss, Jena).
УФ-спектр 6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолина (Фиг.9) с характерной концентрационной зависимостью интенсивности полос поглощения отмечаются максимумы при 252 и 318 нм и минимумы при 228 и 285 нм.
Масс-спектрометрические исследования 6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолина
Масс-спектр 6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолина измерен на масс-спектрометре Finnigan MAT 95 XL пропусканием через капиллярную колонку (фаза - полидиметилсилоксан, содержащий 5% фенильных групп) при энергии ионизирующих электронов 70 эВ.
В спектре 6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолина (Фиг.10) наблюдается пик молекулярного иона [М]+. с m/z 233 (относительная интенсивность 30%), а также пики ионов [М-СН3]+ с m/z 218 (100%), [М-С2Н5]+ с m/z 204 (8%), [М-ОС2Н5+Н]+ с m/z 189 (6%) и пики его фрагментации с отщеплением СН3 и СН2-групп с m/z 174 (5%), 160 (3%), 146 (3%), 132(1%) и 118 (1%).
Впервые, исходя из вышеизложенного, были получены и исследованы спектральными методами и элементным анализом 6-этокси-1,2,2,4-триметил-1,2-дигидрохинолин и 6-этокси-1,2,2,4-триметил-1,2,3,4-тетрагидрохинолин, а также определены их температуры кипения, показатели преломления и плотности.
Эффективность 6-этоксизамещенных 2,2,4-триметил- и новых 1,2,2,4-тетраметил 1,2-ди- и 1,2,3,4-тетрагидрохинолинов по п.1, п.2 определялась по приросту октанового числа, определяемого моторным методом(ОЧМ) и исследовательским методом (ОЧИ) в смеси изооктана и нормального гептана (70:30 объемных %) соответственно.
Пример 1.
6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолин, взятый 1% мас. по отношению к смеси, дал прирост ОЧ на 1 ед. (ОЧМ) и 3 ед. (ОЧИ).
Пример 2.
6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолин, взятый 1% мас., дал прирост на 1,4 ед. (ОЧМ) и 4 ед. (ОЧИ)
Пример 3.
6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолин, взятый 1% мас. по отношению к смеси, дал прирост на 2 ед. (ОЧМ) и 4,3 ед. (ОЧИ)
Пример 4.
Смесь 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина и 6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолина в соотношении 1:1, взятая 1% мас. по отношению к топливной смеси, дала прирост на 1,4 ед. (ОЧМ) и 4 ед. (ОЧИ).
Пример 5.
Смесь 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолина и 6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолина в соотношении 1:1, взятая 1% мас. по отношению к топливной смеси, дала прирост на 1,5 ед. (ОЧМ) и 4,5ед. (ОЧИ).
Пример 6.
Смесь 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина и МТБЭ в соотношении 1:5 соответственно, взятая 5% мас. по отношению к топливной смеси, дала прирост на 5 ед. (ОЧМ) и 7,5 ед. (ОЧИ).
Пример 7.
Смесь 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолина и МТБЭ в соотношении 1:5 соответственно, взятая 10% мас. по отношению к топливной смеси, дала прирост ОЧ на 7 ед. (ОЧМ) и 9 ед. (ОЧИ).
Пример 8.
Смесь 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина и изопропилового спирта в соотношении 1:5 соответственно, взятая 10% мас. по отношению к топливной смеси, дала прирост на 5 ед. (ОЧМ) и 7,5 ед. (ОЧИ).
Пример 9.
Смесь 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолина и бутилового спирта в соотношении 1:5 соответственно, взятая 10% мас. по отношению к топливной смеси, дала прирост на 5,2 ед. (ОЧМ) и 7,8 ед. (ОЧИ).
Испытания, проводимые на бензине прямой гонки (из нефти) (ОЧМ) 58 ед.
Пример 1.
6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолин, взятый 1% мас. по отношению к топливу, дал прирост ОЧ на 3 ед. (ОЧМ) и 4,3 ед. (ОЧИ).
Пример 2.
6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолин, взятый 1% мас. по отношению к топливу, дал прирост на 3,4 ед. (ОЧМ) и 6 ед. (ОЧИ)
Пример 3.
6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолин, взятый 1% мас. по отношению к топливу, дал прирост на 4 ед. (ОЧМ) и 7,3 ед. (ОЧИ)
Пример 4.
Смесь 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина и 6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолина в соотношении 1:1, взятая 1% мас. по отношению к топливу, дала прирост на 3,5 ед. (ОЧМ) и 7 ед. (ОЧИ).
Пример 5.
Смесь 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолина и 6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолина в соотношении 1:1, взятая 1% мас. по отношению к топливу, дала прирост на 4,5 ед. (ОЧМ) и 7,5 ед. (ОЧИ).
Пример 6.
Смесь 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина и МТБЭ в соотношении 1:5 соответственно, взятая 5% мас. по отношению к топливу, дала прирост на 7 ед. (ОЧМ) и 9,5 ед. (ОЧИ).
Пример 7.
Смесь 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолина и МТБЭ в соотношении 1:5 соответственно, взятая 10% мас. по отношению к топливу, дала прирост на 10 ед. (ОЧМ) 11,5 ед. (ОЧИ).
Пример 8.
Смесь 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина и изопропилового спирта в соотношении 1:5 соответственно, взятая 10% мас. по отношению к топливу, дала прирост на 8 ед. (ОЧМ) и 9,5 ед. (ОЧИ).
Пример 9.
Смесь 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолина и бутилового спирта в соотношении 1:5 соответственно, взятая 10% мас. по отношению к топливу, дала прирост на 7,2 ед. (ОЧМ) и 10 ед. (ОЧИ).
Сходные результаты получены на образцах БГС (бензина газового стабильного), авиационного бензина, авиационного керосина, товарных бензинов марок АИ 80, АИ 92, АИ 95, АИ 98.
Источники информации
1. Топлива, смазочные материалы, технические жидкости. Ассортимент и применение: Справочник / И.Г.Анисимов, К.М.Бадыштова, С.А.Бнатов и др.: под ред. В.М.Школьникова. Издание второе, переработанное и дополненное. - М.: Издательский центр «Техинформ», 1999. - 596 с: ил.
2. Б.А.Павлов и А.П.Терентьев. Курс органической химии. - М.: Государственное научно-техническое издательство химической литературы, 1961. - 592 с.
3. Е.С.Хотинский. Курс органической химии. - Харьков: Издательство Харьковского Ордена Трудового Красного Знамени Государственного Университета им. А.М.Горького, 1959. - 724 с.
4. Э.Г.Розанцев. Разрушение и стабилизация органических материалов. - М.: Издательство «Знание», 1974. - 64 с.
5. А.Е Чичибабин. Основные начала органической химии. Том I. - М.: Государственное научно-техническое издательство химической литературы, 1963. - 912 с.
6. Н.Л. Глинка. Общая химия. Издание двенадцатое. М.-Л.: Издательство «Химия», 1965. - 688 с.
7. Б.Н.Степаненко. Курс органической химии. Часть I. Алифатические соединения. - М.: Издательство «Высшая школа», 1976. - 448 с.
8. Г.И.Шор, В.А.Винокуров, И.А.Голезбева. Производство и применение присадок к нефтепродуктам в новых условиях хозяйствования. Под ред. И.Г.Фукса. - М.: Издательство «Нефть и газ», 1996. - 44 с.
9. А.С. №152526, Кл. С10L 1/18; С10L 1/26. (СССР). Присадка к бензинам (В.А.Зайцев, А.Н.Несмиянов, К.И.Анисимов, М.О.Лернер, А.А.Егорова и др. - опубл. в БИ 1963, №1.
10. Патент 2032708, Кл. С10L 1/18. (РФ). Антидетонационная присадка к бензину. - опубл. в БИ 1995, №10.
11. К.К.Панок, И.А.Рагозин. Словарь по топливам, маслам, смазкам, присадкам и специальным жидкостям. - М.: Издательство «Химия», 1975. - 326 с.
12. Патент №2064965, Кл. С10L 1/18, 1/20 (РФ). Многофункциональная присадка к бензину «Экстравит-Ф». - опубл. в БИ 1996, №22.
13. Патент №461512, Кл. С10L 1/18. (СССР). Топливная композиция / Херберт Майерхоффер, Вильгельм Шнайдер, Хардо Нюринг и Вольфганг Экспер. - опубл. в БИ 1975, №7.
14. Патент №2078118, Кл. С10L 1/18, 1/22. Многофункциональная присадка к углеводородным топливам для двигателей внутреннего сгорания и топливная композиция, ее содержащая. / Ребров И.Ю., опубл. в БИ 1997, №12.
15. Патент №2184767, Кл. С10L 1/18, С10L 1/22 (РФ). Добавка к бензину и автомобильное топливо, ее содержащее / Аветисян В.Е. Дата публикации: 2002.07.10. Дата публикации формулы изобретения: 2002.07.10.
16. С.Н.Онойченко. Применение оксигенатов при производстве перспективных автомобильных бензинов. - М.: Издательство «Техника» ООО «Тума Групп». 2003. - 64 с.
17. A.M.Данилов. Применение присадок в топливах. - М.: Издательство «Мир», 2005. - 288 с., ил.
1. 6-Этокси-1,2,2,4-тетраметил-1,2-дигидрохинолин из общей формулы (I)
где пунктирной линией обозначена двойная связь в положении 3-4,
R является радикалом СН3,
в качестве компонента, повышающего стойкость углеводородных топлив к детонации.
2. Применение соединений, выбранных из группы соединений формулы (I), включающей 6-этокси-2,2,4-триметил-1,2,3,4-тетрагидрохинолин и 6-этокси-1,2,2,4-тетраметил-1,2-дигидрохинолин и 6-этокси-1,2,2,4-тетраметил-1,2,3,4-тетрагидрохинолин, и их смеси
где пунктирной линией обозначена двойная или одинарная связь в положении 3-4,
R является Н или радикалом СН3,
в качестве компонентов, повышающих стойкость углеводородных топлив к детонации.
3. Топливная композиция, включающая углеводородное топливо и добавку по п.2, повышающую его стойкость к детонации в количестве 0,1-20 мас.% по отношению к углеводородному топливу.
4. Топливная композиция по п.3, отличающаяся тем, что указанную антидетонационную добавку она содержит в смеси с оксигенатами при соотношении: указанная добавка 0,1-95 мас.% и оксигенат до 100%, в количестве 0,5-30 мас.% по отношению к углеводородному топливу.