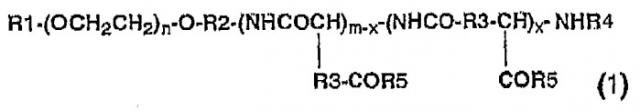Мицеллярный препарат, содержащий малорастворимый в воде противораковый агент, содержащее его противораковое средство и новый блок-сополимер
Иллюстрации
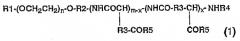
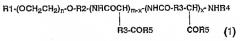
Показать всеИзобретение относится к мицеллярному препарату, образованному из нового блок-сополимера и таксанового противоракового агента, и к противораковому средству, содержащему его в качестве активного ингредиента. Предложен новый мицеллярный препарат, в котором растворимость малорастворимого в воде противоракового агента повышена и который после внутривенного введения обеспечивает сохранение высокой концентрации в крови. Мицеллярный препарат получен из блок-сополимера общей формулы (1):
где R1 представляет собой атом метильную группу; R2 представляет собой триметиленовую группу; R3 представляет собой метиленовую группу; R4 представляет собой ацетильную группу; R5 представляет собой гидроксильную группу, необязательно замещенную арилС2-8алкоксильную группу, замещенную С1-4алкиламиногруппу или аминогруппу, содержащую остаток производного аминокислоты или пептида; n принимает целые значения от 5 до 1000, m принимает целые значения от 2 до 300, и x принимает целые значения от 1 до 300; при условии, что доля гидроксильных групп в R5 составляет от 0 до 99%, и x имеет значение не больше, чем m; и таксанового противоракового агента в концентрации от 0,1 до 50 мас.% из расчета на общую массу агента и блок-сополимера. Препарат имеет высокую медицинскую активность и/или понижает побочные эффекты. 3 н. и 4 з.п. ф-лы, 4 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к мицеллярному препарату, образованному из нового блок-сополимера и малорастворимого в воде противоракового агента, к противораковому средству, содержащему его в качестве активного ингредиента, а также к блок-сополимеру.
Уровень техники
Многие важные лекарства, особенно противораковые агенты, являются гидрофобными соединениями, которые малорастворимы в воде. Чтобы получить требуемые терапевтические эффекты с использованием таких лекарств, обычно необходимо, чтобы лекарства при введении больным были солюбилизированы. Следовательно, солюбилизация малорастворимого в воде противоракового средства является важной методикой для производства их препаратов для перорального или парентерального применения, в особенности при производстве препарата для применения при внутривенном введении.
Одним из способов солюбилизации малорастворимого в воде противоракового агента является добавление поверхностно-активного вещества. Например, полиоксиэтиленовое производное касторового масла (Cremophor) используют для солюбилизации паклитаксела. Другие способы солюбилизации малорастворимого в воде противоракового агента включают использование образующего мицеллы блок-сополимера в качестве носителя для агента, описанного, например, в японских выложенных патентных заявках (KOKAI) №№ 6-107565, 6-206815 и 11-335267 и т.д., и образование содержащей паклитаксел мицеллы с использованием блок-сополимера поли(этиленоксид)-поли(β-бензиласпартат-со-аспарагиновая кислота), описанного в японской выложенной патентной заявке (KOKAI) № 2001-226294.
Однако способ солюбилизации с использованием поверхностно-активного вещества дает вредные побочные эффекты, такие как реакция гиперчувствительности из-за поверхностно-активного вещества, и, кроме того, имеет проблему, заключающуюся в том, что вследствие низкой стабильности препарата имеет место осаждение агента при хранении раствора или когда его оставляют стоять в течение длительного времени.
Кроме того, при внутривенном введении фармацевтического препарата, в котором блок-сополимер используется в качестве носителя для малорастворимого в воде противоракового агента, например, таксанового противоракового агента, не обеспечивается поддержание более высокой концентрации агента в сравнении с введением одного агента, получение повышенных фармакологических эффектов агента и снижение его побочных эффектов.
Таким образом, существует потребность в фармацевтическом препарате, который повышает растворимость в воде малорастворимого в воде противоракового агента, который поддерживает повышенную концентрацию агента и обеспечивает усиление фармакологических эффектов и ослабление побочных эффектов.
Раскрытие изобретения
В результате интенсивных исследований с целью решения описанных выше проблем заявители настоящего изобретения разработали мицеллярный препарат, содержащий новый блок-сополимер и малорастворимый в воде противораковый агент, осуществив, таким образом, настоящее изобретение.
Таким образом, настоящее изобретение относится к:
1) мицеллярному препарату, полученному из блок-сополимера, который представлен ниже общей формулой (1):
где R1 представляет собой атом водорода или С1-5-алкильную группу; R2 представляет собой С1-5алкиленовую группу; R3 представляет собой метиленовую или этиленовую группу; R4 представляет собой атом водорода или С1-4ацильную группу; R5 представляет собой гидроксильную группу, необязательно замещенную арилС2-8алкоксильную группу, замещенную С1-4алкиламиногруппу или аминогруппу, содержащую остаток производного аминокислоты или пептида; n принимает целые значения от 5 до 1000, m принимает целые значения от 2 до 300 и х принимает целые значения от 1 до 300; при условии, что доля гидроксильных групп в R5 составляет от 0 до 99%, и х имеет значение не больше чем m; и малорастворимого в воде противоракового агента;
2) мицеллярному препарату, описанному выше в абзаце 1), где доля гидроксильных групп в заместителях R5 общей формулы (1) составляет от 0 до 90%;
3) мицеллярному препарату, описанному выше в абзаце 1), где в общей формуле (1) R1 представляет собой метильную группу, R2 представляет собой триметиленовую группу, R3 представляет собой метиленовую группу, R4 представляет собой ацетильную группу и R5 представляет собой незамещенную фенилС3-6алкоксильную группу; n принимает целые значения от 20 до 500, m принимает целые значения от 10 до 100, и х принимает целые значения от 1 до 100; при условии, что х имеет значение не больше чем m;
4) мицеллярному препарату, описанному в любом из абзацев 1)-3), где малорастворимый в воде противораковый агент представляет собой таксановый противораковый агент;
5) мицеллярному препарату, описанному выше в абзаце 4), где таксановый противораковый агент представляет собой паклитаксел;
6) противораковому средству, содержащему в качестве активного ингредиента мицеллярный препарат, описанный в любом из абзацев 1)-5);
7) блок-сополимеру, представленному ниже общей формулой (1):
где R1 представляет собой атом водорода или С1-5алкильную группу; R2 представляет собой С1-5алкиленовую группу; R3 представляет собой метиленовую или этиленовую группу; R4 представляет собой атом водорода или С1-4ацильную группу; R5 представляет собой гидроксильную группу, необязательно замещенную арилС2-8алкоксильную группу, замещенную С1-4алкиламиногруппу или аминогруппу, содержащую остаток производного аминокислоты или пептида; n принимает целые значения от 5 до 1000, m принимает целые значения от 2 до 300, и х принимает целые значения от 1 до 300; при условии, что доля гидроксильных групп в R5 составляет от 0 до 99%, и х имеет значение не больше чем m; и
8) блок-сополимеру, описанному в абзаце 7), где в общей формуле (1) R1 представляет собой метильную группу, R2 представляет собой триметиленовую группу, R3 представляет собой метиленовую группу, R4 представляет собой ацетильную группу и R5 представляет собой незамещенную фенилС3-6алкоксильную группу; n принимает целые значения от 20 до 500, m принимает целые значения от 10 до 100 и х принимает целые значения от 1 до 100; при условии, что х имеет значение не больше чем m.
Наилучший способ осуществления изобретения
Мицеллярный препарат по настоящему изобретению получают из блок-сополимера, представленного выше общей формулой (1), (где R1 представляет собой атом водорода или С1-5алкильную группу; R2 представляет собой С1-5алкиленовую группу; R3 представляет собой метиленовую или этиленовую группу; R4 представляет собой атом водорода или С1-4ацильную группу; R5 представляет собой гидроксильную группу, необязательно замещенную арилС2-8алкоксильную группу, замещенную С1-4алкиламиногруппу или аминогруппу, содержащую остаток производного аминокислоты или пептида; n принимает целые значения от 5 до 1000, m принимает целые значения от 2 до 300, и х принимает целые значения от 1 до 300; при условии, что доля гидроксильных групп в R5 составляет от 0 до 99%, и х имеет значение не больше чем m), и малорастворимого в воде противоракового агента.
В блок-сополимере, используемом для мицеллярного препарата по настоящему изобретению, R1 представляет собой атом водорода или С1-5алкильную группу, предпочтительно С1-5алкильную группу. Конкретными примерами С1-5алкильной группы являются метильная, этильная, н-пропильная, изо-пропильная, н-бутильная, втор-бутильная, трет-бутильная, н-пентильная группы и т.д.; особенно предпочтительна метильная группа.
Конкретными примерами С1-5алкиленовой группы в R2 являются метиленовая, этиленовая, триметиленовая, тетраметиленовая группы и т.д.; предпочтительны этиленовая и триметиленовая группы.
Заместитель R3 представляет собой метиленовую или этиленовую группу, предпочтительно метиленовую группу.
R4 представляет собой атом водорода или С1-4ацильную группу, предпочтительно С1-4ацильные группы, представляющие собой формильную, ацетильную, пропионильную, бутилоильную группы или др.; особенно предпочтительна ацетильная группа.
В блок-сополимере, используемом для мицеллярного препарата по настоящему изобретению, R5 представляет собой гидроксильную группу, необязательно замещенную арилС2-8алкоксильную группу, замещенную С1-4алкиламиногруппу или аминогруппу, содержащую остаток производного аминокислоты или пептида, и в одной молекуле заместители R5 могут быть одинаковыми или разными. Доля гидроксильных групп в заместителях R5 составляет от 0 до 99%, предпочтительно от 0 до 90%, более предпочтительно от 15 до 85%, наиболее предпочтительно от 35 до 80%.
АрилС2-8алкоксильная группа может представлять собой линейные или разветвленные С2-8алкоксильные группы, к которым присоединена ароматическая углеводородная группа, такая как фенильная или нафтильная группа, в том числе, например, фенетилокси-, фенилпропокси-, фенилбутокси-, фенилпентилокси-, фенилгексилокси-, фенилгептилокси-, фенилоктилокси-, нафтилэтокси-, нафтилпропокси-, нафтилбутокси- и нафтилпентилоксигруппа.
Заместитель в необязательно замещенной арилС2-8алкоксильной группе может представлять собой низшие алкоксильные группы, такие как метокси-, этокси-, изопропокси-, н-бутокси или трет-бутоксигруппы, атомы галогена, такие как атомы фтора, хлора или брома, нитрогруппу, цианогруппу или др. Число заместителей в необязательно замещенной арилС2-8алкоксильной группе может составлять от одного до максимального числа замещения, и все замещенные арилС2-8алкоксильные группы, в которых замещены все возможные положения, охватываются данным изобретением; однако предпочтительно арилС2-8алкоксильная группа является незамещенной.
Необязательно замещенная арилС2-8алкоксильная группа предпочтительно может представлять собой незамещенные фенилС3-6алкоксильные группы, в том числе незамещенную фенилпропокси-, незамещенную фенилбутокси-, незамещенную фенилпентилокси- или незамещенную фенилгексилоксигруппу; особенно предпочтительной является незамещенная фенилбутоксигруппа.
В заместителе R5 блок-сополимера, представленного общей формулой (1), который используется в мицеллярном препарате по изобретению, замещенная С1-4алкиламиногруппа может представлять собой, например, необязательно замещенную арилС1-4алкиламиногруппу или др. АрилС1-4алкиламиногруппа может представлять собой линейные или разветвленные С1-4алкиламиногруппы, к которым присоединена ароматическая углеводородная группа, такая как фенильная или нафтильная группа, в том числе, например, бензиламино-, фенетиламино-, фенилпропиламино-, фенилбутиламино-, нафтилметиламино-, нафтилэтиламино- или нафтилбутиламиногруппа.
В необязательно замещенной арилС1-4алкиламиногруппе заместитель может представлять собой низшую алкоксильную группу, такую как метокси-, этокси-, изопропокси-, н-бутокси- или трет-бутоксигруппа, атом галогена, такой как атомы фтора, хлора или брома, нитрогруппу, цианогруппу или др. В замещенной арилС1-4алкиламиногруппе, в которой число заместителей составляет от одного до максимального числа замещения, и все замещенные арилС1-4алкиламиногруппы, в которых замещены все возможные положения, охватываются данным изобретением; однако предпочтительно арилС1-4алкиламиногруппа является незамещенной.
Особенно предпочтительными примерами необязательно замещенной арилС1-4алкиламиногруппы являются незамещенная бензиламино-, незамещенная фенетиламиногруппы и т.д.
Заместитель R5 в общей формуле (1) может представлять собой аминогруппу, содержащую остаток производного аминокислоты или пептида. Такая аминогруппа представляет собой первичную аминогруппу, состоящую из производного α- или β-аминокислоты или пептида, в которых две или более аминокислоты соединены через амидную связь. Производное аминокислоты или пептида может представлять собой, например, производное, в котором этерифицирована основная цепь карбоновой кислоты, этерифицирована боковая цепь карбоновой кислоты или гидроксильная группа боковой цепи превращена в простую эфирную группу. Конкретными примерами таких производных являются дибензиласпартат, β-аланил-серин-бензиловый простой эфир бензилового сложного эфира (β-аланил-О-бензил-L-серин-бензиловый эфир) и др.
В блок-сополимере, представленном общей формулой (1), который используется в мицеллярном препарате по настоящему изобретению, n принимает целые значения от 5 до 1000, предпочтительно от 20 до 500, предпочтительно от 80 до 400; m принимает целые значения от 2 до 300, предпочтительно от 10 до 100, в особенности от 15 до 60; х принимает целые значения от 1 до 300, предпочтительно от 1 до 100, особенно от 1 до 60; при условии, что х не больше чем m.
Способ получения блок-сополимера, представленного общей формулой (1), конкретно не ограничен, но может включать, например, введение соединения, в котором R5 представляет собой необязательно замещенную (С2-С8)алкоксильную или замещенную (С1-С4)алкиламиногруппу, в реакцию частичного гидролиза с использованием кислоты или щелочи, как это описано в японской выложенной патентной заявке (KOKAI) №№ 11-335267 и 2001-226294.
Из блок-сополимеров, представленных общей формулой (1), соединение, имеющее в заместителе R5 группы, отличные от гидроксильной группы, также может быть получено реакцией дегидратации с конденсацией соединения общей формулы (1), где все заместители R5 представляют собой гидроксильные группы, с необязательно замещенным арилС2-8спиртом, замещенным С1-4алкиламином или производным аминокислоты или пептида. Необязательно замещенный арилС2-8спирт представляет собой спирт, соответствующий описанной выше необязательно замещенной арилС2-8алкоксильной группе. Замещенный С1-4алкиламин представляет собой амин, соответствующий описанной выше замещенной С1-4алкиламиногруппе.
В качестве необязательно замещенного арилС2-8спирта, замещенного С1-4алкиламина или производного аминокислоты или пептида могут быть использованы коммерчески доступные соединения, или также могут быть использованы соединения, полученные по хорошо известным методикам органического синтеза.
Способ получения соединения, в котором все заместители R5 представляют собой гидроксильные группы, не имеет конкретных ограничений, но может быть использован способ, описанный, например, в японской выложенной патентной заявке (KOKAI) № 6-206815.
Агент дегидратации с конденсацией, используемый в описанной выше реакции дегидратации с конденсацией, может представлять собой, например, агент дегидратации с конденсацией на основе карбодиимида, в том числе 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC·HCl), дициклогексилкарбодиимид (DCC) или диизопропилкарбодиимид (DIPCI).
Агент дегидратации с конденсацией предпочтительно используется в количестве, кратном от 0,1 до 20 молям, предпочтительно кратном 1-5 молям необязательно замещенного С2-8спирта или замещенного С1-4алкиламина. В данном случае также могут сосуществовать гидроксисукцинимид (HOSu), 1-гидроксибензотриазол (HOBt), имид N-гидрокси-5-норборнен-2,3-дикарбоновой кислоты (HOBN), 4-диметиламинопиридин (DMAP), диизопропилэтиламин или др., в количестве, кратном 0,01-20 молям, предпочтительно 0,1-10 молям необязательно замещенного С2-8спирта или замещенного С1-4алкиламина.
Используемое количество необязательно замещенного С2-8спирта или замещенного С1-4алкиламина не имеет конкретного ограничения, но предпочтительно составляет от 0,1 до 5 эквивалентов на один эквивалент карбоксильной группы соединения общей формулы (1), в которой все заместители R5 представляют собой гидроксильную группу.
Реакцию дегидратации с конденсацией предпочтительно проводят в растворителе; в качестве растворителя могут быть использованы различные растворители, такие как, например, N,N-диметилформамид (ДМФА), диметилсульфоксид (ДМСО), диоксан, тетрагидрофуран, вода или их смеси, и конкретных ограничений нет. Количество используемого растворителя не имеет конкретных ограничений, но обычно кратно 1-500 из расчета на массу исходного сополимера.
Реакцию дегидратации с конденсацией проводят предпочтительно при температуре от -10 до 60°С и реакция может быть проведена за 2-48 часов.
Когда блок-сополимер, представленный общей формулой (1), который используется для мицеллярного препарата по настоящему изобретению, содержит карбоксильные группы, соль, полученная ионной диссоциацией части или всех групп, также входит в объем настоящего изобретения. Соль может представлять собой соль щелочного металла, соль щелочноземельного металла, аммонийную соль или органическую аммонийную соль, и, например, конкретными примерами являются натриевая соль, калиевая соль, кальциевая соль, аммониевая соль или триэтиламмониевая соль.
Малорастворимый в воде противораковый агент в мицеллярном препарате по настоящему изобретению относится к таким противораковым агентам, которые по существу не растворяются сами по себе в эквивалентном количестве воды при условиях окружающей среды, таких как комнатная температура или нормальное давление, или которые предпочтительно распределяются в хлороформенную фазу в системе растворителей из равных количеств воды и хлороформа. Такие противораковые агенты могут представлять собой антрациклиновые противораковые агенты, такие как адриамицин, таксановые противораковые агенты, такие как паклитаксел и доцетаксел, vinca-алкалоидные противораковые агенты, такие как винкристин, метотрексат и их производные; предпочтительно используется таксановый противоопухолевый агент, предпочтительно паклитаксел.
Массовое отношение содержания блок-сополимера в мицеллярном препарате по настоящему изобретению к содержанию малорастворимого в воде противоракового агента составляет от 1000:1 до 1:1, предпочтительно от 100:1 до 1,5:1, более предпочтительно от 20:1 до 2:1. Однако когда мицеллярный препарат растворим в воде, агент может присутствовать в наибольшем количестве.
Мицеллярный препарат по настоящему изобретению получают, например, следующими способами.
Способ а: Включение агента путем перемешивания
Малорастворимый в воде противораковый агент, необязательно растворенный в органическом растворителе, смешивающемся с водой, перемешивают и смешивают с водной дисперсией блок-сополимера. В этом случае при перемешивании и смешении может быть использовано нагревание.
Способ b: Испарение растворителя
Малорастворимый в воде противораковый агент в несмешивающемся с водой органическом растворителе смешивают с водной дисперсией блок-сополимера и органический растворитель испаряют с перемешиванием.
Способ с: Диализ
Малорастворимый в воде противораковый агент и блок-сополимер растворяют в смешивающемся с водой органическом растворителе и полученный раствор подвергают диализу против буферного раствора и/или воды с использованием мембраны для диализа.
Способ d: Другой способ
Малорастворимый в воде противораковый агент и блок-сополимер растворяют в несмешивающемся с водой органическом растворителе. Полученный раствор смешивают с водой и перемешивают с образованием эмульсии масло-в-воде (O/W), после чего следует испарение растворителя.
Например, способ получения мицелл по способу с подробно описан в японской выложенной патентной заявке (KOKAI) № 6-107565.
Способы b и d, включающие испарение органического растворителя, описаны, например, в японских выложенных патентных заявках (KOKAI) №№ 11-335267 и 2001-226294.
Если более подробно описывать способы b и d, то несмешивающийся с водой органический растворитель относится к растворителю, имеющему свойства, противоположные свойствам диметилформамида (ДМФА), диметилсульфоксида (ДМСО), ацетонитрила и т.д., которые по существу могут свободно смешиваться с водой и которые используют для получения полимерных мицелл, например, в японской выложенной патентной заявке (KOKAI) № 11-335267, не имеет особенных ограничений и может представлять собой хлороформ, метиленхлорид, толуол, н-гексан или их смесь.
Несмешивающийся с водой органический растворитель смешивают с водной средой, например, с водой (в том числе с очищенной водой или ионообменной водой) или изотонированным или забуференным водным раствором, содержащим сахарид, стабилизатор, хлорид натрия, буферный агент или др. В данном случае смешивающийся с водой органический растворитель или другие неорганические соли (например, сульфат натрия) могут содержаться в небольшом количестве, которое не оказывает отрицательного влияния на образование эмульсии O/W.
Несмешивающийся с водой органический растворитель и водную среду обычно смешивают таким образом, чтобы установить объемное отношение 1:100, предпочтительно, 1:20. В качестве перемешивающих средств могут быть использованы обычно используемые средства для получения различных эмульсий, например, механические мешалки, шейкеры, ультразвуковые излучатели или др. В этом случае рабочая температура конкретно не ограничена, но предпочтительно она устанавливается в интервале приблизительно от -5 до 40°С в зависимости от температуры разложения агента, температуры кипения растворителя и т.д.
Затем описанную выше операцию перемешивания продолжают в открытой системе, или органический растворитель упаривают (или испаряют) при пониженном давлении с перемешиванием.
Водный раствор мицеллярного препарата может быть отфильтрован от нерастворимого материала или осажден сразу же или после обработки ультразвуком, если мицеллярный препарат, как полагают, может быть ассоциирован или образует агрегаты. Фильтрующая пленка не имеет особенных ограничений, но предпочтительна пленка с размером пор от 0,1 до 1 мкм.
Мицеллярный препарат по настоящему изобретению стабилен в водной среде и может обеспечить в воде высокую концентрацию малорастворимого в воде противоракового агента по сравнению с вариантами без использования добавки. Кроме того, чтобы повысить концентрацию такого содержащего агент мицеллярного препарата, может быть также проведено обогащение за счет пониженного давления или ультрафильтрации, лиофилизации или др.
В мицеллярном препарате концентрация агента составляет от 0,1 до 50 мас.%, предпочтительно от 1 до 40 мас.%, особенно предпочтительно от 5 до 35 мас.% из расчета на общую массу агента и блок-сополимера; таким образом, количество агента может составлять приблизительно 0,01 мг или более, предпочтительно приблизительно 1 мг или более, более предпочтительно приблизительно 2 мг или более в 1 мл водного раствора мицеллярного препарата.
Мицеллярный препарат по настоящему изобретению может находиться в форме мицеллы типа ядро-оболочка, в которой структурная часть полиэтиленгликоля обращена наружу в водную среду, и содержит малорастворимый в воде противораковый агент в гидрофобной части внутри мицеллы. В случае мицеллы типа ядро-оболочка, размер частиц может быть измерен с использованием коммерчески доступного светорассеивающего прибора для измерения размера частиц (например, Otsuka Electronics., Ltd., Model DLS-7000DH); средний размер частиц составляет от 10 до 200 нм, предпочтительно от 20 до 100 нм.
Противораковое средство, использующее в качестве активного ингредиента описанный выше содержащий противораковый агент мицеллярный препарат, также входит в объем данного изобретения. Когда мицеллярный препарат вводят в виде фармацевтического препарата, его дозу определяют в зависимости от возраста, массы и патологии больного, терапевтической цели и т.д.; однако его терапевтически эффективное количество составляет приблизительно от 50 до 500 мг/массу тела/день. Вводимый фармацевтический препарат не имеет особенных ограничений до тех пор, пока он содержит мицеллярный препарат, растворенный в фармацевтически приемлемом растворителе, и может содержать фармакологически приемлемые добавки. Мицеллярные препараты по настоящему изобретению также включают лиофилизованные препараты.
Кроме того, настоящее изобретение охватывает блок-сополимер, используемый в описанном выше мицеллярном препарате.
ПРИМЕРЫ
Настоящее изобретение дополнительно описано со ссылкой на конкретные примеры препаратов. Однако изобретение не ограничивается этими примерами.
В указанных примерах этанол обозначают EtOH; диизопропиловый эфир - IPE; 4-диметиламинопиридин - DMAP; N-гидроксисукцинимид - HOSu; и высокоэффективную жидкостную хроматографию - ВЭЖХ.
Пример 1: Получение блок-сополимера 6
К 3,65 г ПЭГ (средняя молекулярная масса: 12000)-pAsp (средняя степень полимеризации: 35)-Ас (соединение общей формулы (1), где R1 представляет собой метильную группу, R2 представляет собой триметиленовую группу, R3 представляет собой метиленовую группу, R4 представляет собой ацетильную группу, R5 представляет собой гидроксильную группу; n составляет приблизительно 272, m составляет приблизительно 35 и x составляет приблизительно 26; далее обозначается как ПЭГ-pAsp-Ac), полученному как описано в японской выложенной патентной заявке (KOKAI) № 6-206815, добавляют 70 мл ДМФА для растворения при 35°С, к которому затем добавляют DMAP (745 мг), 4-фенил-1-бутанол (1,17 мг) и DIPCI (1,19 мл), после чего проводят реакцию в течение 26 час. Реакционную жидкость перед фильтрацией и выделением осадка добавляют по каплям к 700 мл смеси IPE:EtOH (4:1), после чего сушат при пониженном давлении, получают 3,19 г сырых кристаллов. Такие сырые кристаллы растворяют в 50%-ном водном растворе ацетонитрила, который затем пропускают через 40 мл катионообменной смолы DOWEX 50w8 (производство Mitsubishi Chemical Corporation), после чего следует промывка 50%-ным водным ацетонитрилом. Элюат концентрируют в вакууме и затем лиофилизуют, получают 3,85 г блок-сополимера 6.
Блок-сополимер 6 (25,2 мг) растворяют в 2 мл ацетонитрила, к которому добавляют 2 мл 0,5 н. раствора гидроксида натрия, после чего перемешивают при комнатной температуре 20 мин. После нейтрализации 0,5 мл уксусной кислоты объем жидкости доводят до 5 мл, после чего определяют количество свободного 4-фенил-1-бутанола с помощью ВЭЖХ. По данным анализа количество связанного сложноэфирной связью 4-фенил-1-бутанола составляет 44% относительно полиаспарагиновой кислоты.
Пример 2: Получение блок-сополимера 7
По аналогичной методике, что и в примере 1, 3,56 г блок-сополимера 7 получают с использованием ПЭГ-pAsp-Ac и 0,3-кратного количества 4-фенил-1-бутанола (0,36 мл), что и в примере 1.
По данным анализа после проведения аналогичной операции гидролиза, что и в примере 1, количество связанного сложноэфирной связью 4-фенил-1-бутанола составляет 22% относительно полиаспарагиновой кислоты.
Пример 3: Получение блок-сополимера 8
3,02 г ПЭГ (средняя молекулярная масса: 5000)-pAsp (средняя степень полимеризации: 30)-Ас (соединение общей формулы (1), где R1 представляет собой метильную группу, R2 представляет собой триметиленовую группу, R3 представляет собой метиленовую группу, R4 представляет собой ацетильную группу, R5 представляет собой гидроксильную группу; n составляет приблизительно 110, m составляет приблизительно 30 и x составляет приблизительно 22; далее обозначается как ПЭГ*-pAsp*-Ac), полученный, как описано в японской выложенной патентной заявке (KOKAI) № 6-206815, используют для проведения реакции конденсации с 4-фенил-1-бутанолом (1,45 мл) по методике, аналогичной методике примера 1, получают 3,05 г блок-сополимера 8.
По данным анализа после проведения аналогичной операции гидролиза, что и в примере 1, количество связанного сложноэфирной связью 4-фенил-1-бутанола составляет 50% по отношению к полиаспарагиновой кислоте.
Пример 4: Получение блок-сополимера 9
По аналогичной методике, что и в примере 1, получают 2,74 г блок-сополимера 9 с использованием 3,04 г ПЭГ*-pAsp*-Ac и 0,3-кратного количества 4-фенил-1-бутанола (0,44 мл), что и в примере 3.
По данным анализа после проведения аналогичной операции гидролиза, что и в примере 1, количество связанного сложноэфирной связью 4-фенил-1-бутанола составляет 25% по отношению к полиаспарагиновой кислоте.
Пример 5: Получение блок-сополимера 10
По аналогичной методике, что и в примере 1, получают 233 мг блок-сополимера 10 с использованием 200 мг ПЭГ-pAsp-Ac и 6-фенил-1-гексанола (80,1 мкл) вместо 4-фенил-1-бутанола, используемого в примере 1.
По данным анализа после проведения аналогичной операции гидролиза, что и в примере 1, количество связанного сложноэфирной связью 6-фенил-1-гексанола составляет 48% по отношению к полиаспарагиновой кислоте.
Пример 6: Получение блок-сополимера 13
В 4 мл ДМФА растворяют 200 мг ПЭГ-pAsp-Ac, к которому затем добавляют 49,8 мг HOSu, 23,6 мкл бензиламина и 74,6 мкл DIPCI, после чего проводят реакцию при 35°С в течение 4 час. Перед перемешиванием в течение 15 мин к реакционной жидкости добавляют 100 мкл дистиллированной воды, затем перед фильтрацией и выделением осадка добавляют 60 мл смеси IPE:EtOH (9:1), после чего сушат при пониженном давлении, получают 189 мг блок-сополимера 13.
Определяют количество бензиламина, оставшегося в реакционной жидкости; по результатам расчета на основе полученных данных количество связанного амидной связью бензиламина, составляет 61% по отношению к полиаспаргиновой кислоте.
Пример 7: Получение блок-сополимера 15
По аналогичной методике, что и в примере 6, получают 3,35 г блок-сополимера 15 с использованием дибензил-L-аспартаттолуолсульфоната (715 мг) и диизопропилэтиламина (257 мкл) вместо бензиламина, используемого в примере 6, и 3,09 г ПЭГ-pAsp-Ac.
Гидролизом в аналогичных условиях, что и в примере 1, для анализа определяют количество свободного бензилового спирта; количество дибензил-L-аспартата, связанного амидной связью с блок-сополимером 15, составляет 23% по отношению к полиаспарагиновой кислоте.
Пример 8: Получение блок-сополимера 16
По аналогичной методике, что и в примере 6, получают 1,49 г блок-сополимера 16 с использованием гидрохлорида β-аланил-О-бензил-L-серинбензилового эфира (321 мг), который может быть получен обычным способом синтеза дипептидов, и диизопропилэтиламина (142 мкл) вместо бензиламина, используемого в примере 6, и ПЭГ-pAsp-Ac (1,51 г).
По данным анализа с использованием аналогичного способа, что и в примере 7, количество β-аланил-О-бензил-L-серинбензилового эфира, связанного амидной связью с блок-сополимером 16, составляет 26% по отношению к аспарагиновой кислоте.
Пример 9: Получение мицеллярного препарата паклитаксела 10
В винтовой пробирке взвешивают 300 мг блок-сополимера 6 примера 1 (блок-сополимер, конденсированный с 4-фенил-1-бутанолом), к которому перед перемешиванием с образованием дисперсии добавляют 30 мл водного раствора мальтозы 40 мг/мл, затем охлаждают до 4°С при перемешивании. Затем добавляют 3 мл раствора паклитаксела в дихлорметане (30 мг/мл) перед перемешиванием, не закрывая герметично, в холодильнике в течение 16 час, после чего обрабатывают ультразвуком (130 В, импульс 1 сек, 10 мин). Добавляют Macrogol 4000 до концентрации 20 мг/мл для растворения, после чего фильтруют в стерильных условиях, получают мицеллярный препарат 10.
Концентрация паклитаксела составляет 2,8 мг/мл. Средний размер частиц составляет 86,6 нм при определении с помощью динамического светорассеивающего фотометра (Otsuka Electronics, Co., Ltd., Model DLS-7000DH).
Аналогично описанные в примерах блок-сополимеры используют для получения мицеллярных препаратов паклитаксела. Полученные результаты представлены в таблице 1.
| Таблица 1 | |||
| Мицеллярные препараты | |||
| Мицеллярный препарат | Блок-сополимер | Концентрация агента (мг/мл) | Размер частиц (нм) |
| 10 | 6 | 2,8 | 86,6 |
| 11 | 7 | 3,1 | 97,8 |
| 12 | 8 | 2,8 | 53,3 |
| 13 | 9 | 3,0 | 85,3 |
| 18 | 15 | 2,0 | 85,1 |
| 19 | 15 | 4,5 | 20,1 |
| 20 | 16 | 2,0 | 28,8 |
Сравнительный пример
В соответствии с японской выложенной патентной заявкой (KOKAI) № 6-107565 10 г производного полиэтиленгликоля, содержащего метоксигруппу на одном конце и аминогруппу на другом конце, и коммерчески доступный ангидрид β-бензил-L-аспартат-N-карбоновой кислоты растворяют в 80 мл смешанного растворителя ДМФА/ДМСО (50%/50%) для проведения реакции при 40°С в течение 24 час с защитой от света с помощью алюминиевой фольги. Затем реакционный раствор добавляют по каплям к 660 мл смешанного растворителя н-гексан/этилацетат (50%/50%) для переосаждения полимера. Проводят три серии операции переосаждения, после чего сушат при пониженном давлении в течение 24 час, получают приблизительно 19 г блок-сополимера поли(этиленоксид; средняя молекулярная масса: 12000)-поли(β-бензил-L-аспартат; средняя степень полимеризации:50).
В 100 мл ацетонитрила растворяют 10 г полученного блок-сополимера, к которому добавляют 22,72 мл 0,5 н. водного раствора гидроксида натрия для проведения гидролиза при комнатной температуре в течение 10 мин. Реакцию останавливают путем добавления 3,79 мл 6 н. соляной кислоты, после чего переносят реакционную жидкость к мембране для диализа (Spectra/Por7, MWCO 3,500) для проведения диализа относительно 3,3 л ионообменной смолы в течение 9 час или более (ионообменную воду заменяют три или более раза). По окончании диализа проводят фильтрацию с использованием фильтровальной бумаги № 5В (Kiriyama Glass Works Co., 4 мкм), после чего следует лиофилизация с получением приблизительно 9 г блок-сополимера поли(этиленоксид)поли(β-бензил-L-аспартат-со-аспарагиновая кислота), приблизительно 50% которого гидролизовано.
В винтовой пробирке отвешивают 300 мг полученного блок-сополимера, перед перемешиванием для получения дисперсии добавляют 30 мл водного раствора мальтозы (40 мг/мл), затем охлаждают до 4°С с дополнительным перемешиванием. Перед перемешиванием в холодильнике в течение 16 час без герметичного закрывания добавляют 3 мл раствора паклитаксела в дихлорметане (20 мг/мл), после чего обрабатывают ультразвуком (130 В, импульс 1 сек, 10 мин).
Часть образца отбирают и определяют размер частиц с использованием динамического светорассеивающего фотометра (Otsuka Electronics., Co., Ltd., Model DLS-7000DH). Средний размер частиц составляет 107 нм.
Затем перед фильтрацией в стерильных условиях добавляют Macrogol 4000 до концентрации 20 мг/мл для растворения, затем лиофилизуют с получением мицеллярного препарата сравнительного примера.
Пример испытания 1: In vivo противоопухолевый эффект относительно Colon 26
Самок мышей CDF1 заражают подкожным введением в область спины клеток рака прямой кишки мышей Colon 26 и с момента, когда объем опухоли достигнет приблизительно 100 мм3, мицеллярный препарат 10 по настоящему изобретению, мицеллярную композицию сравнительного примера или паклитаксел вводят через хвостовую вену мышей в течение последующих 5 дней для оценки воздействия на развивающийся рак. Каждый агент используют непосредственно или после разбавления перед применением физиологическим раствором. Концентрацию каждого агента выражают из расчета на паклитаксел. Противоопухолевый эффект агента оценивают на основе процента среднего объема опухоли в обработанной группе относительно среднего объема опухоли в необработанной группе (Т/С%) через 11 дней после лечения агентом. Полученные результаты представлены в таблице 2.
| Таблица 2 | ||
| Противоопухолевое действие относительно рака прямой кишки мышей Colon 26 | ||
| Вводимый агент | Доза (мг/кг) | Т/С (%) |
| Мицеллярный препарат 10 | 30 | 13,4 |
| Мицеллярный препарат сравнительного примера | 30 | 42,2 |
| Паклитаксел | 30 | 37,5 |
| Паклитаксел | 30 | 40,0 |
Как показано в таблице 2, паклитаксел отдельно дает степень сокращения опухоли 37,5% или 40,0% в группе, обработанной 30 мг/кг, по сравнению с необработанной группой через 11 дней после лечения; мицеллярный препарат типа бензилового эфира сравнительного примера показывает степень сокращения опухоли 42,2%, демонстрируя почти такой же эффект, что и один паклитаксел; однако мицеллярный препарат 10 по настоящему изобретению дает степень сокращения опухоли до 13,