Способ получения трансгенных растений табака с повышенным содержанием пролина
Иллюстрации
Показать всеИзобретение относится к генетической инженерии растений. Конструируют рекомбинантную плазмидную ДНК pBi-2E, размером 14099 п.н., обеспечивающую перенос целевой последовательности ДНК в геном растений и экспрессию двуцепочечного супрессора гена PDH, состоящую из следующих элементов:
- ДНК векторной плазмиды размером 14758 п.н.
- фрагмента ДНК, содержащего первый экзон гена PDH в прямой ориентации размером 545 п.н.
- фрагмента ДНК, содержащего первый экзон и фрагмент первого интрона гена PDH размером 691 п.н. в обратной ориентации;
- 35S CaMV промотора из генома вируса мозаики цветной капусты;
- 3'НТР области гена нопалинсинтазы.
Плазмиду pBi-2E затем переносят в штамм Agrobacterium tumefaciens AGLO с последующей прямой трансформацией листовых дисков Nicotiana tabacum SRI сокультивацией с агробактерией. Отбор и генерацию производят непосредственно на средах, содержащих NaCl. Способ позволяет получать трансгенные растения табака без использования антибиотиков, обладающие увеличенной стрессоустойчивостью за счет повышенного содержания в них пролина. 3 ил., 1 табл.
Реферат
Изобретение относится к области биотехнологии, в частности к генетической инженерии высших растений, и касается способа получения трансгенных растений табака с повышенным содержанием пролина.
Известны два способа получения трансгенных растений с модифицированным метаболизмом пролина: с помощью повышения экспрессии гена Δ1-пирролин-5-карбоксилатсинтетазы (P5CS), отвечающего за синтез пролина (Hu С-А.A., Delauney A.J., Verma D. P.S. // Proc. Natd. Acad. Sci. USA. 1992. V.89. P.9354-9358), либо снижения активности фермента пролиндегидрогеназы, определяющего скорость деградации пролина (Kiyosue Т., Yoshiba Y., Yamagichi-Shinozaki К., Shinozaki К // Plant Cell. 1996. V.8. P.1323-1335). Основным недостатком данных способов является низкая экологическая безопасность, поскольку отбор трансформантов производят на средах, содержащих антибиотик (канамицин).
Наиболее ближайшим к заявленному способу прототипом является способ получения трансгенных растений табака, экспрессирующих кДНК гена пролиндегидрогеназы (PDH) в антисмысловой (обратной) ориентации, отвечающий за деградацию пролина (Nanjo Т., Kobayashi M., Yoshiba Y. et. al. // FEBS Lett. 1999. V.461. P.205-210). Способ заключается в клонировании кДНК гена PDH из арабидопсиса (Arabidopsis thaliana) в антисмысловой ориентации под контролем конститутивного промотора 35S из вируса мозаики цветной капусты, передаче полученной рекомбинантной плазмиды в штамм агробактерии (Agribacterium tumefaciens) и получении трансгенных растений арабидопсиса (Arabidopsis thaliana) с помощью отбора и генерации на селективной среде с канамицином.
Основными недостатком прототипа являются:
1. Необходимость введения в геном растений гена устойчивости к канамицину в составе Т-ДНК рекомбинантной плазмиды, который не играет никакой другой функциональной роли кроме возможности отбора.
2. Использование для отбора трансгенных растений селективной среды с добавлением антибиотика канамицина, что не позволяет классифицировать растения на повышенное содержание пролина, связанное со стрессоустойчивостью.
Технической задачей настоящего изобретения является упрощение способа за счет оптимизации генетической конструкции для трансформации растений и повышение его экологической безопасности.
Поставленная техническая задача достигается предлагаемым способом, заключающимся в следующем.
Конструируют рекомбинантную плазмидную ДНК путем выделения первого экзона гена PDH из генома арабидопсиса (Arabidopsis thaliana) с помощью ПЦР со специфическими праймерами с последующим соединением фрагментов в прямой и обратной ориентациях в полилинкере Т-ДНК области бинарной векторной плазмиды рВi121. В результате получают рекомбинантную плазмидную ДНК pBi-2E, размером 14099 п.н., обеспечивающую перенос целевой последовательности ДНК в геном растений и экспрессию двуцепочечного супрессора гена PDH.
Рекомбинантная плазмида состоит из следующих элементов:
- ДНК векторной плазмиды размером 14758 п.н.
- фрагмента ДНК, содержащего первый экзон гена PDH в прямой ориентации размером 545 п.н.
- фрагмента ДНК, содержащего первый экзон и фрагмент первого интрона гена PDH размером 691 п.н. в обратной ориентации;
- Промотора 35S РНК из генома вируса мозаики цветной капусты;
- 3'НТР области гена нопалинсинтазы.
Сконструированную рекомбинантную плазмиду pBi-2E, несущую последовательность гена PDH, переносят в штамм агробактерии (Agrobacterium tumefaciens) AGLO с последующей прямой трансформацией листовых дисков табака (Nicotiana tabacum) SR1 сокультивацией с агробактерией с последующим отбором и генерацией непосредственно на средах, содержащих NaCl.
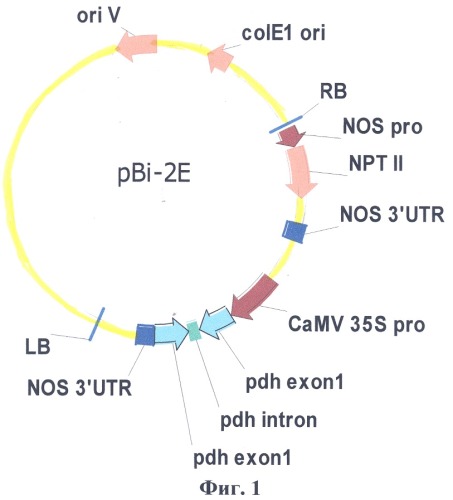
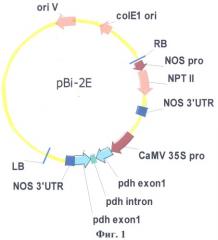
Физическая карта плазмиды pBi-2E с указанием генетических маркеров приведена на фиг.1, где pdh exoni - нуклеотидная последовательность первого экзона гена PDH арабидопсиса; pdh intron - фрагмент первого интрона гена PDH арабидопсиса; CaMV 35S pro - промотор гена 35S РНК вируса мозаики цветной капусты; NOS 3'UTR-3'-нетранслируемый район гена нопалинсинтазы из Ti-плазмиды агробактерии (Agrobacterium tumefaciens); NOS pro - промотор гена нопалинсинтазы; NPTII-ген неомицинфосфотрансферазы II; LB, RB - левая и правая границы Т-ДНК области.
Определяющими отличительными признаками заявляемого способа по сравнению с прототипом, являются:
1. В качестве векторной плазмиды используют вектор рВi121, в котором ген β-глюкуронидазы был заменен на последовательности гена PDH, соединенных в прямой и обратной ориентациях, что позволило получить конструкцию меньшего размера, более оптимальную для трансформации.
2. Используют двуцепочечный супрессор, что более эффективно, чем использование антисмыслового для подавления активности генов (Wang M-B. and Waterhouse Р.М. // Plant Molecular Biology. 2000. V.43. P.67-82). В прототипе был использован вектор рВЕ2113, где кДНК гена PDH в антисмысловой ориентации была встроена перед геном β-глюкуронидазы.
3. Отбор трансгенных растений осуществляют непосредственно на стрессовом фоне, а именно на среде, содержащей 250 mM NaCl.
Изобретение поясняется следующими примерами конкретного выполнения способа.
Пример 1
Конструирование рекомбинантной плазмиды pBi-2E
Конструирование двуцепочечного супрессора в составе вектора pBi121 осуществляли посредством тройного лигирования. В конструкцию собирали три фрагмента: первый экзон гена пролиндегидрогеназы, первый экзон гена PDH с частью первого интрона и фрагмент плазмиды pBi121, содержащий в Т-области ген NPTII, промотор 35S РНК вируса мозаики цветной капусты и 3'-нетранслируемый район гена нопалинсинтазы, включающий сигнал полиаденилирования. Первый экзон гена PDH арабидопсиса был получен с помощью ПЦР (праймеры: 5'-aacaaactggatccggcgatcttac-3'; 5'-gagatgttggtctagatttggcagc-3') и клонирован в плазмиде pBlueScript KSII по сайтам рестрикции BamHI и XbaI. Далее его выделяли с помощью рестриктаз BamHI и HindIII; ПЦР-ный фрагмент первого экзона гена PDH с частью первого интрона гидролизовали рестриктазой HindIII, плазмиду pBi121 гидролизовали рестриктазами BamHI и Есl136II. Продукты рестрикции разделяли в 1% агарозном геле, гель окрашивали раствором бромистого этидия в воде (1 мкг/мл) и методом сорбции ДНК на силикагеле выделяли необходимые фрагменты, которые далее обрабатывали ДНК-лигазой, и лигазной смесью трансформировали компетентные клетки Е. coli XL1 Blue. Трансформанты высевали на чашку с LB-агаром, содержащим 50 мкг/мл канамицина. Клоны, несущие рекомбинантные плазмиды со встроенным геном, отбирали методом ПЦР анализа ДНК отдельных колоний E.coli с праймерами на нуклеотидную последовательность первого экзона гена PDH арабидопсиса.
Пример 2
Получение трансгенных растений, несущих конструкцию pBi-2E
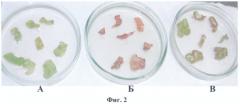
Полученная по примеру 1 конструкция pBi-2E, несущая последовательность гена PDH, была использована для прямой трансформации клеток Agrobacterium tumefaciens штамма AGLO известным способом, описанным в (Horsch R., Fry J., Hoffman N. et al. // Plant Molecular Biology Manual. Dordrecht. Kluwer Academic Publishers. 1988, P.A5/1-A5/9). Для агробактериальной трансформации в качестве исходных эксплантов использовали листья трехнедельных растений табака (Nicotiana tabacum) SR1. Отбор трансформантов проводили на питательной среде с добавлением 250 mM NaCl. На фиг.2 представлены результаты селекции листовых дисков табака, трансформированных конструкцией pBi-2E и контрольной pBi101, которая представляет базовый вектор, без целевого гена, где
А - трансформация конструкцией pBi101, отбор на канамицине;
Б - трансформация конструкцией pBi101, отбор на среде, содержащей 250 mM NaCl;
В - трансформация pBi-2E, отбор на среде, содержащей 250 mM NaCl.
Листовые диски после агробактериальной трансформации были перенесены на среду Мурашиге и Скуга (МС) (Murasige Т., Skoog F. // Physiol. Plant. 1962, V.15, P.473-497), содержащую 250 mM NaCl. На фиг.2 В видно, что каллусообразование на листовых дисках с конструкцией pBi-2E на среде с 250 mM NaCl несколько угнеталось. Листовые диски с контрольной конструкцией pBi101 на среде с 250 mM NaCl (фиг.2Б) полностью некротизировались, а на среде с канамицином развивались нормально (фиг.2А).
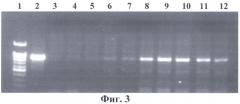
На фиг.3 представлена электрофореграмма ПЦР-анализа геномной ДНК проростков трансгенных растений на наличие встройки 35S промотора вируса мозаики цветной капусты с фрагментом гена PDH в антисмысловой ориентации. Нанесения по дорожкам: 1 - маркерная ДНК; 2 - вектор pBi-2E; 3 - нетрансгенный табак SR1; 4-12 - трансгенные табаки SR1. Из фиг.3 видно, что ПЦР-анализ с праймерами на нуклеотидную последовательность первого экзона PDH подтверждает наличие нуклеотидной последовательности PDH арабидопсиса в геномах отобранных растений.
Трансформанты, несущие рекомбинантную плазмиду pBi-2E, были проанализированы на содержание свободного пролина в листовой ткани. Для измерения использовались растения одного возраста (2-3 недели), выращенные стерильно в условиях климатокамеры, листья отбирались приблизительно одного размера с одного уровня растений в каждом эксперименте. Содержание пролина в листовых экстрактах оценивалась по методу Бэйтса (Bates L.S., Waldren R.P., Teare I.D. // Plants and Soil. 1973. V.39. P.205-207) в микрограммах (мкг) свободного пролина на грамм сырой массы (гсм) образца. Результаты измерений приведены в таблице.
| Таблица | |||
| №№ | Трансгенное растение | мкг/гсм | |
| Опыт | Контроль | ||
| 1 | 2Е №10 | 433 | |
| 2 | 2Е №11 | 715 | |
| 3 | 2Е №13 | 818 | |
| 4 | 2Е №14 | 1128 | |
| 5 | 2Е №16 | 958 | |
| 6 | 2Е №17 | 511 | |
| 7 | pBi №1 | 98 | |
| 8 | pBi №2 | 240 |
Из представленных в таблице данных видно, что полученные трансгенные растения табака, несущие рекомбинантную плазмиду pBi-2E, имеют повышенный в несколько раз уровень содержания пролина по сравнению с контрольными растениями.
Таким образом, способ позволяет получать трансгенные растения табака, несущие последовательность первого экзона гена PDH в прямой и обратной ориентациях, с повышенным содержанием пролина.
Способ получения трансгенных растений табака с повышенным содержанием пролина, включающий конструирование рекомбинантной плазмидной ДНК, содержащей последовательность гена пролин дегидрогеназы (PDH) из Arabidopsis thaliana, передачу полученной плазмидной ДНК в штамм Agrobacterium tumefaciens, инфицирование последним растительного материала, отбор трансгенных растений на селективной питательной среде с последующим тестированием отобранных трансформантов на повышенное содержание пролина, отличающийся тем, что конструируют и передают в штамм указанной бактерии рекомбинантную плазмидную ДНК pBi-2E, состоящую из следующих элементов:
ДНК векторной плазмиды рВI121, не содержащей ген бета-глюкуронидазы;
фрагмента ДНК, содержащего первый экзон гена PDH в прямой ориентации размером 545 п.н;
фрагмента ДНК, содержащего первый экзон и фрагмент первого интрона гена PDH размером 691 п.н. в обратной ориентации;
35S CaMV промотора из генома вируса мозаики цветной капусты;
3'НТР области гена нопалинсинтазы, при этом отбор трансгенных растений осуществляют на питательной среде, содержащей 250 mM NaCl и не содержащей антибиотики.