Способ выделения белков токсин-корегулируемых пилей адгезии и ompu холерного вибриона классического биовара
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Получают клеточную массу холерного вибриона, удаляют с поверхности клеток белки орбитальным вращением бактериальной массы со скоростью 2500 об/мин в течение 2 минут на вортексе. Фракционируют клеточную массу низкоскоростным центрифугированием при 3-4 тыс. об/мин. Надосадок фракционируют высокоскоростным центрифугированием при 18-20 тыс. об/мин. Избирательно экстрагируют осадок для получения супернатанта, содержащего очищенные белки ТКПА и OmpU, раствором 125 мМ этаноламина (рН 10,5) при 4°С на шейкере. Выделяют белки токсин-корегулируемых пилей адгезии и OmpU из супернатанта. 1 н. и 2 з.п. ф-лы, 3 ил.
Реферат
Изобретение относится к биотехнологии и касается выделения белков токсин-корегулируемых пилей адгезии (ТКПА) и OmpU холерного вибриона классического биовара, которые являются важными протективными антигенами, из штаммов холерного вибриона классического биовара и могут быть использованы при создании специфических иммунодиагностических и профилактических препаратов.
Предпосылки для создания изобретения.
Известно, что адгезия в тонком кишечнике является первой стадией в заселении и последующем патогенезе Vibrio cholerae, а эффективная колонизация тонкого кишечника вибрионами в значительной мере обеспечивается наличием у них токсин-корегулируемых пилей адгезии. Наряду с ТКПА в колонизации холерного вибриона к эпителиоцитам кишечника принимают участие белки внешней мембраны, в том числе OmpU, который может составлять до 60% всех белков внешней мембраны. Белки ТКПА и OmpU являются важными протективными антигенами, формирующими антиколонизирующий иммунитет, что предотвращает инфекционный процесс на его первой стадии - колонизации. Очищенные белки ТКПА и OmpU могут быть использованы при создании более эффективных вакцинных препаратов против холеры. Кроме применения в химических вакцинах очищенные белки токсин-корегулируемых пилей адгезии и OmpU могут быть использованы для получения антисывороток, которые являются основой диагностических тест-систем, необходимых для определения присутствия ТКПА в природных штаммах холерного вибриона классического биовара и вакцинных препаратах.
Известен способ выделения белков наружной мембраны Pseudomonas aeruginosa путем экстракции тритоном, этилендиаминтетрауксусной кислотой и лизоцимом. При этом были получены белки наружной мембраны и нековалентно связанный с пептидогликаном протеин (Hancock R.E., Costerton J.W., Carey A.M. J. Bacteriol. 1981. P.628-631). Недостатком данного способа является то, что полученный комплексный белковый препарат содержит значительную группу биополимеров.
Известен также способ выделения и очистки белка внешней мембраны CD из штамма Moraxella catarrhalis, включающий разрушение клеточной массы, центрифугирование, экстракцию осадка тритоном Х-100, додецилсульфатом натрия, солюбилизацией в мочевине, диализ и использование очищенного белка для иммунизации людей. Однако данный способ является сложным и трудоемким и предполагает выделение одного белка внешней мембраны (патент на изобретение RU №2186582, опубликован 10.08.2002).
Известен способ выделения белка 39 кДа наружной мембраны возбудителя мелиоидоза методом обработки клеточной суспензии ультразвуком, центрифугированием препарата клеточных мембран в ступенчатом градиенте плотности сахарозы для изоляции наружной мембраны, последующей очисткой белка гель-хроматографией и препаративным электрофорезом (патент на изобретение RU №2208445, опубликован 20.07.2003). Однако и в данном случае способ позволяет выделять только один белок наружной мембраны.
Известен способ выделения белка токсин-корегулируемых пилей адгезии из штаммов холерного вибриона классического биовара (Sun D. et al. J. Infect. Dis. 1990. V.161. P.1231-1236; Taylor R.K. et al. PNAS USA. 1987. V.84, N9. P.2833-2837), включающий выращивание клеток холерного вибриона в оптимальных для синтеза ТКПА условиях - 30°С с аэрацией, суспендирование бактерий в трис-HCl буфере и последующее разрушение клеток продавливанием через иглу. Неразрушенные клетки удаляют низкоскоростным центрифугированием, а белок ТКПА осаждается высокоскоростным центрифугированием и солюбилизируется в этаноламине. Для освобождения белка ТКПА от этаноламина проводят хроматографию. Однако разработанный способ предназначен для получения одного из протективных белков холерного вибриона - токсин-корегулируемых пилей адгезии.
Проведенный поиск по патентной и научно-технической литературе показал, что в настоящее время не существует способа, позволяющего выделять одновременно два протективных белка холерного вибриона.
Для создания диагностических тест-систем, а также эффективных химических холерных вакцин необходимы биологические препараты, содержащие два протективных белка холерного вибриона - ТКПА и OmpU.
Задачей изобретения является выделение основных протективных белков токсин-корегулируемых пилей адгезии и OmpU из штаммов холерного вибриона классического биовара.
Для решения поставленной задачи предложен способ выделения белков токсин-корегулируемых пилей адгезии и OmpU из штаммов холерного вибриона классического биовара, включающий следующие стадии:
а) получение клеточной массы;
б) удаление белков с поверхности клеток;
в) фракционирование клеточной массы для получения надосадка;
г) фракционирование надосадка для получения осадка белков;
д) избирательное экстрагирование осадка для отделения супернатанта, содержащего очищенные белки ТКПА и OmpU;
е) выделение белков токсин-корегулируемых пилей адгезии и OmpU из супернатанта.
При этом клеточную массу можно получать из любого штамма холерного вибриона классического биовара, продуцирующего токсин-корегулируемые пили адгезии и белок внешней мембраны OmpU, выращиванием в питательном бульоне. Материал, содержащий белки ТКПА и OmpU, расположенные на поверхности бактериальных клеток, выделяют из предварительно подготовленной бактериальной массы орбитальным вращением при 2500 об/мин. Для получения надосадка, содержащего выделяемые белки, бактериальную массу фракционируют низкоскоростным центрифугированием при 3-4 тыс.об/мин, осадок бактериальных клеток удаляют. Полученный надосадок, содержащий белки ТКПА и OmpU, фракционируют высокоскоростным центрифугированием при 18-20 тыс. об/мин и избирательно экстрагируют в 125 мМ растворе этаноламина (рН 10,5) при 4°С на шейкере. Выделение очищенных белков токсин-корегулируемых пилей адгезии и OmpU из супернатанта можно осуществлять методом диализа в фосфатном буфере (рН 7,4).
Совокупность указанных выше действий позволяет получить белковый комплекс, представляющий собой очищенный препарат, содержащий 70% белков ТКПА и OmpU, пригодный при производстве химических холерных вакцин для эффективной профилактики холеры в современных условиях и как диагностический реагент в качестве антигена для генерирования антител против ТКПА и OmpU при создании диагностических тест-систем.
Настоящее изобретение обеспечивает выделение белкового комплекса, содержащего неденатурированные протективные белки ТКПА и OmpU, из штаммов холерного вибриона классического биовара достаточной степени очистки.
В пределах объема изобретения возможны модификации.
Сущность изобретения поясняется примерами.
Пример 1, иллюстрирующий значительную продукцию токсин-корегулируемых пилей адгезии штаммами холерного вибриона классического биовара, используемыми для выделения белков ТКПА и OmpU.
Высушенную ампульную культуру штамма холерного вибриона классического биовара засевают на любой питательный агар, предназначенный для выращивания холерных вибрионов, и инкубируют 18 ч при 37°С. Выросшую культуру рассевают на LB-агар для получения изолированных колоний и последующей проверки наличия токсин-корегулируемых пилей адгезии методом самоагглютинации (Chiang S.L. et al. Molecular Microbiology. 1995. V.17. P.1133-1142). Через 18 ч ресуспендируют одну выросшую колонию в 1 мл LB бульона и как инокулят вносят 10 мкл этой суспензии в 5 мл казаминового бульона, содержащего 3% казаминовых кислот и 0,5% дрожжевого экстракта (рН 7,6) или LB бульона (рН 7,6). Культуру выращивают 17-18 ч на круговом шейкере при 30°С. Степень агглютинации учитывают визуально. Штамм, образующий значительное количество ТКПА, вызывает видимую самоагглютинацию бактериальных клеток в бульоне за счет синтеза значительного количества находящихся на поверхности токсин-корегулируемых пилей адгезии, в результате чего клетки оседают на дно пробирки, а бульон остается прозрачным или почти прозрачным.
Пример 2, иллюстрирующий присутствие белка OmpU в используемых штаммах холерного вибриона.
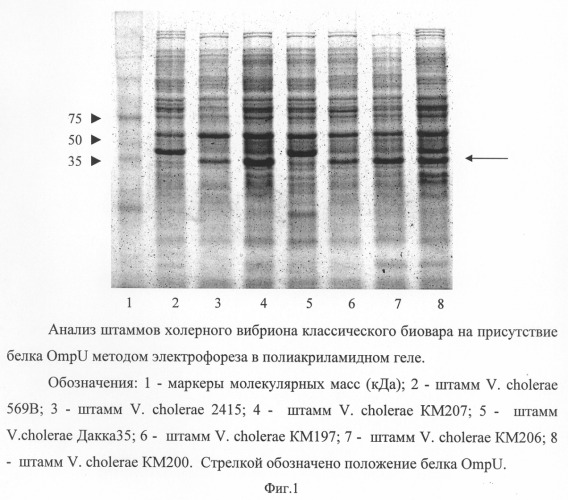
Наличие белка OmpU в штаммах холерного вибриона классического биовара, используемых для получения белков ТКПА и OmpU, определяют методом электрофореза в полиакриламидном геле. Электрофорез проводят на приборе Mighty Small II в присутствии додецилсульфата натрия в пластинах размером 8×7 см. В работе используют 15% разделяющий гель. Концентрирующий гель всегда применяют 4% (Laemmli U.F. Nature, 1970. V.227. P.680-685). Для приготовления образцов культур холерного вибриона штаммы выращивают на LB агаре (рН 7,2) в течение 17-18 ч при 37°С. Суспендируют одну бактериологическую петлю культуры №2 в 200 мкл дистиллированной воды и добавляют равный объем «буфера для приготовления образцов», содержащего 0,125 М трис солянокислый (рН 6,8), 4% додецилсульфат натрия, 20% глицерин, 2% меркаптоэтанол, рН 6,8. Кипятят на водяной бане в течение 5-7 мин. Электрофорез проводят до вхождения образца в гель при токовой нагрузке 10 мА и далее при 20 мА. Используют электродный буфер, содержащий 0,195 М глицина/0.025 М трис/0,1% додецилсульфат натрия, рН 8,3. После проведения электрофореза осуществляют фиксацию белков в течение часа или ночи в фиксирующем растворе (25% изопропиловый спирт на 10% уксусной кислоте), затем гелевые пластины в течение 10-15 мин окрашивают раствором кумасси R-250 и помещают в отмывающий раствор (10% этиловый спирт на 7% уксусной кислоте). В исследуемых культурах определяют присутствие белка OmpU с молекулярной массой 38 кДа относительно маркеров молекулярной массы. На фигуре 1 приведены маркеры молекулярных масс (полоса 1) и штаммы холерного вибриона, содержащие белок OmpU (полосы 3, 4, 6, 7, 8) и не содержащие белок (полосы 2, 5). Положение белка OmpU обозначено стрелкой.
Пример 3. Способ получения белков токсин-корегулируемых пилей адгезии и OmpU.
Заявляемый способ авторами апробирован на штаммах холерного вибриона классического биовара - продуцентах протективных антигенов КМ197, КМ200, КМ206, КМ207. Штамм выращивают в бульоне Хоттингера (рН 7,6) на ферментере «New Brunswik M19» (США) при 30°С с интенсивной аэрацией в течение 14-16 ч. После выращивания для обеззараживания материала в бульон вносят 37% р-р формальдегида до конечной концентрации 0,6%, перемешивают в течение 15 мин и выдерживают 14 ч. Проверяют специфическую стерильность согласно инструкции, после получения отрицательного результата (отсутствие роста) препарат считается стерильным (Инструкция по контролю специфической стерильности экспериментальных препаратов, приготовленных из культур чумного и холерного микробов. Утверждено ГУКИ МЗ СССР. Москва. 1982). Так как белки токсин-корегулируемых пилей адгезии и OmpU расположены на поверхности, то после получения бактериальной массы клетки ресуспендируют в трис-HCl-буфер (рН 7,0), содержащем 12,5 мМ трис/25 мМ NaCl/4 мМ MgCl2/4 мМ CaCl2 (Sun D. et al. J. Infect. Dis. 1990. V.161. P.1231-1236) и обрабатывают в течение 2 мин на вортексе, обеспечивающем орбитальное движение клеток с высокой скоростью (2500 об/мин). При данной обработке не происходит разрушения клеток, а расположенные на поверхности клетки белки ТКПА и OmpU отделяются от клеток. Бактериальные клетки осаждают низкоскоростным центрифугированием (3-4 тыс. об/мин) и отбрасывают, а отделенные от клеток белки ТКПА и OmpU осаждают высокоскоростным центрифугированием (18-20 тыс. об/мин). Полученный осадок разводят в 125 мМ этаноламине (рН 10,5) и для растворения белков ТКПА и OmpU материал выдерживают в течение 2 ч при 4°С на шейкере. Несолюбилизированный материал удаляют центрифугированием при 5000 об/мин. Супернатант диализуют с перемешиванием в 10 мМ PBS (рН 7,4) в течение суток со сменой раствора. Выделенные белки разливают в ампулы по 2 мл и лиофильно высушивают. Ампулы хранят при 4°С. Присутствие белков ТКПА и OmpU в полученных препаратах устанавливают методом гель-электрофореза (методика описана в примере 2). Для этого делают навеску выделенных белков из расчета 100 мкг/мл, растворяют ее в дистиллированной воде, добавляют равный объем "буфера образца" и кипятят на водяной бане в течение 5-7 мин. На фигуре 2 изображена электрофореграмма штамма - продуцента протективных антигенов V.cholerae KM197 (полоса 6) и выделенного из него белкового препарата (полоса 9). В полученном белковом препарате (полоса 9) стрелками показано присутствие двух белков. Верхняя стрелка указывает положение белка OmpU, нижняя - белка токсин-корегулируемых пилей адгезии.
Пример 4, иллюстрирующий получение антисыворотки.
Для получения антисыворотки из лиофильно высушенного белкового препарата, полученного из штамма V.cholerae KM197 делают навеску, содержащую 100 мкг белка, и растворяют в 1 мл дистиллированной воды. В полученный раствор добавляют мертиолят натрия до концентрации 1:10000 и хранят при 4°С. Для иммунизации используют кроликов весом 2,5-3 кг, которых иммунизируют 3-кратно внутривенно с интервалом 7 дней в дозах - 1; 1,5; 2 мл и однократно подкожно в дозе 3 мл с полным адъювантом Фрейнда. Интервал между иммунизациями составляет 7 дней. После последней иммунизации проводят тотальное обескровливание. Сыворотку разливают по ампулам и хранят при - 20°С. По данным иммуноферментного метода титр сыворотки составляет в среднем более 1:100000. Для подтверждения присутствия в сыворотке антител к белкам ТКПА и OmpU проводят иммуноблоттинг (Towbin H., Staehelin Т., Gordon J. Proc. Natl. Acad. Sci. USA. 1979. V.76, N 3. P.4350-4353). На первом этапе проводят электрофорез штаммов в присутствии додецилсульфата натрия, как описано в примере 2. После электрофореза осуществляют электроперенос белков на нитроцеллюлозные фильтры (0,22 мкм) в аппарате Transblot. Пластину полиакриламидного геля помещают на нитроцеллюлозный фильтр, смоченный в буфере для иммуноблоттинга, фиксируют сетчатыми пластинами с фильтровальной бумагой и помещают в прибор нитроцеллюлозным фильтром к аноду. Электроперенос осуществляют при 50 V - 2 ч или при 5 V в течение ночи. Затем часть фильтра для контроля переноса окрашивают раствором, содержащим: 0,1% амидо-черный; 30% изопропанол; 7% уксусная кислоту и отмывают тем же раствором, не содержащим красителя. Вторую часть фильтра помещают в блокирующий буфер (рН 7,4), содержащий: 3% БСА; 10 мМ фосфатный буфер на 1 ч при 37°С или ночь в холодильнике. После отмывания фосфатным буфером с твином (0,1% твин-80, рН 7,4), фильтр инкубируют 2 ч при комнатной температуре в растворе антисыворотки, отмывают и обрабатывают рабочим разведением антикроличьих иммуноглобулинов, меченных пероксидазой. Проявление фильтра осуществляют О-дианизидином в фосфатном буфере (0,1 мМ O-дианизидин; 0,2 мМ перекись водорода, рН 7,4), реакцию останавливают, помещая фильтр в дистиллированную воду.
На фигуре 3 стрелками показаны белки OmpU и ТКПА, которые выявлены антисывороткой, в белковом препарате, использованном для иммунизации (полоса 9), в штамме V.cholerae KM197 (полоса 6), а также в белковом препарате, выделенном из штамма КМ206 (полоса 10), и в штамме V.cholerae KM206 (полоса 7), что подтверждает специфичность антисыворотки. Положение белка OmpU обозначено верхней стрелкой, а белка токсин-корегулируемых пилей адгезии - нижней.
Биологические депозиты
Штаммы V.cholerae KM197 серовара Огава (патент RU №2169187), V.cholerae КМ206 серовара Огава (патент RU №2222594), V.cholerae KM207 серовара Инаба (патент RU №2222595), КМ200 серовара Огава (патент RU №2193598) - продуценты протективных антигенов, о которых говорится здесь, депонированы в Государственной коллекции патогенных бактерий «Микроб», находящейся по адресу 410005 Россия г.Саратов ул. Университетская 46 РосНИПЧИ «Микроб». Изобретение, описанное здесь, не ограничивается указанными штаммами, которые предназначены только для иллюстрирования изобретения. Любые штаммы холерного вибриона классического биовара, которые продуцируют ТКПА и дают реакцию агглютинации, а также синтезируют белок OmpU во внешней мембране, находятся в сфере действия настоящего изобретения.
1. Способ выделения белков токсин-корегулируемых пилей адгезии и OmpU из штаммов холерного вибриона классического биовара, включающий получение клеточной массы, удаление с поверхности клеток белков орбитальным вращением бактериальной массы со скоростью 2500 об/мин в течение 2 мин на вортексе, фракционирование клеточной массы низкоскоростным центрифугированием при 3-4 тыс.об/мин для получения надосадка, фракционирование надосадка высокоскоростным центрифугированием при 18-20 тыс. об/мин для получения осадка белков, избирательное экстрагирование осадка для получения супернатанта, содержащего очищенные белки ТКПА и OmpU, раствором 125 мМ этаноламина (рН 10,5) при 4°С на шейкере, выделение белков токсин-корегулируемых пилей адгезии и OmpU из супернатанта.
2. Способ по п.1, отличающийся тем, что клеточную массу получают выращиванием штаммов на жидкой или твердой питательной среде, пригодной для культивирования холерного вибриона.
3. Способ по п.1, отличающийся тем, что выделение белков токсин-корегулируемых пилей адгезии и OmpU из супернатанта производят методом диализа в фосфатном буфере (рН 7,4).