Способ определения составов равновесных твердых фаз в многокомпонентных водно-солевых системах
Иллюстрации
Показать всеИзобретение относится к использованию физико-химического анализа для определения составов равновесных твердых фаз при исследовании растворимости в многокомпонентных водно-солевых системах. Способ определения составов равновесных твердых фаз при исследовании растворимости в n-компонентных водно-солевых системах осуществляют путем определения составов нонвариантных растворов, насыщенных n-2 и n-1 солями, и вычисления соотношения компонентов по уравнению прямой, при этом экспериментально определяют координаты границ нонвариантных областей изогидрических разрезов в (n-1)- и вершин в n-компонентной системах, не прибегая к разделению равновесных фаз, и устанавливают составы равновесных твердых фаз, находя точку пересечения двух предельных нод, заданных составами соответствующих нонвариантных растворов и границ или вершин нонвариантных областей. Достигается снижение трудоемкости и повышение надежности определения. 12 табл., 6 ил.
Реферат
Область техники
Изобретение относится к области химии, а именно к использованию метода физико-химического анализа для определения составов равновесных твердых фаз при исследовании растворимости в многокомпонентных водно-солевых системах.
Уровень техники
Известны классические методы определения составов равновесных твердых фаз при изучении растворимости в трехкомпонентных системах, такие как метод остатков Схрейнемакерса [Аносов В.Я., Погодин С.А. Основные начала физико-химического анализа. М.; Л.: Изд-во АН СССР, 1947.; Аносов В.Я., Озерова М.И., Фиалков Ю.А. Основы физико-химического анализа. М.: Наука, 1976.], метод сечений Мерцлина [Никурашина Н.И., Мерцлин Р.В. Метод сечений, приложение его к изучению многофазного состояния многокомпонентных систем. Саратов: Изд-во Саратовск. ун-та, 1969]; Метод материального баланса [Федотьев П.П. Сборник исследовательских работ. Л.: ОНТИ-ХИМТЕОРЕТ, 1936] и прогностический метод [Мазунин С.А. Основы физико-химического анализа: Учебн. пособие по спецкурсу / Перм. ун-т. - Пермь, 2000. - Ч.2. Многокомпонентные водно-солевые системы.] позволяют вычислять соотношение исходных компонентов в донной фазе по составам равновесной жидкой фазы и исходной смеси компонентов (далее ИСК), используя математические уравнения.
Сущность метода остатков Схрейнемакерса состоит в определении состава насыщенного раствора и твердой фазы, смоченной маточным раствором - остатка, методами химического анализа. Анализируя несколько сопряженных растворов и остатков, строя и определяя точку пересечения соединительных прямых (лучей кристаллизации) с осями состава концентрационной фигуры, графически находят состав равновесной твердой фазы (кристаллогидрата, химического соединения или образовавшихся твердых растворов).
Недостатками данного метода являются неприменимость к четырем и более компонентным системам, невозможность определения ИСК на границах фазовых областей (т.е. он не является структурно-чувствительным), а также не дает точных составов равновесных твердых фаз в трехкомпонентных системах в связи с неизбежным изменением остатков при их изоляции для химического анализа.
Сущность метода сечений состоит в измерении какого-либо физического свойства жидкой фазы, образующейся в равновесных условиях из ИСК системы, находящихся в строго определенных сечениях фигуры состава. По экспериментальным данным строят график "состав-свойство", получают систему взаимно пересекающихся линий, число которых равно числу полей, рассекаемых изучаемым сечением. Точки пересечения функциональных линий в нескольких сечениях определяют границы полей с разным фазовым состоянием, в том числе и предельные ноды. Продолжения предельных нод до пересечения с ветвями растворимости с одной стороны и границами треугольника состава - с другой графически находят составы равновесных жидких и твердых фаз. Метод сечений является графоаналитическим и структурно-чувствительным.
Данный метод детально разработан только для трехкомпонентных систем. Использование уравнений аналитической геометрии позволяет применить его к более высококомпонентным системам, но метод при этом становится чрезвычайно трудоемким.
Для контроля составов донной фазы при исследовании четверной взаимной водно-солевой системы, лежащей в основе аммиачного способа производства соды, Федотьев применил метод материального баланса. На основе данных химического анализа равновесной жидкой фазы по прямым пропорциям вычислялись количества растворенных солевых компонентов, сравнивались с таковыми взятыми для приготовления ИСК и определялись избытки солей, находящиеся в донной фазе. Данная процедура применялась к растворам, насыщенным одной, двумя и тремя солями.
Однако указанная процедура не позволяет определить наличие новой твердой фазы, если она представляет собой смесь двух или более компонентов или твердый раствор. Кроме того, метод не допускает вычисление оптимальных ИСК для исследования интересующих фазовых равновесий определение координат точек на границах фазовых областей и составов равновесных, жидких и твердых фаз без их разделения в четырех и более компонентных системах.
Наиболее близким по технической сущности к предлагаемому способу является способ контроля состава донной фазы при исследованиях водно-солевых систем [Мазунин С.А. Основы физико-химического анализа: Учебн. пособие по спецкурсу / Перм. ун-т. - Пермь, 2000. - Ч.2. Многокомпонентные водно-солевые системы].
Данным способом косвенно определяют равновесную донную фазу, когда используют данные химического анализа равновесной жидкой фазы и состав ИСК, вычислением соотношения компонентов в ней по уравнению прямой. Решая системы уравнений, определяют оптимальные ИСК для исследования интересующих фазовых равновесий.
Недостатками данного способа-прототипа являются невозможность определения координат точек на границах фазовых областей и составов равновесных твердых фаз без их отделения от жидкой в четырех и более компонентных системах.
Раскрытие изобретения
Задачей создания изобретения является разработка универсального способа определения с достаточной точностью состава равновесных твердых фаз в водно-солевых системах с любым числом и сложностью взаимодействия компонентов без изоляции фаз и нарушения равновесия.
Поставленная задача решается с помощью признаков, указанных в формуле изобретения, общих с прототипом, таких как способ исследования растворимости в n-компонентных водно-солевых системах путем определения составов нонвариантных растворов, насыщенных n-2 и n-1 солями, и вычисления соотношения компонентов по уравнению прямой, и отличительных существенных признаков, таких как экспериментальное определение координат границ нонвариантных областей изогидрических разрезов (n-1)- и вершин в n-компонентной системах, не прибегая к разделению равновесных фаз, устанавливая составы равновесных твердых фаз нахождением точки пересечения двух предельных нод, заданных составами соответствующих нонвариантных растворов и границ или вершин нонвариантных областей (n - число компонентов в системе).
Технический результат - значительное снижение трудоемкости исследований и возможность максимально надежного определения составов равновесных твердых фаз без их отделения от жидких.
Предлагаемый комбинированный способ использует лучшие стороны рассмотренных методов и позволяет по экспериментальным данным определить составы равновесных твердых фаз без их изоляции от жидкой фазы. Составы твердых фаз находят по координатам жидких фаз, границ в оконтуривающих системах и вершин нонвариантных областей в изогидрических разрезах системы, определенных экспериментально, как пересечение соответствующих предельных нод.
Примеры осуществления изобретения.
Пример 1. Определение составов равновесных твердых фаз в тройной водно-солевой системе с кристаллизацией инконгруэнтно растворимого химического соединения.
Система NaHCO3-Na2CO3-H2O при 25°С - тройная водно-солевая система с кристаллизацией инконгруэнтно растворимого химического соединения [Мазунин С.А.].
Для определения составов равновесных твердых фаз необходимо экспериментально найти составы нонвариантных растворов, насыщенных одной и двумя солями (табл.1), а также границы нонвариантных областей (табл.2) в изогидрических разрезах тройной системы, не прибегая к разделению равновесных фаз, установить точки пересечения предельных нод, заданных этими составами.
| Таблица 1Составы нонвариантных растворов системы NaHCO3-Na2CO3-Н2O при 25°С | ||||
| Точка | Состав насыщенного раствора, мас.% | Твердая фаза | ||
| NaHCO3 | Na2CO3 | H2O | ||
| R2 | 0.00 | 22.70 | 77.30 | Na2CO3·10H2O |
| Е | 1.50 | 22.60 | 75.90 | NaHCO3·Na2CO3·2H2O+Na2CO3·10H2O |
| Р | 4.05 | 17.90 | 78.05 | NaHCO3+NaHCO3·Na2CO3·2H2O |
| R1 | 9.30 | 0.00 | 90.70 | NaHCO3 |
Результаты определения составов равновесных твердых фаз, приведенные в табл.3 и изображенные на фиг.1, подтверждают факт кристаллизации в системе безводного гидрокарбоната натрия, химического соединения и десятиводного карбоната натрия.
На фиг.1 белыми кружками изображены экспериментальные составы насыщенных растворов, границ изогидрических нонвариантных областей и истинных равновесных твердых фаз, черными кружками - установленные предлагаемой процедурой точки пересечения предельных нод. Сплошными жирными линиями изображены "задающие части" предельных нод, пунктирными линиями - их продолжения до точек взаимного пересечения.
| Таблица 2Границы нонвариантных областей изогидрических сечений | ||||
| Точка | Состав насыщенного раствора, мас.% | ПримечаниеТочка на ноде: | ||
| NaHCO3 | Na2CO3 | H2O | ||
| а | 34.00 | 0.00 | 66.00 | R1 - NaHCO3 |
| b | 18.86 | 15.14 | 66.00 | р - NaHCO3 |
| с | 10.47 | 23.53 | 66.00 | p - NaHCO3·Na2CO3·2H2O |
| f | 3.82 | 24.18 | 72.00 | е - NaHCO3·Na2CO3·2H2O |
| g | 1.05 | 26.95 | 72.00 | е - Na2CO3·10H2O |
| h | 0.00 | 28.00 | 72.00 | R2 - Na2CO3·10H2O |
| Таблица 3Установленные составы твердых фаз | ||||
| № п/п | Состав твердой фазы, мас.%/Мольная доля компонента | ПримечаниеПересечение нод: | ||
| NaHCO3 | Na2CO3 | H2O | ||
| 1 | 100.10/1.00 | 0.00/0.00 | -0.10/-0.00 | R1-a и p-b; |
| 2 | 36.90/1.00 | 46.71/0.98 | 16.38/2.07 | р-с и е-f; |
| 3 | 0.00/0.00 | 37.10/1.00 | 62.90/10.17 | R2-h и e-g. |
Приведенные данные показывают, что погрешность определения мольного соотношения компонентов в составах равновесных твердых фаз является удовлетворительной и не превышает 0.17.
Пример 2. Определение составов равновесных твердых фаз в четверной водно-солевой системе простого эвтонического типа с кристаллизацией безводных индивидуальных исходных солевых компонентов.
Система NH4H2PO4-(NH4)2НРО4-NH4Cl-H2O при 20°С - простая четверная водно-солевая система эвтонического типа [Мазунин С.А.].
Для нахождения составов равновесных твердых фаз в четверной системе также необходимо экспериментально определить составы нонвариантных растворов, насыщенных двумя и тремя солями (табл.4), все границы нонвариантных изогидрических областей в оконтуривающих тройных системах и вершины этих областей (см. табл.5 и 6 соответственно), не прибегая к разделению равновесных фаз, установить точки пересечения предельных нод, заданных этими составами.
Результаты определения составов равновесных твердых фаз, приведенные в табл.7 и изображенные на фиг.2, подтверждают факт кристаллизации в системе безводных исходных солевых компонентов.
На фиг.2 белыми кружками изображены экспериментальные составы насыщенных растворов, границ изогидрических нонвариантных областей, черными кружками - установленные предлагаемой процедурой точки пересечения предельных нод. Сплошными жирными линиями изображены "задающие части" предельных нод, пунктирными линиями - их продолжения до точек взаимного пересечения.
| Таблица 4Составы нонвариантных растворов системы NH4H2PO4-(NH4)2HPO4-NH4Cl-H2O при 20°С | |||||
| Точка | Состав насыщенного раствора, мас.% | Твердаяфаза | |||
| NH4H2PO4 | (NH4)2HPO4 | NH4Cl | H2O | ||
| E12 | 25.0 | 32.7 | - | 42.3 | NH4H2PO4+(NH4)2HPO4 |
| Е13 | 5.2 | - | 25.4 | 69.4 | NH4H2PO4+NH4Cl |
| Е23 | - | 12.9 | 22.4 | 64.7 | (NH4)2HPO4+NH4Cl |
| Е | 16.0 | 23.2 | 11.5 | 49.3 | (NH4)2HPO4+NH4Cl+NH4H2PO4 |
| Таблица 5Границы нонвариантных областей изогидрических сечений тройных оконтуривающих систем | |||||
| Точка | Состав, мас.% | ПримечаниеТочка на ноде: | |||
| NH4H2PO4 | (NH4)2HPO4 | NH4Cl | H2O | ||
| а | 36.2 | 27.8 | 0.0 | 36.0 | Е12 - NH4H2PO4 |
| b | 21.3 | 42.7 | 0.0 | 36.0 | E12 - (NH4)2HPO4 |
| с | 19.4 | 0.0 | 21.6 | 59.0 | E13 - NH4H2PO4 |
| d | 4.4 | 0.0 | 36.6 | 59.0 | E13 - NH4Cl |
| f | 0.0 | 26.0 | 19.0 | 55.0 | E23 - (NH4)2HPO4 |
| g | 0.0 | 11.0 | 34.0 | 55.0 | Е23 - NH4Cl |
| Таблица 6Вершины нонвариантной области в изогидрическом разрезе четверной системы NH4H2PO4-(NH4)2HPO4-NH4Cl-H2O при 20°С | |||||
| Точка | Состав, мас.% | ПримечаниеТочка на ноде: | |||
| NH4H2PO4 | (NH4)2HPO4 | NH4Cl | H2O | ||
| Н | 31.8 | 18.8 | 9.4 | 40.0 | Е - NH4H2PO4 |
| К | 13.0 | 37.7 | 9.3 | 40.0 | E - (NH4)2HPO4 |
| М | 13.0 | 18.8 | 28.2 | 40.0 | E - NH4Cl |
Приведенные данные показывают, что погрешности определения составов равновесных твердых фаз являются удовлетворительными и не превышает 0.58 мас.%.
Фиг.3 показывает определение составов всех кристаллизующихся фаз. Гидрофосфат аммония в системе кристаллизуется в виде безводной исходной соли, состав которой находится взаимным пересечением трех предельных нод (E13-b; Е23-f; Е-k), найденные значения содержания компонентов сведены в табл.8. Хлорид аммония в системе также кристаллизуется в виде безводной исходной соли, состав которой определяется взаимным пересечением трех предельных нод (Е13-d; E23-g; E-m), найденные значения содержания компонентов сведены в табл.9.
На фиг.2 и 3 белыми кружками отмечены экспериментальные данные, черными - установленные. Сплошными жирными линиями изображены "задающие части" предельных нод, пунктирными линиями - их продолжения до точек взаимного пересечения.
| Таблица 7Найденные составы твердой фазы NH4H2PO4 | |||||
| № п/п | Состав твердой фазы, мас.% | ПримечаниеПересечение нод: | |||
| NH4H2PO4 | (NH4)2HPO4 | NH4Cl | H2O | ||
| 1 | 100.11 | 0.00 | 0.00 | -0.11 | E12-a и E13-с; |
| 2 | 99.30 | 0.35 | 0.00 | 0.35 | E12-a и Е-H; |
| 3 | 100.58 | 0.00 | -0.26 | -0.32 | E13-c и Е-H. |
| Ср. | 100.00 | 0.12 | -0.09 | -0.03 | Средний состав |
| Таблица 8Найденные составы твердой фазы (NH4)2HPO4 | |||||
| № п/п | Состав твердой фазы, мас.% | ПримечаниеПересечение нод: | |||
| (NH4)2HPO4 | NH4H2PO4 | NH4Cl | H2O | ||
| 1 | 99.14 | 0.34 | 0.11 | 0.42 | Е12-b и E-K; |
| 2 | 100.78 | 0.00 | -0.14 | -0.64 | Е23-f и E-K; |
| 3 | 100.05 | 0.00 | 0.00 | -0.05 | E12-b и Е23-f. |
| Ср. | 99.99 | 0.11 | -0.01 | -0.09 | Средний состав |
| Таблица 9Найденные составы твердой фазы NH4Cl | |||||
| № п/п | Состав твердой фазы, мас.% | ПримечаниеПересечение нод: | |||
| NH4Cl | (NH4)2HPO4 | NH4H2PO4 | H2O | ||
| 1 | 100.43 | 0.00 | 0.05 | -0.48 | E13-d и E-M; |
| 2 | 99.99 | 0.11 | 0.13 | -0.24 | E23-g и Е-М; |
| 3 | 100.69 | 0.00 | -0.14 | -0.55 | Е23-g и E13-d. |
| Ср. | 100.37 | 0.04 | 0.01 | -0.42 | Средний состав |
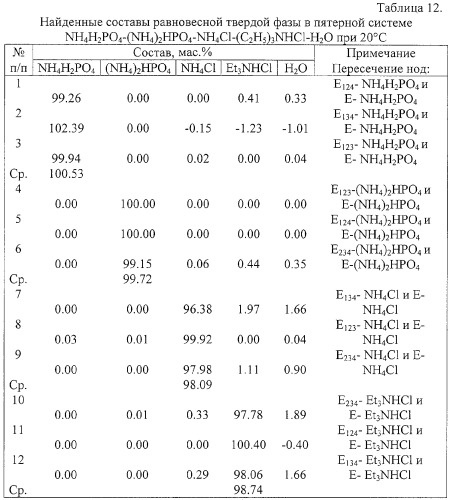
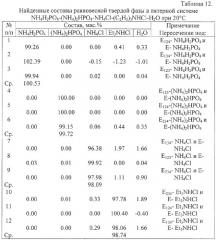
Пример 3. Определение составов равновесных твердых фаз в пятерной водно-солевой системе простого эвтонического типа с кристаллизацией безводных индивидуальных исходных солевых компонентов.
Система NH4H2PO4-(NH4)2HPO4-NH4Cl-(С2Н5)3NHCl-H2O при 20°С - пятерная водно-солевая система эвтонического типа [Мазунин С.А.].
Для определения составов равновесных твердых фаз необходимо экспериментально определить составы эвтонических растворов, насыщенных тремя и четырьмя солями (табл.10), а также координаты вершин изогидрических нонвариантных областей в оконтуривающих четверных и в пятерной системах (табл.11), не прибегая к разделению равновесных фаз, установить точки пересечения предельных нод, заданных этими составами.
Результаты определения составов равновесных твердых фаз, приведенные в табл.12 и изображенные на фиг.4-6, подтверждают факт кристаллизации в системе безводных исходных солевых компонентов.
| Таблица 10Составы нонвариантных растворов системы NH4H2PO4-(NH4)2HPO4-NH4Cl-(C2H5)3NHCl-H2O при 20°С | ||||||
| Состав насыщенного раствора, мас.% | Твердая фаза | |||||
| Точка | NH4H2PO4 | (NH4)2HPO4 | NH4Cl | (C2H5)3NHCl | H2O | |
| E124 | 1.2 | 0.2 | - | 56.0 | 42.6 | (NH4)2HPO4+NH4H2PO4+(C2H5)3NHCl |
| E134 | 0.4 | - | 7.0 | 50.5 | 42.1 | NH4H2PO4+NH4Cl+(С2Н5)3NHCl |
| Е234 | - | 0.1 | 6.9 | 51.5 | 41.5 | (NH4)2HPO4+NH4Cl+(C2H5)3NHCl |
| Е123 | 16.0 | 23.2 | 11.5 | - | 49.3 | (NH4)2HPO4+NH4Cl+NH4H2PO4 |
| E | 0.4 | 0.1 | 6.7 | 51.1 | 41.7 | (NH4)2HPO4+NH4H2PO4+NH4Cl+(C2H5)3NHCl |
| Таблица 11Вершины нонвариантных областей в изогидрических разрезах пятерной системы NH4H2PO4-(NH4)2HPO4-NH4Cl-(C2H5)3NHCl-H2O при 20°С | ||||||
| Точка | Состав, мас.% | Примечание.Точка на ноде: | ||||
| NH4H2PO4 | (NH4)2HPO4 | NH4Cl | Et3NHCl | H2O | ||
| Н | 33.55 | 18.35 | 9.10 | 0.00 | 39.00 | E123 - NH4H2PO4 |
| К | 12.66 | 39.24 | 9.10 | 0.00 | 39.00 | El23 - (NH4)2HPO4 |
| М | 12.66 | 18.35 | 29.99 | 0.00 | 39.00 | E123 - NH4Cl |
| p | 21.15 | 0.16 | 0.00 | 44.69 | 34.00 | E124 - NH4H2PO4 |
| q | 0.96 | 20.35 | 0.00 | 44.69 | 34.00 | E124 - (NH4)2HPO4 |
| o | 0.96 | 0.16 | 0.00 | 64.88 | 34.00 | E124 - Et3NHCl |
| x | 21.93 | 0.00 | 5.49 | 39.58 | 33.00 | E134 - NH4H2PO4 |
| у | 0.31 | 0.00 | 27.11 | 39.58 | 33.00 | E134 - NH4Cl |
| z | 0.31 | 0.00 | 5.49 | 61.20 | 33.00 | E134 - Et3NHCl |
| r | 0.00 | 20.56 | 5.49 | 40.95 | 33.00 | E234 - (NH4)2HPO4 |
| s | 0.00 | 0.08 | 25.97 | 40.95 | 33.00 | E234 - NH4Cl |
| t | 0.00 | 0.08 | 5.49 | 61.43 | 33.00 | E234 - Et3NHCl |
| а | 21.18 | 0.08 | 5.30 | 40.44 | 33.00 | E - NH4H2PO4 |
| b | 0.32 | 20.94 | 5.30 | 40.44 | 33.00 | E - (NH4)2HPO4 |
| с | 0.32 | 0.08 | 26.16 | 40.44 | 33.00 | E - NH4Cl |
| d | 0.32 | 0.08 | 5.30 | 61.30 | 33.00 | E - Et3NHCl |
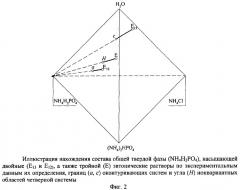
На фиг.4-6 белыми кружками изображены экспериментальные составы насыщенных растворов, границ изогидрических нонвариантных областей, черными кружками - установленные предлагаемой процедурой точки пересечения предельных нод. Сплошными жирными линиями изображены "задающие части" предельных нод, пунктирными линиями - их продолжения до точек взаимного пересечения.
Фиг.4 показывает при помощи солевой проекции пятерной системы определение составов одной из кристаллизующихся фаз, а именно дигидрофосфата аммония, состав которого найден взаимным пересечением трех предельных нод (E123-h; E124-p и E134-x) с нодой Е-a, найденные значения содержания компонентов сведены в табл.12.
Фиг.5 показывает при помощи солевой проекции пятерной системы определение составов всех кристаллизующихся фаз, найденные значения содержания компонентов в которых сведены в табл.12. Кристаллизация исходного безводного хлорида аммония доказана составами взаимного пересечения трех предельных нод (Е123-m; E234-s и E134-у) с нодой Е-с. Кристаллизация исходного безводного гидрофосфата аммония определена по составам взаимного пересечения трех предельных нод (Е123-k; E234-r и E124-q) с нодой Е-b. Кристаллизация исходного безводного хлорида триэтиламмония доказана составами взаимного пересечения трех предельных нод (Е124-o; E134-z и Е234-t с нодой Е-d.
Фиг.6 позволяет рассмотреть на увеличенном масштабе угол солевой проекции пятерной системы, отвечающий хлориду триэтиламмония, и определение составов этой соли, найденных пересечением трех предельных нод (Е124-o; E134-z и Е234-t) с нодой Е-d.
Приведенные данные показывают, что погрешности определения составов равновесных твердых фаз зависят от величины угла пересечения предельных нод, являются удовлетворительными и не превышают 2.39 мас.%.
Предложенный способ определения составов равновесных твердых фаз в водно-солевых системах является универсальным, применимым к системам с любым числом и сложностью взаимодействия компонентов.
Способ определения составов равновесных твердых фаз при исследовании растворимости в n-компонентных водно-солевых системах путем определения составов нонвариантных растворов, насыщенных n-2 и n-1 солями, и вычисления соотношения компонентов по уравнению прямой, отличающийся тем, что экспериментально определяют координаты границ нонвариантных областей изогидрических разрезов в (n-1)- и вершин в n-компонентной системах, не прибегая к разделению равновесных фаз, и устанавливают составы равновесных твердых фаз, находя точку пересечения двух предельных нод, заданных составами соответствующих нонвариантных растворов и границ или вершин нонвариантных областей.