Способ изучения растворимости в многокомпонентных водно-солевых системах
Иллюстрации
Показать всеИзобретение относится к области использования методов физико-химического анализа для исследования растворимости в многокомпонентных водно-солевых системах при постоянной температуре. Способ включает экспериментальное определение состава равновесной жидкой фазы исходной смеси компонентов оптимального состава, измерение какого-либо легко определяемого физического свойства жидкой фазы после установления равновесия в известной исходной смеси компонентов, располагающихся строго по сечениям треугольника состава, при этом строят график "состав-свойство", получают систему взаимно пересекающихся линий, число которых равно числу полей, рассекаемых избранным сечением, при этом точки пересечения функциональных линий определяют границы полей с разным фазовым состоянием. Твердые фазы устанавливают по точкам пересечения предельных нод, приходящих в одну и ту же твердую фазу, задаваемых координатами экспериментально определенных составов нонвариантных жидких фаз, границ в оконтуривающих системах и вершин нонвариантных областей изогидрических разрезов системы без изоляции, разделения и дополнительной идентификации донных фаз, при этом ориентация границ нонвариантной области к сторонам солевой (безводной) концентрационной фигуры разреза изучаемой системы определяет тип фазового взаимодействия в ней, а параллельность этих границ сторонам концентрационной фигуры изогидрического разреза свидетельствует о кристаллизации из нонвариантного раствора безводных солевых компонентов, слагающих данную концентрационную фигуру, а не параллельность границ нонвариантной области сторонам концентрационной фигуры изогидрического разреза свидетельствует об образовании новой твердой фазы или кристаллогидратов в системе. При наличии новой твердой фазы соответствующим образом триангулируют исходную систему, экспериментально определяют все составы нонвариантных растворов, насыщенных и этой твердой фазой, координаты вершин соответствующих нонвариантных изогидрических областей, комбинацией полученных результатов устанавливают составы всех равновесных твердых фаз для подтверждения типов фазовых взаимодействий в полученных подсистемах и доказательства отсутствия других твердых фаз не прибегая к их изоляции от жидкой. Достигается упрощение, а также - повышение надежности и информативности определения. 1 з.п. ф-лы, 14 табл., 4 ил.
Реферат
Изобретение относится к области использования методов физико-химического анализа для исследования растворимости в многокомпонентных водно-солевых системах при постоянной температуре.
Уровень техники
Известны изотермические методы изучения растворимости в водно-солевых системах [Аносов В.Я., Погодин С.А. Основные начала физико-химического анализа. М.: Л.: Изд-во АН СССР, 1947; Аносов В.Я., Озерова М.И., Фиалков Ю.А. Основы физико-химического анализа. М.: Наука, 1976], такие как метод сечения [Никурашина Н.И., Мерцлин Р.В. Метод сечений, приложение его к изучению многофазного состояния многокомпонентных систем. Саратов: Изд-во Саратов, ун-та, 1969] и прогностический метод [Мазунин С.А. Основы физико-химического анализа: Учеб. пособие по спецкурсу / Перм. ун-т. - Пермь, 2000. - Ч.2. Многокомпонентные водно-солевые системы], которые позволяют вычислять оптимальный состав исходной смеси компонентов (далее ИСК), соотношение исходных компонентов в донной фазе по составам равновесной жидкой фазы и ИСК, используя математические уравнения.
Сущность метода сечений состоит в определении какого-либо легко измеримого физического свойства жидкой фазы после установления равновесия в известной ИСК системы, располагающиеся строго по сечениям треугольника состава, строят график "состав-свойство", получают систему взаимно пересекающихся линий, число которых равно числу полей, рассекаемых избранным сечением. Точки пересечения функциональных линий определяют границы полей с разным фазовым состоянием. Метод сечений является графоаналитическим и структурно-чувствительным методом.
Недостатком данного метода являются косвенное определение состава равновесной жидкой фазы, невозможность определения состава равновесной твердой фазы без ее изоляции от жидкой фазы в четырех- и более компонентных системах.
Прогностический метод использует химический анализ для определения состава насыщенного раствора, позволяет найти соотношение исходных компонентов в равновесной донной фазе по уравнению прямой линии, задаваемой координатами составов жидкой фазы и ИСК.
Ключевым моментом данного метода является вычисление оптимального состава ИСК по предполагаемому составу жидкой фазы и наилучшего соотношения твердых и жидких фаз. Оптимальный состав ИСК вычисляется исходя из следующих условий:
1. Находиться в исследуемой фазовой области системы.
2. В процессе термостатирования распадаться на жидкие и твердые фазы в количествах, позволяющих легко производить перемешивание (15-30% твердых веществ) и вычислять состав твердой фазы.
3. Количества твердых фаз должны быть приблизительно одинаковыми.
Оптимальный план изучения простой четверной системы состоит в следующем. Сначала изучают оконтуривающие системы и определяют составы двойных эвтоник. Далее находят состав тройного эвтонического раствора, изучают линии двойного насыщения, исследуют поверхности кристаллизации всех слагающих систему твердых фаз.
Данный метод не позволяет определить составы ИСК на границах фазовых областей и равновесных твердых фаз без их изоляции от жидких в четырех- и более компонентных системах, но является наиболее близким к заявляемому.
Раскрытие изобретения
Задачей создания изобретения является получение надежных данных о растворимости в системе, исключающих даже гипотетическую возможность появления неизученных фазовых областей, упрощение процесса и возможность определения состава равновесной твердой фазы без ее изоляции от жидкой фазы в четырех- и более компонентных системах.
Поставленная задача решается с помощью признаков, указанных в 1-м пункте формулы изобретения, общих с прототипом, таких как способ изучения растворимости в многокомпонентных водно-солевых системах, включающий экспериментальное определение состава равновесной жидкой фазы исходной смеси компонентов оптимального состава, измерение какого-либо легко определяемого физического свойства жидкой фазы после установления равновесия в известной исходной смеси компонентов, располагающихся строго по сечениям треугольника состава, строят график "состав-свойство". Получают систему взаимно пересекающихся линий, число которых равно числу полей, рассекаемых избранным сечением, при этом точки пересечения функциональных линий определяют границы полей с разным фазовым состоянием, и отличительных существенных признаков, таких как твердые фазы, устанавливают по точкам пересечения предельных нод, приходящих в одну и ту же твердую фазу, задаваемых координатами экспериментально определенных составов нонвариантных жидких фаз, границ в оконтуривающих системах и вершин нонвариантных областей изогидрических разрезов системы без изоляции, разделения и дополнительной идентификации донных фаз. При этом ориентация границ нонвариантной области к сторонам солевой (безводной) концентрационной фигуры разреза изучаемой системы определяет тип фазового взаимодействия в ней. Параллельность этих границ сторонам концентрационной фигуры изогидрического разреза свидетельствует о кристаллизации из нонвариантного раствора безводных солевых компонентов, слагающих данную концентрационную фигуру, а не параллельность границ - об образовании новой твердой фазы или кристаллогидратов в системе.
Согласно пункту 2 формулы изобретения при наличии новой твердой фазы соответствующим образом триангулируют (разбивают на подсистемы, каждая из которых является самостоятельной системой) исходную систему. Экспериментально определяют все составы нонвариантных растворов, насыщенных и этой твердой фазой, координаты вершин соответствующих нонвариантных изогидрических областей, комбинацией полученных результатов устанавливают составы всех равновесных твердых фаз для подтверждения типов фазовых взаимодействий в полученных подсистемах и доказательства отсутствия других твердых фаз, не прибегая к их изоляции от жидкой.
Вышеперечисленная совокупность существенных признаков позволяет получить следующий технический результат: получение надежных данных о растворимости в системе, исключающих даже гипотетическую возможность появления неизученных фазовых областей, упрощение процесса изучения изотерм растворимости и возможность определения состава равновесной твердой фазы без ее изоляции от жидкой фазы в четырех- и более компонентных системах.
Ниже приведены примеры осуществления изобретения.
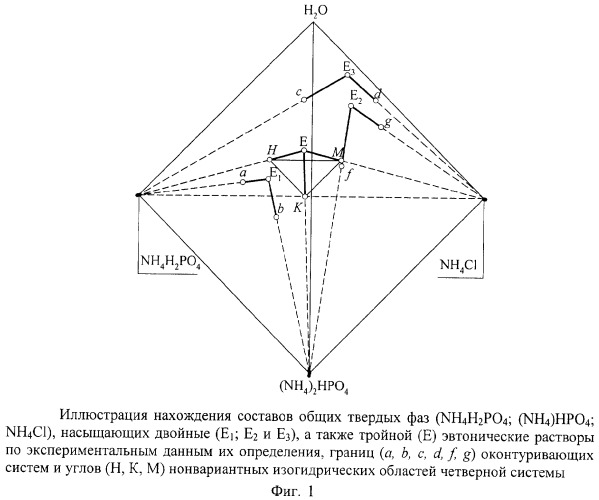
Пример 1. Определение типа фазовых взаимодействий в четверной водно-солевой системе простого эвтонического типа с кристаллизацией безводных индивидуальных исходных солевых компонентов без изоляции твердых фаз.
Демонстрацию доказательства отсутствия в системе новой твердой фазы и определения составов равновесных твердых фаз проведем на примере простой четверной системы эвтонического типа: NH4H2PO4-(NH4)2HPO4-NH4Cl-H2O при 20°С [Мазунин С.А., Ч.2, стр.230].
Исходные данные для определения составов равновесных твердых фаз и типа фазовых равновесий в четверной системе NH4H2PO4-(NH4)2HPO4-NH4Cl-H2О при 20°С сведены в табл.1-4 и изображены на фиг.1.
| Таблица 1Составы эвтонических растворов системы NH4H2PO4-(NH4)2HPO4-NH4Cl-Н2О при 20°С | |||||
| Точка | Состав насыщенного раствора, мас.% | ТвердаяФаза | |||
| NH4H2PO4 | (NH4)2HPO4 | NH4Cl | Н2О | ||
| E1 | 25 | 32.7 | 0 | 42.3 | NH4H2PO4+(NH4)2HPO4 |
| E3 | 5.2 | 0 | 25.4 | 69.4 | NH4H2PO4+NH4Cl |
| E2 | 0 | 12.9 | 22.4 | 64.7 | (NH4)2HPO4+NH4Cl |
| E | 16 | 23.2 | 11.5 | 49.3 | (NH4)2HPO4+NH4Cl+NH4H2PO4 |
| Таблица 2Вершины нонвариантной области в изогидрическом разрезе четверной системы NH4H2PO4-(NH4)2HPO4-NH4Cl-Н2О при 20°С | |||||
| Точка | Состав, мас.% | Примечание | |||
| NH4H2PO4 | (NH4)2HPO4 | NH4Cl | Н2О | Точка на ноде: | |
| Н | 31.8 | 18.8 | 9.4 | 40.0 | Е-NH4H2PO4 |
| K | 13.0 | 37.7 | 9.3 | 40.0 | E-(NH4)2HPO4 |
| М | 13.0 | 18.8 | 28.2 | 40.0 | E-NH4Cl |
Данные, приведенные в табл.1, получены прогностическим методом в результате вычисления предполагаемых составов двойных и тройного эвтонических растворов, двух оптимальных составов ИСК для каждого эвтонического раствора, проведения эксперимента по насыщению жидких фаз и аналитическому определению их состава.
Данные, приведенные в табл.2 и 3, получены методом сечений в результате экспериментального исследования изогидрического разреза четверной системы.
Для нахождения составов равновесных твердых фаз в четверной системе (табл.4) устанавливаем точки пересечения предельных нод, приходящих в одну и ту же твердую фазу, заданных составами нонвариантных жидких фаз, координатами границ в оконтуривающих системах и вершин нонвариантной области изогидрического разреза системы.
| Таблица 3Границы нонвариантных областей изогидрических сечений тройных оконтуривающих систем | |||||
| Точка | Состав, мас.% | Примечание | |||
| NH4H2PO4 | (NH4)2HPO4 | NH4Cl | Н2О | Точка на ноде: | |
| а | 29.1 | 30.9 | 0.0 | 40.0 | E1-NH4H2PO4 |
| b | 23.6 | 36.4 | 0.0 | 40.0 | E1-(NH4)2HPO4 |
| с | 45.4 | 0.0 | 14.6 | 40.0 | E3-NH4H2PO4 |
| d | 3.0 | 0.0 | 57.0 | 40.0 | E3-NH4Cl |
| f | 0.0 | 46.2 | 13.8 | 40.0 | E2-(NH4)2HPO4 |
| g | 0.0 | 12.2 | 13.8 | 40.0 | E2-NH4Cl |
| Таблица 4Вычисленные составы твердых фаз | |||||
| № | Состав твердой фазы, мас.% | Примечание | |||
| п/п | NH4H2PO4 | (NH4)2HPO4 | NH4Cl | Н2О | Пересечение нод |
| 1 | 99.95 | 0.00 | 0.01 | 0.04 | Е1-a и Е-Н |
| 2 | 99.95 | 0.00 | 0.01 | 0.04 | Е3-c и Е-Н |
| 3 | -0.01 | 99.99 | 0.00 | 0.01 | Е1-b и E-K |
| 4 | 0.00 | 99.97 | 0.00 | 0.03 | Е2-f и E-K |
| 5 | 0.00 | 0.00 | 99.90 | 0.04 | Е3-d и E-M |
| 6 | 0.00 | -0.01 | 99.92 | 0.03 | Е2-g и E-M |
На фиг.1 белыми кружками изображены экспериментальные составы насыщенных растворов, границ изогидрических нонвариантных областей, черными кружками - установленные предлагаемой процедурой точки пересечения предельных нод. Сплошными жирными линиями показаны "задающие части" предельных нод, пунктирными линиями - их продолжения до точек взаимного пересечения, тонкими сплошными представлены границы нонвариантной области.
Результаты определения составов равновесных твердых фаз, приведенные в табл.4 и изображенные на фиг.1, доказывают факт насыщения тройного эвтонического раствора системы безводными исходными солевыми компонентами и отсутствия в системе новой твердой фазы.
Далее исследуются линии моновариантных равновесии (ЕЕ1, ЕЕ3, EE2) и поверхности кристаллизации трех исходных солевых компонентов.
Пример 2. Определение типа фазовых взаимодействий в тройной водно-солевой системе простого эвтонического типа с образованием химического соединения солевыми компонентами без изоляции твердых фаз.
Демонстрацию процедуры определения в тройной системе новой твердой фазы и определения составов равновесных твердых фаз проведем на системе Na2SO4-Na2СО3-Н2О при 50°С, в которой образуется химическое соединение состава Na2CO3·2Na2SO4 - беркеит. Система триангулируется на две тройные подсистемы: Na2SO4-Na2CO3·2Na2SO4-Н2О и Na2CO3·2Na2SO4-Na2CO3-Н2О, каждая из которых содержит соответствующий нонвариантный раствор (Е1 и Е2), насыщенный двумя твердыми фазами [Здановский А.Б., Т.1. стр.114]. Составы растворов E1 и Е2, определяемые химическими анализами, границы фазовых областей с и d, устанавливаемые методом сечений, задают ноды, пересекающиеся в составе химического соединения.
Исходные данные для определения составов равновесных твердых фаз и типа фазовых равновесии в тройной системе Na2SO4-Na2СО3-Н2О при 50°С сведены в табл.5-7 и изображены на фиг.2.
| Таблица 5Составы нонвариантных растворов системы Na2SO4-Na2СО3-Н2О при 50°С | ||||
| Точка | Состав насыщенного раствора, мас.% | Твердая фаза | ||
| Na2SO4 | Na2СО3 | Н2О | ||
| R2 | 31.8 | 0 | 68.2 | Na2SO4 |
| E1 | 24.6 | 8.4 | 67.0 | Na2SO4+Na2CO3·2Na2SO4 |
| Е2 | 4.2 | 29.5 | 66.3 | Na2CO3·2Na2SO4+Na2CO3·Н2О |
| R3 | 0 | 32.2 | 67.8 | Na2СО3·Н2О |
Данные, приведенные в табл.5, получены аналитическими определениями состава двойных эвтонических растворов (Е1 и Е2) и двух составов насыщенных растворов сульфата и карбоната натрия в воде (R2 и R3) после проведения термостатирования ИСК и установления равновесия. Данные, приведенные в табл.6, получены методом сечений.
Для нахождения составов равновесных твердых фаз в тройной системе (табл.7) устанавливаем точки пересечения предельных нод, приходящих в одну и ту же твердую фазу, заданных составами нонвариантных жидких фаз, координатами границ в тройной системе нонвариантных областей изогидрических сечений.
| Таблица 6Границы нонвариантных областей изогидрических сечений | ||||
| Точка | Состав насыщенного раствора, мас.% | ПримечаниеТочка на ноде: | ||
| Na2SO4 | Na2СО3 | Н2О | ||
| а | 43.00 | 0.00 | 57.00 | R2-Na2SO4 |
| b | 35.85 | 7.15 | 57.00 | E1-Na2SO4 |
| с | 31.80 | 11.20 | 57.00 | E1-Na2CO3·2Na2SO4 |
| d | 11.76 | 29.24 | 59.00 | Е2-Na2CO3·2Na2SO4 |
| f | 3.61 | 37.39 | 59.00 | Е2-Na2CO3·H2O |
| g | 0.00 | 41.00 | 59.00 | R3-Na2CO3·H2O |
На фиг.2 белыми кружками изображены экспериментальные составы насыщенных растворов, границ нонвариантных областей изогидрических сечений, черными кружками - установленные предлагаемой процедурой точки пересечения предельных нод. Сплошными жирными линиями показаны "задающие части" предельных нод, пунктирными линиями - их продолжения до точек взаимного пересечения.
Результаты определения составов равновесных твердых фаз, приведенные в табл.7 и изображенные на фиг.2, доказывают факт образования конгруэнтно растворимого химического соединения - Na2CO3·2Na2SO4, наличия в системе двух нонвариантных двояконасыщенных эвтонических растворов относительно сульфата натрия и химического соединения, моногидрата карбоната натрия и химического соединения.
| Таблица 7Установленные составы твердых фаз | ||||
| № п/п | Состав твердой фазы, мас.%/Мольное соотношение компонентов | ПримечаниеПересечение нод: | ||
| Na2SO4 | Na2СО3 | Н2О | ||
| 1 | 100.20/1.00 | 0.00/0.00 | -0.20/-0.00 | R2-a и E1-b; |
| 2 | 72.79/2.00 | 27.14/1.00 | 0.07/0.02 | E1-c и E2-d; |
| 3 | 0.00/0.00 | 85.67/1.00 | 14.33/0.99 | R3-g и E2-f. |
Пример 3. Определение типа фазовых взаимодействий в четверной водно-солевой системе Na2SO4-Na2CO3-NaCl-Н2О с кристаллизацией инконгруэнтно растворимого химического соединения Na2CO3·2Na2SO4 без изоляции твердых фаз.
Демонстрацию доказательства присутствия в системе новой твердой фазы, определения ее состава и составов остальных равновесных твердых фаз проведем на примере изотермы простой четверной системы с образованием двойного химического соединения Na2SO4-Na2CO3-NaCl-Н2О при 50°С, в которой образуется химическое соединение состава Na2CO3·2Na2SO4 - беркеит.
Система триангулируется на две четверные подсистемы: Na2SO4-Na2CO3·2Na2SO4NaCl-Н2О и Na2CO3·2Na2SO4-Na2CO3-NaCl-Н2О, каждая из которых содержит соответствующий нонвариантный раствор (Р и Е), насыщенный тремя твердыми фазами. [Здановский А.Б., Т.2. стр.694]. Составы растворов Р и Е, определяемые химическими анализами, углы нонвариантных областей изогидрического разреза R и W, устанавливаемые методом сечений, задают ноды, пересекающиеся в составе химического соединения.
Исходные данные для определения составов равновесных твердых фаз и типа фазовых равновесии в четверной системе Na2SO4-Na2CO3-NaCl-Н2O при 50°С сведены в табл.8-14 и изображены на фиг.3, 4.
Данные, приведенные в табл.8, получены аналитическими определениями составов жидких фаз после установления равновесия в соответствующих ИСК. Данные, приведенные в табл.9-10, получены методом сечений.
Для нахождения составов равновесных твердых фаз в четверной системе (табл.11-14) устанавливаем точки пересечения предельных нод, задаваемых составами нонвариантных жидких фаз, координатами границ в оконтуривающих системах и вершин нонвариантной области изогидрического разреза системы, приходящих в одну и ту же твердую фазу.
| Таблица 8Составы нонвариантных растворов системы Na2SO4-Na2CO3-NaCl-Н2О при 50°С | |||||
| Точка | Состав насыщенного раствора, | ||||
| мас.% | Твердая | ||||
| NaCl | Na2SO4 | Na2CO3 | Н2О | Фаза | |
| Е1 | 0.0 | 24.6 | 8.4 | 67.0 | Na2SO4+Na2CO3·2Na2SO4 |
| Е2 | 0.0 | 4.2 | 29.5 | 66.3 | Na2CO3·2Na2SO4+Na2CO3·H2O |
| E3 | 24.10 | 5.55 | 0.00 | 70.35 | NaCl+Na2SO4 |
| Е4 | 18.3 | 0 | 14.1 | 67.6 | Na2CO3·H2O+NaCl |
| Р | 22.9 | 5.4 | 2.0 | 69.7 | NaCl+Na2SO4+Na2CO3·2Na2SO4 |
| Е | 17.8 | 1.3 | 13.6 | 67.3 | NaCl+Na2CO3·2Na2SO4+Na2CO3·H2O |
| Таблица 9Границы нонвариантных областей изогидрических сечений тройных оконтуривающих систем в четверной Na2SO4-Na2CO3-H2O при 50°С | |||||
| Точка | Состав, мас.% | ПримечаниеТочка на ноде: | |||
| NaCl | Na2SO4 | Na2CO3 | H2O | ||
| b | 0.00 | 35.85 | 7.15 | 57.00 | E1-Na2SO4 |
| с | 0.00 | 31.80 | 11.20 | 57.00 | E1-Na2CO3·2Na2SO4 |
| d | 0.00 | 11.76 | 29.24 | 59.00 | E2-Na2CO3·2Na2SO4 |
| f | 0.00 | 3.61 | 37.39 | 59.00 | E2-Na2CO3·H2O |
| q | 35.27 | 4.73 | 0.00 | 60.00 | Е3-NaCl |
| s | 20.55 | 19.45 | 0.00 | 60.00 | E3-Na2SO4 |
| k | 27.49 | 0.00 | 12.51 | 60.00 | E4-NaCl |
| m | 15.68 | 0.00 | 24.32 | 60.00 | E4-Na2CO3·H2O |
| Таблица 10Вершины нонвариантной области в изогидрическом разрезе четверной системы Na2SO4-Na2CO3-H2O при 50°С | |||||
| Точка | Состав, мас.% | Примечание | |||
| NaCl | Na2SO4 | Na2CO3 | H2O | Точка на ноде: | |
| H | 34.74 | 4.57 | 1.69 | 59.00 | P-NaCl |
| N | 19.38 | 19.92 | 1.69 | 59.00 | P-Na2SO4 |
| R | 19.38 | 15.75 | 5.87 | 59.00 | P-Na2CO3·2Na2SO4 |
| Т | 27.94 | 1.14 | 11.92 | 59.00 | E-NaCl |
| V | 15.00 | 1.10 | 24.90 | 59.00 | E-Na2CO3·H2O |
| W | 15.60 | 10.12 | 15.27 | 59.00 | E-Na2CO3·2Na2SO4 |
На фиг.3 белыми кружками изображены экспериментальные составы нонвариантных насыщенных растворов, границ и вершин изогидрических нонвариантных областей, черными кружками - установленные предлагаемой процедурой точки пересечения предельных нод. Сплошными жирными линиями показаны "задающие части" предельных нод, пунктирными линиями - их продолжения до точек взаимного пересечения, тонкими сплошными представлены границы нонвариантных областей.
| Таблица 11.Результаты применения процедуры по определению равновесной твердой фазы для NaCl | |||||
| № п/п | Состав твердой фазы, мас.% | Примечание | |||
| NaCl | Na2SO4 | Na2СО3 | Н2О | Пересечение нод: | |
| 1 | 99.93/1.00 | -0.02/0.00 | 0.00/0.00 | 0.09/0.00 | Е3-q и Р-H |
| 2 | 99.87/1.00 | -0.01/0.00 | 0.00/0.00 | 0.14/0.00 | Е3-q и E4-k |
| 3 | 102.28/1.00 | -0.03/0.00 | -0.40/0.00 | -1.85/-0.06 | E4-k и Е-Т |
| 4 | 100.09/1.00 | 0.00/0.00 | -0.03/0.00 | -0.06/0.00 | Р-Н и Е-Т |
| Сред. | 100.55 | -0.02 | -0.11 | -0.42 | Средний состав |
| Таблица 12.Результаты применения процедуры по определению равновесной твердой фазы для Na2СО3·Н2О | |||||
| № п/п | Состав твердой фазы, мас.% | Примечание | |||
| NaCl | Na2SO4 | Na2CO3 | H2O | Пересечение нод: | |
| 1 | -0.31/-0.01 | 0.00/0.00 | 86.69/1.00 | 13.62/0.93 | E4-m и Е-V |
| 2 | 0.00/0.00 | 0.02/0.00 | 85.41/1.00 | 14.57/1.00 | E4-m и E2-f |
| 3 | 0.00/0.00 | 0.01/0.00 | 85.50/1.00 | 14.49/1.00 | Е2-f и E-V |
| Сред. | -0.10 | 0.01 | 85.86 | 14.23 | Средний состав |
| Таблица 13.Результаты применения процедуры по определению равновесной твердой фазы для Na2CO3·2Na2SO4 | |||||
| № п/п | Состав твердой фазы, мас.% | Примечание | |||
| NaCl | Na2SO4 | Na2CO3 | H2O | Пересечение нод: | |
| 1 | 0.00/0.00 | 72.90/2.00 | 27.18/1.00 | -0.08/-0.02 | E1-c и P-R |
| 2 | 0.00/0.00 | 72.79/2.00 | 27.14/1.00 | 0.07/0.02 | E1-c и Е2-d |
| 3 | 0.00/0.00 | 72.85/2.00 | 27.14/1.00 | 0.01/0.00 | E2-d и E-W |
| 4 | -0.08/-0.01 | 72.96/2.00 | 27.26/1.00 | -0.14/-0.03 | P-R и E-W |
| Сред. | -0,02 | 72,89 | 27,18 | -0,04 | Средний состав |
Фиг.4 иллюстрирует взаимное расположение солевых составов двойных (E1, E2, Е3, E4), тройных (Р, Е) нонвариантных растворов, углов (H, R, N, Т, V, W) и границ (b, с, d, f, т, k, q, s) нонвариантных изогидрических областей четверной системы на перспективной проекции четверной системы. На фиг.4 белыми кружками изображены солевые составы насыщенных растворов, границы изогидрических нонвариантных областей, белыми треугольниками - солевые составы трояконасыщенных нонвариантных растворов и углы изогидрических нонвариантных областей. Сплошными жирными линиями показаны границы изогидрических нонвариантных областей, тонкими сплошными представлены условно прямолинейные границы моновариантных областей совместной кристаллизации двух твердых фаз.
| Таблица 14.Результаты применения процедуры по определению равновесной твердой фазы для Na2SO4 | |||||
| № п/п | Состав твердой фазы, % мас. | Примечание | |||
| NaCl | Na2SO4 | Na2CO3 | H2O | Пересечение нод: | |
| 1 | 0.06/0.00 | 99.69/1.00 | 0.00/0.00 | 0.25/0.02 | E3-s и E1-b |
| 2 | -0.24/-.01 | 100.86/1.00 | 0.00/0.00 | -0.62/-0.05 | E3-s и P-N |
| 3 | 0.00/0.00 | 100.08/1.00 | -0.01/0.00 | -0.07/-0.01 | P-N и E1-b |
| Сред. | -0.06 | 100.21 | 0 | -0.15 | Средний состав |
Результаты определения составов равновесных твердых фаз, приведенные в табл.11-14 и изображенные на фиг.3 и 4, доказывают факт насыщения обоих трояко насыщенных нонвариантных растворов системы безводным химическим соединением Na2CO3·2Na2SO4, состав которого установлен без его изоляции. Данные табл.10 наглядно показывают параллельность отрезков HN и RN сторонам солевого основания тетраэдра состава, что доказывает кристаллизацию безводных NaCI и Na2SO4. Отрезки TV и WV непараллельны сторонам солевого основания тетраэдра состава, что свидетельствует о наличии кристаллогидрата Na2CO3·H2O.
Далее исследуются линии моновариантных равновесии (EE2, EE4, ЕР, РЕ1, РЕ3) и поверхности кристаллизации трех исходных солевых компонентов и химического соединения.
Приведенные данные показывают, что погрешности определения составов равновесных твердых фаз являются удовлетворительными и не превышает 0.5 мас.%.
Из описания и практического применения настоящего изобретения специалистам будут очевидны и другие частные формы его выполнения. Данное описание и примеры рассматриваются как материал, иллюстрирующий изобретение, сущность которого и объем патентных притязаний определены в нижеследующей формуле изобретения, совокупностью существенных признаков и их эквивалентами.
1. Способ изучения растворимости в многокомпонентных водно-солевых системах, включающий экспериментальное определение состава равновесной жидкой фазы исходной смеси компонентов оптимального состава, измерение какого-либо легко определяемого физического свойства жидкой фазы после установления равновесия других исходных смесей компонентов, располагающихся строго определенным образом, строят график "состав-свойство", определяют границы полей с разным фазовым состоянием, отличающийся тем, что твердые фазы устанавливают по точкам пересечения предельных нод, приходящих в одну и ту же твердую фазу, задаваемых координатами экспериментально определенных составов нонвариантных жидких фаз, границ в оконтуривающих системах и вершин нонвариантных областей изогидрических разрезов системы без изоляции, разделения и дополнительной идентификации донных фаз, при этом ориентация границ нонвариантной области к сторонам солевой (безводной) концентрационной фигуры разреза изучаемой системы определяет тип фазового взаимодействия в ней, а параллельность этих границ сторонам концентрационной фигуры изогидрического разреза свидетельствует о кристаллизации из нонвариантного раствора безводных солевых компонентов, слагающих данную фигуру, а не параллельность границ нонвариантной области сторонам концентрационной фигуры изогидрического разреза указывает на образование новой твердой фазы или кристаллогидратов в системе.
2. Способ по п.1, отличающийся тем, что при наличии новой твердой фазы соответствующим образом триангулируют исходную систему, экспериментально определяют все составы нонвариантных растворов, насыщенных и этой твердой фазой, координаты вершин соответствующих нонвариантных изогидрических областей и комбинацией полученных результатов устанавливают составы всех равновесных твердых фаз для подтверждения типов фазовых взаимодействий в полученных подсистемах и доказательства отсутствия других твердых фаз не прибегая к их изоляции от жидкой.