Способ временного сосудистого шунтирования при трансплантации и аутотрансплантации печени
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к хирургии. Осуществляют канюляцию правого предсердия, воротной и нижней полой вен. Выполняют нижнекавально-порто-правопредсердный обход на агепатическом этапе операции. При этом правое предсердие канюлируют через супрапеченочный сегмент нижней полой вены в условиях ее бокового отжатия. Доступ к ней получают путем рассечения сухожильного центра диафрагмы и нижней стенки перикарда. Воротную и нижнюю полую вены канюлируют на фоне сохраненного кровотока в условиях их бокового отжатия. Канюли соединяют посредством двух тройников между собой и канюлей, установленной в правое предсердие, а также системой для герметизации и контроля проходимости обхода. Вены пересекают дистальнее зон их канюлюции после включения системы временного сосудистого шунтирования и функционирование ее поддерживают весь агепатический период операции до этапа завершения сосудистой реконструкции. После этого канюли последовательно извлекают из просвета вен в условиях их бокового отжатия. Способ расширяет арсенал средств для временного сосудистого шунтирования при трансплантации и аутотрансплантации печени. 5 ил.
Реферат
Изобретение относится к медицине, а именно к хирургии, и может быть использовано для временного шунтирования магистрального кровотока при аутотрансплантации и трансплантации печени при ее первичных и вторичных опухолях и хронических диффузных заболеваниях.
Традиционные подходы в лечении тяжелых хронических диффузных поражений печени, нерезектабельных опухолей, ряда другой патологии печени отличаются крайне низкой эффективностью и по сути своей бесперспективны, так как не улучшают качество жизни этих пациентов, не увеличивают продолжительность их жизни - быстро прогрессирующее течение заболеваний приводит к неминуемой гибели всех без исключения больных.
Наиболее эффективным и радикальным методом лечения данных заболеваний является аутотрансплантация и трансплантация печени.
Основополагающим моментом при аутотрансплантации и трансплантации печени является адекватное поддержание системной гемодинамики и протезирование портального кровотока в агепатическом периоде. В целом, агепатический период при трансплантации и аутотрансплантации печени может проводится в условиях:
- отжатия магистральных сосудов (пережатия над- и подпеченочного отдела нижней полой вены и воротной вены без последующего временного протезирования магистрального кровотока);
- временного протезирования магистрального кровотока по нижней полой и воротной венам.
Методика отжатия над- и подпеченочного отдела нижней полой вены и воротной вены без временного сосудистого протезирования имеет ряд недостатков. Во-первых, полное прекращение кровотока по нижней полой и воротной венам приводит к нестабильности системной гемодинамики вследствие резкого снижения объема циркулирующей крови и венозного возврата к сердцу. Это требует незамедлительной коррекции значительными инфузионными объемами коллоидов и кристаллоидов, что может привести к перегрузке в малом круге кровообращения и, как следствие, возникновению в послеоперационном периоде РДСВ-синдрома. Более чем в 40% случаев приходится отказываться от намеченной тактики оперативного вмешательства, так как возникает угроза жизни пациента. Прекращение кровотока по воротной вене сопряжено с риском развития острого мезентериального венозного тромбоза.
Метод временного протезирования магистрального кровотока обладает рядом преимуществ по отношению к вышеописанной методике, поэтому его использование при аутотрансплантации и трансплантации является более предпочтительным.
В качестве аналога взят способ бедренно-порто-подмышечного обхода при аутотрансплантации печени, предложенный R.Pichlmayr в 1988 г. [Pichlmayr R., Bretschneider H.J., Kirchner et coll. Ex situ operation and der leber. Eine neue Moglichkeit in der Leberchirurgie. // Langenbecks Arch. Chir. - 1988. - P.373-122-126.]. Способ заключается в следующем. Выделяют левую подмышечную вену и большую подкожную вену бедра слева. Затем гепаринизированными армированными трубками канюлируют нижнюю полую вену через выделенную большую подкожную вену слева, воротную вену - через нижнюю чревную вену и верхнюю полую вену - через левую подмышечную вену. Через тройник соединяют бассейны нижней полой и воротной вен и подключают к приводящей части принудительного насоса подачи крови, а бассейн верхней полой вены - в отводящую часть насоса. Пережимая под- и надпеченочные отделы нижней полой вены и включая насос, получают вено-венозный байпас.
Недостатки:
1. Технически трудно адекватно контролировать и устанавливать необходимую скорость кровотока в контуре с насосом. В противном случае, при замедлении кровотока возникают благоприятные условия для тромбообразования как в контуре, так и в магистральных сосудах, либо возникновения реперфузионного синдрома при восстановлении адекватной скорости кровотока.
2. Данная методика не позволяет обеспечить адекватный венозный возврат крови к сердцу, что опасно развитием выраженных гемодинамических расстройств в агепатическом этапе и реперфузионного синдрома.
3. При ограниченном притоке крови насосы развивают высокое отрицательное давление в контуре, приводящее к возникновению кавитации крови, что может привести к воздушной эмболии.
4. При блоке в отводящей части (переломе контура или миграции канюли) возникает опасность повышения давления в контуре и, как следствие, разгерметизации контура - кровотечение и нарушение функции байпаса.
5. За счет принудительного движения крови через аппаратную часть контура наблюдается выраженный гемолиз эритроцитов, что увеличивает объем интраоперационной кровопотери, существенно повышает риск развития острой почечной недостаточности.
6. За счет канюляции нижней полой и верхней полой вен через ее притоки (бедренную и левую подключичную вены) увеличивается длина байпаса и, как следствие, резкое возрастание вероятности тромбоза системы и уменьшение объемной скорости кровотока по системе.
7. Требует системной гепаринизации, что существенно увеличивает интраоперационную кровопотерю.
8. Использование насосов крови приводит к повышению себестоимости операции за счет дорогостоящих одноразовых расходных материалов и высокой стоимости самого аппарата.
В качестве ближайшего аналога взят способ, предложенный Fonkalsrud с соавторами в 1968 году [Ю.М.Дедерер, Н.П.Крылова. Атлас операций на печени. - М.: «Медицина», 1975. - С.197, рис.235.]. Способ заключается в следующем. После выполнения лапаро-торако-френо-перикардиотомии, производят канюляцию правого предсердия через его ушко силиконизированной трубкой в центре предварительно наложенного кисетного шва, который затягивают. Пересекают воротную вену ниже ее бифуркации в воротах печени и в дистальный ее отрезок вводят вторую силиконизированную трубку. Трубку прочно фиксируют к стенке воротной вены шелковой лигатурой. При помощи трехходового крана удаляют воздух из канюлей и восстанавливают отток крови от воротной системы. Затем пересекают нижнюю полую вену на 5-6 см ниже печеночных вен и в ее просвет устанавливают третью трубку, которую также укрепляют и подключают к трехходовому крану. Получают нижнеполо-воротно-правопредсердный байпас.
Недостатки:
1. На этапе сосудистой реконструкции воротной и нижней полой вен необходимо прерывание работы байпаса и удаление канюли из просвета вены. Это может привести к тромбозу вен, возникновению острого дефицита венозного возврата крови к сердцу, сопровождающегося выраженными нарушениями, значительно увеличивает риск развития острой почечной недостаточности, массивного реперфузионного синдрома, некроза кишечника.
2. Данная методика не дает возможности контроля проходимости и адекватного функционирования сосудистого байпаса и требует системного введения антикоагулянтов, что может привести к существенному увеличению интраоперационной кровопотери.
3. Для формирования сосудистого байпаса по данной методике необходимым является выполнение стернотомии и широкой перикардиотомии, а также манипуляции непосредственно на сердце, что значительно увеличивает травматичность и длительность операции в целом.
Задачи:
1. Обеспечить гарантированную бесперебойную работу байпаса на этапе деваскуляризации и реконструкции, которая обуславливает стабильный кровоток и, следовательно, безопасность жизни пациента.
2. Обеспечить контроль проходимости байпаса и возможность локальной фракционной гепаринизации системы байпаса.
3. Обеспечить наложение байпаса из менее травматичного доступа.
Для решения поставленных задач выполняют лапаротомию, которую дополняют по сухожильному центру френотомией в проекции кавального отверстия диафрагмы и частичным рассечением нижних листков перикарда. Канюлируют воротную и нижнюю полую вены и осуществляют нижнекавально-порто-правопредсердный обход в агепатическом этапе операции, отличающийся тем, что правое предсердие канюлируют через супрапеченочный сегмент нижней полой вены в условиях ее бокового отжатия. При этом доступ к ней получают путем рассечения сухожильного центра диафрагмы и нижнего листка перикарда, а воротную и нижнюю полую вены канюлируют через передние стенки вен на фоне сохраненного кровотока в условиях их бокового отжатия, соединяют посредством двух тройников между собой канюлей, установленной в правое предсердие и системой для гепаринизации и контроля проходимости обхода. При этом вены пересекают дистальнее зон их канюляции после включения системы временного сосудистого шунтирования и функционирование ее поддерживают весь агепатический период операции до этапа завершения сосудистой реконструкции, после чего канюли последовательно извлекают из просвета вен в условиях их бокового отжатия.
По отношению к ближайшему аналогу заявляемый способ имеет следующий технический результат. Обеспечивает постоянную адекватную работу байпаса как на агепатическом этапе, так и на этапе сосудистой реконструкции, вследствие чего исключается возможность развития гемодинамических и тромботических осложнений. Не возникает опасности синдрома реперфузии. Структура байпаса дает возможность осуществлять контроль проходимости и проводить локальную гепаринизацию системы байпаса. Наложение байпаса происходит из менее травматичного доступа.
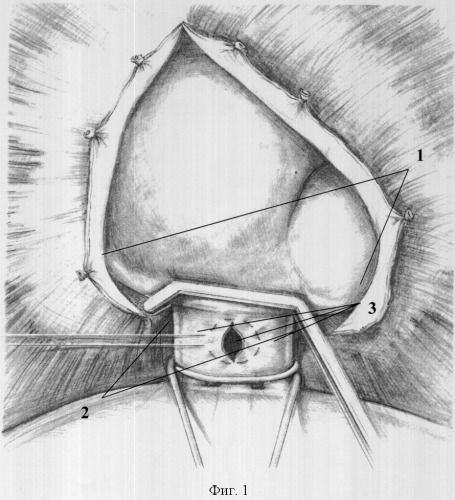
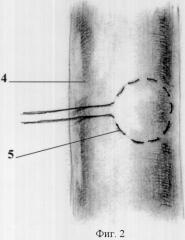
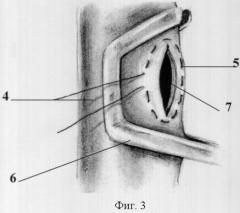
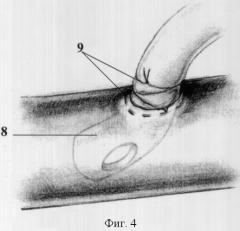
Способ поясняется чертежами 1-5, где фиг.1: 1 - рассеченный сухожильному центру в проекции кавального отверстия диафрагмы с нижним листком перикарда, 2 - турникет на нижней полой вене, 3 - кавальные ворота печени; фиг.2: 4 - участок вены, 5 - кисетный шов; фиг.3: 4 - участок вены, 5 - кисетный шов, 6 - сосудистый зажим, 7 - просвет вены; фиг.4: 8 - канюля, 9 - фиксация канюли к стенке вены; фиг.5: 10 - канюля в просвете правого предсердия. 11 - нижнекавально-порто-правопредсердный обход, 12 - сосудистые зажимы на супра- и инфрапеченочные сегментах нижней полой вены; 13 - сосудистый зажим на воротной вене, 14 - порт для гепаринизации.
Способ осуществляют следующим образом. После лапаротомии выполняют френотомию в проекции кавального отверстия диафрагмы с рассечением нижнего листка перикарда (1). Трансперикардиально, трансдиафрагмально и из брюшной полости выделяют супрапеченочный сегмент нижней полой вены, который берется на турникет (2) (интраперикардиально), обнажают кавальные ворота печени (3) (фиг.1). Выделяют инфрапеченочный сегмент нижней полой вены. Мобилизуют элементы гепатодуоденальной связки: выделяют общий желчный проток, гепатикохоледох, левый и правый долевые желчные протоки, общую печеночную артерию, основной ствол воротной вены и их ветви. На переднюю стенку инфрапеченочного сегмента нижней полой вены накладывают кисетный шов (фиг.2). В условиях бокового отжатия нижней полой вены в просвет вены устанавливают канюлю, конец которой ориентируют краниально (фиг.3). Канюлю фиксируют к стенке вены (фиг.4). На переднюю стенку воротной вены у верхнего края поджелудочной железы накладывают кисетный шов, в условиях бокового отжатия воротной вены в ее просвет устанавливают канюлю (фиг.4), которую направляют каудально. На переднюю стенку супрапеченочного сегмента нижней полой вены накладывают кисетный шов (фиг.2). В условиях бокового отжатия нижней полой вены в просвет вены устанавливают канюлю, при этом канюлю проводят в просвет правого предсердия под пальпаторным контролем (10).
С целью гепаринизации системы байпаса и контроля его проходимости через дополнительный порт системы (14, фиг.5) посредством шприца с периодичностью, зависящей от состояния системы гемостаза пациента, в просвет обхода подают фракционно раствор гепарина (20 ЕД в 1 мл), после этого оценивают функциональное состояние обхода. При адекватной проходимости обхода, непосредственно после введения раствора через прозрачную стенку силиконовой канюли, наблюдают движение прозрачного раствора током крови темного цвета со скоростью, прямо пропорциональной линейной скорости кровотока. При отсутствии кровотока в системе байпаса содержимое замещается прозрачным раствором, наполняющим его до момента устранения фактора, препятствующего ее перфузии.
Таким образом, формируют временный нижнекавально-порто-правопредсердный обход (11), в условиях которого накладывают сосудистые зажимы на супра- и инфрапеченочные сегменты нижней полой вены (12) и воротную вену (13) (фиг.5) и осуществляют последующие этапы операции.
После выполнения основного этапа операции в агепатический период (трансплантации либо аутотрансплантации печени) и восстановления целостности кровотока по системам воротной и нижней полой вен удаляют канюли из просвета вен на боковом отжатии с последующем ушиванием дефекта.
Заявляемый способ временного протезирования магистрального кровотока применен у 12 больных. 8 из них оперированы по поводу метастатического поражения печени с инвазией магистральных сосудов (нижней полой, воротной и печеночных вен), 4 - первичной гепатоцеллюлярной карциномы ворот печени больших размеров с инвазией сосудов портальных или кавальных ворот печени. Всем больным выполнена аутотрансплантация печени в варианте in situ или ex situ.
Общая частота послеоперационных осложнений: острая печеночная недостаточность - 17%, желчные затеки - 26%; острая сердечно-сосудистая недостаточность - 9%, внутрибрюшное кровотечение - 9%, внутрибрюшные жидкостные скопления - 26%. Госпитальная летальность составила 26%. Средняя интраоперационная кровопотеря - 1320,4±380,5 мл. Средний послеоперационный койко-день 14,5±3,5 суток. Специфических осложнений в связи с применением заявляемого способа байпаса не отмечено.
Возможность практического использования заявляемого способа иллюстрируется примером его выполнения в клинической практике.
Пример 1. Больной К., 50 лет поступил в клинику 11.09.2005 г. с диагнозом: первичный местнораспространенный рак печени T4NXMX (II, IV, VI, VIII сегменты) с инвазией левой и правой печеночных. II клиническая группа.
По данным инструментального обследования данных за наличие отдаленных метастазов не получено.
Выполнена операция: лапаротомия, дополненная френотомией в проекции кавального отверстия диафрагмы с рассечением нижнего листка перикарда. Трансперикардиально, трансдиафрагмально и из брюшной полости выделяют супрапеченочный сегмент нижней полой вены, который берется на турникет, обнажают канальные ворота печени. Выделяют инфрапеченочный сегмент нижней полой вены. Мобилизуют элементы гепатодуоденальной связки: выделяют общий желчный проток, гепатикохоледох, левый и правый долевые желчные протоки, общую печеночную артерию, основной ствол воротной вены и их ветви. На переднюю стенку инфрапеченочного сегмента нижней полой вены накладывают кисетный шов. В условиях бокового отжатия нижней полой вены в просвет вены устанавливают канюлю. Канюлю фиксируют к стенке вены. На переднюю стенку воротной вены у верхнего края поджелудочной железы накладывают кисетный шов, в условиях бокового отжатия воротной вены в ее просвет устанавливают канюлю. На переднюю стенку супрапеченочного сегмента нижней полой вены накладывают кисетный шов. В условиях бокового отжатия нижней полой вены в просвет вены устанавливают канюлю, при этом канюлю проводят в просвет правого предсердия под пальпаторным контролем. Таким образом, формируют временный нижнекавально-порто-правопредсердный обход, в условиях которого после наложения сосудистого зажима на супра- и инфрапеченочные сегменты нижней полой вены и воротной вену осуществляют консервацию и охлаждение печени; аутотрансплантацию I, III, V, VII сегментов печени (операция типа Pichlmayr), резекцию II, IV, VI, VIII сегментов печени "ex situ" с сохранением нижней полой вены, реконструкцию кавальных ворот печени, наружное дренирование холедоха через культю пузырного протока, дренирование полости перикарда, брюшной полости.
Больной был выписан на 12 сутки после операции в удовлетворительном состоянии.
Социально-экономическое значение. Разработанный способ позволяет значительно улучшить результаты трансплантации и аутотрансплантации печени при ее хронических диффузных поражениях, а также первичных или вторичных нерезектабельных опухолях печени, послеоперационных осложнений и величину кровопотери, летальности.
Способ временного сосудистого шунтирования при трансплантации и аутотрансплантации печени, включающий канюляцию правого предсердия, воротной и нижней полой вен и осуществление нижнекавально-порто-правопредсердного обхода в агепатическом этапе операции, отличающийся тем, что правое предсердие канюлируют через супрапеченочный сегмент нижней полой вены в условиях ее бокового отжатия, при этом доступ к ней получают путем рассечения сухожильного центра диафрагмы и нижней стенки перикарда, а воротную и нижнюю полую вены канюлируют на фоне сохраненного кровотока в условиях их бокового отжатия, канюли соединяют посредством двух тройников между собой и канюлей, установленной в правое предсердие, а также системой для герметизации и контроля проходимости обхода, при этом вены пересекают дистальнее зон их канюляции после включения системы временного сосудистого шунтирования и функционирование ее поддерживают весь агепатический период операции до этапа завершения сосудистой реконструкции, после чего канюли последовательно извлекают из просвета вен в условиях их бокового отжатия.