Новые антихолинергические средства, способ их получения, а также их применение в качестве лекарственных средств
Иллюстрации
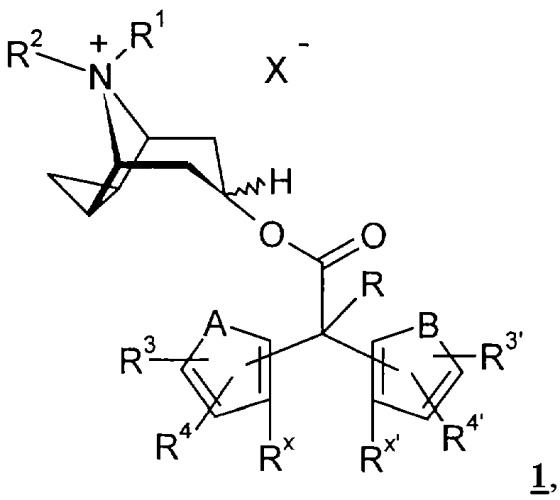
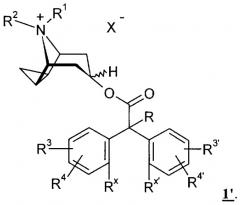
Показать всеНастоящее изобретение относится к производным циклопропилтропина общей формулы I
в которой X- обозначает однозарядный анион,
А и В обозначают -СН=СН-,
R обозначает водород, гидроксигруппу, -С1-С4алкил,
R1 и R2 имеют идентичные или различные значения и обозначают -C1-С5алкил,
R3, R4, R3′ и R4′ имеют идентичные или различные значения и обозначают водород или галоген,
Rх и Rx' совместно обозначают простую связь или мостиковую группу -О-,
необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей. Соединения формулы I являются антагонистами мускаринового рецептора подтипа 3, что позволяет предположить возможность их использования в качестве антихолинергического средства. Описаны также промежуточные соединения, используемые в синтезе соединений I, фармацевтические композиции на основе соединений I и применение последних для получения лекарственного средства, предназначенного для лечения астмы, спазмов, хронического обструктивного заболевания легких. 5 н. и 4 з.п. ф-лы.
Реферат
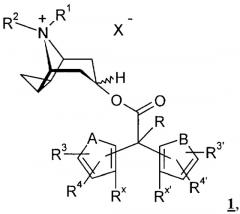
Настоящее изобретение относится к новым антихолинергическим средствам общей формулы 1
в которой Х- и остатки A, B, R, R1, R2, R3, R3', R4, R4', Rx и Rx' могут иметь указанные в формуле изобретения и в последующем описании значения,
к способу их получения, а также к их применению в качестве лекарственных средств.
Подробное описание изобретения
В настоящем изобретении предлагаются соединения общей формулы 1
в которой X- обозначает однозарядный анион, предпочтительно анион, выбранный из группы, включающей хлорид, бромид, иодид, сульфат, фосфат, метансульфонат, нитрат, малеат, ацетат, цитрат, фумарат, тартрат, оксалат, сукцинат, бензоат и n-толуолсульфонат,
А и В имеют идентичные или различные, предпочтительно идентичные, значения и обозначают -О-, -S-, -NH-, -CH2-, -CH=CH- или -N(С1-С4алкил)-,
R обозначает водород, гидроксигруппу, -С1-С4алкил, -С1-С4алкилоксигруппу, -С1-С4алкиленгалоген, -O-С1-С4алкиленгалоген, -С1-С4алкилен-ОН, -CF3, -CHF2, -С1-С4алкилен-С1-С4алкилоксигруппу, -O-СОС1-С4алкил, -O-СОС1-С4алкиленгалоген, -С1-С4алкилен-С3-С6циклоалкил, -О-COCF3 или галоген,
R1 и R2 имеют идентичные или различные значения и обозначают -С3-С5алкил, который необязательно может быть замещен -С3-С6циклоалкилом, гидроксигруппой или галогеном, или
R1 и R2 совместно обозначают -С3-С5алкиленовый мостик,
R3, R4, R3' и R4' имеют идентичные или различные значения и обозначают водород, С1-С4алкил, С1-С4алкилоксигруппу, гидроксигруппу, -CF3, -CHF2, CN, NO2 или галоген,
Rx и Rx' имеют идентичные или различные значения и обозначают водород, С1-С4алкил, С1-С4алкилоксигруппу, гидроксигруппу, -CF3, -CHF2, CN, NO2 или галоген либо
Rx и Rx' совместно обозначают простую связь или мостиковую группу, выбранную из -О-, -S-, -NH-, -CH2-, -СН2-СН2-, -N(С1-С4алкила)-, -СН(С1-С4алкила)- и -С(С1-С4алкила)2-.
Предпочтительны соединения общей формулы , в которых
X- обозначает однозарядный анион, выбранный из группы, включающей хлорид, бромид, 4-толуолсульфонат и метансульфонат, предпочтительно бромид,
А и В имеют идентичные или различные, предпочтительно идентичные, значения и обозначают -О-, -S-, -NH- или -СН=СН-,
R обозначает водород, гидроксигруппу, -С1-С4алкил, -С1-С4алкилоксигруппу, -CF3, -CHF2, фтор, хлор или бром,
R1 и R2 имеют идентичные или различные значения и обозначают С1-С4алкил, который необязательно может быть замещен гидроксигруппой, фтором, хлором или бромом, либо
R1 и R2 совместно обозначают -С3-С4алкиленовый мостик,
R3, R4, R3' и R4' имеют идентичные или различные значения и обозначают водород, С1-С4алкил, С1-С4алкилоксигруппу, гидроксигруппу, -CF3, -CHF2, CN, NO2, фтор, хлор или бром,
Rx и Rx' имеют идентичные или различные значения и обозначают водород, С1-С4алкил, С1-С4алкилоксигруппу, гидроксигруппу, -CF3, -CHF2, CN, NO2, фтор, хлор или бром либо
Rx и Rx' совместно обозначают простую связь или мостиковую группу, выбранную из -О-, -S-, -NH- и -CH2-.
Более предпочтительны соединения общей формулы , в которых
X- обозначает однозарядный анион, выбранный из группы, включающей хлорид, бромид и метансульфонат, предпочтительно бромид,
А и В имеют идентичные или различные, предпочтительно идентичные, значения и обозначают -S- или -СН=СН-,
R обозначает водород, гидроксигруппу, метил, этил, метилоксигруппу, этилоксигруппу, -CF3 или фтор,
R1 и R2 имеют идентичные или различные значения и обозначают метил, этил, -CH2F или -CH2-CH2F, предпочтительно метил или этил,
R3, R4, R3' и R4' имеют идентичные или различные значения и обозначают водород, метил, метилоксигруппу, -CF3 или фтор,
Rx и Rx' имеют идентичные или различные значения и обозначают водород, метил, метилоксигруппу, -CF3 или фтор либо
Rx и Rx' совместно обозначают простую связь или мостиковую группу -О-.
Согласно изобретению особо предпочтительны соединения общей формулы , в которых
X- обозначает однозарядный анион, выбранный из группы, включающей хлорид, бромид и метансульфонат, предпочтительно бромид,
А и В имеют идентичные или различные, предпочтительно идентичные, значения и обозначают -S- или -СН=СН-,
R обозначает водород, гидроксигруппу или метил,
R1 и R2 имеют идентичные или различные значения и обозначают метил или
R3, R4, R3' и R4' имеют идентичные или различные значения и обозначают водород, -CF3 или фтор, предпочтительно водород,
Rx и Rx' имеют идентичные или различные значения и обозначают водород, -CF3 или фтор, предпочтительно водород, либо
Rx и Rx' совместно обозначают простую связь или мостиковую группу -О-.
К особо предпочтительным соединениям согласно изобретению относятся далее соединения общей формулы , в которых
X- обозначает бромид,
А и В обозначают -СН=СН-,
R обозначает водород, гидроксигруппу или метил,
R1 и R2 обозначают метил,
R3, R4, R3' и R4' имеют идентичные или различные значения и обозначают водород или фтор, предпочтительно водород,
Rx и Rx' имеют идентичные или различные значения и обозначают водород или фтор, предпочтительно водород, либо
Rx и Rx' совместно обозначают простую связь или мостиковую группу -О-.
Объектом изобретения являются соответствующие соединения формулы , представленные при определенных условиях в виде отдельных оптических изомеров, смесей отдельных энантиомеров или рацематов, а также представленные при определенных условиях в виде их фармакологически приемлемых кислотно-аддитивных солей.
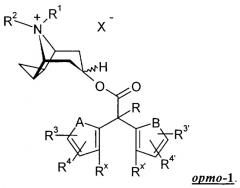
В соединениях общей формулы каждый из остатков R3, R4, R3' и R4', если они не обозначают водород, может находиться в орто-, мета- или пара-положении относительно места присоединения к группе "-C-R". Если ни один из остатков R3, R4, R3' и R4' не обозначает водород, то R3 и R3' предпочтительно присоединены в пара-положении, а R4 и R4' предпочтительно присоединены в орто- или мета-положении, наиболее предпочтительно в мета-положении. Если же один из остатков R3 и R4 и один из остатков R3' и R4' обозначает водород, то соответствующий другой остаток предпочтительно присоединен в мета- или пара-положении, наиболее предпочтительно в пара-положении. Если ни один из остатков R3, R4, R3' и R4' не обозначает водород, то особенно предпочтительны согласно изобретению те соединения общей формулы , в которых остатки R3, R4, R3' и R4' имеют идентичное значение.
Особое значение согласно изобретению имеют далее соединения общей формулы , в которых оба кольца, содержащие заместители А и В, расположены таким образом, что каждый из заместителей А и В имеет орто-конфигурацию относительно связи с атомом углерода группы "C-R". Эта конфигурация предпочтительна прежде всего в том случае, когда заместители А и В не обозначают группу -СН=СН-. Такие соединения соответствуют общей формуле
Особое значение имеют согласно изобретению соединения общей формулы , в которых А обозначает -СН=СН- и В обозначает -СН=СН-. Такие соединения соответствуют общей формуле
Особое значение согласно изобретению имеют далее те соединения общей формулы , в которых сложноэфирный заместитель имеет α-конфигурацию по отношению к азотсодержащему бициклу. Такие соединения соответствуют общей формуле
Предпочтительные согласно изобретению соединения общей формулы , в которых оба кольца, содержащие заместители А и В, расположены таким образом, что каждый из заместителей А и В имеет орто-конфигурацию относительно связи с атомом углерода группы "C-R", и в которых, кроме того, сложноэфирный заместитель имеет α-конфигурацию по отношению к азотсодержащему бициклу, соответствуют общей формуле α
Наиболее предпочтительные согласно изобретению соединения общей формулы , в которых А обозначает -СН=СН- и В обозначает -СН=СН- и в которых сложноэфирный заместитель имеет α-конфигурацию по отношению к азотсодержащему бициклу, соответствуют общей формуле
Особо важное значение имеют согласно изобретению следующие конкретные соединения:
- метобромид циклопропилтропинового эфира бензиловой кислоты,
- метобромид циклопропилтропинового эфира 2,2-дифенилпропионовой кислоты,
- метобромид циклопропилтропинового эфира 9-гидроксиксантен-9-карбоновой кислоты,
- метобромид циклопропилтропинового эфира 9-метилфлуорен-9-карбоновой кислоты,
- метобромид циклопропилтропинового эфира 9-метилксантен-9-карбоновой кислоты,
- метобромид циклопропилтропинового эфира 9-гидроксифлуорен-9-карбоновой кислоты,
- метобромид циклопропилтропинового эфира метилового эфира 4,4'-дифторбензиловой кислоты.
В контексте настоящего описания под алкильными группами подразумеваются, если не указано иное, разветвленные и неразветвленные алкильные группы с 1-4 атомами углерода. В качестве примера таких групп можно назвать метил, этил, пропил или бутил. Для обозначения подобных групп, т.е. метила, этила, пропила или же бутила, в некоторых случаях используются также соответствующие им сокращенные названия Me, Et, Prop или Bu. Если не указано иное, то в понятия "пропил" и "бутил" включены также все возможные изомерные формы каждого из таких остатков. Так, например, в понятие "пропил" включены н-пропил и изопропил, а в понятие "бутил" включены изобутил, втор-бутил и трет-бутил и т.д.
Под циклоалкильными группами подразумеваются, если не указано иное, алициклические группы с 3-6 атомами углерода. При этом речь идет о таких группах, как циклопропил, циклобутил, циклопентил и циклогексил. Особое значение в контексте настоящего изобретения имеет циклопропил.
Под алкиленовыми группами имеются в виду, если не указано иное, разветвленные и неразветвленные алкильные мостики с двумя связями и с 1-4 атомами углерода. В качестве примера при этом можно назвать метилен, этилен, пропилен или бутилен.
Алкиленгалогеновыми группами обозначаются, если не указано иное, разветвленные и неразветвленные алкильные мостики с двумя связями и с 1-4 атомами углерода, одно-, дву- или тризамещенные, предпочтительно двузамещенные, атомом галогена. Аналогичным образом алкилен-ОН-группы представляют собой, если не указано иное, разветвленные и неразветвленные алкильные мостики с двумя связями и с 1-4 атомами углерода, одно-, дву- или тризамещенные, предпочтительно однозамещенные, гидроксигруппой.
Под алкилоксигруппами подразумеваются, если не указано иное, разветвленные и неразветвленные алкильные группы с 1-4 атомами углерода, присоединенные через атом кислорода. В качестве примера при этом можно назвать метилокси-, этилокси-, пропилокси- или бутилоксигруппу. В некоторых случаях для обозначения таких групп, т.е. метилокси-, этилокси-, пропилокси- или же бутилоксигруппы, используются также соответствующие им сокращенные названия МеО-, EtO-, PropO- или BuO-. Если не указано иное, то в понятия "пропилоксигруппа" и "бутилоксигруппа" включены также все возможные изомерные формы каждого из таких остатков. Так, например, в понятие "пропилоксигруппа" включены н-пропилоксигруппа и изопропилоксигруппа, в понятие "бутилоксигруппа" включены изобутилоксигруппа, втор-бутилоксигруппа и трет-бутилоксигруппа и т.д. В некоторых случаях в настоящем описании вместо обозначения "алкилоксигруппа" используется также эквивалентное ему понятие "алкоксигруппа". В соответствии с этим для обозначения таких групп, как метилокси-, этилокси-, пропилокси- или же бутилоксигруппа, в некоторых случаях используются эквивалентные им понятия метокси", этокси-, пропокси- или бутоксигруппа.
Алкиленалкилоксигруппы представляют собой, если не указано иное, разветвленные и неразветвленные алкильные мостики с двумя связями и с 1-4 атомами углерода, одно-, дву- или тризамещенные, предпочтительно однозамещенные, алкилоксигруппой.
Под -O-СО-алкильными группами подразумеваются, если не указано иное, разветвленные и неразветвленные алкильные группы с 1-4 атомами углерода, присоединенные через сложноэфирную группу. При этом алкильные группы непосредственно присоединены к карбонильному атому углерода сложноэфирной группы. Аналогичным образом трактуется и понятие "-O-СО-алкилгалогеновая группа". Группа -O-СО-CF3 представляет собой трифторацетат.
Галоген в контексте настоящего изобретения представляет собой фтор, хлор, бром или иод. Если не указано иное, то фтор и бром являются предпочтительными галогенами. Группа СО представляет собой карбонильную группу.
Предлагаемые в изобретении соединения частично можно получать, как это более подробно описано ниже, аналогично уже известным из уровня техники методам (схема 1). Производные карбоновых кислот формулы 3 известны из уровня техники или их можно получать по известным из уровня техники методам синтеза. Если из уровня техники известны только соответствующим образом замещенные карбоновые кислоты, то соединения формулы 3 можно также непосредственно получать из них путем катализируемой кислотой или основанием этерификации соответствующими спиртами либо путем галогенирования соответствующими галогенирующими агентами.
Схема 1
Сложные эфиры общей формулы 4 получают исходя из соединений формулы 2 их взаимодействием с производными карбоновой кислоты формулы 3, в которых R' обозначает, например, хлор или С1-С4алкилоксигруппу. Если R' представляет собой С1-С4алкилоксигруппу, то такое взаимодействие можно проводить, например, в расплаве натрия при повышенной температуре, предпочтительно при примерно 50-150°С, наиболее предпочтительно при примерно 90-100°С, и при пониженном давлении, предпочтительно при давлении менее 500 мбар, наиболее предпочтительно менее 75 мбар. В другом варианте вместо производных формулы 3, в которых R' представляет собой С1-С4алкилоксигруппу, можно также использовать соответствующие хлорангидриды кислот (R обозначает Cl).
Полученные таким путем соединения формулы 4 их взаимодействием с соединениями формулы R2-X, в которых R2 и Х могут иметь указанные выше значения, можно перевести в требуемые соединения формулы 1. Эту стадию синтеза также можно проводить аналогично рассмотренным в WO 92/16528 примерам синтеза. В том случае, когда R1 и R2 совместно образуют алкиленовый мостик, добавления реагента R2-X, как это очевидно для специалиста, не требуется. В подобном случае соединения формулы 4 содержат соответствующим образом замещенный остаток R1 (например -С3-С5алкиленгалоген) согласно указанным выше для него значениям, а соединения формулы 1, получают при этом путем внутримолекулярной кватернизации амина.
В другом варианте соединения формулы 4, в которых R обозначает галоген, можно также получать методом, проиллюстрированным ниже на схеме 2.
Схема 2
В соответствии с этим методом соединения формулы 4, в которых R обозначает гидроксигруппу, переводят с применением приемлемых галогенирующих агентов в соединения формулы 4, в которых R обозначает галоген. Реакция галогенирования, проводимая в соответствии со схемой 2, достаточно хорошо известна из уровня техники.
Очевидно, что в реакции, проиллюстрированной на схеме 1, важное значение имеют промежуточные продукты общей формулы 4. В соответствии с этим еще одним объектом настоящего изобретения являются промежуточные соединения формулы 4
в которой остатки А, В, R, R1, R3, R3', R4, R4', Rx и Rx' могут иметь указанные выше значения, необязательно в виде их кислотно-аддитивных солей. Под такими кислотно-аддитивными солями при этом подразумеваются соли, выбранные из группы, включающей гидрохлорид, гидробромид, гидроиодид, гидросульфат, гидрофосфат, гидрометансульфонат, гидронитрат, гидромалеат, гидроацетат, гидроцитрат, гидрофумарат, гидротартрат, гидрооксалат, гидросукцинат, гидробензоат и гидро-n-толуолсульфонат, предпочтительны из которых гидрохлорид, гидробромид, гидросульфат, гидрофосфат, гидрофумарат и гидрометансульфонат.
В соединениях общей формулы 4 аналогично соединениям формулы 1 каждый из остатков R3, R4, R3' и R4', если они не обозначают водород, также может находиться в орто-, мета- или пара-положении относительно места присоединения к группе "-C-R". Если ни один из остатков R3, R4, R3' и R4' не обозначает водород, то R3 и R3' предпочтительно присоединены в пара-положении, а R4 и R4' предпочтительно присоединены в орто- или мета-положении, наиболее предпочтительно в мета-положении. Если же один из остатков R3 и R4 и один из остатков R3' и R4' обозначает водород, то соответствующий другой остаток предпочтительно присоединен в мета- или пара-положении, наиболее предпочтительно в пара-положении. Если ни один из остатков R3, R4, R3' и R4' не обозначает водород, то особенно предпочтительны согласно изобретению те соединения общей формулы 4, в которых остатки R3, R4, R3' и R4' имеют идентичное значение.
Согласно приведенной выше схеме 1 исходными продуктами для получения соединений 1 служат соединения 2. Эти соединения еще не известны из уровня техники. В соответствии с этим еще одним объектом настоящего изобретения являются соединения общей формулы 2
в которой R1 обозначает водород или -С1-С5алкил, который необязательно может быть замещен -С3-С6циклоалкилом, гидроксигруппой или галогеном, необязательно в виде их кислотно-аддитивных солей. Под такими кислотно-аддитивными солями при этом подразумеваются соли, выбранные из группы, включающей гидрохлорид, гидробромид, сульфат, фосфат, фумарат и метансульфонат.
Предпочтительны соединения общей формулы 2, в которой R1 обозначает водород или С1-С4алкил, который необязательно может быть замещен гидроксигруппой, фтором, хлором или бромом, необязательно в виде их кислотно-аддитивных солей.
Особо предпочтительны соединения общей формулы формулы 2, в которой R1 обозначает водород, метил, этил, -CH2F или -CH2-CH2F, предпочтительно метил или этил, необязательно в виде их кислотно-аддитивных солей.
Согласно изобретению особое значение имеют соединения 2, в которой R1 обозначает водород, метил или этил, необязательно в виде их кислотно-аддитивных солей.
Согласно изобретению предпочтительны далее соединения общей формулы 2, в которой R1 обозначает водород или метил, необязательно в виде их кислотно-аддитивных солей.
В качестве исходных соединения формулы 2 предпочтительно их использовать согласно изобретению в форме, в которой они имеют α-конфигурацию. В соответствии с этим такие соединения с α-конфигурацией имеют согласно изобретению особое значение и соответствуют общей формуле 2-α
Соединения общей формулы 2-α, в которой R1 обозначает метил, в последующем описании обозначаются как циклопропилтропин. При этом предполагается, что спиртовая группа находится в α-положении, a циклопропильная группа имеет экзо-конфигурацию (циклопропилтропин соответствует экзо-циклопропил-α-тропину). Соответствующее соединение с β-конфигурацией при определенных условиях обозначается как псевдо-циклопропилтропин, а эндо-изомер - как эндо-циклопропилтропин.
Следующим объектом настоящего изобретения является применение соединений общей формулы 2 для получения соединений общей формулы 4. Настоящее изобретение относится далее к применению соединений общей формулы 2 в качестве исходных соединений для получения соединений общей формулы 1.
Соединения общей формулы 2 можно получать аналогично известным из уровня техники методам исходя из соответствующих производных тропенола. В качестве примера приемлемых агентов циклопропилирования можно при этом назвать диазометан.
Ниже настоящее изобретение поясняется на примерах синтеза предлагаемых в нем соединений. Очевидно, что такие примеры носят исключительно иллюстративный характер и служат только для пояснения лежащих в основе изобретения принципов, не ограничивая его объема рассмотренными в последующем описании в качестве примеров конкретными вариантами его осуществления.
Получение соединения формулы 2
Циклопропилтропин 2а
К 35 мл (0,35 моля) 40%-ного водного раствора гидроксида калия добавляют 100 мл диэтилового эфира и охлаждают на ледяной бане. Далее порциями добавляют 23,64 г (0,101 моля) N-метил-N-нитрозомочевины и после этого перемешивают в течение примерно 10 мин. Эфирную фазу удаляют декантированием и полученный раствор используют на последующей стадии синтеза.
К раствору 4,01 г (0,028 моля) тропенола в 25 мл диэтилового эфира и 5 мл метанола при охлаждении на ледяной бане добавляют 25 мл полученного на предыдущей стадии раствора диазометана. После этого добавляют 53,4 мг (0,000139 моля) бис(бензонитрил)дихлорпалладия (II). Затем порциями добавляют еще 28 мл раствора диазометана. По истечении примерно 1,5 ч отгоняют растворитель в вакууме, полученный остаток экстрагируют, этот раствор фильтруют и растворитель удаляют путем перегонки.
Выход 4,25 г соединения 2а в виде желтоватых кристаллов (соответствует 96% от теории).
Пример 1: метобромид циклопропилтропинового эфира бензиловой кислоты
1.1: метиловый эфир бензиловой кислоты За
90 г (0,394 моля) бензиловой кислоты растворяют в 900 мл ацетонитрила и при 5°С по каплям смешивают с 109,6 г (0,72 моля) ДБУ. После добавления 204,4 г (1,44 моля) метилиодида смесь в течение 24 ч перемешивают при комнатной температуре (около 20-23°С). Затем раствор упаривают до образования остатка, который растворяют в диэтиловом эфире и экстрагируют водой. Органическую фазу промывают 5%-ным водным раствором карбоната натрия и водой, сушат и отгоняют растворитель. Продукт очищают путем перекристаллизации из циклогексана.
Выход 77,19 г белых кристаллов (соответствует 81% от теории).
Температура плавления 74-76°С.
1.2: циклопропилтропиновый эфир бензиловой кислоты 4а
5,34 г (0,022 моля) метилового эфира бензиловой кислоты 3а, 1,53 г (0,01 моля) соединения 2а и 0,25 г (0,01 моля) натрия в виде расплава в течение 1 ч нагревают при умеренном встряхивании и при давлении 75 мбар на бане с кипящей водой. После охлаждения остаток натрия растворяют ацетонитрилом, раствор упаривают досуха и остаток экстрагируют смесью дихлорметан/вода. Органическую фазу экстрагируют 10%-ным раствором гидросульфата калия, образовавшуюся в результате водную фазу подщелачивают и экстрагируют дихлорметаном. Органическую фазу отделяют, сушат и упаривают досуха. Продукт очищают путем перекристаллизации из ацетонитрила.
Выход 2,41 г белых кристаллов (соответствует 66% от теории).
1.3: метобромид циклопропилтропинового эфира бензиловой кислоты
0,46 г (0,0013 моля) соединения 4а растворяют в 5 мл ацетонитрила и перемешивают в находящемся под давлением реакционном сосуде при 80°С с 1,53 г (0,0082 моля) 50%-ного раствора метилбромида в ацетонитриле. Через 2 дня раствор упаривают досуха, остаток растворяют в ацетонитриле и фильтруют в горячем состоянии. После охлаждения выпавшие кристаллы отделяют, сушат и перекристаллизовывают из ацетонитрила.
Выход 0,066 г белых кристаллов (соответствует 11% от теории).
Температура плавления 208-209°С.
| Элементный анализ: рассчитано: | С 62,89, Н 6,16 N 3,06; |
| обнаружено: | С 62.98, Н 6,20 N 3,03. |
Пример 2: метобромид циклопропилтропинового эфира 2,2-дифенилпропионовой кислоты
2.1: хлорангидрид 2,2-дифенилпропионовой кислоты 3b
К суспензии 25,0 г (0,11 моля) 2,2-дифенилпропионовой кислоты, 100 мл дихлорметана и 4 капель диметилформамида при 20°С по каплям медленно добавляют 52,08 г (0,33 моля) оксалилхлорида. Смесь перемешивают в течение 1 ч при 20°С и в течение 0,5 ч при 50°С. После этого отгоняют растворитель и полученный остаток без дополнительной очистки используют в реакции на следующей стадии.
2.2: циклопропилтропиновый эфир 2,2-дифенилпропионовой кислоты 4b
2,3 г (0,015 моля) соединения 2a и 2,13 г (0,016 моля) диизопропилэтиламина добавляют к 30 мл дихлорметана и в течение 15 мин смешивают с раствором полученного на стадии 2.1 хлорангидрида кислоты 3b в дихлорметане. После этого в течение 2 ч перемешивают при комнатной температуре и в течение 72 ч при 40°С. Для переработки смесь промывают водой, сушат над MgSO4 и отгоняют растворитель. Продукт с помощью раствора HCl в диэтиловом эфире переводят в его гидрохлорид. Для очистки выпавший в осадок гидрохлорид растворяют в воде и экстрагируют диэтиловым эфиром. Водную фазу подщелачивают 10%-ным водным раствором карбоната натрия и экстрагируют дихлорметаном. Органическую фазу сушат над MgSO4 и отгоняют растворитель.
Выход 2,15 г желтого масла (соответствует 36% от теории).
2.3: метобромид циклопропилтропинового эфира 2,2-дифенилпропионовой кислоты
1,8 г (0,005 моля) свободного основания 4b подвергают химическому превращению аналогично стадии 1.3. Продукт очищают путем перекристаллизации из смеси ацетонитрил/диэтиловый эфир.
Выход 1,53 г белых кристаллов (соответствует 67% от теории).
Температура плавления 208-209°С.
| Элементный анализ: рассчитано: | С 65,79, Н 6,63, N 3,07; |
| обнаружено.: | С 65,47, Н 6,77, N (3,03). |
Пример 3: метобромид циклопропилтропинового эфира 9-гидроксиксантен-9-карбоновой кислоты
3.1: метиловый эфир 9-гидроксиксантен-9-карбоновой кислоты 3с
а) Метиловый эфир ксантен-9-карбоновой кислоты
Из 21,75 г (0,95 моля) натрия и 1500 мл этанола приготавливают раствор этилата натрия. В этот раствор порциями добавляют 214 г (0,95 моля) ксантен-9-карбоновой кислоты и затем полученную суспензию перемешивают в течение 1 ч при комнатной температуре. После этого твердое вещество отделяют, промывают 1500 мл диэтилового эфира, выделенные кристаллы суспендируют в 1500 мл диметилформамида и смешивают с 126,73 мл (2,0 моля) метилиодида. Полученный раствор оставляют стоять на 24 ч при комнатной температуре, после чего разбавляют водой, доводя общий объем раствора до 6 л, кристаллизуют, подвергают вакуум-фильтрации, промывают водой и сушат.
Выход 167 г белых кристаллов (соответствует 74% от теории).
Температура плавления 82°С.
б) Метиловый эфир 9-гидроксиксантен-9-карбоновой кислоты 3с
48,05 г (0,2 моля) метилового эфира ксантен-9-карбоновой кислоты растворяют в 1200 мл тетрагидрофурана и при 0°С смешивают с 23,63 г (0,2 моля) трет-бутилата калия. Далее в течение 2 ч при температуре в пределах от -10 до -5°С барботируют кислородом, после чего подкисляют 2 н. водной соляной кислотой и большую часть растворителя удаляют путем перегонки. Полученный остаток экстрагируют этилацетатом и водой, органическую фазу экстрагируют водным раствор Na2S2О5, промывают водой, сушат и отгоняют растворитель. Продукт очищают путем кристаллизации из диизопропилового эфира и циклогексана.
Выход 11,10 г белых кристаллов (соответствует 22% от теории).
3.2: циклопропилтропиновый эфир 9-гидроксиксантен-9-карбоновой кислоты 4с
6,0 г (0,023 моля) соединения 3с, 3,065 г (0,02 моля) соединения 2а и 0,02 г натрия подвергают взаимодействию между собой аналогично стадии 1.2 с получением соединения 4с.
Выход 2,2 г белых кристаллов (соответствует 25% от теории).
Температура плавления 115-116°С.
3.3: метобромид циклопропилтропинового эфира 9-гидроксиксантен-9-карбоновой кислоты
2,1 г (0,006 моля) свободного основания 4с подвергают химическому превращению аналогично стадии 1.3. Продукт очищают путем перекристаллизации из изопропанола.
Выход 1,05 г бежевых кристаллов (соответствует 37% от теории).
Температура плавления 218°С.
| Элементный анализ: рассчитано: | С 61,02, Н 5,55, N 2,97; |
| обнаружено.: | С (60,40) Н (5,72) N (2,96). |
Пример 4: метобромид циклопропилтропинового эфира 9-метилфлуорен-9-карбоновой кислоты
4.1: 9-метилфлуорен-9-карбоновая кислота 3d
а) Метиловый эфир 9-метилфлуорен-9-карбоновой кислоты
Из 7,6 г (0,33 моля) натрия и 300 мл этанола приготавливают раствор этилата натрия, в который порциями добавляют 69,6 г (0,33 моля) 9-флуоренкарбоновой кислоты. По завершении этой операции добавления смесь в течение 2,5 ч перемешивают при комнатной температуре. Затем смесь упаривают досуха, остаток суспендируют в 600 мл диметилформамида и по каплям добавляют 93,96 г (0,662 моля) метилиодида. После этого смесь перемешивают в течение 3 ч при постоянной температуре. Полученный мутный раствор при охлаждении примешивают к 500 мл воды и 300 мл диэтилового эфира и экстрагируют, органическую фазу промывают водой и 10%-ным раствором карбоната натрия, сушат и упаривают досуха. Остаток очищают колоночной хроматографией с использованием в качестве элюента смеси циклогексан/этилацетат в соотношении 96:4.
Выход 12,61 г белых кристаллов (соответствует 16% от теории).
Температура плавления 108-109°С.
б) 9-Метилфлуорен-9-карбоновая кислота 3d
12,6 г (0,053 моля) метилового эфира 9-метилфлуорен-9-карбоновой кислоты и 53 мл 2-молярного водного раствора гидроксида натрия в течение 24 ч перемешивают при комнатной температуре в 120 мл 1,4-диоксана. После этого диоксан отгоняют, общий объем смеси доводят добавлением воды до 300 мл и экстрагируют диэтиловым эфиром. Водную фазу подкисляют 3-молярной водной HCl, кристаллизуют и фильтруют.
Выход 11,25 г белых кристаллов (соответствует 95% от теории).
Температура плавления 168-169°С.
4.2: циклопропилтропиновый эфир 9-метилфлуорен-9-карбоновой кислоты 4d
Из 4,0 г (0,018 моля) соединения 3d, 4,53 г (0,036 моля) оксалилхлорида и 4 капель диметилформамида в 40 мл дихлорметана получают хлорангидрид кислоты. В 30 мл дихлорэтана суспендируют 2,48 г (0,016 моля) соединения 2а и 1,91 г (0,019 моля) триэтиламина, к этой суспензии в течение 15 мин при 30°С по каплям добавляют полученный ранее хлорангидрид кислоты в 30 мл дихлорэтана и затем перемешивают в течение 24 ч при 40°С. Далее суспензию экстрагируют дихлорметаном и водой, органическую фазу промывают уксуснокислой водой, сушат и растворитель удаляют путем перегонки. Полученный продукт переводят в его гидрохлорид. Для очистки выпавший в осадок гидрохлорид растворяют в воде и экстрагируют диэтиловым эфиром. Водную фазу подщелачивают и экстрагируют дихлорметаном. Органическую фазу сушат над MgSO4 и отгоняют растворитель. Сырой продукт очищают путем перекристаллизации из ацетонитрила.
Выход 1,81 г бежеватых кристаллов (соответствует 30% от теории).
Температура плавления 138-139°С.
4.3: метобромид циклопропилтропинового эфира 9-метилфлуорен-9-карбоновой кислоты
1,81 г (0,005 моля) свободного основания 4d подвергают химическому превращению аналогично стадии 1.3. Продукт очищают путем перекристаллизации из ацетонитрила.
Выход: 1,26 г белых кристаллов (соответствует 56% от теории).
Температура плавления 228-229°С.
| Элементный анализ: рассчитано: | С 66,09, Н 6,21, N 3,08; |
| обнаружено.: | С 66,26, Н 6,26, N 3,11. |
Пример 5: метобромид циклопропилтропинового эфира 9-метилксантен-9-карбоновой кислоты
5.1: 9-метилксантен-9-карбоновая кислота 3е
а) Метиловый эфир 9-метилксантен-9-карбоновой кислоты
Указанное в заголовке соединение получают исходя из 9,61 г (0,04 моля) метилового эфира 9-ксантенкарбоновой кислоты (получаемого в соответствии со стадией 3.1.а) аналогично стадии 4.1.а.
Выход 6,05 г белых кристаллов (соответствует 60% от теории).
Температура плавления 91-92°С.
б) 9-Метилксантен-9-карбоновая кислота 3е
Указанное в заголовке соединение получают исходя из 20,34 г (0,08 моля) метилового эфира 9-метилксантен-9-карбоновой кислоты аналогично стадии 4.1.б.
Выход 14,15 г белых кристаллов (соответствует 74% от теории).
Температура плавления 207-208°С.
5.2: циклопропилтропиновый эфир 9-метилксантен-9-карбоновой кислоты 4е
Из 5,0 г (0,021 моля) соединения 3е, 5,53 г (0,042 моля) оксалилхлорида и 4 капель диметилформамида в 50 мл дихлорметана получают хлорангидрид кислоты. Из 3,06 г (0,02 моля) соединения 2а и полученного ранее хлорангидрида кислоты аналогично стадии 4.2 получают указанное в заголовке соединение.
Выход 1,95 г бежеватых кристаллов (соответствует 26% от теории).
Температура плавления 87-88°С.
5.3: метобромид циклопропилтропинового эфира 9-метилксантен-9-карбоновой кислоты
1,95 г (0,005 моля) свободного основания 4е подвергают химическому превращению аналогично стадии 1.3. Продукт очищают путем перекристаллизации из ацетонитрила.
Выход 0,54 г белых кристаллов (соответствует 23% от теории).
Температура плавления 193-194°С.
| Элементный анализ: рассчитано: | С 63,83, Н 6,00 N 2,98; |
| обнаружено: | С 61,42 Н 6,24 N 2,97. |
Пример 6: метобромид циклопропилтропинового эфира 9-гидроксифлуорен-9-карбоновой кислоты
6.1: метиловый эфир 9-гидроксифлуорен-9-карбоновой кислоты 3f
50,4 г (0,223 моля) 9-гидрокси-9-флуоренкарбоновой кислоты растворяют в 500 мл метанола, смешивают с 5 мл (0,089 моля) концентрированной серной кислоты и в течение 1 ч кипятят с обратным холодильником. После охлаждения добавляют 100 мл раствора гидрокарбоната натрия (рН около 8) и практически полностью выпаривают метанол. После этого экстрагируют дихлорметаном и водой, органическую фазу сушат и упаривают досуха. Продукт очищают путем перекристаллизации из этилацетата.
Выход 50,0 г белых кристаллов (соответствует 93% от теории).
6.2: циклопропилтропиновый эфир 9-гидроксифлуорен-9-карбоновой кислоты 4f
6,0 г (0,025 моля) соединения 3f, 3,45 г (0,023 моля) соединения 2а и 0,03 г натрия подвергают взаимодействию между собой аналогично стадии 1.2 с получением соединения 4f. Продукт очищают путем перекристаллизации из ацетонитрила.
Выход 3,46 г белых кристаллов (соответствует 38% от теории).
Температура плавления 131-132°С.
6.3: метобромид циклопропилтропинового эфира 9-гидроксифлуорен-9-карбоновой кислоты
3,36 г (0,009 моля) свободного основания 4f подвергают химическому прев