Производные 5бета-сапогенина и псевдосапогенина и их применение при лечении деменции
Иллюстрации
Показать всеВ изобретении раскрыты производные 5β-сапогенина и псевдосапогенина общей формулы I или II, где в общей формуле I или II: R1, R2, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13 и, если присутствует, R15 - H, независимо R1 и R13 - ОН или R3 - ОН, =O или OR, где R - необязательно замещенный алкил; низший ацил, необязательно замещенный карбамоилом или амино или низшим алкоксикарбонилом; низший алкоксикарбонил; R14 низший алкил, необязательно двойная связь за исключением смилагенина и тех соединений формулы I, где одновременно R1=R2=R4=R5=R6=R7=R8=R9=R10=R11=R12=R13=H, R3=βOH, R14=CH3, и метил в С20 положении имеет α-ориентацию и С25 имеет S-конфигурацию. Соединения увеличивают, количество мускариновых рецепторов для усиления функции мускариотных рецепторов у человека или животного, а также полезны для усиления когнитивной функции у человека или животного. 3 н. и 8 з.п. ф-лы, 5 ил., 21 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение касается производных сапогенина и их применения при лечении нарушений умственных способностей и подобных заболеваний, а также касается композиций, применяемых при таком лечении. Изобретение также касается лечения заболеваний, характеризующихся недостаточным числом или нарушением функции мембраносвязанных рецепторов. В дальнейшем при описании настоящего изобретения будет привлекаться главным образом лечение болезни Альцгеймера (AD) и старческой деменции по типу Альцгеймера (SDAT), при которых была показана недостаточность ряда типов рецепторов. Однако следует иметь в виду, что настоящее изобретение в общем касается лечения заболеваний, обусловленных собственным патологическим состоянием и/или воздействием неблагоприятных условий окружающей среды, причем именно таких заболеваний, которые характеризуются недостаточным числом или нарушением функции мембраносвязанных рецепторов либо нарушением синаптической передачи между нейронами или нейронами и эффекторными клетками.
Уровень техники
К заболеваниям указанного выше типа относятся болезнь Паркинсона, деменция, сопровождающаяся изменениями в тельцах Льюиса, постуральная (ортостатическая) гипотензия, аутизм, синдром хронического утомления, миастения, болезнь Ламберта-Итона (Lambert-Eaton), болезни и недомогания, связанные с синдромом войны в Персидском заливе, профессиональное воздействие фосфороорганических соединений и недомогания, связанные с возрастом.
Болезнь Альцгеймера (AD) и старческая деменция по типу Альцгеймера (SDAT) - это серьезные и все нарастающие проблемы во всех обществах, в которых, вследствие увеличения продолжительности жизни и сдерживания легких заболеваний, демографический профиль все более сдвигается в сторону стареющих популяций. Имеется настоятельная потребность в средствах, которые способны излечивать или способствовать лечению AD/SDAT.
Ухудшение памяти в связи с возрастом (AAMI) характерно для пожилых пациентов, которые, будучи психически и физически нормальными, жалуются на потерю памяти. Это мало изученный синдром, однако препараты, эффективные при лечении AD/SDAT, могут быть полезными также и для этих пациентов.
Исследования AD/SDAT проводятся традиционными и стандартными методами медицинских исследований и дисциплин. В традиционной медицине существует несколько подходов к лечению AD/SDAT. Известно, что биохимические процессы, лежащие в основе памяти в коре головного мозга, являются (по меньшей мере частично) холинергическими. Специалистам в этой области известно, что "холинергически опосредованные" механизмы непосредственно объясняются действием ацетилхолина на рецепторы, и эти эффекты - прямые. Другие клинически полезные эффекты могут быть вызваны модуляцией высвобождения ацетилхолина из пресинаптических нервных окончаний или ингибированием ферментов, разрушающих ацетилхолин. Эти модулирующие факторы могут действовать через нейроны с нехолинергическим медиатором, и такие эффекты относятся к косвенным. Некоторые попытки лечения были сосредоточены на роли других медиаторов, таких как 5-гидрокситриптамин, являющийся медиатором в других областях мозга, например ядрах среднего мозга. Однако поскольку волокна из этих областей выходят вперед к церебральной коре, где основным нейромедиатором является ацетилхолин, то на этом медиаторе было сосредоточено внимание при поиске подходящих лекарственных средств.
Холинергическая стратегия при лечении AD/SDAT была направлена на несколько точек биохимических путей образования, синаптического выброса и удаления высвобожденного ацетилхолина.
Один из подходов включает лечение высокими дозами лецитина и других предшественников ацетилхолина. Он имеет ограниченное применение в обеспечении продолжительного улучшения когнитивных функций.
Другой подход включает применение растительных препаратов типа экстракта корней Polygalae, который, как было показано, повышает активность холинацетилхолинтрансферазы (CAT) и секрецию фактора роста нервов (NGF) в мозге. Пероральное введение NGF не влияло на нейроны центральной нервной системы, так как это высокомолекулярный белок, который не проходит через гематоэнцефалический барьер. Однако для улучшения поведения, связанного с памятью, были предложены вещества, способные проходить через гематоэнцефалический барьер и оказывающие стимулирующий эффект на синтез NGF в центральной нервной системе.
Результаты третьего клинического подхода, в котором применяются ингибиторы холинэстеразы, такие как такрин гидрохлорид, были слегка более положительными, чем вышеуказанные. Препараты, полученные из растений, применяемых в китайской и западной медицине, к примеру гуперзин, галантамин и физостигмин, все оказывали некоторое, хотя и ограниченное, улучшение при лечении AD/SDAT в клинических испытаниях, а также на лабораторных моделях. Все эти вещества являются ингибиторами ацетилхолинэстеразы (AChE). У пациентов с AD/SDAT может происходить снижение синтеза ацетилхолина (ACh), уменьшение эффективности высвобождения ACh из пресинаптических терминалей и снижение числа или функции постсинаптических (M1) рецепторов. Также отмечалось снижение числа пресинаптических М2-рецепторов. Положительное действие ингибиторов AChE объясняется повышением содержания ACh в синапсах мозга вследствие замедленного разрушения высвобожденного медиатора.
Известно, что композиции, модулирующие холинергические функции, влияют на память и воспроизведение. Например, никотин стимулирует никотиновые рецепторы ацетилхолина и считается, что краткосрочное улучшение памяти при табакокурении обусловлено никотином. Антагонист ацетилхолина-скополамин вызывает амнезию и нарушение когнитивных функций, что в психомоторных тестах проявляется в виде замедления простых реакций, возможно, как следствие нарушения внимания, и он применяется с этой целью как сопутствующий анальгетик. Амнезирующее действие скополамина может антагонизироваться никотином.
Имеется два семейства субтипов никотиновых рецепторов (α и β), и каждое из них включает четыре подгруппы, различающиеся по специфичности к лиганду. Роль никотиновых рецепторов в ЦНС еще недостаточно изучена на молекулярном уровне. Возможно, что вещества, связывающиеся с никотиновыми рецепторами, модифицируют скорость метаболизма на сайтах мускариновых рецепторов мозга. Никотиновые рецепторы представляют собой лигандзависимые ионные каналы, активация которых вызывает кратковременное (миллисекундное) увеличение клеточной проводимости Na+ и Са++, деполяризацию и возбуждение.
Другой класс холинергических рецепторов стимулируется мускарином. Такие мускариновые (М) рецепторы относятся к рецепторам, связанным с G-белками. Ответы мускариновых рецепторов более медленные; они могут быть и возбуждающими, и тормозными. Они необязательно связаны с изменениями ионной проводимости. При клонировании холинергических рецепторов было обнаружено пять типов мускариновых рецепторов, которым присвоены обозначения M1-M5. Фармакологической активностью обладают четыре из клонированных рецепторов, обозначаемые как M1-M4 на основании их фармакологической специфичности.
Применение специфических рецепторных белков и моноклональных антител дало возможность установить локализацию в мозге мускариновых M1 (постсинаптические) и М2 (пресинаптические) рецепторов. Но в сердце М2-рецепторы являются постсинаптическими. Пресинаптические мускариновые рецепторы считаются тормозными, связывание ACh с этими рецепторами ослабляет дальнейшее высвобождение ACh, обеспечивая механизм отрицательной обратной связи при высвобождении ACh. Следовательно, избирательные антагонисты М2-рецепторов, преобладающих в мозге, могут быть полезными при лечении болезни Альцгеймера.
Известно, что при таких заболеваниях, как AD/SDAT, наблюдается общая гибель нейронов и недостаточность холинергической функции нервов. Высказывалось предположение, что при лечении таких заболеваний участки с высоким сродством к никотину на оставшихся холинергических нейронах могут превращаться в участки с низким сродством связывания, тем самым продлевая высвобождение медиатора. При снижении сродства участков связывания к никотину предотвращается процесс быстрой десенситизации.
Активация никотиновых рецепторов агонистами в мозге имеет быстрое начало и быстрый конец. Уменьшение сродства никотиновых рецепторов приводит к снижению процесса десенситизации. Schwartz R.D. et al. (J. Neuro Chem. 42 (1984), 1495-98) показали, что сайты связывания никотина локализованы пресинаптически на холинергических (а также 5-гидрокситриптаминергических и катехоламинергических) окончаниях аксонов. Изменения в участках с высоким сродством связывания при AD/SDAT могут повлечь за собой изменения модулирующего действия, которое никотиновые участки оказывают на другие медиаторные системы.
Пресинаптические холинергические механизмы также находятся под тормозным контролем ГАМК-ергических нейронов и полагают, что такое торможение может усиливаться при AD/SDAT. Снятие или ослабление торможения усиливает корковую пресинаптическую холинергическую активность и интенсифицирует когнитивную обработку информации.
Межнейронные взаимодействия волокон, имеющих никотиновую иннервацию (которая снижает сродство связывания), так же как и растормаживание ГАМК-ергических волокон, имеют пресинаптическую локализацию.
Эта модель передачи сигналов в ЦНС - упрощенная, но она обеспечивает основу для понимания попыток, предпринимавшихся с целью увеличения эффективной концентрации ацетилхолина в центральных синапсах. Кроме того, она иллюстрирует концепцию прямого и непрямого воздействия. Указанным выше трем традиционным подходам к лечению AD/SDAT: добавлению предшественников ACh, заместительной терапии агонистами и ингибированию АХЭ присущи и недостатки. Такое лечение может приводить к кратковременному увеличению количества ACh, который будет активировать механизмы обратной связи, приводящие к десенситизации постсинаптических рецепторов. Исходя из теории, не просматриваются долговременные положительные эффекты, а с прекращением лечения положительные эффекты на AD/SDAT и AAMI исчезнут и состояние может даже ухудшиться.
Было показано, что соединение, обладающее активностью M1-агониста и М2/М3-антагониста улучшает умственные способности пациентов с SDAT (Sramak et al., Life Sciences, vol 2, No. 3, 195-202 (1997)). Однако это соединение вызывает неприемлемые побочные холинергические эффекты, такие как утомление, понос и тошнота.
Более радикальный подход к AD/SDAT и AAMI заключается в увеличении числа постсинаптических (M1) рецепторов в мозге. Из китайского патента № CN1096031 A известно, что сарсасапогенин (SaG) способен увеличивать число холинергических M1-рецепторов.
Были патентные публикации, в которых заявлялось о полезности ряда стероидных сапогенинов, обладающих структурой спиростана, фуро-спиростана, спиросолана или соланидина, при лечении заболеваний, включая SDAT. Две патентные публикации имеют особое отношение к настоящему изобретению: китайская патентная публикация № CN 1096031 A о применении спиростанового сапогенина - сарсасапогенина при лечении SDAT. В этом документе, однако, дано лишь краткое описание. Другой документ, имеющий отношение к настоящему изобретению, - это патентная публикация DE 4303214 А1, в которой идет речь о применении очень большого числа сапонинов и сапогенинов при лечении целого ряда заболеваний, имеющих, по мнению авторов, вирусное происхождение. Раскрытие этого изобретения, однако, имеет сомнительную ценность, так как хорошо известно, что при очень большом числе заболеваний, характеризующихся недостаточностью синаптической передачи, отсутствует элемент инфекционности, поэтому основная предпосылка заявленного изобретения ошибочна. Кроме того, они не представили никаких данных, позволяющих специалисту в этой области выбрать предпочтительное соединение из большого числа заявленных.
Авторы настоящего изобретения обнаружили, что некоторые производные сапогенина проявляют способность к регуляции рецепторов. В частности, было обнаружено, что эти соединения увеличивают число М2-рецепторов в мозге. Поэтому один из аспектов изобретения предусматривает применение производных сапогенина общей формулы (I) или (II) в изготовлении лекарства для лечения заболеваний, характеризующихся недостаточным числом или нарушением функции мембраносвязанных рецепторов.
Специалистам в этой области известно о взаимоотношениях между сапонинами и их сапогенинами, как и то, что сапогенины преимущественно жирорастворимы, тогда как сапонины в основном водорастворимы. Сапогенины, таким образом, более способны к проникновению через гематоэнцефалический барьер. Специалистам также известно об эпимеризации ряда сапогенинов в условиях кислотного гидролиза.
Различия в фармакологических свойствах и фармакодинамическом действии разных видов сапогенинов подчеркивают необходимость отбора веществ, наиболее полезных для лечения AD/SDAT. Открытие новых фактов в отношении действия производных сапогенина дало возможность определить, какие именно вещества наиболее пригодны для лечения AD/SDAT и тому подобных заболеваний.
Авторы изобретения обнаружили, что описанные выше свойства проявляют те производные сапогенина, которым присуща cis-конформация кольца А/В в замкнутой кольцевой системе.
Соответственно, представляющие интерес производные сапогенина по настоящему изобретению имеют следующую общую формулу (I) или (II):
а также их стереоизомеры и рацемические смеси, их фармацевтически приемлемые пролекарства и соли.
В общей формуле (I):
- R1, R2, R3, R4, R5, R6, R7, R8, R10, независимо друг от друга, представляют собой Н, ОН, =O или OR, где R - необязательно замещенный алкил, необязательно замещенный ацил, необязательно замещенный карбамоил или алкоксикарбонил;
- R9, R11, R12, R13 представляют собой Н, ОН или OR, где R - необязательно замещенный алкил, необязательно замещенный ацил, необязательно замещенный карбамоил или алкоксикарбонил;
- R14 - необязательно замещенная алкильная группа,
означает необязательно двойную связь,
кроме тех случаев, когда одновременно:
- R1=R2=R4=R5=R6=R7=R8=R9=R10=R11=R12=R13=Н,
- R3=βОН,
- R14=СН3,
- метильная группа в С22 является α-группой,
- С20 является α-группой, a C25 обладает S-конфигурацией.
Предпочтительно в общей формуле (I):
- R4, R9, R12, R13=Н;
- R1, R2, R3, R5, R6, R7, R8, R10, независимо друг от друга, представляют собой Н, ОН, =O или OR, где R - необязательно замещенный алкил, необязательно замещенный ацил, необязательно замещенный карбамоил или алкоксикарбонил;
- R11=Н, ОН или OR, где R - необязательно замещенный алкил, необязательно замещенный ацил, необязательно замещенный карбамоил иди алкоксикарбонил;
- R14 - необязательно замещенная алкильная группа,
означает необязательно двойную связь,
кроме тех случаев, когда одновременно:
- R1=R2=R4=R5=R6=R7=R8=R9=R10=R11=R12=R13=Н,
- R3=βOH,
- R14=CH3,
- метильная группа в С22 является α-группой,
- С20 является α-группой, a C25 обладает S-конфигурацией.
Более предпочтительно в общей формуле (I):
- R1=R2=R4=R5=R6=R7=R8=R9=R10=R11=R12=R13=Н,
- R3=Н, -ОН, -ОМе, -ОСОСН3, =O, -O-CO-OEt или -O-СО-(СН2)2-CO2Н,
- R14=СН3,
кроме тех случаев, когда одновременно:
- R1=R2=R4=R5=R6=R7=R8=R9=R10=R11=R12=R13=Н,
- R3=βОН,
- R14=CH3,
- С25 обладает S-конфигурацией,
- С20 является α-группой и метильная группа в С22 является α-группой.
В общей формуле (II):
- R1, R2, R3, R4, R5, R6, R7, R8, R10, независимо друг от друга, представляют собой Н, ОН, =O или OR, где R - необязательно замещенный алкил, необязательно замещенный ацил, необязательно замещенный карбамоил или алкоксикарбонил;
- R9, R11, R12, R13 представляют собой Н, ОН или OR, где R - необязательно замещенный алкил, необязательно замещенный ацил, необязательно замещенный карбамоил или алкоксикарбонил;
- R14 = необязательно замещенная алкильная группа;
- R15 = Н, необязательно замещенный алкил, необязательно замещенный ацил или глюкозил;
означает необязательно двойную связь.
Предпочтительно в общей формуле (II):
- R4, R9, R12, R13=Н;
- R1, R2, R3, R5, R6, R7, R8, R10, независимо друг от друга, представляют собой Н, ОН, =O или OR, где R - необязательно замещенный алкил, необязательно замещенный ацил, необязательно замещенный карбамоил или алкоксикарбонил;
- R11=Н, ОН или OR, где R - необязательно замещенный алкил, необязательно замещенный ацил, необязательно замещенный карбамоил или алкоксикарбонил;
- R14 - необязательно замещенная алкильная группа;
- R15=Н, необязательно замещенный алкил, необязательно замещенный ацил или глюкозил;
означает необязательно двойную связь.
Особенно предпочтительны следующие соединения:
В настоящем изобретении применяются следующие обозначения:
"Ацил" означает группу Н-СО- или алкил-СО-, в которой алкильная группа соответствует описанию настоящего изобретения. Предпочтительно ацильные группы содержат низший алкил. К типичным ацильным группам относятся формил, ацетил, пропаноил, 2-метилпропаноил, бутаноил и пальмитоил.
"Алкил" означает алифатическую углеводородную группу, которая может быть линейной или разветвленной, с длиной цепи примерно от 1 до 20 углеродных атомов. Предпочтительно алкильные группы имеют длину цепи от 1 до 12 углеродных атомов. Разветвленная цепь означает, что к линейной цепи алкильной группы присоединена одна или несколько низших алкильных групп, таких как метил, этил или пропил. "Низший алкил" означает цепь примерно из 1 до 4 углеродных атомов, которая может быть линейной или разветвленной. К типичным алкильным группам относятся метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил, 3-пентил.
"Необязательно замещенный" означает, что указанная группа может содержать одну или несколько замещающих групп, которые могут быть одинаковыми или разными, к числу которых относятся гало, алкил, циклоалкил, гидрокси, алкокси, амино, ациламино, арил, ароиламино, карбокси, алкоксикарбонил, аралкоксикарбонил, гетероаралкоксикарбонил, необязательно замещенный карбамоил.
Термин "фармацевтическая композиция" обозначает композицию, содержащую соединение формулы I или II и, по меньшей мере, один компонент, выбранный из группы, включающей фармацевтически приемлемые носители, разбавители, адъюванты, инертные наполнители и растворители - консерванты, наполнители, дезинтегрирующие вещества, смачивающие вещества, диспергирующие вещества, суспендирующие вещества, подслащивающие вещества, ароматизирующие вещества, отдушки, антибактериальные вещества, противогрибковые вещества, смазывающие вещества и высвобождающие вещества, в зависимости от способа введения и дозовой формы.
"Фармацевтически приемлемый" означает, в рамках здравого медицинского рассуждения, годный для применения при контакте с клетками человека и низших животных без нежелательной токсичности, раздражения, аллергического ответа и т.п., и соразмерный с удовлетворительным соотношением польза/вред.
"Фармацевтически приемлемые дозовые формы" означает дозовые формы соединения по изобретению, к которым относятся, к примеру, таблетки, драже, порошки, эликсиры, сиропы, жидкие препараты, включая суспензии, аэрозоли, таблетки для ингаляции, леденцы, эмульсии, растворы, гранулы, капсулы и свечи, а также жидкие препараты для инъекций, включая препараты липосом. Основные методы и композиции можно найти в Remington, Pharmaceutical Sciences, Mack Publishing, Co., Easton, PA, последнее издание.
"Фармацевтически приемлемые пролекарства", в применении к настоящему изобретению, означает пролекарства из соединений, применяемых согласно настоящему изобретению, которые, в рамках здравого медицинского рассуждения, пригодны для применения при контакте с тканями человека и низших животных с нежелательной токсичностью, аллергическими реакциями и т.п., соразмерно с удовлетворительным соотношением польза/вред, и эффективны для своего назначения, а также цвиттерионные формы, если это возможно, соединений по изобретению. Термин "пролекарство" означает соединения, которые подвергаются быстрому превращению in vivo, образуя родительское соединение приведенной выше формулы, например, при гидролизе в крови. Функциональные группы, которые подвергаются быстрому превращению путем метаболического расщепления in vivo, составляют класс групп, реагирующих с карбоксильной группой соединений настоящего изобретения. Вследствие легкости, с которой метаболически расщепляемые группы в соединениях, применяемых согласно настоящему изобретению, расщепляются in vivo, соединения, несущие такие группы, действуют как пролекарства. Всестороннее обсуждение пролекарств представлено в следующих работах:
Design of Prodrugs, H. Bundgaard, ed., Elsevier, 1985; Methods in Enzymology, K. Widder et al., Ed., Academic Press, 42, p.309-396, 1985; A Textbook of Drug Design and Development, Krogsgaard-Larsen and H. Bundgaard, ed., Chapter 5; Design and Applications of Prodrugs, p.113-191, 1991; Advanced Drug Delivery Reviews, H. Bundgaard, 8, p.1-38, 1992; Journal of Pharmaceutical Sciences, 77, p.285, 1988; Chem. Pharm. Bull., N. Nakeya et al., 32, p.692, 1984; Pro-drugs as Novel Delivery Systems, T. Higuchi and V. Stella, Vol.14 of the A.C.S. Symposium Series, и Bioreversible Carriers in Drug Design, Edward B. Roche, ed., American Pharmaceutical Association and Pergamon Press, 1987, которые включены в настоящее изобретение в виде ссылок.
"Фармацевтически приемлемые соли" обозначает относительно нетоксичные, неорганические и органические соли соответствующих кислот и оснований из соединений настоящего изобретения. Эти соли могут быть получены in situ во время заключительного выделения и очистки соединений. В частности, соли соответствующих кислот можно получить путем проведения отдельной реакции между очищенным соединением в виде свободного основания и подходящей органической или неорганической кислотой и выделения образовавшейся при этом соли. Смотри, к примеру, работу S.M. Berge et al., Pharmaceutical Salts, J. Pharm. Sci., 66: p.1-19 (1977), которая включена в виде ссылки. Соли соответствующих оснований также можно получить путем проведения отдельной реакции между очищенным соединением в виде кислоты и подходящим органическим или неорганическим основанием и выделения образовавшейся при этом соли. К числу солей оснований относятся фармацевтически приемлемые соли металлов и аминов.
Некоторые производные сапогенина, представляющие интерес для настоящего изобретения, в природе могут встречаться в ряде растений, особенно из родов Smilax, Asparagus, Anemarrhena, Yucca и Agave. К видам, представляющим сейчас наибольший интерес, относятся Smilax regelii Kilip & Morton, известная как гондурасская сассапариль; Smilax aristolochiaefolia Miller, известная как мексиканская сассапариль; Smilax ornata Hooker, известная как ямайская сассапариль; Smilax aspera, известная как испанская сассапариль; Smilax glabra Roxburgh; Smilax febrifuga Kunth, известная как эквадорская или перуанская сассапариль; Anemarrhena asphodeloides Bunge; Yucca schidigera Roezl ex Ortgies и Yucca brevifolia Engelm. Представляющие интерес производные сапогенина могут происходить также из других родов, к примеру Dioscorea, Trillium, Solanum, Strophantus, Digitalis и Trigonella. Однако некоторые производные сапогенина из этих источников обладают нежелательными свойствами и поэтому не рекомендуются для применения в настоящем изобретении.
Производные сапогенина настоящего изобретения можно также приобрести коммерческим путем, а их поставщики хорошо известны в этой области и включают Sigma Aldrich, Research Plus Inc., Steraloids Inc. и др.
Следующий аспект изобретения предусматривает способ получения соединений настоящего изобретения.
Замещенные сапогенины настоящего изобретения можно получить синтетическим путем. Например, их можно получить из незамещенных производных сапогенина, встречающихся в природе или приобретаемых коммерческим путем, как указано выше.
Исходя из этих незамещенных сапогенинов, реакция может включать, по меньшей мере, одну стадию замещения, в которой функциональная группа производного сапогенина подвергается замещению. Обычно исходным материалом служит незамещенный сапогенин с требуемой стереохимией, а реакция включает замещение одной ОН-группы требуемым функциональным радикалом, при этом в качестве исходного материала предпочтительны смилагенин и эписмилагенин.
Соединения, применимые согласно настоящему изобретению, можно получить путем приложения или адаптации известных методов, что означает методы, применявшиеся до этого или описанные в литературе, например, описанные R.C. Larock in Comprehensive Organic Transformations, VCH publishers, 1989.
В описываемых далее реакциях может возникнуть необходимость в защите реакционноспособных функциональных групп, например гидроксильных или карбоксильных групп, если они должны присутствовать в конечном продукте, чтобы предотвратить нежелательное участие их в реакциях. Могут применяться общепринятые защитные группы в соответствии со стандартной практикой, примеры которых приведены T.W. Green and P.G.M. Wuts in "Protective Groups in Organic Chemistry" John Wiley and Sons, 1991; J.F.W. McOmie in "Protective Groups in Organic Chemistry" Plenum Press, 1973.
Полученное таким образом соединение можно выделить из реакционной смеси стандартными методами. Например, соединения можно выделить отгонкой растворителя из реакционной смеси или, при необходимости, после отгонки растворителя из реакционной смеси вылить остаток в воду и экстрагировать в несмешивающемся с водой органическом растворителе, а затем отогнать растворитель из экстракта. Кроме того, при желании продукт можно дополнительно очистить различными известными методами, такими как перекристаллизация, переосаждение или различные хроматографические методы, особенно методами колоночной хроматографии или препаративной тонкослойной хроматографии.
Следующий аспект настоящего изобретения предусматривает фармацевтическую композицию, обладающую свойством усиления когнитивных функций, которая содержит эффективное количество производного сапогенина по изобретению.
В следующем аспекте изобретения производные сапогенина по настоящему изобретению представляют собой стероиды, которые предпочтительно не обладают эстрогенным действием.
Другой аспект изобретения предусматривает фармацевтическую композицию, обладающую свойством усиления когнитивных функций, которая содержит эффективное количество производного сапогенина по изобретению в виде экстракта, происходящего из растений рода Smilax, Asparagus, Anemarrhena, Yucca или Agave.
Следует иметь в виду, что изобретение охватывает собой применение композиций, определенных выше. Таким образом, согласно пятому аспекту, настоящее изобретение предусматривает способ усиления когнитивных функций, включающий введение человеку или животному эффективной дозы композиции настоящего изобретения.
Изобретение также предусматривает способ усиления когнитивных функций у человека или животного, включающий введение эффективной дозы производные сапогенина по изобретению. Также оно касается применения производных сапогенина по изобретению в пищевых продуктах или напитках для усиления когнитивных функций.
В применении к настоящему изобретению термин "когнитивная функция" относится к таким функциям, как мышление, рассуждение, запоминание, воображение и обучение.
Следующий аспект изобретения также касается композиции, обладающей свойством усиления когнитивных функций, которая содержит, по меньшей мере, два и предпочтительно два производных сапогенина по изобретению.
При определении соединений, которые могут применяться при лечении SDAT и других заболеваний, характеризующихся уменьшением числа рецепторов или снижением синаптической передачи, авторы учитывали потребность в идентификации соединений, обладающих требуемым действием, но лишенных каких бы то ни было эстрогенных эффектов, которые были бы неприемлемыми, особенно для пациентов-мужчин. Ряд соединений, заявленных в качестве активных в патентной заявке DE 4303214 A1, обладают заметной эстрогенной активностью и поэтому неприемлемы. Предпочтительно, однако, производные сапогенина настоящего изобретения не проявляют эстрогенной активности. Кроме того, эти соединения тестировали на других стероидных рецепторах и они не проявляли активности на следующих рецепторах:
прогестерона, глюкокортикоидов, тестостерона.
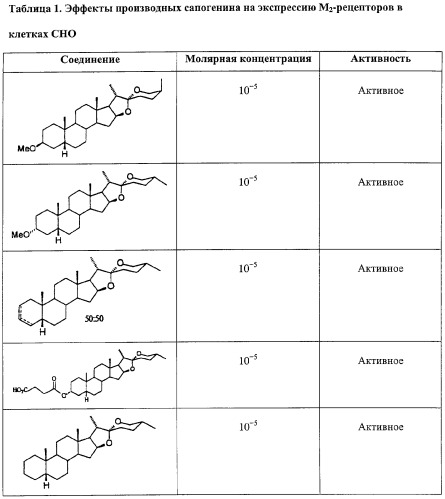
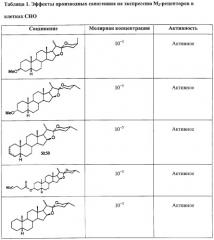
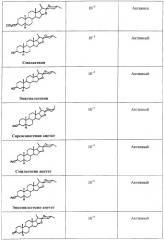
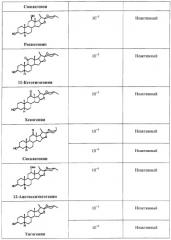
Производные сапогенина по настоящему изобретению также тестировали на активность в ряде тестов in vitro. Следующие тесты/эксперименты считались наиболее важными в определении возможной активности повышения числа мембраносвязанных рецепторов: клетки яичников китайского хомячка (СНО), трансфецированные фрагментом ДНК, кодирующим мускариновый рецептор. В большинстве экспериментов использовали клеточную линию, экспрессирующую М2-рецептор.
Далее описываются методы и результаты этих экспериментов.
Эксперименты с клеточной линией СНО
Эффекты различных соединений на экспрессию М2-рецепторов изучали на клетках СНО, трансфецированных ДНК, кодирующей М2-рецептор. Число рецепторов определяли по связыванию меченного тритием QNB за вычетом неспецифического связывания. Соединения растворяли в DMSO, который также применяли в качестве контроля. Соединения тестировали при различных конечных концентрациях. Соединения также тестировали в присутствии и в отсутствие тамоксифена, чтобы отличить механизм, опосредованный эстрогеновыми рецепторами.
Соединения считались активными, если они повышали экспрессию рецептора, выраженную в % относительно контроля, более чем на 15%.
Результаты суммированы ниже в Таблице 1.
Таким образом, эти эксперименты показывают, что производные сапогенина по изобретению обладают способностью увеличивать число мускариновых рецепторов, экспрессированных на поверхности клеток СНО, культивированных in vitro. Тамоксифен не устранял этот эффект, значит, механизм не связан с эстрогеновыми рецепторами.
Проведенная экспериментальная работа показывает, что соединения настоящего изобретения способны нормализировать число мускариновых рецепторов, а именно они имеют тенденцию предотвращать снижение количества рецепторов со временем, а также восстанавливать число рецепторов до нормального уровня при добавлении к клеткам, в которых количество рецепторов снижено.
Мы предполагаем, что активные соединения, заявленные в настоящем изобретении, действуют через G-белки и что их эффекты на число рецепторов являются вторичными по отношению к эффекту на G-белки. При стимуляции связанных с G-белками мембранных рецепторов запускаются два основных процесса: эффекторный ответ и интернализация рецептора. Последующий процессинг рецептора до такого состояния, что он обретает способность вернуться на поверхность клетки или другой мембраны, где он может снова взаимодействовать с другим рецепторным лигандом, по-видимому, зависит от ряда факторов. Многие из этих факторов или механизмов, по-видимому, связаны с G-белками. Есть данные, что активация М3-рецепторов оказывает влияние на экспрессию G-белков или их уровень. Можно предположить, что эффекты соединений, описанных в настоящем патенте, обусловлены их влиянием на процессы регенерации рецепторов, соединения с G-белками или гомеостаза G-белков.
Альтернативная гипотеза состоит в том, что эти соединения усиливают синтез или высвобождение либо снижают скорость деградации нейротрофических факторов, таких как мозговой фактор роста и/или фактор роста нервов. Такие эффекты на факторы роста могут быть обусловлены влиянием соединения на цитозольный или ядерный рецептор либо связыванием соединения с промоторным участком и последующим действием его непосредственно на образование мРНК для фактора роста, или же быть следствием увеличения продукции другого материального фактора типа G-белка, наконец, эти эффекты могут быть вторичными по отношению к эффекту на процессинг рецептора или G-белка.
Повышенная экспрессия и/или аномальный процессинг предшественника амилоидного белка (АРР) связаны с образованием амилоидных бляшек и амилоидных отложений в сосудах мозга, которые являются основными морфологическими признаками болезни Альцгеймера. Особый интерес представляют процессы, регулирующие протеолитическое расщепление АРР на амилоидогенные и неамилоидогенные фрагменты. Расщепление АРР ферментом α-секретазой в β-амилоидной последовательности белка приводит к образованию неамилоидогенного С-концевого фрагмента и растворимого фрагмента APPsα; для последнего было показано, что он обладает нейротрофической и нейропротекторной активностью, а также улучшает память у мышей при введении в желудочки мозга (ICV). Наоборот, процессинг АРР β-секретазой обнажает N-конец β-амилоида, который удаляется при расщеплении γ-секретазой по вариабельному С-концу. При этом образуются β-амилоидные пептиды, содержащие по 39-43 аминокислоты, которые оказались нейротоксичными и накапливаются в бляшках, создавая помехи для межнейронных связей.
В ряде исследований было показано, что стимуляция связанных с протеинкиназой С (РКС) мускариновых M1- и М3-рецепторов приводит к повышению активности α-секретазы. В результате этого усиливается процессинг АРР до APPsα, обладающего нейропротекторным действием. Параллельно этому снижается процессинг АРРβ- и γ-секретазой, вследствие чего уменьшается образование β-амилоида. Другие медиаторы, такие как фактор роста нервов (NGF) и мозговой нейротрофический фактор (BDNF), а также брадикинин и вазопрессин, могут оказывать подобные эффекты, увеличивая процессинг АРР до APPsα. В эффектах NGF может также участвовать ряд других факторов, включая связывание фактора со связанным с тирозинкиназой (TrkA) рецептором и стимуляцию фосфолипазы Сγ с последующим фосфорилированием и активацией протеинкиназы С (РКС) и возрастанием активности α-секретазы.
Следует ожидать, что любое воздействие, приводящее к избирательной активации протеинкиназы С в мозге, будет полезным при лечении болезни Альцгеймера. До недавнего времени не было селективных агонистов M1-рецептора. А неселективные агонисты будут стимулировать пресинаптические М2-рецепторы, что должно привести к образованию отрицательной обратной связи и поэтому еще более ослабит мускариновую передачу. Сейчас уже появляются селективные агонисты M1-рецептора (талсаклидин) и их уже исследуют на предмет лечения болезни Альцгеймера (AD). Существует, однако, существенный риск, как и при хроническом введении любых рецепторных агонистов, что наблюдаемый положительный клинический эффект будет сильно ограничен в количественном отношении из-за уменьшения числа рецепторов или снижения чувствительности и в отношении побочных эффектов из-за отсутствия рецепторной специфичности. Таким образом, следует ожидать, что описанные в настоящем изобретении соединения, избирательно регулирующие число и функции мускариновых рецепторов, будут лишены тех проблем, которые наблюдаются с мускариновыми агонистами, и поэтому будут особенно полезными. Действительно, их преимущества м