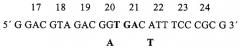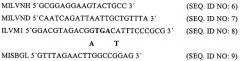Мутанты синтетазы ацетооксикислот, устойчивые к обратной связи
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Предложена нуклеотидная последовательность, кодирующая полипептид, обладающий активностью синтетазы ацетооксикислот (AHAS) и кодируемый полипептид. Последовательности приведены в описании. Раскрыто применение полипептида для ферментативного получения энантиомерно обогащенных аминокислот с разветвленной цепью. Описаны вектор, обеспечивающий экспрессию синтетазы аминокислот (AHAS) в клетках Corynebacterium и микроорганизм Corynebacterium, несущий указанный вектор. Раскрыт праймер для получения с помощью ПЦР метода кодирующей нуклеотидной последовательности. Описан гибридизационный зонд для обнаружения указанных нуклеотидных последовательностей. Раскрыт способ создания рекомбинантных полипептидов, где указанную нуклеотидную последовательность подвергают мутагенезу. Затем клонируют в пригодном векторе и переносят в пригодную экспрессионную систему. Обнаруживают и выделяют образовавшиеся полипептиды. Описан рекомбинантный полипептид, полученный указанным способом, и его применение для ферментативного получения энантиомерно обогащенных аминокислот с разветвленной цепью. Данное изобретение позволяет увеличить производство аминокислот с разветвленной цепью путем ферментации. 11 н. и 5 з.п. ф-лы, 2 ил., 3 табл.
Реферат
Настоящее изобретение относится к специфическим нуклеиновым кислотам и полипептидам, кодируемым этими нуклеиновыми кислотами, а также к их применению. Полипептиды, предлагаемые в настоящем изобретении, служат для увеличения производства аминокислот с разветвленной цепью путем ферментации.
В частности, в настоящем изобретении предложены нуклеотидные последовательности, кодирующие мутанты синтетазы ацетооксикислот (AHAS), сами мутантные ферменты и способ ферментативного производства аминокислот с разветвленной цепью с использованием этих ферментов в специфических хозяевах, в которых происходит экспрессия генов, кодирующих модифицированную синтетазу ацетооксикислот (AHAS).
Известно, что аминокислоты можно получать ферментативным путем с использованием штаммов коринебактерий, прежде всего с использованием Corynebacterium glutamicum. Поскольку эти продукты имеют большое значение, постоянно ведутся работы по совершенствованию метода их производства. Усовершенствования метода могут касаться технических сторон процесса ферментации, таких, например, как перемешивание и обеспечение кислородом, или состава питательных сред, например концентрации сахара в процессе ферментации, или обработки продукта, например, с помощью ионообменной хроматографии, или присущей микроорганизму продуктивности.
Для улучшения продуктивности этих микроорганизмов применяют методы мутагенеза, селекции и отбора мутантов. Таким путем получают штаммы, которые обладают устойчивостью к антиметаболитам, таким, например, как аналог изолейцина гидроксамат изолейцина (Kisumi M, Komatsubara S, Sugiura М, Chibata I, Journal of Bacteriology, 110, 1972, сс.761-763), аналог валина 2-тиазолаланин (Tsuchida Т, Yoshinanga F, Kubota К, Momose H., Agricultural and Biological Chemistry, Japan, 39, 1975, сс.1319-1322) или аналоги лейцина α-аминобутираты (Ambe-Ono Y, Sato К, Totsuka К, Yoshihara Y, Nakamori S., Bioscience Biotechnology Biochemistry, 60, 1996, сс.1386-1387), или которые являются ауксотрофами в отношении обладающих важной регуляторной функцией метаболитов и продуцируют, например, аминокислоты с разветвленной цепью (Tsuchida Т, Yoshinaga F, Kubota K, Momose H, Okumura S., Agricultural and Biological Chemistry, 1975; Nakayama K, Kitada S, Kinoshita S., Journal of General and Applied Microbiology, Japan, 7, 1961, сс.52-69; Nakayama К, Kitada S, Sato Z, Kinoshita., Journal of General and Applied Microbiology, Japan, 7, 191?, cc.41-51).
В течение ряда лет для улучшения продуцирующих аминокислоты с разветвленной цепью штаммов Corynebacterium glutamicum применяют также методы рекомбинантной ДНК, с помощью которых амплифицируют отдельные гены биосинтеза аминокислот с разветвленной цепью и исследуют влияние на их производство. Обзор работ в этой области можно найти среди прочего у Kinoshita ("Glutamic Acid Bacteria" в: Biology of Industrial Microorganisms, под ред. Domain и Solomon, изд-во Benjamin Cummings, London, UK, 1985, cc.115-142), Hilliger (BioTec, 2, 1991, cc.40-44), Eggeling (Amino Acids, 6, 1994, cc.261-272), Jetten и Sinskey (Critical Reviews in Biotechnology, 15, 1995, cc.73-103), Sahm и др. (Annuals of the New York Academy of Science, 782, 1996, сс.25-39) и Eggeling и др., Journal of Biotechnology, 56, 1997, сс.168-180).
Аминокислоты с разветвленной цепью L-изолейцин, L-валин и L-лейцин находят среди прочего применение в фармацевтической промышленности, медицине и в кормах для животных. Одним из ферментов, имеющих решающее значение для синтеза всех трех аминокислот в бактериях, является синтетаза ацетооксикислот (AHAS). Она катализирует две реакции, приводящие к образованию предшественников трех аминокислот.
В пути биосинтеза валина и лейцина субстратом для AHAS является пируват. AHAS катализирует декарбоксилирование пирувата и его конденсацию с второй молекулой пирувата с образованием ацетолактата. В пути биосинтеза изолейцина AHAS катализирует взаимодействие пирувата с 2-кетобутиратом с образованием ацетогидроксибутирата. В штаммах Escherichia coli присутствуют все три изофермента AHAS. Активность изоферментов ингибируется комбинациями аминокислот, при этом наиболее сильным ингибитором является валин (De Felice M., Levinthal M., laccarino M., Guardiola J., Growth inhibition as a consequence of antagonism between related amino acids: effect of valine in Escherichia coli K12, Microbiol Rev., 43, 1979, сс.4258). AHAS I, кодируемая генами ilvBN, ингибируется валином и изолейцином, AHAS II, кодируемая ilvGM, устойчива к валину, а AHAS III, кодируемая ilvIH, ингибируется валином и изолейцином. Во всех трех случаях фермент состоит из 2 субъединиц. В AHAS I и AHAS III ингибирование обусловлено присутствием малых регуляторных субъединиц, кодируемых генами ilvN и ilvH соответственно.
В отличие от Е. coli в С. glutamicum ген ilvBN кодирует только AHAS (Keilhauer С., Eggeling L., Sahm Н., Изолейцин synthesis in Corynebacterium glutamicum: molecular analysis of the ilvB-ilvN-ilvC operon, J. Bacteriol., 175, 1993, cc.5595-5603). Активность фермента С. glutamicum ингибируется валином, лейцином и изолейцином (Eggeling I., Cordes С., Eggeling L., Sahm Н., Regulation of acetohydroxy acid synthetase in Corynebacterium glutamicum during fermentation of alfa-ketobutyrate to L-isoleucine, Appi Microbiol Biotechnol, 25, 1987, cc.346-351). Экспрессия кластера генов ilvBNC также регулируется этими тремя аминокислотами в результате ослабления транскрипции (Morbach S., Junger С., Sahm Н., Eggeling L., Attenuation control of ilvBNC in Corynebacterium glutamicum: evidence of leader peptide formation without the presence of a ribosome binding site, J Biosci Bioeng, 90, 2000, cc.501-507).
До настоящего времени не были описаны мутации на молекулярном уровне, нарушающие регуляцию активности AHAS в Corynebacterium glutamicum.
Целью настоящего изобретения было создание модифицированной синтетазы ацетооксикислот (AHAS). В частности, AHAS, предлагаемая в настоящем изобретении, должна быть менее чувствительной к ингибирующему действию, обусловленному аминокислотами.
Эта цель достигается в соответствии с формулой изобретения. П.1 относится к определенным нуклеиновым кислотам, кодирующим полипептид, который обладает рассматриваемыми отличительными признаками. Под объем п.2 подпадают сами полипептиды. П.3 и п.4 касаются хозяев, содержащих нуклеиновые кислоты, предлагаемые в изобретении, или специальные праймеры или зонды для их получения с помощью ПЦР. Кроме того, в п.5 определен способ получения дополнительно улучшенных полипептидов, предлагаемых в изобретении, в то время как п.6 защищает полученные таким способом полипептиды и нуклеиновые кислоты соответственно. П.7 и п.8 относятся к конкретным применениям, а под объем п.9 подпадает способ получения аминокислот. Аналогично этому в п.10 и п.11 указаны конкретные векторы и микроорганизмы.
При создании настоящего изобретения неожиданно было установлено, что в результате получения выделенных нуклеотидных последовательностей, кодирующих полипептид, который обладает активностью синтетазы ацетооксикислот (AHAS), выбранных из ряда, включающего:
а) нуклеотидную последовательность, представленную в SEQ ID NO: 1 или SEQ ID NO:3;
б) нуклеотидную последовательность, которая содержит в положениях 21 и 22 триплет оснований, кодирующий Asp и Phe соответственно;
в) нуклеотидную последовательность, гибридизующуюся в строгих условиях с нуклеотидными последовательностями, указанными в а) или б);
г) нуклеотидную последовательность, гомологичную по меньшей мере на 70% нуклеотидной последовательности, указанной в а) или б);
д) нуклеиновую кислоту, кодирующую полипептид, гомологичный на аминокислотном уровне по меньшей мере на 80% полипептиду, кодируемому нуклеотидной последовательностью, указанной в а) или б);
е) нуклеиновую кислоту, кодирующую полипептид, который обладает улучшенной активностью, и/или селективностью, и/или стабильностью по сравнению с полипептидом, кодируемым нуклеотидной последовательностью, указанной в а) или б), которую получают путем
I) мутагенеза нуклеиновой кислоты, указанной в а) или б),
II) встраивания путем лигирования нуклеотидной последовательности, которую можно получать, как указано в I), в пригодный вектор с последующей трансформацией пригодной экспрессионной системы, и
III) экспрессии и обнаружения имеющего решающее значение полипептида, который обладает улучшенной активностью, и/или селективностью, и/или стабильностью;
ж) нуклеотидную последовательность, содержащую по меньшей мере 15 последовательных пар оснований нуклеотидных последовательностей, указанных в а)-е),
препятствия, отмеченные выше и характерные для прототипов, были успешно преодолены. Нуклеиновые кислоты, предлагаемые в изобретении, кодируют полипептиды, обладают пониженной чувствительностью к ингибирующему действию аминокислот по типу обратной связи по сравнению с ферментом дикого типа.
Методы улучшения с помощью мутагенеза нуклеиновых кислот, предлагаемых в изобретении, или кодируемых ими полипептидов достаточно хорошо известны специалисту в данной области. В качестве пригодных методов мутагенеза можно применять любые пригодные для этой цели методы, известные специалисту в данной области. К ним относятся, в частности, насыщающий мутагенез, неспецифический мутагенез, методы рекомбинации in vitro и сайтнаправленный мутагенез (Eigen М. и Gardiner W., Evolutionary molecular engineering based on RNA replication, Pure Appl. Chem., 56, 1984, cc.967-978; Chen К. и Arnold F., Enzyme engineering for non-aqueous solvents: random mutagenesis to enhance activity of subtilisin E in polar organic media,
Bio/Technology, 9, 1991, cc. 1073-1077; Horwitz M. и Loeb L., Promoters Selected From Random DNA-Sequences, Proc Nati Acad Sci USA, 83, 1986, cc.7405-7409; Dube D. и L. Loeb, Mutants Generated By The Insertion Of Random Oligonucleotides Into The Active-Site Of The Beta-Lactamase Gene, Biochemistry, 28, 1989, cc.5703-5707; Stemmer P.C., Rapid evolution of a protein in vitro by DNA shuffling, Nature, 370, 1994, cc.389-391 и Stemmer P.C., DNA shuffling by random fragmentation and reassembly: In vitro recombination for molecular evolution. Proc Nati Acad Sci USA, 91, 1994, cc.10747-10751).
Полученные новые нуклеотидные последовательности клонируют в организме-хозяине с помощью общепринятых методов, указанных ниже, и экспрессируемые при этом полипептиды обнаруживают и затем выделяют с использованием пригодных методов скрининга. Для целей обнаружения в принципе можно применять любые возможные реакции, позволяющие обнаруживать молекулы, образованные с таким полипептидом. В частности, для обнаружения образовавшихся аминокислот можно применять фотометрические тесты с определением образовавшихся (например, типа ацетолактата) или прореагировавших соединений, методы ЖХВР или ГХ. Кроме того, для обнаружения новых полипептидов, модифицированных с помощью генной инженерии, можно применять также методы обнаружения с помощью гель-электрофореза или методы обнаружения с использованием антител.
Как отмечалось выше, под объем изобретения подпадают также нуклеотидные последовательности, которые гибридизуются в строгих условиях с одноцепочечными нуклеотидными последовательностями, предлагаемыми в изобретении, или комплементарными им одноцепочечными нуклеотидными последовательностями.
В контексте настоящего описания понятие "в строгих условиях" следует понимать в том смысле, как оно описано у Sambrook и др. (Sambrook J.; Fritsch E.F. и Maniatis Т., Molecular cloning: a laboratory manual, 2-е изд., изд-во Cold Spring Harbor Laboratory Press, New York, 1989). Согласно настоящему изобретению под гибридизацией в строгих условиях предпочтительно подразумевается, что после выращивания в течение 1 ч с 1×SSC (150 мМ хлорид натрия, 15 мМ цитрат натрия, рН 7,0) и 0,1% ДСН (додецилсульфат натрия) при 50°С, предпочтительно при 55°С, более предпочтительно при 62°С и наиболее предпочтительно при 68°С, и более предпочтительно в течение 1 ч с 0,2×SSC и 0,1% ДСН при 50°С, предпочтительно при 55°С, более предпочтительно при 62°С и наиболее предпочтительно при 68°С, все еще обнаруживается позитивный сигнал гибридизации.
Вторым объектом настоящего изобретения являются полипептиды, выбранные из группы, включающей
а) полипептид, кодируемый нуклеотидной последовательностью по п.1;
б) полипептид, имеющий последовательность, указанную в SEQ. ID NO: 2 или SEQ. ID NO: 4;
в) полипептид, гомологичный по меньшей мере на 84% полипептиду, который имеет последовательность SEQ. ID NO: 2 или SEQ: ID NO. 4 и у которого активность, и/или селективность, и/или стабильность не является существенно более низкой по сравнению с полипептидом, имеющим последовательность, указанную в SEQ. ID NO: 2 или SEQ. ID NO: 4,
которые могут служить в качестве модифицированных AHAS-ферментов в пути биосинтеза при получении посредством ферментации аминокислот с разветвленной цепью, в частности, валина, лейцина и изолейцина. Как уже отмечалось, эти ферменты обладают меньшей чувствительностью к ингибированию по типу обратной связи, что позволяет достигать высоких концентраций аминокислот в ферментативном бульоне без возникновения неблагоприятных ингибирующих действий.
Третий объект настоящего изобретения касается плазмид, векторов, микроорганизмов, содержащих одну или несколько нуклеотидных последовательностей, предлагаемых в изобретении.
Пригодными плазмидами или векторами в принципе могут служить любые известные специалисту в данной области плазмиды и векторы, применяемые для этой цели. Эти типы плазмид и векторов описаны у Studier и др. (Studier W.F., Rosenberg A.H., Dunn J.J.; DubendroffJ.W., Use of the T7 RNA polymerase to direct expression of cloned genes, Methods EnzymoL, 185, 1990, cc.61-89) или в серии проспектов, выпущенных фирмами Novagen, Promega, New England Biolabs, Clontech или Gibco BRL. Другие предпочтительные плазмиды и векторы описаны у: Glover D.M., DNA cloning: a practical approach, тома I-III, изд-во IRL Press Ltd., Oxford, 1985; Vectors: a survey of molecular cloning vectors and their uses, под ред. Rodriguez R.L. и Denhardt D. Т, изд-во Butterworth, Stoneham, 1988, cc.179-204; Goeddel D.V., Systems for heterologous gene expression., Methods EnzymoL, 185, 1990, cc.3-7; Sambrook J.; Fritsch E.F. и Maniatis Т., Molecular cloning: a laboratory manual, 2-е изд., изд-во Cold Spring Harbor Laboratory Press, New York, 1989.
Наиболее предпочтительные плазмиды, с помощью которых генные конструкции, содержащие нуклеиновые кислоты, предлагаемые в изобретении, можно клонировать в организме-хозяине, представлены на фиг.1 и фиг.2.
Аналогично этому в изобретении предложены также микроорганизмы, содержащие одну или несколько нуклеотидных последовательностей, предлагаемых в изобретении.
Микроорганизм, в котором клонируют плазмиды, содержащие нуклеотидные последовательности, предлагаемые в изобретении, можно использовать для размножения и получения достаточного количества рекомбинантного фермента. Методы, применяемые для этой цели, хорошо известны специалисту в данной области (Sambrook J.; Fritsch E.F. и Maniatis Т., Molecular cloning: a laboratory manual, 2-е изд., изд-во Cold Spring Harbor Laboratory Press, New York, 1989). К микроорганизмам, которые можно отметить в этой связи, в принципе относятся любые организмы, известные специалисту в данной области, которые пригодны для указанной цели, такие, например, как дрожжи, например Hansenula polymorpha, Pichia sp., Saccharomyces cerevisiae, прокариоты, Е. coli. Bacillus subtilis или эукариоты, такие как клетки млекопитающих, клетки насекомых. Предпочтительными для этой цели являются штаммы Е. coli. Наиболее предпочтительными являются следующие штаммы: Е. coli XL1 Blue, NM 522, JM101, JM109, JM105, RR1, DH5α, TOP 10- или НВ101. Предпочтительные плазмиды, с помощью которых клонируют генную конструкцию, содержащую нуклеиновую кислоту, предлагаемую в изобретении, указаны выше.
Предпочтительные микроорганизмы, предлагаемые в настоящем изобретении, могут продуцировать аминокислоты с разветвленной цепью из глюкозы, сахарозы, лактозы, маннозы, фруктозы, мальтозы, мелассы, крахмала, целлюлозы или глицерина и этанола. В качестве микроорганизмов можно применять представителей коринебактерий, в частности из рода Corynebacterium. В роде Corynebacterium следует прежде всего отметить вид Corynebacterium glutamicum, который, как известно специалистам в данной области, обладает способностью продуцировать энантиомерно обогащенные аминокислоты, предпочтительно L-аминокислоты.
Пригодными штаммами бактерий р. Corynebacterium, прежде всего вида Corynebacterium glutamicum, являются известные штаммы дикого типа
Corynebacterium glutamicum ATCC 13032,
Brevibacterium flavum ATCC 14067,
Brevibacterium lactofermentum ATCC 13 869 и
Brevibacterium divaricatum ATCC 14020
и полученные из них мутанты, соответственно штаммы, продуцирующие аминокислоты с разветвленной цепью, такие, например, как продуцирующие изолейцин штаммы
Corynebacterium glutamicum ATCC 14309,
Corynebacterium glutamicum ATCC 14310,
Corynebacterium glutamicum ATCC 14311,
Corynebacterium glutamicum ATCC 15168,
Corynebacterium ammoniagenes ATCC 6871,
такие, например, как продуцирующие лейцин штаммы
Corynebacterium glutamicum ATCC 21885
Brevibacterium flavum ATCC 21889,
или такие, например, как продуцирующие валин штаммы
Corynebacterium glutamicum DSM 12455,
Corynebacterium glutamicum FERM-P 9325,
Brevibacterium lactofermentum FERM-P 9324,
Brevibacterium lactofermentum FERM-BP 1763.
Нуклеотидные последовательности, предлагаемые в настоящем изобретении, можно сверхэкспрессировать в пригодном хозяине. Для достижения сверхэкспрессии можно увеличивать количество копий соответствующего гена или можно вызывать мутации в промоторной и регуляторной областях или в сайте связывания рибосомы, расположенном против хода транскрипции относительно структурного гена. Таким же образом действуют кассеты экспрессии, встроенные против хода транскрипции относительно структурного гена. Кроме того, экспрессию можно дополнительно повышать в процессе ферментативного продуцирования аминокислот с разветвленной цепью с помощью индуцибельных промоторов. Экспрессию можно усиливать также за счет увеличения продолжительности жизни мРНК. Кроме того, ферментативная активность может быть усилена также путем ингибирования разложения белка фермента. При этом гены или генные конструкции либо могут находиться в различном количестве копий в плазмидах, либо их интегрируют в хромосому и амплифицируют. В альтернативном варианте сверхэкспрессия рассматриваемых генов может быть также достигнута путем изменения состава питательных сред и условий культивирования. Дополнительные рекомендации в этом отношении можно найти в US 09/471803 или его эквиваленте DE 19951708.
Следующим объектом настоящего изобретения являются праймеры для получения с помощью ПЦР или гибридизационные зонды для обнаружения нуклеотидных последовательностей, предлагаемых в изобретении.
Нуклеотидные последовательности, предлагаемые в изобретении, можно применять в качестве гибридизационных зондов для РНК, кДНК и ДНК для выделения полноразмерной кДНК, кодирующей белки AHAS, и для выделения такой кДНК или генов, последовательность которых обладает высоким уровнем сходства с последовательностью, предлагаемой в настоящем изобретении.
Кроме того, нуклеотидные последовательности, предлагаемые в изобретении, можно применять в качестве праймеров, с помощью которых с использованием полимеразной цепной реакции (ПЦР) можно создавать ДНК генов, кодирующих AHAS. К ним относятся смысловые и антисмысловые праймеры, обеспечивающие кодирование соответствующих аминокислотных последовательностей или комплементарных последовательностей ДНК. В принципе пригодные праймеры можно создавать методами, известными специалисту в данной области. Конструирование праймеров, предлагаемых в изобретении, осуществляют на основе сравнения с известными последовательностями ДНК или путем трансляции аминокислотных последовательностей, обнаруженных визуально в предпочтительном кодоне рассматриваемого организма (см., например, для Streptomyces: Wright F. и Bibb M.J., Codon usage in the G+C-rich Streptomyces genome. Gene, 113, 1992, cc.55-65). Для этой цели можно использовать также общие отличительные признаки аминокислотной последовательности белков из так называемых суперсемейств (Firestine S.M.; Nixon A.E.; Benkovic S.J., Threading your way to protein function, Chem. Biol., 3, 1996, cc. 779-783). Дополнительную информацию касательно данного предмета можно найти у Gait M.J., Oligonucleotide synthesis: a practical approach, изд-во IRL Press Ltd., Oxford, 1984; Innis M.A., Gelfound D.H., Sninsky J.J. и White T.J., PCR Protocols: A guide to methods and applications, изд-во Academic Press Inc., San Diego, 1990. Наиболее предпочтительными являются следующие праймеры:
Такие нуклеотидные последовательности, применяемые в качестве зондов или праймеров, имеют по меньшей мере 30, предпочтительно по меньшей мере 20, наиболее предпочтительно по меньшей мере 15, последовательных нуклеиновых кислот, одинаковых с нуклеиновыми кислотами, предлагаемыми в изобретении. Можно использовать также нуклеотидные последовательности, имеющие длину по меньшей мере 40 или 50 пар оснований.
Следующий вариант осуществления настоящего изобретения относится к способу создания улучшенных рекомбинантных полипептидов, обладающих активностью синтетазы ацетооксикислот (AHAS), на основе нуклеотидных последовательностей, предлагаемых в изобретении, заключающемуся в том, что
а) нуклеотидные последовательности подвергают мутагенезу,
б) нуклеотидные последовательности, полученные согласно а), клонируют в пригодном векторе и переносят в пригодную экспрессионную систему, и
в) обнаруживают и выделяют образовавшиеся полипептиды, обладающие улучшенной активностью, и/или селективностью, и/или стабильностью.
Под объем изобретения подпадают также рекомбинантные полипептиды или кодирующие их нуклеотидные последовательности, которые можно получать способом, аналогичным только что описанному способу.
Получение нуклеотидных последовательностей, требуемых для создания улучшенных рекомбинантных полипептидов и их экспрессии в хозяевах, описано выше и соответственно подпадает под объем изобретения.
Полипептиды и улучшенные рекомбинантные полипептиды, предлагаемые в изобретении, предпочтительно применяют для получения энантиомерно обогащенных аминокислот с разветвленной цепью, более предпочтительно валина, лейцина и изолейцина.
Кроме того, нуклеотидные последовательности и улучшенные нуклеотидные последовательности предпочтительно можно применять для создания микроорганизма, продуцирующего аминокислоты с разветвленной цепью.
Следующий вариант осуществления изобретения относится к способу продуцирования аминокислот с разветвленной цепью с использованием полипептида, предлагаемого в изобретении.
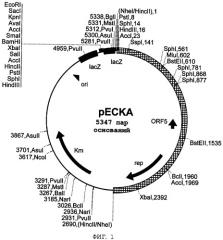
Кроме того, под объем настоящего изобретения подпадают векторы pECKA (фиг.1) или pECKA/ilvBNC (фиг.2). Кроме того, в объем настоящего изобретения включены модифицированные микроорганизмы типа DSM15652, DSM 15561 или DSM15650. Они депонированы согласно Будапештскому договору в Немецкой коллекции микроорганизмов и клеточных культур (Deutsche Sammlung für Mikroorganismen und Zeilkulturen GmbH), Mascheroder Weg 1b, D-38124, 4 июня 2003 г.
Для клонирования оперона ilvBNC, имеющего мутации в гене ilvN, конструировали бифункциональный вектор Escherichia coli - Corynebacterium glutamicum. Сначала из вектора рK19 удаляли сайт, распознаваемый рестриктазой BglII. Затем HindIII/HindII-фрагмент (2,7 т.п.н.) плазмиды pBL1 из Brevibacterium lactofermentum клонировали в сайте Nhel рK19. Образовавшийся плазмидный вектор pECKA (5,4 т.п.н.), обладающий способностью реплицироваться в Escherichia coli и Corynebacterium glutamicum, имел 7 уникальных сайтов клонирования, маркер устойчивости к канамицину и α-комплементацию β-галактозидазы для клонирования в Е. coli. SspI/EcoRI-фрагмент хромосомы (5,7 т.п.н.) (с концами SspI+BamHI), несущий оперон ilvBNC, клонировали в расщепленном с помощью HindII+BamHI векторе рЕСКА, в результате чего создавали плазмиду pECKAilvBNC (11,1 т.п.н.).
Встречающийся в естественных условиях ScaI/BglII-фрагмент оперона ilvBNC (770 пар оснований) заменяли фрагментом той же длины, содержащим 3-5 измененных оснований, который конструировали с помощью сайтнаправленного мутагенеза. Мишенью для сайтнаправленного мутагенеза был консервативный домен регуляторной субъединицы, кодируемый ilvN, расположенным вблизи N-конца. Мутации создавали с помощью ПЦР с учетом последовательностей мутантов AHAS Escherichia coli и Streptomyces cinnamonensis. Мутации обнаруживали путем секвенирования последовательностей.
Плазмидную ДНК выделяли из Escherichia coli и штамм Corynebacterium glutamicum ATCC13032Δilvin трансформировали плазмидами pECKAilvBNC(WT), pECKAilvBNC(M8) и pECKAilvBNC(M13). Подтверждали уменьшение ингибирования AHAS, обусловленного аминокислотами с разветвленной цепью.
Понятие "выделенный" обозначает выделенный из своего естественного окружения.
В контексте настоящего изобретения оптически обогащенные (энантиомерно обогащенные, обогащенные энантиомерами) соединения обозначают смесь двух оптических изомеров (антиподов), в которой на долю одного из антиподов приходится >50 мол.%.
Подразумевается, что экспрессионные нуклеотидные последовательности включают все типы одноцепочечной или двухцепочечной ДНК, а также РНК или их смеси.
В контексте настоящего изобретения улучшение активности, и/или селективности, и/или стабильности означает, что полипептиды являются более активными, и/или более селективными, и/или более стабильными в рассматриваемых реакционных условиях. В то время как активность и стабильность ферментов в условиях промышленного применения должна, естественно, быть как можно выше, то в отношении селективности улучшение означает как то, что понижается субстратная селективность, так и то, что повышается энантиоселективность ферментов. В этой связи для того, чтобы выражение не теряло смысл в значительной степени, одно и то же выражение следует понимать с соответствующими изменениями (mutatis mutandis).
Согласно изобретению заявленные белковые последовательности и нуклеотидные последовательности включают также последовательности, гомологичные (за исключением встречающейся в естественных условиях вырожденности генетического кода) более чем на 91%, предпочтительно более чем на 92, 93 или 94%, более предпочтительно более чем на 95 или 96% и наиболее предпочтительно более чем на 97, 98 или 99%, одной из указанных последовательностей, при условии, что сохраняются механизм действия или функция такой последовательности. В контексте настоящего описания понятие "гомология" (или идентичность) можно определять согласно уравнению Н(%)=[1-V/X]×100, где Н обозначает гомологию, Х обозначает общее количество нуклеотидов/аминокислот в последовательности, с которой производят сравнение, и V обозначает количество несовпадающих нуклеотидов/аминокислот в предназначенной для сравнения последовательности и в последовательности, с которой производится сравнение. В каждом случае экспрессионные нуклеотидные последовательности, кодирующие полипептиды, включают все последовательности, которые, по-видимому, могут существовать, с учетом вырожденности генетического кода.
Подразумевается, что литературные источники, упомянутые в настоящем документе, включены в описание в качестве ссылки.
Примеры:
1. Конструирование плазмидного вектора рЕСКА
Для клонирования оперона ilvBNC С. glutamicum, имеющего мутации в гене ilvN, и для его сверхэкспрессии конструировали бифункциональный вектор, обладающий способностью реплицироваться в Escherichia coli и в Corynebacterium glutamicum. Сначала из вектора рK19 (Pridmore R.D., New and versatile cloning vectors with kanamycin-resistance marker. Gene, 56, 1987, cc.309-312) удаляли сайт, распознаваемый рестриктазой BglII. Плазмиду рK19 расщепляли с помощью BglII, затупляли концы с помощью полимеразы Кленова и повторно встраивали путем лигирования. После лигирования клетки DH5α E. coli трансформировали полученной в результате лигирования смесью и отбирали трансформанты, несущие образовавшуюся плазмиду рK19В на агаровых планшетах, содержащих канамицин (20 мг/л). Удаление сайта BglII из рK19В подтверждали путем обработки выделенной плазмидной молекулы с помощью BglII (такое удаление позволяло в дальнейшем осуществлять субклонирование фрагмента, несущего ген ilvN, в новом сконструированном векторе pECKA.) Затем HindIII/HindII-фрагмент (2,7 т.п.н.) плазмиды pBL1 из Brevibacterium lactofermentum с затупленными с помощью полимеразы Кленова концами клонировали в сайте NheI с затупленными концами плазмиды рK19В. Образовавшийся плазмидный вектор pECKA (5,4 т.п.н.) обладал способностью реплицироваться в Escherichia coli и Corynebacterium glutamicum, содержал 7 уникальных сайтов клонирования (HindII, SalI, BamHI, SmaI, AvaI, KpnI, SacI), маркер устойчивости к канамицину и α-комплементацию β-галактозидазы для клонирования в Е. coli. Его рестрикционная и генетическая карты представлены на фиг.1.
2. Клонирование оперона ilvBNC в векторе pECKA
Фрагмент хромосомы С. glutamicum длиной 5,7 т.п.н., несущий оперон ilvBNC, получали путем расщепления плазмиды рKK5 (Keilhauer С., Eggeling L., Sahm H., Isoleucine synthesis in Corynebacterium glutamicum: molecular analysis of the ilvB-ilvN-ilvC operon, J. Bacteriol., 175, 1993, cc.5595-5603) с помощью рестриктаз SspI и BamHI. Фрагмент встраивали путем лигирования в расщепленный с помощью HindII+BamHI вектор pECKA, полученную в результате лигирования смесь использовали для трансформации штамма Е. coli DH5α. Трансформанты отбирали на агаровых планшетах, содержащих канамицин (30 мг/л). Структуру образовавшейся плазмиды pECKAilvBNC (11,1 т.п.н.) подтверждали с помощью рестрикционного анализа. Рестрикционная и генетическая карты плазмиды pECKAilvBNC представлены на фиг.2.
3. Конструирование олигонуклеотидного праймера для мутагенеза гена ilvN
Осуществляли сравнительный анализ известной аминокислотной последовательности регуляторной субъединицы AHAS, кодируемой геном ilvN С glutamicum (GenBank, регистрационный номер L09232), и известных аминокислотных последовательностей регуляторных субъединиц AHAS из Streptomyces cinnamonensis (GenBank, регистрационный номер AF175526) и из Escherichia coli (GenBank, регистрационный номер АЕ0116769, секция 15 полного генома). Ранее были описаны несколько мутаций в Escherichia coli и Streptomyces cinnamonensis, обусловливающих устойчивость к валину (Vyazmensky M., Sella С., Barak Z., Chipman D.M., Isolation and characterization of subunits of acetohydroxy acid synthase isozyme III and reconstitution of the holoenzyme, Biochemistry, 35, 1996, cc.10339-10346; Janata J., Felsberg J., Mutations in two distinct regions of acetolactate synthase regulatory subunit from Streptomyces cinnamonensis result in the lack of sensitivity to end-product inhibition, Biochem Biophys Res Commun, 266, 1999, cc.162-166). В некоторых штаммах, имеющих указанный фенотип, мутация, приводящая к аминокислотной замене глицина на аспартат в положении 20 (согласно нумерации в последовательности Е. coli), была обнаружена как в Е. coli, так и в S. cinnamonensis, в частично консервативном домене вблизи N-конца белка:
| С. glutamicum | (SEQ. ID NO: 10) |
MANSDVTRHILSVLVQDVDGIISRVSGMFTRRAFNLVSLVSAKTETHGINRITVV
VD
| S. cinnamonensis | (SEQ. ID NO: 11) |
MS----TKHTLSVLVENKPGVLARITALFSRRGFNIDSLAVGVTEHPDISRITIVVN
| E. coli | (SEQ. ID NO: 12) |
MQNTTHDNVILELTVRNHPGVMTHVCGLFARRAFNVEGILCLPIQDSDKSHIWL
LVN
При создании изобретения конструировали вырожденный олигонуклеотидный праймер ILVNM1 (SEQ. ID NO: 7), предназначенный для сайтнаправленного мутагенеза гена ilvN C.glutamicum. Этот праймер позволял обеспечивать интродукцию мутаций в ген ilvN в положениях триплетов нуклеотидов, соответствующих аминокислотам глицину, изолейцину и изолейцину в положениях 20-22 регуляторной субъединицы AHAS С. glutamicum:
Праймер ILVNM1 (SEQ. ID NO: 7):
Нуклеотиды, измененные по сравнению с нуклеотидами последовательности дикого типа, выделены жирным шрифтом. В триплетах 20 и 22 имеются два вырожденных положения (G или А и А или Т, соответственно).
4. Сайт направленный мутагенез гена ilvN
Сайт направленный мутагенез встречающегося в естественных условиях ScaI/BglII-фрагмента оперона ilvBNC С. glutamicum (770 пар оснований) осуществляли с помощью ПЦР с использованием 4 олигонуклеотидных праймеров (Ito W., Ishiguro H., Kurosawa Y., A general method for introducing a series of mutations into cloned DNA using the polymerase chain reaction. Gene, 102, 1991, cc.67-70).
Применяли следующие праймеры:
Первая ПЦР: С использованием праймеров MILVNH и MISBGL амплифицировали фрагмент А (786 пар оснований) с измененным сайтом BglII, встречающимся в естественных условиях. С использованием праймеров ILVM1 и MILVND амплифицировали фрагмент В (491 пара оснований), имеющий мутации в гене ilvN. В качестве матрицы использовали плазмиду pECKAilvBNC. Образовавшиеся ДНК-фрагменты разделяли на агарозном геле, выделяли и очищали путем осаждения.
Вторая ПЦР: С использованием праймеров MILVNH - MILVND и используемых в качестве матриц фрагментов А+В (смешанных в молярном соотношении 1:1) амплифицировали смесь, содержащую фрагмент С (803 пары оснований), имеющий мутацию в сайте BglII, и фрагмент D (803 пары оснований), имеющий мутации в гене ilvN. Эту смесь расщепляли с помощью Seal и BglII и образовавшиеся фрагменты выделяли из агарозного геля. Плазмиду pECKAilvBNC расщепляли с помощью тех же самых ферментов с получением фрагментов длиной 766 и 10334 пар оснований и более крупный фрагмент также выделяли из геля. Выделенные фрагменты смешивали и лигировали. Клетки Е. coli DH5α трансформировали полученной в результате лигирования смесью и трансформанты отбирали на планшетах с канамицином (30 мг/л). Таким методом встречающийся в естественных условиях ScaI/BclII-фрагмент хромосомы (766 пар оснований) в плазмиде pECKAilvBNC заменяли фрагментом той же длины, в котором ген ilvN мог содержать 3-5 измененных нуклеотидов.
5. Секвенирование мутантов гена ilvN
Выделяли плазмидную ДНК из полученных клонов Е. coli DH5α и секвенировали с использованием праймера SILVNH и автоматического секвенатора типа Vistra (фирма Amersham).
Праймер SILVNH:
5' GATCCTGCCGACATTCACGA 3' (SEQ. ID NO: 9)
Выделяли клоны с 2 различными последовательностями в триплетах 20-22.
Получали клоны, имеющие мутации в гене ilvN:
| Мутант | Последовательность ДНК | Положение аминокислот | ||
| 20 | 21 | 22 | ||
| WT | GGAATCATT | Gly | Ile | Ile |
| М8 | GGTGACTTT | Gly | Asp | Phe |
| М13 | GATGACTTT | Asp | Asp | Phe |
Полные последовательности гена ilvN мутантов М8 и М13 представлены в SEQ. 3 и 1 соответственно.
6. Трансформация Corvnebacterium glutamicum
Плазмидную ДНК выделяли из Escherichia coli и штамм Corynebacterium glutamicum ATCC 13032 ΔilvN трансформировали плазмидами pECKAilvBNC (WT), pECKAilvBNC (M8) и pECKAilvBNC (M13) с помощью метода электропорации (Liebl W., Bayeri A., Schein В., Stillner U., Schleifer K.H., High efficiency electroporation of intact Corynebacterium glutamicum cells, FEMS Microbiol. Lett., 53, 1989, cc.299-303). Трансформанты отбирали на планшетах с канамицином (30 мг/л).
7. Измерения активности AHAS и ее ингибирования валином, лейцином и изолейдином
Для измерения активности AHAS использовали штаммы С. glutamicum АТСС13032 ΔilvN, содержащие плазмиды pECKAilvBNCCWT), pECKAilvBNC (M8) и pECKAilvBNC (M13). Клетки культивировали в течение ночи в минимальной среде CGXII, собирали центрифугированием и разрушали путем облучения ультразвуком. После центрифугирования (16000×g, 30 мин) проводили измерение активности AHAS в бесклеточном экстракте. С помощью спектрофотометрического ферментного анализа проводили непрямое обнаружение ацетолактата, представляющего собой продукт реакции (Singh В.K., Stidham M.A., Shaner D.L., Assay of acetohydroxyacid synthase, Anal Biochem., 171, 1988, cc.173-179). Анализ основан на превращении конечного продукта ацетолактата в ацетоин и обнаружении ацетоина по образованию комплекса креатина и нафтола.
Результаты измерений ферментативной активности представлены в табл. 1. Для оценки ингибирования фермента валином, лейцином и изолейцином все три аминокислоты (10 мМ) добавляли по отдельности в реакционную смесь. Результаты приведены в табл. 2 и табл. 3 соответственно.
| Таблица 1Активность AHAS | ||||
| Штамм/плазмида | Удельная активность AHAS (нмоли ацетоина × мин-1 × мг-1 белка) | |||
| С. glutamicum ATCC 13032 | 33,7±10 | |||
| С. glutamicum ATCC 13032 ΔlivN | 0,43 | |||
| С. glutamicum ATCC 13032 ΔilvN/pECKAilvBNC (WT) | 110±40 | |||
| С. glutamicum ATCC 13032 ΔilvN/pECKAilvBNC(M8) | 31,1±0,9 | |||
| С. glutamicum ATCC13032 ΔilvN/pECKAilvBNC (M13) | 40,9±13 | |||
| Таблица 2Ингибирование активности AHAS | ||||
| Штамм/плазмида | Удельная активность AHAS в присутствии 10 мМ аминокислоты (нмоли ацетоина × мин-1 × мг-1 белка) | |||
| - | Val | Leu | He | |
| С. glutamicum ATCC13032 | 33,7 | 16,9 | 20,9 | 21,2 |
| С. glutamicum ATCC13032 ΔilvN/pECKAilvBNC WT | 110 | 61,6 | 71,5 | 68,2 |
| С. glutamicum ATCC13032 ΔilvN/pECKAilvBNC(MS) | 31,1 | 35,1 | 34,8 | 32,7 |
| С. glutamicum ATCC13032 ΔilvN/pECKAilvBNC (M13) | 40,9 | 40,7 | 44,2 | 40,0 |
| Таблица 3Ингибирование активности AHAS в процентах | ||||
| Штамм/плазмида | Ингибирование (10 мМ аминокислоты) | |||
| Val | Leu | IIe | ||
| С. glutamicum ATCC13032 | 50% | 38% | 37% | |
| С. glutamicum ATCC13032 | 44% | 35% | 38% |
| Штамм/плазмида | Ингибирование (10 мМ аминокислоты) | ||
| Val | Leu | Ile | |
| ΔilvN/pECKAilvBNC WT | |||
| С. glutamicum ATCC13032 ΔilvN/pECKAilvBNC(M8) | 0% | 0% | 0% |
| С. glutamicum ATCC13032 ΔilvN/pECKAilvBNC (M13) | 0% | 0% | 2,5% |
1. Нуклеотидная последовательность, кодирующая полипептид, который обладает активностью синтетазы ацетооксикислот (AHAS), выбранная из ряда, включающего
а) нуклеотидную последовательность, представленную в SEQ. ID No: 1 или SEQ.ID NO:3;
б) нуклеотидную последовательность гена ilvN, которая содержит в положениях 21 и 22 триплет оснований, кодирующий Asp и Phe, соответственно;
в) нуклеотидную последовательность, гибридизирующуюся в строгих условиях с нуклеотидными последовательностями, указанными в а) или б);
г) нуклеотидную последовательность, гомологичную по меньшей мере на 70% нуклеотидной последовательности, указанной в а) или б), кодирующую фермент с такой же активностью, что и полипептид, кодируемый нуклеотидной последовательностью по п.1 (а);
д) нуклеиновую кислоту, кодирующую полипептид, гомологичный на аминокислотном уровне по меньшей мере на 80% полипептиду, кодируемому нуклеотидной последовательностью, указанной в а) или б), кодирующую фермент с такой же активностью, что и полипептид, кодируем