Рекомбинантная плазмидная днк pgg-1, кодирующая полипептид проинсулина glargin человека и штамм бактерий escherichia coli bgg18 - продуцент рекомбинантного проинсулина glargin
Иллюстрации
Показать всеИзобретение относится к генной инженерии, конкретно к получению проинсулина Glargin, и может быть использовано для создания лекарственных препаратов нового поколения для лечения инсулинозависимого сахарного диабета. Конструируют рекомбинантную плазмидную ДНК pGG-1, кодирующую гибридный белок с аминокислотной последовательностью проинсулина Glargin, в котором последовательность домена В белка A Staphylococcus aureus соединена через пептидный линкер His6GlySerArg с аминокислотной последовательностью проинсулина Glargin, имеющую молекулярную массу 3,3 МДа (5051 п.о.), содержащую HindIII/BamHI-фрагмент плазмиды pPINS07, включающий гибридный tac-промотор, ген β-лактамазы (bla), область начала репликации (ori), терминатор транскрипции рибосомного оперона Е.coli, последовательность нуклеотидов, кодирующую аминокислотную последовательность домена В белка A Staphylococcus aureus, соединенную с последовательностью нуклеотидов, кодирующей пептид His6GlySerArg, и HindIII/BamHI-фрагмент (271 п.о.), кодирующий проинсулин Glargin; уникальные сайты рестрикции со следующими координатами: EcoRI - 1, NcoI - 217, BamHI - 221, PstI - 342 и 417, HindIII - 492, SalGI - 4513, ClaI - 4792. Бактерии Escherichia coli BL21 трансформируют плазмидой pGG-1 и получают штамм Escherichia coli BGG18, продуцент гибридного полипептида, содержащего аминокислотную последовательность проинсулина Glargin. Изобретение позволяет получить инсулин Glargin с высоким выходом и по упрощенной технологии. 2 н.п. ф-лы, 4 ил.
Реферат
Изобретение относится к биотехнологии, в частности к генной инженерии, в частности к получению проинсулина Glargin, и может быть использовано для создания лекарственных препаратов нового поколения для лечения инсулинозависимого сахарного диабета.
Лечение больных сахарным диабетом I типа включает использование комбинации препаратов инсулина человека быстрого (короткого) и длительного (пролонгированного) действия. Короткодействующий инсулин должен быстро достигать пика активности в соответствии с подъемом уровня глюкозы, связанным с приемом пищи, и прекращать свое действие после его падения. Инсулин пролонгированного действия, напротив, должен в течение длительного времени обеспечивать определенный базовый уровень глюкозы в промежутках между приемами пищи. Инсулиновая терапия с использованием инсулина человека имеет ряд недостатков, которые удалось преодолеть только после получения его генно-инженерных аналогов [Walsh G. // Appl. Microbiol. Biotechnol., 2005, v.67, р.151-159].
Известны быстродействующие аналоги инсулина человека: инсулин Lyspro, у которого в аминокислотной последовательности В-цепи, инвертированы остатки пролина-В28 и лизина-В29 В-цепи, и инсулин Aspart, в молекуле которого остаток пролина в положении В28 В-цепи заменен остатком аспарагиновой кислоты. Эти замены уменьшили тенденцию молекул инсулина человека к агрегации и, соответственно, время абсорбции гормона из места инъекции [Setter S.M., Corbett C.F., Campbell P.К., White J.R. // Ann. Pharmacother., 2000; v.34, p.1423-1431], что привело к значительному снижению времени начала действия препаратов, увеличению максимально достижимой концентрации препаратов в крови и более быстрому восстановлению исходного уровня гормонов в крови [Simpson K.L., Spenser C.M. // Drugs, 1999, v.57, p.759-765].
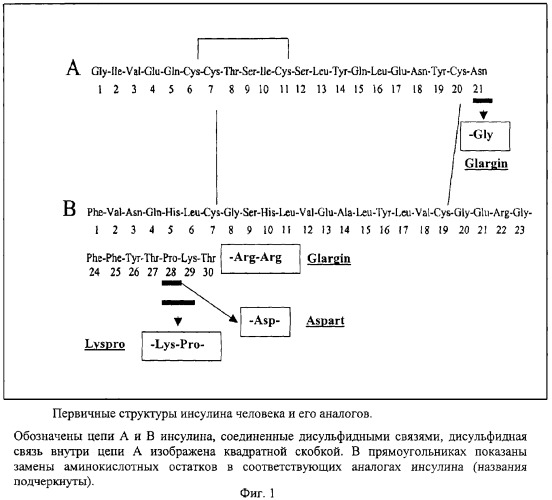
В отличие от аналогов инсулина, рассмотренных выше, разрешенный к клиническому использованию инсулин Glargin является рекомбинантным производным инсулина пролонгированного действия, которое продолжается в течение 24 часов после инъекции. Аминокислотная последовательность инсулина Glargin отличается от последовательности инсулина человека заменой остатка аспарагина в положении 21 А-цепи на глицин (GlyA21) и наличием двух дополнительных остатков аргинина в С-концевой части В-цепи, ArgB31, ArgB32 (фиг.1) [Levien T.L., Baker D.E., White J.R., Campbell R.K. // Ann. Pharmacother., 2002, v.36, p.1019-1027]. Эти модификации, а также добавление в небольшом количестве ионов цинка улучшают стабильность препарата и повышают изоэлектрическую точку аналога с 5,4 до 6,7, что приводит к уменьшению растворимости препарата в нейтральной среде подкожной клетчатки. Инсулин Glargin хорошо растворим при рН 4,0, кислый раствор препарата при подкожных инъекциях нейтрализуется и аналог инсулина образует микропреципитаты, из которых происходит медленное высвобождение гексамеров инсулина Glargin и их диссоциация с образованием димеров и мономеров. Благодаря этим свойствам инсулин Glargin медленно всасывается из подкожной ткани в кровоток, не обладает выраженным пиком действия и обеспечивает практически постоянную концентрацию гормона в крови в течение суток. Добавление ионов цинка в препарат также замедляет процесс освобождения димеров и мономеров, что увеличивает время действия аналога [Dunn C.J., Ploscer G.L., Keating G.M., McKeage K., Scott L.J. // Drugs, 2003; v.63, p.1743-1778].
Известен способ получения аналога инсулина Glargin, в котором искусственный ген проинсулина человека синтезируют из олигонуклеотидов и экспрессируют в клетках Е.coli W3110 дикого типа [Пат. США №5656722, МКИ А61К 038/28, опубл. 1997]. Одним из недостатков этого штамма-продуцента является неоптимальный для экспрессии рекомбинантных белков генетический фон бактериальных клеток, содержащих неизмененный набор генов протеолитических ферментов, которые участвуют в деградации рекомбинантных белков, образующихся в результате экспрессии рекомбинантных генов. Это приводит к необходимости отделения аналога инсулина от продуктов его деградации, что затрудняет очистку и уменьшает выход конечного продукта.
Известен наиболее близкий по технической сущности к заявленному изобретению штамм-продуцент рекомбинантного проинсулина Lyspro человека Escherichia coli pLP-3-1/TG-1, в котором рекомбинантная плазмида, кодирующая гибридный полипептид с последовательностью проинсулина Lyspro человека, соединенный через пептидный линкер с аминокислотной последовательностью домена В стафилококкового белка А, введена в клетки Escherichia coli TG-1 дикого типа. Индукция экспрессии рекомбинантного гена в этом штамме осуществляется с использованием изопропил-β-D-тиогалактопиранозида (ИПТГ) [патент РФ №2235776, МКИ C12N 15/00, опубл. 2004]. Несмотря на то, что для данного штамма-продуцента характерен высокий уровень биосинтеза рекомбинантного белка, последний в процессе синтеза и последующей очистки подвергается заметной деградации из-за наличия в бактериальных клетках ряда протеолитических ферментов. Это затрудняет очистку рекомбинантного белка и конечного продукта, что уменьшает его выход и повышает себестоимость препарата.
Задачей изобретения является конструирование плазмиды и создание высокопродуктивного бактериального штамма-продуцента проинсулина Glargin, позволяющего получать инсулин Glargin с высоким выходом и по упрощенной технологии.
Поставленная задача решается путем конструирования рекомбинантной плазмидной ДНК pGG-1, кодирующей гибридный белок с аминокислотной последовательностью проинсулина Glargin, в котором последовательность домена В белка A Staphylococcus aureus соединена через пептидный линкер His6GlySerArg с аминокислотной последовательностью проинсулина Glargin, имеющей молекулярную массу 3,3 МДа (5051 п.о.), содержащей HindIII/BamHI-фрагмент плазмиды pPINS07, включающий гибридный tac-промотор, ген β-лактамазы (bla), область начала репликации (ori), терминатор транскрипции рибосомного оперона Е.coli, последовательность нуклеотидов, кодирующую аминокислотную последовательность домена В белка А Staphylococcus aureus, соединенную с последовательностью нуклеотидов, кодирующей пептид His6GlySerArg, и HindIII/BamHI-фрагмент (271 п.о.), кодирующий проинсулин Glargin; уникальные сайты рестрикции со следующими координатами: EcoRI - 1, NcoI - 217, BamHI - 221, PstI - 342 и 417, HindIII - 492, SalGI - 4513, ClaI - 4792, а также за счет создания штамма бактерий Escherichia coli BGG18 - продуцента рекомбинантного белка с аминокислотной последовательностью проинсулина Glargin, полученного путем трансформации клеток родительского штамма Escherichia coli BL21 рекомбинантной плазмидной ДНК pGGI по п.1.
Исходной плазмидой для конструирования является плазмида pPINS07, кодирующая:
- гибридный полипептид, состоящий из одного IgG-связывающего домена белка А Staphylococcus aureus, пептидного линкера His6GlySerArg и проинсулина человека,
- гибридный tac-промотор и
- терминатор транскрипции рибосомного оперона Е.coli.
[Патент РФ №2144957, МКИ C12N 15/00, опубл. 2000].
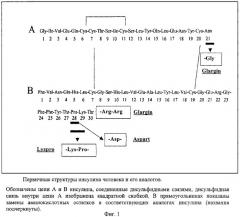
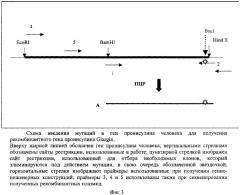
Аминокислотная последовательность проинсулина Glargin отличается от последовательности природного проинсулина человека аминокислотным остатком в положении А21. Для получения гена проинсулина Glargin используют ПЦР с праймерами 1 и 2 (фиг.2 и 3), при этом праймер 2 содержит требуемую мутацию (обозначена звездочкой). Синтезированный продукт ПЦР (А), содержащий требуемую мутацию, а также уникальные сайты рестрикции BamHI и HindIII на своих концах, очищают на ДЭАЭ-мембране. Далее его инкубируют с рестриктазами BamHI и HindIII и переносят в предварительно подготовленный вектор, который представляет собой исходную плазмиду, содержащую рекомбинантный ген гибридного полипептида без последовательности проинсулина человека, удаленной с помощью тех же рестриктаз (фиг.2). Отбор рекомбинантных клонов проводят по элиминации сайта рестрикции BsuI в продукте ПЦР, полученном в результате амплификации рекомбинантной плазмиды pGG-1 (кодирует проинсулин Glargin) с помощью праймеров 1 и 3, соответственно (фиг.3). Элиминация сайта рестрикции является следствием изменения с помощью проведенного направленного мутагенеза последовательности нуклеотидов гена проинсулина исходной плазмиды, приводящего к появлению в А-цепи инсулина измененного аминокислотного остатка глицина-А21 (фиг.1). Плазмиду очищают щелочным методом [Maniatis Т., Fritsch E.F., Sambrook J. // Molecular Cloning: a Laboratory Manual, 1982, Cold Spring Harbor Laboratory Press] и последовательность нуклеотидов клонированного фрагмента ДНК определяют методом Сэнгера с использованием дидезоксирибонуклеотидных производных в качестве терминаторов синтеза ДНК термосеквеназой на автоматическом секвенаторе. Полученную последовательность сравнивают с последовательностью исходной плазмиды, определенной тем же методом. Итогом работы является получение рекомбинантной плазмиды pGG-1.
Плазмиду pGG-1 вводят в компетентные клетки Е.coli BL21 [патент РФ №2267534, МКИ C12N 15/17, опубл. 2006], что приводит к созданию рекомбинантного штамма-продуцента проинсулина Glargin (Е.coli BL21/pGG-1). Исследование уровней экспрессии гибридных белков, содержащих последовательность аналога проинсулина Glargin в полученном рекомбинантном штамме, показывает, что содержание рекомбинантных полипептидов в бактериальных клетках после завершения индукции с помощью ИПТГ составляет не менее 25% от суммарного клеточного белка.
Рекомбинантная плазмидная ДНК pGG-1, кодирующая гибридный полипептид с последовательностью аналога проинсулина Glargin, характеризуется следующими свойствами:
- имеет молекулярную массу 3,3 МДа (5051 п.о.);
- кодирует гибридные белки, в которых последовательность домена В стафилококкового белка А с С-концевым гексагистидиновым линкером соединена через трипептид GlySerArg с последовательностью проинсулина Glargin (плазмида pGG-1) человека;
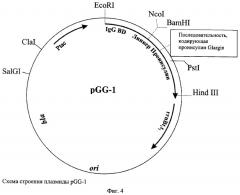
- состоит из HindIII/BamHI-фрагмента плазмиды pPNIS07, содержащего синтетический tac-промотор транскрипции, ген β-лактамазы (bla), определяющий устойчивость клеток бактерий к ампициллину, область инициации репликации плазмидной ДНК (ori), терминатор транскрипции рибосомного оперона Е.coli, а также включающего часть искусственного гена, кодирующую IgG-связывающий домен белка А из S.aureus и гексагистидиновый домен, соединенный с трипептидом GlySerArg, а также HindIII/BamHI-фрагмента, кодирующего проинсулин Glargin (плазмида pGG-1), содержащий в аминокислотной последовательности остатки GlyA21; уникальные сайты рестрикции имеют следующие координаты: EcoRI - 1, NcoI - 217, BamHI - 221, PstI - 342 и 417, HindIII - 492, SalGI - 4513, ClaI - 4792.
Преимуществом полученной плазмиды перед известными плазмидами является то, что она кодирует полипептиды проинсулина Glargin под контролем синтетического tac-промотора, индуцируемого изопропил-β-D-тиогалактопиранозидом. Это позволяет индуцировать и осуществлять синтез проинсулина при обычной для Е.coli температуре 37°С, что значительно повышает выход рекомбинантного белка и облегчает его дальнейшую очистку. Кроме того, в отличие от известных плазмид, сконструированная плазмида содержит ген β-лактамазы в качестве селектируемого маркера.
Для получения штамма-продуцента гибридного полипептида, содержащего последовательность проинсулина Glargin человека, рекомбинантную плазмиду pGG-1 вводят с помощью электропорации в компетентные клетки Е.coli BL21.
Полученный штамм Е.coli BL21/pGG-1, названный Е.coli BGG18, характеризуется следующими свойствами.
Культурально-морфологические признаки: клетки мелкие, палочковидной формы, грамотрицательные, 1×3,5 мкм, подвижные. Штамм хорошо растет на обычных питательных средах (МПА, МПБ, LB-бульон, LB-агар, минимальная среда с глюкозой). При росте на агаризованной среде LB колонии округлые, гладкие, полупрозрачные, блестящие, серые. Край ровный, диаметр колоний 1-3 мм, консистенция пастообразная. Рост в жидких средах (LB, минимальная среда с глюкозой) характеризуется ровным помутнением, осадок легко седиментирует.
Физиолого-биохимические признаки: клетки растут при 4-42°С, оптимум рН 6,8-7,6. В качестве источника азота используют как минеральные соли аммония, так и органические соединения: аминокислоты, пептон, триптон, дрожжевой экстракт. В качестве источника углерода при росте на минимальной среде используют глицерин, углеводы, аминокислоты.
Генетические признаки: F- ompT hsdSB(rB - mB -)gal dcm. Проявляют устойчивость к ампициллину (до 300 мкг/мл), обусловленную наличием генов устойчивости к антибиотику в ДНК рекомбинантной плазмиды pGG-1.
Условия хранения: штамм бактерий Е.coli BGG18 хранят на чашках и косяках при 4°С. Пересевы на свежие среды проводят один раз в месяц. Может храниться не менее одного года в среде LB, содержащей 30% глицерина, при -20-70°С.
Устойчивость к антибиотикам: клетки штаммов-продуцентов проявляют устойчивость к ампициллину (до 300 мкг/мл), обусловленную наличием генов устойчивости в ДНК рекомбинантной плазмиды pGG-1.
Преимуществом полученного бактериального штамма является обеспечение им высокой внутриклеточной стабильности гибридного полипептида аналога проинсулина Glargin человека, как следствие неактивного состояния в этих клетках бактериальных генов lon и ompT, кодирующих соответственно АТР-зависимую протеиназу и протеиназу внешней мембраны. В результате в клетках этого штамма отсутствуют продукты деградации рекомбинантных предшественников инсулина, затрудняющих их очистку, что сопровождается повышением выхода очищенного гибридного белка, содержащего последовательность проинсулина Glargin и, соответственно, конечного продукта, инсулина Glargin.
Изобретение иллюстрируют примеры.
Пример 1. Получение фрагментов ДНК, кодирующих аминокислотную последовательность проинсулина Glargin.
80 нг плазмидной ДНК плазмиды pPINS07, содержащей ген природного проинсулина человека, используют в качестве матрицы для синтеза фрагмента А (фиг.3) в полимеразной цепной реакции (ПЦР), добавляя к 50 мкл реакционной смеси следующего состава: 20 мМ Трис-HCl рН 8,8, 67 мМ (NH4)2SO4, 1,5 мМ MgCl2, no 0,2 мМ dATP, dCTP, TTP и dGTP каждого, 0,5 ед. смеси Taq- и Pfu-ДНК-полимераз (в отношении 50/1 по активности), и для синтеза фрагмента ДНК, кодирующего последовательность проинсулина Glargin, по 1 мкМ каждого из праймеров CAGGATCATCACCATGGATCCCG и AACAAAGCTTACTAACCGCAGTAGTTTTCC (праймеры 1 и 2 соответственно на фиг.3, подчеркнута мутантная последовательность). В работе используют модифицированную моноклональными антителами (для имитации «горячего старта») термостабильную Taq-ДНК-полимеразу. Амплификацию соответствующего участка плазмиды осуществляют, проводя 20 циклов ПЦР (94°С, 20 с; 59°С, 20 с; 72°С, 20 с) на амплификаторе «Терцик» фирмы «ДНК-технология», Россия. Синтезированный фрагмент А очищают электрофоретически в 3% агарозном геле, перенося на кусочки ДЭАЭ-мембраны NA-45 (Schleicher&Schuhle), и элюируют в центрифужных микропробирках на 1,5 мл 200 мкл буфера, содержащего 1,5 М NaCl, 10 мМ ЭДТА, в течение 40 мин при 65°С. К буферу добавляют тРНК Е.coli до конечной концентрации 100 мкг/мл и полинуклеотидный фрагмент осаждают 2,5 объемами 96% этилового спирта. Осадок собирают центрифугированием на микроцентрифуге «Эппендорф» при максимальных оборотах в течение 15 мин, супернатант отбрасывают, осадок промывают 1 мл холодного 70% этилового спирта, подсушивают при комнатной температуре и растворяют в 50 мкл деионизованной воды. Для получения липких концов синтезированный фрагмент А инкубируют с эндонуклеазами рестрикции HindIII и BamHI (Fermentas, Латвия) в стандартных условиях, рекомендованных фирмой-производителем. По окончании инкубации фрагмент А, содержащий липкие концы, осаждают 96% этиловым спиртом, промывают 70% спиртом как описано выше, но не добавляя тРНК, и растворяют в 20 мкл воды.
Пример 2. Подготовка экспрессирующего вектора для клонирования синтезированного фрагмента А.
3 мкг плазмиды pPINS07 инкубируют с эндонуклеазами рестрикции HindIII и BamHI, как описано выше, и образовавшийся большой фрагмент векторной ДНК, взятый для получения экспрессирующей плазмиды, электрофоретически отделяют от малого фрагмента с использованием легкоплавкой агарозы (1,5%), после чего его переносят электрофоретически в лунку, заполненную легкоплавкой агарозой, откуда выделяют фенольным методом [Maniatis Т., Fritsch E.F., Sambrook J. // Molecular Cloning: a Laboratory Manual, 1982, Cold Spring Harbor Laboratory Press]. Перемещение фрагмента в агарозном геле контролируют в УФ-свете при 366 нм. После перехода требуемого фрагмента ДНК в легкоплавкую агарозу ее переносят в пробирку «Эппендорф» на 1,5 мл, содержащую равный объем ТЕ-буфера (10 мМ Трис-HCl (рН 8,0), 1 мМ ЭДТА), плавят в течение 5-10 мин при температуре 65°С, добавляют равный объем нейтрализованного фенола, перемешивают на вортексе и центрифугируют в течение 7 мин при 14000 g. Супернатант переносят в чистую пробирку, содержащую 0,1 объема (от вносимого объема супернатанта) 4 М LiCl, выдерживают 2 мин во льду, после чего центрифугируют в течение 3 мин. Векторную ДНК осаждают из верхней фазы 96% этанолом с тРНК в качестве носителя, промывают 70% спиртом и растворяют в 20 мкл деионизованной воды.
Пример 3. Получение плазмиды pGG-1, экспрессирующей ген гибридного проинсулина Glargin, и штамма-продуцента гибридного белка, содержащего последовательность проинсулина Glargin.
10 мкг большого фрагмента плазмиды pPINS07, содержащего липкие концы HindIII/BamHI, лигируют с 50 мкг очищенного фрагмента ДНК А (фиг.3) с теми же липкими концами [Maniatis Т., Fritsch E.F., Sambrook J. // Molecular Cloning: a Laboratory Manual, 1982, Cold Spring Harbor Laboratory Press]. Продукт реакции осаждают и промывают этиловым спиртом, как описано выше, и растворяют в 10 мкл воды; 5 мкл продуктов лигирования используют для трансформации компетентных клеток Е.coli BL21 методом электропорации в стандартных условиях. Суспензию трансформированных клеток (200 мкл) высевают на LB-агар, содержащий ампициллин (100 мкг/мл) в качестве селектирующего агента.
При анализе плазмиды pGG-1 среди выросших колоний бактерий с помощью ПЦР в присутствии праймеров 1 и 3 (CTACTGCCGCCAGGCAAATTCTG) (фиг.3) (последовательность праймера 1 см. выше) отбирают клоны, содержащие вставку клонируемого фрагмента А. Для этого образовавшиеся продукты ПЦР инкубируют с использованием рестриктазы BsuI (Fermentas, Латвия) в условиях, рекомендуемых фирмой-производителем, разделяя образующиеся фрагменты ДНК в 3% агарозном геле. В этом случае мутация проинсулина Glargin элиминирует единственный сайт рестрикции BsuI. Строение плазмиды pGG-1 представлено на фиг.4. Бактериальные клоны, содержащие плазмиду pGG-1 (штамм Е.coli BGG18) рассевают до отдельных колоний, которые выращивают в течение ночи на жидкой среде LB, добавляют стерильный глицерин до конечной концентрации 30% и хранят при -70°С.
Из клонов, содержащих требуемую мутацию, выделяют плазмидную ДНК стандартным фенольным методом [Maniatis Т., Fritsch E.F., Sambrook J. // Molecular Cloning: a Laboratory Manual, 1982, Cold Spring Harbor Laboratory Press] и последовательность нуклеотидов гена проинсулина Glargin определяют методом Сэнгера с использованием набора реактивов для секвенирования ThermoSequenase Cycle Sequencing Kit фирмы Amersham BioSciences (США). Электрофоретическое разделение продуктов секвенирования проводят с помощью автоматического секвенатора ALF Express II фирмы Amersham BioSciences (США).
Пример 4. Определение продуктивности штамма-продуцента гибридного белка, содержащего аминокислотную последовательность проинсулина Glargin.
В 20 мл жидкой среды LB, содержащей 100 мкг/мл ампициллина, вносят индивидуальную колонию клеток Е.coli BGG18 и выращивают при 37°С на качалке при 180 об/мин в течение 4 ч до мутности 0,8. Затем добавляют индуктор ИПТГ до конечной концентрации 0,5 мМ и продолжают инкубацию в тех же условиях в течение 6 ч. Отбирают пробу 2 мл и центрифугируют 5 мин при 6000 об/мин, после чего клетки суспендируют в 200 мкл буфера, содержащего 125 мМ Трис-HCl, рН 6,8, 20% глицерина, 3% додецилсульфата натрия, 3% меркаптоэтанола и 0,01% бромфенолового синего, нагревают 10 мин на кипящей водяной бане. Отбирают аликвоты объемом 2,5, 5, 7,5, 10 и 15 мкл и анализируют электрофорезом в 13%-ном полиакриламидном геле, содержащем 0,1% додецилсульфат натрия. Гель окрашивают Кумасси R250 и сканируют на лазерном денситометре Ultrascan XL. По данным сканирования содержание гибридного белка составляет не менее 25% суммарного клеточного белка бактериальных клеток анализируемого штамма-продуцента.
1. Рекомбинантная плазмидная ДНК pGG-1, кодирующая гибридный белок с аминокислотной последовательностью проинсулина Glargin, в котором последовательность домена В белка A Staphylococcus aureus соединена через пептидный линкер His6GlySerArg с аминокислотной последовательностью проинсулина Glargin, имеющая молекулярную массу 3,3 МДа (5051 п.о.), содержащая HindIII/BamHI-фрагмент плазмиды pPINS07, включающий гибридный tac-промотор, ген β-лактамазы (bla), область начала репликации (ori), терминатор транскрипции рибосомного оперона Е.coli, последовательность нуклеотидов, кодирующую аминокислотную последовательность домена В белка A Staphylococcus aureus, соединенную с последовательностью нуклеотидов, кодирующей пептид His6GlySerArg, и HindIII/BamHI-фрагмент (271 п.о.), кодирующий проинсулин Glargin; уникальные сайты рестрикции со следующими координатами: EcoRI - 1, NcoI - 217, BamHI - 221, PstI - 342 и 417, HindIII - 492, SalGI - 4513, ClaI - 4792.
2. Штамм бактерий Escherichia coli BGG18 - продуцент рекомбинантного белка с аминокислотной последовательностью проинсулина Glargin, полученный путем трансформации клеток родительского штамма бактерий Escherichia coli BL21 рекомбинантной плазмидной ДНК pGG-1 по п.1.