Способ определения содержания бактериальных эндотоксинов с использованием тал-теста, в котором регистрацию образования полимера коагулогена производят по структуре образующихся белковых фракталов
Иллюстрации
Показать всеНастоящее изобретение относится к медицине, в частности к фармации и клинической лабораторной диагностике, а именно к способу проведения бактериологического теста присутствия эндотоксинов с помощью тахплеус лизата (ТАЛ-теста) в биологических средах и лекарственных средствах. Сущность способа: смешивают тахплеус лизат и разведения исследуемого образца нанесением на апирогенную поверхность, инкубируют с закрытой крышкой в течение 30-60 мин при 37°С, выдерживают апирогенную поверхность в термостате при открытой крышке до высыхания капель смеси реагентов, регистрируют образование полимера коагулогена под увеличением по образующимся белковым фракталам и при их наличии определяют активность эндотоксина в последнем разведении. Заявленный способ позволяет использовать малые количества дорогостоящих реагентов, не требует дополнительных реагентов и специального оборудования и позволяет сохранить результаты анализа в течение длительного времени; 1 з.п. ф-лы, 4 ил, 3 табл.
Реферат
Изобретение относится к медицине, в частности к фармации и клинической лабораторной диагностике, а именно к способу проведения бактериологического теста присутствия эндотоксинов с помощью тахплеус лизата (ТАЛ-теста) в биологических средах и лекарственных средствах методом, при котором регистрация образования полимера коагулогена производят по структуре образующихся белковых фракталов после высушивания смеси; заявляемый способ может быть использован во всех областях, в которых необходим анализ определения активности бактериальных эндотоксинов, например в фармацевтической промышленности для контроля при изготовлении инъекционных лекарственных препаратов, в клинической практике для ранней диагностики заболеваний, вызванных грамотрицательными бактериями, в ветеринарии для контроля ветеринарных препаратов и диагностики заболеваний животных, вызванных грамотрицательными бактериями, в производстве, связанном с переработкой сельскохозяйственной продукции, в пищевой промышленности для контроля бактериологического качества сырья и готовой продукции, для контроля качества питьевой воды и воздушной среды жилых и производственных помещений при анализе определения их чистоты на бактериальное загрязнение, а также в других областях, где требуется анализ для определения активности бактериальных эндотоксинов.
В 1956 году ученый Bang обнаружил, что грамотрицательные бактерии, попадая в лимулус полифемус (Limulus Polyhemus, реликтовое животное-мечехвост, обитающее в прибрежных водах Северной Америки), могут вызывать реакцию застывания гемолимфы в сосудах, способную вызвать смерть лимулуса полифемуса. Впоследствии Левин, Бан и другие исследователи открыли причины застывания гемолимфы: эндотоксин, взаимодействуя с клетками гемолимфы лимулуса полифемуса, активизирует содержащийся в них определенный фермент, вследствие чего растворимый белок преобразуется в гель. В 1959 году Рогас Корома (Rogas-Coroma) впервые провел клинические испытания на содержание эндотоксина с использованием лимулус полифемус. После чего метод тестирования с использованием лимулус полифемус (ЛАЛ-тест) привлек пристальное внимание исследователей. В настоящее время ЛАЛ-тест узаконен Фармакопеями многих стран, а с 1997 года введен в Фармакопею РФ [ВФС 42-2960-97 «Определение содержания бактериальных эндотоксинов. ЛАЛ-тест»]. В 2000 году была утверждена Общая фармакопейная статья «Бактериальные эндотоксины» [ОФС 42-0002-00].
Известен способ определения количества эндотоксина (патент N 7015474 В4, Япония, G01N 33/579), в котором при проведении исследования в раствор, где протекает реакция между эндотоксином и лизатом амебоцитов японского мечехвоста, добавляют водорастворимый полисахарид, структурным компонентом которого является - 1,3-гликан и/или водорастворимое производное этого полисахарида, в количестве 100 нг/мл - 100 мг/мл. Таким образом определяют следовое количество эндотоксина в образце.
Известен способ измерения концентрации эндотоксина [патент N 0350273 В1, ЕПВ, G01N 33/5 79], в котором измерение производят по изменению оптической плотности вследствие реакции AL-раствора с эндотоксином.
Известен способ определения количества эндотоксина [Ситников А.Г., Травина Л.А., Багирова В.П. ЛАЛ-Тест. Современные подходы к определению пирогенности. - М., 1997, 96 стр.] путем смешивания лимулюс лизата и разведения испытуемого образца с последующей регистрацией результата анализа по образованию полимера коагулогена в последнем разведении. Этот способ характеризуется недостаточной чувствительностью (не более 0,001 EU/мл), большим расходом реагентов на проведение реакции.
Известен способ определения активности эндотоксина путем смешивания лимулюс лизата и разведения исследуемого образца с последующей регистрацией образования полимера коагулогена в последнем разведении, включающий смешивание лимулюс лизата (2-8 мкл) и разведение исследуемого образца нанесением на пластиковую поверхность, инкубирование с закрытой крышкой пластиковой поверхности в течение 30 мин при 37°С, выдерживание пластиковой поверхности в термостате при открытой крышке до высыхания капель смеси реагентов, регистрирование образования полимера коагулогена под увеличением по образующимся белковым фракталам (специфическим кристалловидным структурам) и при их наличии - определение активности эндотоксина в последнем разведении [RU 2169367 С1, 20.06.2001].
С 1978 года в КНР в городе Сямэн началось исследование свойств тахплеус тридентатус лич (Tahupleus tridentatus Leach, реликтовое животное краб-мечехвост, обитающее в прибрежных водах КНР, гемолимфа которого обладает теми же свойствами, что и гемолимфа лимулус полифемус). Китайскими учеными была разработана технология получения ТАЛ-реагента (лизата гемолимфы тахплеус тридентатус лич) и методики проведения гель-тромб ТАЛ-тестов, анналогичных ЛАЛ-тестам.
[У Шан-и. Общий обзор китайских исследований по тахплеусу (Tahupleus). // Сборник статей о тахплеусе (Tahupleus) и об экспериментах с тахплеусом. Составитель Увэй хун. Издательство: медицинская лаборатория исследования тахплеуса города Сямэнь, 1983, стр.62-63.]
Ся Чжэныминь и Дин Юлинь исследовали метод проведения реакции гемолимфы Tahupleus на планшете с использование красителей [Ся Чжэныминь и Дин Юлинь. Вэйлян хоу шиянь цзишу - цзайбопяньфа. // Хоу юй хоу шиянь луньвэнь хуйбянь. Увэй хунбянь. Сямэньши ияо янцзю сохоу янши, 1983. (Опыт с тахплеус (Tahupleus) на стеклянном планшете. Ся Чжэныминь и Дин Юлинь. // Сборник статей о тахплеусе (Tahupleus) и об экспериментах с тахплеусом. Составитель Увэй хун. Издательство: медицинская лаборатория исследования тахплеуса города Сямэнь, 1983, стр.62-63], при котором смешивают равные по объему раствор реагента Tahupleus и раствор эндотоксина на стеклянном планшете, инкубируют в течение 30 мин при 37°С во влажной среде, добавляют каплю красителя, закрывают крышкой и исследуют под микроскопом: при отрицательной реакции на токсин появляется ясно различимое цветовое «кольцо», тогда как при положительной реакции, поскольку реагент Tahupleus и соединение токсина после этапа сохранения определенной температуры преобразуются в гель, то после окрашивания и закрытия планшета стеклом происходит очень быстрая диффузия, которую можно наблюдать подобно «туману». Метод позволяет не только уменьшить расход реактива Tahupleus, но и значительно повысить степень чувствительности эксперимента с Tahupleus, кроме того, зафиксировав стеклянную крышку планшета древесной смолой, можно сохранить результат реакции в течение сравнительно долгого времени, и его можно проверить позднее.
Этот метод является качественным и не дает четкой достоверной картины образования коагулогена.
Задача изобретения - новый высокочувствительный способ определения содержания эндотоксинов, расширяющий арсенал известных способов, позволяющий использовать малые количества реагентов, не требующий дополнительных реагентов и специального оборудования и доступный для любой клинической и аналитической фармацевтической лаборатории, который позволяет сохранить результаты анализа в течение длительного времени.
Технический результат изобретения - определение наличия эндотоксина по его реакции с тахплеус лизатом по структуре образующихся белковых фракталов.
Технический результат достигается заявляемым способом определения активности эндотоксинов, включающим смешивание тахплеус лизата и разведений исследуемого образца нанесением на апирогенную поверхность, инкубирование апирогенной поверхности с закрытой крышкой в течение 30-60 мин при 37°С, выдерживание апирогенной поверхности в термостате при открытой крышке до высыхания капель смеси реагентов, регистрирование образования полимера коагулогена под увеличением по образующимся белковым фракталам (специфическим кристалловидным структурам), и при их наличии - определение активности эндотоксина в последнем разведении.
Способ осуществляют следующим образом.
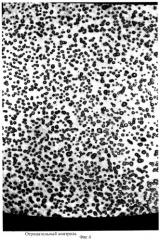
Приготавливают разведения исследуемого образца. Приготавливают стандартные разведения эндотоксина согласно рекомендациям фирмы-изготовителя для контроля чувствительности ТАЛ-реактива. Рабочее разведение тахплеус лизата готовят согласно рекомендациям фирмы-изготовителя. На апирогенную поверхность (например, чашка Петри, планшет) наносят микроколичество (2-8 мкл) растворов тахплеус лизата по числу исследуемых образцов и стандартных разведений эндотоксина и контроля (для контроля используют чистый раствор ТАЛ-реагента) с использованием варипипеток с апирогенными наконечниками. Сверху на капли тахплеус лизата наносят такое же количество (2-8 мкл) разведений исследуемого образца, закрывают крышкой для предотвращения высыхания и помещают в стерильный термостат и инкубируют при 37°С 30-60 мин, после чего крышку открывают и выдерживают в термостате до высыхания капель смеси реагентов. Результаты определяют визуально под увеличением. При наличии эндотоксина образуются фракталы - специфические кристалловидные структуры, причем если при реакции эндотоксина и лимулус лизата (ЛАЛ-тест) фракталы имеют вид «еловой ветви», «снежинки», «папоротника» (фигура 1), то в нашем случае фракталы имеют вид упорядоченных «брусков» (фигуры 2, 3). При отсутствии эндотоксина или в отрицательном контроле капля высыхает в виде ровного поля с редкими вкраплениями по краям поля ромбических кристаллов солей, иногда присутствующих в испытуемых образцах (фигура 4).
Способ иллюстрируется следующими примерами конкретного выполнения.
Исследования фармацевтических препаратов (инъекционной формы) на наличие бактериальных эндотоксинов.
Для исследования выбраны стандартные препараты, купленные в аптеке. Используют набор реагентов для проведения ТАЛ-теста ООО «Опытный завод Сямэнь хоушицзи», чувствительность ТАЛ-реактива -0,03 EU/мл. Испытуемый раствор должен иметь рН в пределах, указанных производителем ТАЛ-реактива - обычно 6,0-8,0. В случае необходимости рН доводится апирогенными растворами 0,1N HCl, 0,1N NaOH или буфером.
Пример 1.
Приготавливают разведения исследуемого образца - инъекционной формы аскорбиновой кислоты - каждый последующий образец разводят в 2 раза апирогенной водой. Приготавливают стандартные разведения эндотоксина согласно рекомендациям фирмы изготовителя для контроля чувствительности ТАЛ-реактива - таблица 1. Рабочее разведение тахплеус лизата готовят согласно рекомендациям фирмы-изготовителя. На апирогенную поверхность наносят микроколичество (7 мкл) растворов тахплеус лизата по числу исследуемых образцов и стандартных разведении эндотоксина и контроля (для контроля используют чистый раствор ТАЛ-реагента) с использованием варипипеток с апирогенными наконечниками. Сверху на капли тахплеус лизата наносят такое же количество (7 мкл) разведений аскорбиновой кислоты, закрывают крышкой для предотвращения высыхания и помещают в стерильный термостат и инкубируют при 37°С 30 мин, после чего крышку открывают и выдерживают в термостате до высыхания капель смеси реагентов. Результаты определяют визуально под увеличением. При наличии эндотоксина наблюдают фракталы в виде упорядоченных «брусков» (фигура 2). Учитывают последнее разведение, где еще встречается подобная реакция. В отрицательном контроле - ровное поле с вкраплениями ромбических кристаллов солей (фигура 4). Результаты испытаний представлены в Таблице 2. Из данных опыта следует, что аскорбиновая кислота в разведении в 16 раз содержит эндотоксин менее 0,03 EU. Чтобы вычислить количество эндотоксина в исследуемой аскорбиновой кислоте, необходимо 0,03 EU умножить на 16. Полученная цифра не должна превышать указанного в частной фармакопейной статье производителем препарата Предельного содержания бактериальных эндотоксинов.
Аналогично примеру 1 исследуют на наличие бактериальных эндотоксинов инъекционные формы «Физиологический раствор 400 мл», «Физиологический раствор 5 мл», «Алоэ», «Глюкоза». Результаты представлены в таблице 2. По данным таблицы видно, что «Физиологический раствор 400 мл», «Алоэ», «Глюкоза» не содержат бактериальных эндотоксинов, а «Физиологический раствор 5 мл» в разведении в 8 раз содержит эндотоксин менее 0,03 EU. Чтобы вычислить количество эндотоксина в исследуемом образце, необходимо 0,03 EU умножить на 8. Полученная цифра не должна превышать указанного в частной фармакопейной статье производителем препарата Предельного содержания бактериальных эндотоксинов..
Пример 2
Определение содержания эндотоксина в сыворотке (плазме) крови с использованием ТАЛ-теста по образованию фракталов.
Подготовка образцов сыворотки: забор крови у пациента осуществляется апирогенным шприцом, переносится в апирогенную (стеклянную или пластиковую) пробирку, выдерживается в термостате 30 мин при 37°С для полного свертывания крови и ретракции сгустка. 10 мкл сыворотки переносится в пробирку с 90 мкл дистиллированной воды, свободной от эндотоксина, и прогревается в течение 2-3 мин при 100°С для денатурации сывороточных белков и высвобождения связанного с белками и липопротеидами эндотоксина [Ситников А.Г., Травина Л.А., Багирова В.П. ЛАЛ-Тест. Современные подходы к определению пирогенности]. Все операции проводятся в условиях, препятствующих попаданию эндотоксина из внешней среды в испытуемые образцы и используемые реагенты.
Приготавливают стандартные разведения эндотоксина согласно рекомендациям фирмы изготовителя для контроля чувствительности ТАЛ-реактива. Рабочее разведение тахплеус лизата готовят согласно рекомендациям фирмы изготовителя (ООО «Опытный завод Сямэнь хоушицзи», чувствительность ТАЛ-реактива - 0,03 EU/мл). На апирогенную полистироловую поверхность на расстоянии 1 см друг от друга наносят варипипеткой 7 мкл рабочего разведения тахплеус лизата по числу исследуемых образцов и стандартных разведений эндотоксина. Сверху на капли лизата наносят 7 мкл разведений образцов, закрывают крышкой для предотвращения высыхания и помещают в стерильный термостат 37°С на 30 мин.
Через 30 мин инкубации пластиковую поверхность открывают и оставляют в том же термостате на срок до высыхания смеси реагентов. Результат учитывают визуально под увеличением. При наличии эндотоксина наблюдают фракталы в виде упорядоченных «брусков» (фигура 3). Учитывают последнее разведение, где еще встречается подобная реакция. В отрицательном контроле - ровное поле с вкраплениями ромбических кристаллов солей.
Результаты приведены в таблице 3. Содержание эндотоксина в крови в пределах нормы 0-1,0 EU/ml.
Анализ крови на наличие бактериальных эндотоксинов позволяет оценить состояние пациента, выявить скрытое заболевание или скрытую патологию.
Таким образом, заявляемый способ является новым, поскольку способ определения содержания эндотоксинов с использованием ТАЛ-теста, в котором регистрацию образования полимера коагулогена производят по структуре образующихся белковых фракталов, в литературе не описан; он малозатратен по времени, высокочувствителен (обеспечивает чувствительность 0,0001 EU/мл), позволяет использовать дорогостоящие реагенты на проведение теста в очень малых количествах (2-8 мкл) и сохранять полученные результаты в течение длительного времени. Кроме того, он доступен для любой клинической и аналитической фармацевтической лаборатории, так как не требует специального дорогостоящего оборудования и дополнительных реагентов. Микро-ТАЛ-тест значительно более дешев, чем ЛАЛ за счет стоимости используемых реагентов.
Заявленный способ определения бактериальных эндотоксинов в биологических средах и лекарственных средствах с использованием ТАЛ-теста, при котором регистрацию образования полимера коагулогена производят по структуре образующихся белковых фракталов после высушивания смеси, может быть эффективно использован во всех областях, в которых необходим анализ определения активности бактериальных эндотоксинов, например в фармацевтической промышленности для контроля при изготовлении инъекционных лекарственных препаратов (контроль сырья, воды для инъекций, проверка элементов фильтра на вымывание из них пирогенов, контроль растворов перед стерилизующим фильтрованием, контроль чистоты ампул, флаконов, а также при отработке режимов технологического оборудования); в клинической практике для ранней диагностики заболеваний, вызванных грамотрицательными бактериями (в биологических жидкостях человека, таких как кровь, спинномозговая жидкость, моча, уретральный и цервикальным секреты, глазной экссудат); в ветеринарии для контроля ветеринарных препаратов и диагностики заболеваний животных, вызванных грамотрицательными бактериями; в производстве, связанном с переработкой сельскохозяйственной продукции; в пищевой промышленности, где заявляемый способ может использоваться для контроля бактериологического качества сырья и готовой продукции; для контроля качества питьевой воды и воздушной среды жилых и производственных помещений при анализе определения их чистоты на бактериальные загрязнения, а также в других областях, где требуется анализ для определения активности бактериальных эндотоксинов.
| Таблица 1 | |||||
| Приготовление стандартных разведений эндотоксина | |||||
| Наименование препарата | Контрольный стандарт эндотоксина | ||||
| Концентрация эндотоксина, EU/мл | 0,0625 | 0,0312 | 0,016 | 0,008 | 0,004 |
| ТАЛ (0,03 EU/мл) | + | + | - | - | - |
| «+» - образование фракталов | |||||
| «-» - отсутствие фракталов |
| Таблица 2 | |||||
| Результаты исследования фармацевтических препаратов (инъекционной формы) на наличие бактериальных эндотоксинов. | |||||
| препарат | Аскорбиновая кислота | ||||
| Разведения | исходн. | в 2 раза | в 4 раза | в 8 раз | в 16 раз |
| ТАЛ (0,03 EU/мл) | + | + | + | + | +/- |
| препарат | Физиологический раствор 400 мл | ||||
| Разведения | исходн. | в 2 раза | в 4 раза | в 8 раз | в 16 раз |
| ТАЛ (0,03 EU/мл) | - | - | - | - | - |
| препарат | Физиологический раствор 5 мл | ||||
| Разведения | исходн. | в 2 раза | в 4 раза | в 8 раз | в 16 раз |
| ТАЛ (0,03 EU/мл) | + | + | + | ± | - |
| препарат | Алоэ | ||||
| Разведения | исходн. | в 2 раза | в 4 раза | в 8 раз | в 16 раз |
| ТАЛ (0,03 EU/мл) | - | - | - | - | - |
| препарат | Глюкоза | ||||
| Разведения | исходн. | в 2 раза | в 4 раза | в 8 раз | в 16 раз |
| ТАЛ (0,03 EU/мл) | - | - | - | - | - |
| «+» - образование фракталов | |||||
| «-»- отсутствие фракталов | |||||
| «±» - нечеткое образование фракталов |
| Таблица 3 | |
| Результаты исследования в сыворотки (плазмы) крови на наличие бактериальных эндотоксинов. | |
| Номер исследованной сыворотки | Концентрация эндотоксина, EU/ml |
| 1 | 3,0 |
| 2 | 3,0 |
| 3 | 3,0 |
| 4 | 2,5 |
| 5 | 2,5 |
| 6 | 2,0 |
| 7 | 2,0 |
| 8 | 2,0 |
| 9 | 2,0 |
| 10 | 2,0 |
| 11 | 2,0 |
| 12 | 1,5 |
| 13 | 1,25 |
| 14 | 1,25 |
| 15 | 1,25 |
1. Способ определения содержания эндотоксинов, включающий смешивание тахплеус лизата и разведений исследуемого образца нанесением на апирогенную поверхность, инкубирование с закрытой крышкой в течение 30-60 мин при 37°С, выдерживание апирогенной поверхности в термостате при открытой крышке до высыхания капель смеси реагентов, регистрирование образования полимера коагулогена под увеличением по образующимся белковым фракталам и при их наличии - определение активности эндотоксина в последнем разведении.
2. Способ по п.1, отличающийся тем, что тахплеус лизат и разведения исследуемого образца берут в равных количествах в пределах 2-8 мкл.