Способ получения титаната калия
Иллюстрации
Показать всеИзобретение может быть использовано при получении неволокнистого титаната калия, применяемого в производстве наполнителей композиционных материалов. Способ получения титаната калия включает приготовление реакционной смеси из порошка оксида титана и соединений калия, ее последующую термическую обработку, охлаждение и промывание в воде для удаления непрореагировавших и избыточных соединений калия. Для приготовления реакционной смеси в качестве соединений калия используют смесь нитрата и гидроксида калия. Термическую обработку реакционной смеси проводят в температурном интервале от 410 до 580°С. Оксид титана и гидроксид калия берут в массовом соотношении от 0,6:1 до 2,6:1, а оксид титана и нитрат калия - в массовом соотношении от 0,12:1 до 1,4:1. Изобретение позволяет снизить энергоемкость технологического процесса получения неволокнистого титаната калия. 1 табл., 4 ил.
Реферат
Изобретение относится к синтезу неорганических материалов, а именно к способам получения неволокнистого титаната калия, и может найти применение в химической промышленности, в частности в производстве наполнителей композиционных материалов.
Волокнистые кристаллические титанаты калия с общей химической формулой К2O·nTiO2, где n=4, 6 и 8 (соответственно, тетра-, гекса- и октатитанат калия), характеризуются высокими прочностными и теплоизоляционными свойствами, а также низким коэффициентом трения и высокими химической стойкостью и электросопротивлением, что позволяет использовать их в качестве относительно дешевых и высокоэффективных наполнителей композиционных материалов.
Между тем, нановолокна титанатов калия по своей структуре подобны асбестам, имеют диаметр менее 3 мкм и длину более 5 мкм, а также отношение длина:толщина более 3, и, согласно классификации ILO (International Labor Organization), AIA (Asbestos International Association), DFG (Deutsche Forschungs Gemeinschaft) и других международных и национальных организаций, рассматриваются как опасные для здоровья пылеобразующие волокна, оказывающие канцерогенный эффект (см., например, Stanton M.F., et al. Relation of particle dimension to carcinogenieity in amphybole asbestoses and other fibrous minerals, J.Natl. Cancer Inst., 1981, vol.67. No 5, p.965-975).
Кроме того, волокнистая структура частиц титанатов калия резко увеличивает вязкость расплавов, производимых при изготовлении композиционных материалов, приводит к фиксации частиц наполнителя на стенках смесителей, экструдеров и других видов механического оборудования, используемых при производстве.
Перечисленные проблемы стимулировали разработку слабокристаллических (порошкообразных, чешуйчатых) титанатов калия, имеющих стехиометрию, близкую к волокнистым кристаллическим модификациям тетра-, гекса- и октатитанатов калия, а также форму частиц с отношением длина:диаметр менее 3. Подобные материалы не представляют опасности для здоровья технического персонала при их производстве и дальнейшем использовании и сохраняют большинство свойств, позволяющих использовать их в качестве наполнителей современных композиционных материалов. С другой стороны, неволокнистые титанаты калия могут быть использованы в качестве промежуточного продукта при производстве волокнистых кристаллических титанатов калия, в которые они могут быть преобразованы при дополнительной термической обработке, что особенно перспективно при производстве композиционных материалов, получаемых при высоких температурах, например композитов с металлической матрицей.
Известен способ получения титаната калия, частицы которого имеют чешуйчатую структуру и размер от 1 до 100 мкм с отношением длина:толщина от 3 до 500 (см. патент США на изобретение №6677041, МПК В32 В 5/66, опубл. 13.01. 2004 г.). Химический состав титаната калия, получаемого в соответствии с данным патентом, может соответствовать тетра-, гекса- или октатитанату. Способ получения титаната калия по указанному патенту предусматривает на первой стадии осуществлять синтез промежуточного продукта (K0.8Mg0.4Ti1.6O4 или K0.8Li0.2Ti1.8O4) при 1000-1100°С, далее проводить деинтеркаляцию ионов магния (лития) из полученного продукта в растворе кислоты, а также последующую интеркаляцию ионов калия при обработке полупродукта в щелочном растворе и финишную термическую обработку при 500°С. Отношение TiO2:K2O в конечном продукте зависит от условий обработки промежуточного продукта при интеркаляции ионов калия.
Известен также способ получения неволокнистого титаната калия путем составления сырьевой смеси, состоящей из источника оксида титана и источника оксида калия, взятых в весовых отношениях, соответствующих в пересчете на мольное отношение TiO2:K2O=5,5-6,5, и последующей термической обработки сырьевой смеси при температуре выше 800°С (см. патент США на изобретение №6251361, МПК С01G 23/00, опубл. 26.01.2001 г.). Данный процесс очень чувствителен к скорости нагрева, поскольку при скорости нагрева ниже 20°С/мин продукт имеет довольно высокое (более 6%) содержание частиц опасных размеров с отношением длина:толщина более 3.
Известен также ряд способов получения волокнистых кристаллических титанатов калия, в которых промежуточным продуктом является неволокнистый титанат калия.
Например, в известном способе волокнистые кристаллические титанаты калия получают при составлении смеси TiO2 и калийсодержащего соединения в мольном соотношении TiO2:К2O=3-4, обжиге полученной смеси при 900-1200°С в течение 0,5-5 ч, последующей обработки полученного слабокристаллического волокнистого титаната калия (характеризуется как смесь тетра- и гексатитанатов калия) для удаления избытка щелочного металла и разрушения структуры волокон промежуточного продукта (видимо, при обработке в воде или водном растворе), просушивания полученного продукта и его дополнительной термической обработки при 700-1000°С в течение 0,5-2 ч с целью получения смеси волокнистых кристаллических тетра- и гексатитаната, гексатитаната или октатитаната калия (см. патент Кореи на изобретение №9708595, МПК С08К 3/22, С08К 3/00, опубл. 27.05.1997 г.).
Аналогичная схема синтеза рассматривается в другом известном изобретении (см. патент КНР на изобретение №1468805, МПК С01G 23/00, опубл. 21.01.2004 г.), в котором составляют смесь TiO2 и калийсодержащего соединения в мольном соотношении TiO2:К2O=2,5-3,5 при дополнительном введении борсодержащего компонента (1-5 вес.% от массы TiO2), нагревают полученную смесь сначала до 800°С, а затем до 900-1200°С со скоростью 1°С/мин, при выдержке при температуре обработки в течении 1-4 ч, медленно охлаждают полученный продукт до температуры 800°С для получения волокнистых кристаллов тетратитаната калия в виде агрегатов. Далее промывают агрегаты тетратитаната калия в воде при 80-100°С (с перемешиванием) в течение 1-4 ч и нейтрализуют полученную суспензию при обработке в 5-15% растворе серной кислоты. Полученные аморфные волокнистые частицы гидратированного гексатитаната калия подвергают термической обработке при 800-1200°С в течение 2-6 ч для завершения кристаллизации аморфных частиц гексатитаната калия. После термической обработки полученный волокнистый кристаллический гексатитанат калия, промывается в горячей (80-100°С) воде и просушивается при 200°С.
В другом известном изобретении (см. патент Великобритании на изобретение №862593, МПК С01G 23/00, опубл. 15.03.1961 г.) водонерастворимый титанат калия получают при растворении оксида титана в расплаве фторида и/или хлорида щелочного металла, кристаллизации титаната калия и его выделения из расплава. Полученный продукт представляет собой смесь волокнистых кристаллов K2O·4TiO2 и K2O·6TiO2 и требует от 2 до 100 ч промывки в воде при 20-100°С для отделения от расплава. Мольное отношение TiO2:К2О в сырьевых материалах лежит в интервале от 1:1 до 8:1, при этом отношения TiO2:К2О от 1:1 до 5:1 способствуют образованию К2O·4TiO2, в то время как при TiO2:К2O, изменяющемся от 6:1 до 8:1, образуется К2O·6TiO2. Кроме того, содержание фторида калия в смеси фторид-хлорид, лежащее в пределах 35-60%, способствует образованию К2O·4TiO2, а содержание фторида 10-20% приводит к образованию К2O·6TiO2. Предпочтительный температурный интервал синтеза находится ниже 1200°С и составляет 750-1150°С. При этом более высокие температуры синтеза способствуют более интенсивному образованию К2О·6TiO2. Удаление остатков галлидов калия может проводиться при его растворении в воде или при термическом разложении расплава, отфильтрованного от полученного титаната калия, при температуре около 1000°С. Для дополнительной очистки полученного титаната калия используют его промывание в водном растворе соляной кислоты и обжиг при 600°С.
Все известные способы получения неволокнистых титанатов калия представляют собой сложные многостадийные процессы, в которых синтез титаната калия проводится при высоких (более 750°С) температурах и требует значительных энергозатрат.
Наиболее близким к предложенному техническому решению является известный способ получения кристаллического титаната калия, в котором гексатитанат калия как конечный продукт получают на основе шихты, включающей титансодержащий компонент (TiO2) и калийсодержащий компонент (КОН, КНСО3, К2СО3, КМО3), взятые в весовом отношении, соответствующем мольному отношению TiO2:К2O от 5:1 до 1:1. В шихту также могут вводиться небольшие добавки натрийсодержащего компонента, позволяющие снизить температуру плавления калийсодержащего компонента. На основе данной шихты при ее плавлении (в приведенном в патенте примере рассматривается обработка при 1100°С в течение 30 минут) получают однородный расплав, который отливают на охлаждаемую металлическую плиту. Охлаждение расплава при наличии градиента температуры способствует направленному росту кристаллов титаната калия в направлении от охлаждаемой поверхности в объем. Далее проводят удаление из охлажденного расплава непрореагировавшего и избыточного калия при промывке последовательно в воде и кислом водном растворе. Полученный отфильтрованный слабокристаллический титанат калия, характеризуемый на диффрактограммах широкими пиками при углах 2 тетта, равных 11, 29 и 48°, подпрессовывают и подвергают его дополнительной термической обработке при температуре, лежащей в интервале от 400°С до температуры плавления продукта (1370°С), для получения волокнистого кристаллического гексатитаната калия (см. патент США на изобретение №4265872, МПК С01G 23/00, опубл. 05.05.1981 г.).
Однако известный способ получения неволокнистого титаната калия также представляет собой сложный многостадийный процесс, в котором синтез титаната калия проводится при высоких температурах, требующих полного плавления реакционной смеси (минимальная температура плавления системы K2O-TiO2 составляет 926°С, см., например, статью N.Bao, X.Lu, X.Feng, J.Xie, Thermodynamic modeling and experimental verification for ion-exchange synthesis of K2O·6TiO2 and TiO2 fibers from K2O·4TiO2 // Fluid Phase Equilibria. - 2002. - Vol.193. - P.229-243), что приводит к высокой энергоемкости технологического процесса.
Задачей настоящего изобретения является получение неволокнистого титаната калия, пригодного для последующего получения волокнистых кристаллических титанатов калия.
Техническим результатом, достигаемым при решении настоящей задачи, является снижение энергоемкости технологического процесса получения неволокнистого кристаллического титаната калия за счет уменьшения температуры процесса.
Указанный технический результат достигается тем, что в способе получения титаната калия, включающий приготовление реакционной смеси из порошка оксида титана и соединений калия, ее последующую термическую обработку, охлаждение и промывание в воде для удаления непрореагировавших и избыточных соединений калия, согласно изобретению при приготовлении реакционной смеси в качестве соединений калия используют смесь нитрата и гидроксида калия, термическую обработку реакционной смеси проводят в температурном интервале от 410 до 580°С, при этом оксид титана и гидроксид калия берут в массовом соотношении от 0,6:1 до 2,6:1, а оксид титана и нитрат калия - в массовом соотношении от 0,12:1 до 1,4:1.
В соответствии с полученными экспериментальными результатами температура расплава при проведении синтеза титаната калия должна быть не ниже 410°С, т.е. данная температура является минимальной, позволяющей перевести в титанат калия весь оксид титана, введенный в реакционную смесь, за время обработки, приемлемое с технологической и экономической точек зрения (8 ч). Более низкие температуры обработки реакционной смеси не дают такой возможности.
Верхний предел температуры синтеза ограничен термической стабильностью нитрата калия. Экспериментально установлено, что при температуре выше 580°С в течение 1 ч нитрат калия полностью распадается на оксид калия и оксид азота, что не дает возможности полностью преобразовать порошок оксида титана в титанат калия за указанное время, а также приводит к интенсивному загрязнению атмосферы оксидами азота и неприемлемо с точки зрения охраны окружающей среды. В связи с этим температуру 580°С можно определить как верхний допустимый предел температуры синтеза неволокнистого титаната калия. Предпочтительным для синтеза титаната калия является температурный интервал от 450 до 500°С, так как он обеспечивает достаточно высокую скорость синтеза (полное преобразование оксида титана в титанат калия происходит за 60-120 минут). При этом ситнез не сопровождается интенсивным распадом нитрата калия и загрязнением атмосферы оксидами азота.
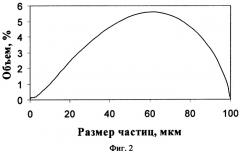
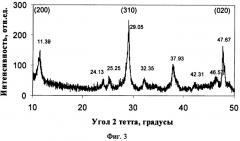
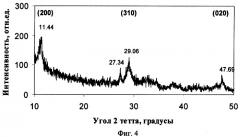
Предложенный способ получения титаната калия иллюстрируется чертежами, где на фиг.1 показана микрофотография порошка титаната калия (увеличение Х5000), полученного в примере 4; на фиг.2 - распределение по размерам частиц титаната калия, полученного в примере 4, на фиг.3 - диффрактограмма порошка титаната калия, полученного в примере 4, на фиг.4 - диффрактограмма порошка титаната калия, полученного в примере 6.
Сущность предложенного способа получения титаната калия заключается в следующем. Берут оксид титана в виде порошка рутила, анатаза или из их смеси и смешивают с порошками нитрата калия и гидроксида калия в количестве, соответствующем весовому отношению TiO2:КОН, лежащему в пределах от 0,6:1 до 2,6:1, а также массовому отношению TiO2:KNO3, лежащему в пределах от 0,12:1 до 1,4:1. Полученную смесь нагревают до температуры в интервале 410-580°С для получения расплава смеси нитрата и гидроксида калия, который в течение термической обработки реагирует с порошком оксида титана с образованием слабокристаллического титаната калия, имеющего неволокнистую структуру и характеризуемого пиками на рентгеновских диффрактограммах имеющими максимумы, соответствующие углам 2 тетта, равным 11,4; 29,1 и 47,7 градусов (фиг.3, фиг.4). Полученный титанат калия промывают водой и далее отфильтровывают и просушивают.
Возможно также введение порошка TiO2 непосредственно в расплав смеси КОН и KNO3, нагретый до температуры обработки.
Использование оксида титана в качестве компонента сырьевой смеси в форме анатаза предпочтительно, так как скорость процесса его преобразования в титанат калия при том же размере частиц порошка и той же температуре синтеза происходит на 30% быстрее, чем в случае использования оксида титана в форме рутила. Однако возможно использование в качестве компонента реакционной смеси как порошка рутила, так и различных смесей порошков рутила и анатаза.
Существенным является присутствие в расплаве, реагирующем с порошком оксида титана, как гидроксида, так и нитрата калия. Экспериментально установлено, что нагрев различных смесей, полученных в системе КОН-TiO2, приводит к образованию неволокнистого титаната калия с отношением TiO2:K2O, изменяемым в пределах от 2 до 2,8. Последующая термическая обработка полученного продукта при 1000-1200°С позволяет получить только кристаллический дититанат калия, имеющий слоистую структуру и содержащий лишь незначительные примеси волокнистого кристаллического тетратитаната калия. В то же время нагрев любых смесей TiO2 и КМО3 вообще не сопровождается какими-либо химическими превращениями оксида титана.
При отношении m(TiO2):m(KOH) более 2,6 и отношении m(TiO2):m(KNO3) менее 0,12 скорость взаимодействия расплава с порошком TiO2 слишком мала и при обработке в течение 10 ч в титанат калия переходит не более 10% массы оксида титана. Если же отношение m(TiO2):m(KOH) имеет значение менее 0,6, а m(TiO2):m(KNO3) - более 1,4, то мольное отношение TiO2:К2О в полученном титанате калия снижается до уровня менее 2,6, что делает слабокристаллический титанат калия растворимым в воде и особенно в кислых водных растворах и не дает возможности его полного отделения от остальных водорастворимых компонентов прореагировавшей смеси.
Новизна изобретения заключается в том, что в предложенных условиях образование титаната калия происходит при взаимодействии порошка оксида титана с бинарным расплавом, обладающим повышенной реакционной способностью и позволяющим получить необходимый продукт при нормальном атмосферном давлении при значительно более низких температурах (410-580°С) по сравнению с известными способами его синтеза, который проводится при более высоких температурах (750-1300°С).
Результаты экспериментальных исследований, показывающих влияние содержания компонентов в реакционной смеси на выход неволокнистого титаната калия и состав волокнистых кристаллов, полученных после его кристаллизации при 1000°С в течение 2 ч, приведены в таблице в примерах 1-9.
Приготавливали смесь, состоящую из TiO2, КОН и KNO3 в количестве, приведенном в примерах 1-9 таблицы. Нагревали полученную смесь до температуры 500°С и выдерживали при этой температуре в течение 2 ч. Расплав, включающий порошкообразный продукт, отливали на стальную плиту и после охлаждения помещали в емкость, содержащую 5 л дистиллированной воды, и перемешивали до полного растворения водорастворимых компонентов смеси. Порошок титаната калия отфильтровывали с помощью бумажного фильтра и снова промывали в 5 л дистиллированной воды и отфильтровывали.
| Таблица | ||||||||
| Пример | Содержание компонентов в реакционной смеси, г | Массовое отношение содержания компонентов в реакционной смеси | Выход по TiO2 после промывания, % | Мольное отношение TiO2:К2О в титанате калия | Продукт, полученный после дополнительной термообработки при 1000°С в течение 2 ч | |||
| TiO2 | KOH | KNO3 | [TiO2]/[КОН] | [TiO2]/[КМО3] | ||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 1 | 10 | 3 | 87 | 3,33 | 0,11 | 10 | 9,1:1 | Смесь TiO2 (более 80%) и волокон К2O·6TiO2 и К2O·8TiO2 |
| 2 | 32 | 12 | 56 | 2,67 | 0,77 | 18 | 8,9: 1 | Смесь TiO2 (более 70%) и волокон К2O·6TiO2 и К2O·8TiO2 |
| 3 | 10 | 4 | 86 | 2,50 | 0,12 | 95 | 9,1:1 | Смесь волокон К2O·6TiO2 и К2O·8TiO2 |
| 4 | 10 | 10 | 80 | 1,00 | 0,13 | 98 | 6,8: 1 | Волокнистый K2O·6TiO2 |
| 5 | 10 | 15 | 75 | 0,67 | 0,13 | 99 | 4,5:1 | Смесь волокон К2O·4TiO2 и К2O·6TiO2 |
| 6 | 20 | 20 | 60 | 1,00 | 0,33 | 97 | 4,1: 1 | Волокнистый К2O·4TiO2 |
| 7 | 30 | 30 | 40 | 1,00 | 0,75 | 96 | 3,9:1 | Волокнистый К2O·4TiO2 |
| 8 | 20 | 35 | 45 | 0,57 | 0,44 | 39 | 2,8: 1 | Отсутствует |
| 9 | 40 | 32 | 27 | 1,25 | 1,48 | 46 | 2,7:1 | Отсутствует |
Если в реакционной смеси отношение m(TiO2):m(KOH) имело значение более 2,6 и отношение m(TiO2):m(KNO3) имело значение менее 0,12 (примеры 1 и 2), полученный продукт содержал не более 20% слабокристаллического титаната калия и при дополнительной термической обработке не мог быть полностью преобразован в волокнистую форму. При отношении m(TiO2):m(KOH), имеющем значение менее 0,6, и отношении m(TiO2):m(КМО3), имеющем значение более 1,4 (примеры 8 и 9), продукт представлял собой слабокристаллический титанат калия, имеющий мольное отношение TiO2:K2O менее 3, который при дополнительной термической обработке не мог быть преобразован в кристаллы волокнистой формы.
В остальных случаях (примеры 3-7) полученный продукт представлял собой порошок титаната калия, состоящий из агрегатов сферической формы размером от 3 до 100 мкм (см., например, фиг.2, пример 4), сформированных кристаллами нерегулярной формы (см., например, фиг.1, пример 4). При этом титанат калия независимо от условий синтеза и отношения TiO2:K2O имел слабокристаллическую структуру, подтверждаемую низкой интенсивностью и большой полушириной пиков на его диффрактограммах (см., например, фиг.3, пример 4 и фиг.4, пример 6). Отношение интенсивностей пиков (200) и (310) на диффрактограммах, соответствующих углам 2 тетта 11,4 и 29,1 градуса, имеет значения менее 3 и находится в пределах от 0,6 до 1,6, что подтверждает их неволокнистый характер и безопасность (см. патент США на изобретение №6335096, МПК В32 В 5/16, опубл. 01.01.2002 г.). Мольное отношение TiO2:K2O в полученном титанате калия зависит от соотношения компонентов в реакционной смеси и увеличивается при снижении отношения m(TiO2):m(KOH) и увеличении отношения m(TiO2):m(KNO3) в пределах от TiO2:K2O=3,9 до TiO2:K2O=9,1.
Из приведенных в таблице примеров следует, что предлагаемый способ обеспечивает получение неволокнистых титанатов калия, имеющих отношение TiO2:K2O, регулируемое в пределах от 3,9:1 (см. таблицу, пример 7) до 9,1:1 (см. таблицу, пример 3) за счет варьирования соотношения массы компонентов в используемой шихте. При этом термическая обработка шихты проводится при более низких температурах по сравнению с известными способами. Получаемые неволокнистые титанаты калия при дополнительной термической обработке переходят в кристаллические волокнистые титанаты калия (К2O·4TiO2, К2O·6TiO2, K2O·8TiO2 или их смеси, см. таблицу, примеры 3-7).
Таким образом, получаемые согласно изобретению неволокнистые титанаты калия имеют безопасную и технологичную форму и могут быть самостоятельно использованы в качестве наполнителей композиционных материалов или же, при необходимости, они могут быть легко преобразованы в волокнистые титанаты калия за счет дополнительной термической обработки при температуре, не превышающей температуру плавления волокнистого титаната калия, соответствующего стехиометрии используемого неволокнистого титанана калия (1114°С для К2O·4TiO2 и 1370°С для К2O·6TiO2).
Способ получения титаната калия, включающий приготовление реакционной смеси из порошка оксида титана и соединений калия, ее последующую термическую обработку, охлаждение и промывание в воде для удаления непрореагировавших и избыточных соединений калия, отличающийся тем, что при приготовлении реакционной смеси в качестве соединений калия используют смесь нитрата и гидроксида калия, термическую обработку реакционной смеси проводят в температурном интервале от 410 до 580°С, при этом оксид титана и гидроксид калия берут в массовом соотношении от 0,6:1 до 2,6:1, а оксид титана и нитрат калия - в массовом соотношении от 0,12:1 до 1,4:1.