Искусственный промотор для экспрессии последовательностей днк в растительных клетках
Иллюстрации
Показать всеИзобретение относится к генной инженерии растений. Искусственный промотор является химерной молекулой рекомбинантной ДНК, такой, что при введении в клетки растения вызывает высокий уровень экспрессии молекулы ДНК, слитой с его 3'-концом. Основные генетические элементы химерной молекулы включают ядро промотра с консенсусным ТАТА-боксом, область экзон/интрон/экзона и энхансер трансляции. Каждый из этих элементов сконструирован искусственно. Регуляторные элементы транскрипции могут быть встроены в обратном направлении в данный промотр для органоспецифической, тканеспецифической или специфической в отношении стадии развития экспрессии. Сконструированные искусственные генетические элементы могут быть функционально встроены между любым промотором, активным в клетках растения, и любой последовательностью ДНК для повышения уровней их трансляции/транскрипции. 9 н. и 59 з.п. ф-лы, 12 ил., 7 табл.
Реферат
Область техники, к которой относится изобретение
Это изобретение относится к биотехнологии, в частности к генной инженерии растений. Преимущественно к химерным ДНК-конструкциям, которые демонстрируют высокую активность промотора трансляции и транскрипции любой нуклеотидной последовательности, которая введена в клетки однодольного или двудольного растения, что позволяет получить трансгенное растение с повышенным уровнем интересующих генов или ДНК-последовательностей.
Предшествующий уровень техники
Генная инженерия растений - это технология, показавшая свою высокую продуктивность и в области научных исследований, и в области коммерческого производства новых биотехнологических продуктов (Hammond J. Curr. Top.Microbiol. Immunol 1999, 240:1-19; Simoens C. and Van Montagu M. Reproduction Update, 1995, 1:523-542).
Выбор сигналов промотора гарантирует адекватную экспрессию, обусловленную силой, временной или пространственной специфичностью гена или последовательности ДНК, введенной в генетически измененное растение с помощью средств молекулярной биотехнологии, и является очень важным для достижения успехов в генной инженерии. Поэтому в последние два десятилетия было проведено множество исследований, связанных с поиском промоторов и сигналов, способных гарантировать экспрессию каждого заданного трансгена. Таким образом, промоторы различного происхождения (растительного, вирусного, Agrobacterium Ti или Ri или химерного) были оценены и использованы для получения трансгенных растений.
Более широко используемые в генной модификации растений конститутивные промоторы, такие как 35S-промотор ARN вируса мозаики цветной капусты (CaMV) (Odell J.T; Nagy F; Chua N.H. Nature 1985, 313:810-812); промотор гена (nos) нопалинсинтетазы плазмиды Ti A. tumefaciens (An G; Costa M.A; Mitra A; Ha S; Marton L. Plant Phisiol. 1986, 88:547-552), промотор гена актина-1 риса (McElroy D; Zhang W; Cao J; Wu R. Plant Cell 1990, 2:163-171), промотор гена убиквитина-1 кукурузы (Christensen A.H; Sharrock R.A; Quail P.H.Plant Mol. Biol. 1992, 18:675-689). Однако каждая из этих естественных систем экспрессии имеет ограничения, в основном потому, что уровни экспрессии недостаточно высоки в любом классе растений, например, экспрессия промотора низка в клетках двудольных растений и почти не обнаруживается в клетках однодольных растений, хотя экспрессия 35S-промотора CaMV, самого широко используемого промотора, значительно выше в клетках табака, чем в клетках однодольных растения (Topfer R; Maas C; Horicke-Grandpierre C; Schell J; Steinbiss H.H. Methods Enzymol. 1993, 217:67-78; Mitsuhara I; Ugaki M; Hirochika H; Ohshima M; Murakami T; Gotoh Y; et al. Plant Cell Physiol. 1996, 37:49-59). Сходным образом, промоторы актина-1 риса и убиквитина-1 кукурузы более эффективны при трансляции генов в прямом направлении у однодольных растений, но при этом активность этих промоторов в клетках табака низка (Schledzewski K; Mendel R.R. Transgenic Research 1994, 3:249-255).
Для повышения уровней экспрессии гетерологичных белков в трансгенных растениях было сконструировано большое число вариантов химерных промоторов, в которых природные промоторы были скомбинированы с энхансерами транскрипции и трансляции. Среди таких энхансерных элементов можно упомянуть трансляционный энхансер Омега из вируса табачной мозаики (TMV) (Gallie D.R; Sleat D.E; Watts J.W; Turner P.C; Wilson T.M.A. Nucleic Acids Res. 1987, 15:3257-3273), трансляционный энхансер из вируса гравировки табака (TEV) (Carrington J.C; Freed D.D.J. Virol. 1990, 64:1590-1597), энхансеры транскрипции промотора из октопинсинтазы (Fromm H; Katagiri F; Chua N.H. Plant Cell 1989, 1:977-984), маннопинсинтазы (Comai L; Moran P; Maslyar D. Plant Mol Biol. 1990, 15:373-381) и 35S-промотор CaMV (Kay R; Chan A; Daly M; McPherson J. Science 1987, 236:1299-1302) и природные экзоны и интроны, например, интрон-1 алкогольдегидрогеназы кукурузы (Callis J; Fromm M; Walbot V. Genes Devel. 1987, 1:1183-1200; Last D.I; Brettell R.I.S; Chamberlaine D.A; Chaudhury A.M; Larkin P.J; et al. Theor Appl. Gen. 1991, 81:581-588), первый экзон/интрон из синтазы сахарозы кукурузы (Maas C; Laufs J; Grant S; Korfhage C; Werr W.Plant Mol. Biol. 1991, 16:199-207), первый экзон/интрон из гена актина-1 риса (McElroy D; Blowers A.D; Jenes B; Wu R. Mol. Gen. Genet. 1991, 231:150-160) и др. Это привело к появлению таких промоторов как 2X35S, Mac, Emu и другие (EP0459643; EP0651812), которые являются сильными в основном в растительных клетках особого класса, в двудольных или однодольных растениях (Schledzewski K; Mendel R.R. Transgenic Research 1994, 3:249-255).
Многими лабораториями ведутся разработки сильных промоторов, которые могут быть использованы для экспрессии генов в клетках как двудольных, так и однодольных растений, что является не только поиском решения чисто научной задачи получения уникальной генетической конструкции для трансформации различных классов растений, но и для того, чтобы иметь свои собственные системы экспрессии, которые могли бы облегчить производство и коммерциализацию биотехнологических продуктов. Синтетический промотор, заявленный в патентной заявке WO9943838, заявленный в последовательности от ТАТА-бокса до сайта инициации транскрипции с повышенным содержанием GC (64% или выше), слитый с его 5'-концом для транскрипции энхансерных последовательностей из 35S-промоторов, убиквитина-1 кукурузы и октопинсинтазы. С другой стороны, с целью осуществления не только поиска экспрессии в однодольных и двудольных растениях, но также и возможности избегать экспрессию молчащих зависимых генов с гомологичными последовательностями (Park Y.D; Papp I; Moscone E; Iglesias V; Vaucheret H; Matzke A; Matzke M.A. Plant J. 1996, 9:183-194), в патентной заявке WO0058485 заявлен искусственный промотор, полученный путем комбинации последовательностей, происходящих из двух геномов вирусов растений вируса Commelina Yellow Mottle Virus (CoYMV) и вируса мозаики жидки кассава (CaVMV), а также энхансерные последовательности из 35S-промотора.
Механизмы, позволяющие этим различным генетическим элементам усиливать транскрипцию или трансляцию нуклеотидных последовательностей, все еще не ясны. Например, сообщалось, что лидерные последовательности из многих вирусных РНК могут усиливать трансляцию различных матричных РНК (мРНК), независимо от наличия кэпа (m7 G (5') ppp (5') N), слитого с 5'-концом (Sleat D.E; Wilson T.M.A. 1992. Plant virus genomes as sources of novel functions for genetic manipulations. In: T.M.T. Wilson & J.W. Davies (Eds), Genetic engineering with plant viruses. CRC Press, Inc. p.55-113; Gallie D.R; Sleat D.E; Watts J.W; Turner P.C; Wilson T.M. Nucleic Acids Res. 1987, 15:8693-8711).
В частности, сообщалось, что усиление трансляции фрагмента Омега TMV происходит благодаря наличию по меньшей мере одной копии октамера ACATTTAC, который повторяется в этой последовательности, и области в 25-оснований (САА)n, которая считается критическим мотивом (двух копий области (САА)n достаточно для получения высокоуровневого энхансера) (Gallie D.R; Walbot V. Nucleic Acids Res. 1992, 20:4631-4638). Однако СА-богатая область в 28-оснований из лидерной последовательности Х-вируса картофеля (PVX) как таковая не обладала усиливающей трансляцию активностью (Pooggin M.M; Skryabin K.G. Mol. Gen.Genet. 1992, 234:329-331), хотя было заявлено, что ССАСС - пентануклеотид, присутствующий в СА-области лидерной последовательности PVX, может иметь комплементарные связи с 3'-концом 18S рРНК (Tomashevskaya O.L; Solovyev A.G; Karpova O.V; Fedorkin O.N; Rodionova N.P; Morozov S.Y; Atabekov J.G. J. Gen. Virol. 1993, 74:2717-2724).
В случае с лидерной последовательностью TEV две области, названные CIRE-1 и CIRE-2, между нуклеотидами с 28 по 65 и с 66 по 118, соответственно, были идентифицированы как ответственные за усиление трансляционных свойств указанной вирусной лидерной последовательности в 148 п.н. (Niepel M; Gallie D.R. J. Virol. 1999, 73:9080-9088). Однако внутри областей CIRE не был определен специфический элемент, который бы считался критичным для активности энхансера этих вирусных лидерных последовательностей.
Как указывалось выше, интроны природного происхождения и примыкающие к ним последовательности были также широко использованы для усиления различных систем экспрессии генов, особенно когда интрон расположен вблизи 5'-конца гена. Однако, также сообщалось об опосредованном интроном усилении экспрессии генов (IME), зависящим от таких факторов как происхождение интрона, экзонные фланкирующие области и тип клеток. Сильный IME экспрессии обнаружен главным образом в клетках однодольных растений, а в двудольных он обычно не превышает 2-5-кратное усиление. Молекулярные механизмы IME еще не полностью открыты (Simpson G.G; Filipowicz W. Plant Mol. Biol. 1996, 32:1-41; Schuler M.A. 1998. Plant pre-мRNA splicing. In: J. Bailey-Serres & D.R. Gallie (Eds)). A look beyond transcription: mechanisms determining mRNA stability and translation in plants. American Society of Plant Physiologists. P. 1-19; Lorkovic Z.J; Kirk D.A.W; Lambermon M.H.L; Filipowicz W. Trends in Plant Science 2000, 5:160-167).
Вариации в экспрессии IME, обнаруженные между клетками однодольных и двудольных растений, могут быть за счет различных требований для адекватного процессинга пре-мРНК в клетках растений различных классов. Действительно, наличие AU - богатых сегментов в интронной последовательности клеток однодольных растений, в отличие от клеток двудольных растений, не является необходимым условием для их процессинга; в клетках однодольных растений может осуществляться процессинг интронов с высоким GC-содержанием (более 50%) и сложными вторичными структурами (шпилька-петля), что указывает, что клетки двудольных растений не способны осуществлять процессинг интронов со сложной вторичной структурой (Goodall G.J; Filipowicz W. The EMBO Journal 1991, 10:2635-2644; Lorkovic Z.J; Kirk D.A.W; Lambermon M.H.L; Filipowicz W.Trends in Plant Science. 2000, 5:160-167). Это может объяснить, по крайней мере частично, почему применяющаяся в настоящее время система IME для искусственного усиления экспрессии нуклеотидной последовательности специфична для каждого класса растений.
Подробное описание изобретения
Последовательность промотора экспрессии, предложенная в данной патентной заявке, обладает целым рядом различных характеристик: 1) она универсально функциональна, так как она активна как в клетках двудольных, так и клетках однодольных растений, позволяя получить трансгенные растения любого класса с высоким уровнем экспрессии интересующих генов и последовательностей ДНК; 2) она основана на комбинации искусственно собранных генетических элементов, повышающих уровни мРНК не только при помощи IME, но также и путем промоции ее трансляции; 3) отсутствие длинных ДНК-фрагментов с последовательностями, идентичными природным или вирусным генам, в этом промоторе уменьшает до минимума риск экспрессии РНК-опосредованных гомологичных молчащих генов и возможность появления новых видов или штаммов вируса как результат in planta гомологичной рекомбинации; 4) GC-содержание в последовательности ТАТА-бокса сайта инициации транскрипции не обязательно должно быть высоким; 5) многофункциональность полученной авторами изобретения последовательности промотора позволяет встраивать в его 5'-конец регуляторные элементы транскрипции, которые соответствуют временной, органной и тканевой специфичности экспрессии; 6) включающие это искусственные генетические элементы также могут быть функционально встроены между любым активным промотором в растительные клетки и любую последовательность ДНК для повышения ее транскрипции/трансляции.
Структура химерной области экзон/интрон/зкзон со значительно усиленной активностью накопления мРНК в клетках растения любого класса и их функциональная интеграция с искусственным энхансером трансляции составляет два основных компонента данной патентной заявки, потому что эти элементы позволяют эффективно экспрессировать любую последовательность ДНК интересующих растительных клеток.
Важно уяснить, что когда здесь говорится, что область, молекула или последовательность ДНК являются искусственными или химерными, это относится к созданным и синтезированным in vitro, таким образом, таковым является не любой генетический элемент с идентичной первичной структурой ДНК, несмотря на то что маленькие фрагменты этих последовательностей могут иметь естественную природу.
Для создания интрона с соответствующими прилегающими к нему экзонными последовательностями, способными к промоции экспрессии IME, авторы изучали то, какие мотивы последовательностей и генетические компоненты были общими у растительных интронов с известной из публикаций активностью энхансера транскрипции. В то же время авторы ставили перед собой задачу получения адекватного и эффективного процессинга этого интрона как для однодольных, так и для двудольных растений, независимо от содержания в них GC.
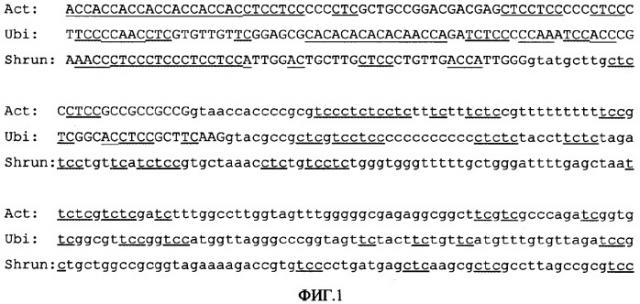
При сравнении широко используемых в качестве транскрипционных энхансеров интронных последовательностей промоторов актина-1 риса, убиквитина-1 кукурузы и синтазы-1 сахарозы, для всех них обнаружили общие и повторяющиеся последовательности мотивов (Фигура 1). При сравнении этих интронов не было обнаружено, что какой-либо из этих мотивов ответственен за экспрессию гена IME, но высокая консервативность уровней мотива СТСС (или гомологичных ему последовательностей СТС, ТСС и ТС) в этих областях и 5'-области ТАТА-боксов в различных растительных промоторах указывает на возможность лучшего связывания факторов транскрипции, что может активизировать промотор РНК-полимеразы II. В то же время изобилие С- и А-богатых последовательностей и их консервативность в первых экзонах (области, остающиеся в виде нетрансляционных лидерных последовательностей с нетранслируемой мРНК) и в вирусных лидерных последовательностях с упомянутой активностью энхансера транскрипции указывает на то, что такие последовательности могут содействовать стабильности полученной мРНК и ее транслируемости.
Принято считать, что ни одна из вышеописанных теорий не имеет полного научного подтверждения, и таким образом, не является очевидным то, что конструкция искусственного интрона со смежными экзонными последовательностями, содержащими повторяющиеся последовательности заданных мотивов, даст в результате область, которая будет вызывать промоцию высоких уровней транскрипции и аккумуляцию мРНК; и тем не менее, результаты настоящей работы на это указывают.
На основе упомянутого сравнительного изучения различных интронов (с соответствующими им экзонами) авторы решили создать искусственную область экзон/интрон/экзон, в которой объединены фрагменты интрон/экзонных последовательностей актина-1 риса и убиквитина-1 кукурузы, богатые мотивами, которые авторы считают релевантными IME экспрессии гена. Для достижения этой цели необходимо было учитывать, что полученный искусственный интрон должен подвергаться эффективному процессингу в клетках двудольных растений, так, чтобы усиление экспрессии гена могло происходить также и в этих классах растений. Тем не менее, авторы обнаружили, что интронные последовательности, используемые ими в качестве первичного материала, имеют высокое содержание GC, сложные вторичные структуры со множеством шпилек-петель, и последовательность их 3'-сайта сплайсинга AG-акцептора несколько отличается от точки ответвления консенсусной последовательности, таким образом, эти интроны могут с трудом подвергаться процессингу в клетках двудольных растений.
Чтобы упростить вторичную структуру созданного авторами экзон/интрон/экзона, чтобы она могла подвергаться процессингу в клетках растений любого класса, было решено произвести несколько точечных изменений в этой последовательности и встроить UUUUUAU-подобные последовательности, которые активируют ее процессинг (Gniadkowski M; Hemmings-Mieszczak M; Klahre U; Liu H.X; Filipowicz W. Nucleic Acids Res. 1996, 24:619-627). Кроме того, химерная конструкция согласно изобретению была слита со вторым экзоном и встроена во второй интрон актина-1 кукурузы (IVS2), получая преимущество его эффективного процессинга в двудольных (например, табаке) (Goodall G.J; Filipowicz W. The EMBO Journal 1991, 10:2635-2644). Предполагаемая вторичная структура каждого из искусственных вариантов экзон/интрон/зкзона была исследована компьютерными методами с использованием программы PCFOLD 4.0 (Zuker M. Meth. Enzymology 1989, 180:262-288). Искусственная последовательность экзон/интрон/экзон, созданная для авторов настоящего изобретения, будет далее называться ART.
Как было уже упомянуто, второй относящийся к этой патентной заявке компонент - это искусственный энхансер трансляции, который был слит в прямом направлении с химерным экзон/интроном для повышения уровней экспрессии гена.
Искусственный энхансер трансляции был создан на основе анализа последовательности и вторичной структуры, образуемой некоторыми вирусными лидерными последовательностями. Из этого анализа авторы сделали заключение, что энхансерам трансляции свойственны три существенных элемента: 1) низкая степень сложности вторичных структур; 2) С- и А-обогащенные сегменты последовательности; 3) мотивы, имеющие вплоть до 83% гомологии с консенсусной последовательностью HCAYYY (где H=C или U или A; Y=C или U, см. таблицу 1), экспонированной и часто повторяющейся в шпильках со структурами с низкой температурой плавления хвостов.
| Структурно консервативные последовательности в некоторых фрагментах лидерных последовательностей РНК вирусов (H=C/U/A; Y=C/U) | |
| Таблица 1 | |
| Вирусная лидерная последовательность | Последовательность |
| TMV | ACAUUUAC |
| TEV(CIRE-1) | GCAUUCUA |
| TEV(CIRE-2) | UCAUUUCU |
| PVS | ACCUUUAG |
| A1MV(RNA3) | UAAUUCG |
| A1MV(RNA3) | ACUUUUC |
| PVX | CCAAUUG |
| BMV | AACAUCGG |
| RVS | CCAUUCA |
| Консенсус | HCAYYY |
На основе вышеизложенного авторами создан искусственный энхансер трансляции, в котором HCAYYY-подобные последовательности, каждая из которых в составе структур шпилька-петля была встроена внутрь С- и А-богатой последовательности длиной в 45 оснований. Этот искусственный энхансер трансляции не более чем на 55% гомологичен лидерным последовательностям вирусной РНК, которые являются теоретической предпосылкой при его получении, в нем нет даже ни одного сегмента последовательности, содержащей более 6 нуклеотидов со 100% гомологией. Вот почему можно утверждать, что полученный энхансер трансляции не является ни производным какого-либо из описанных ранее или защищенных (ЕР 0270611) энхансеров трансляции, ни имеющим последовательности, непосредственно из них полученные.
Для упрощения манипуляции и слияния интересующих генов сайты рестрикции добавляли к энхансеру трансляции согласно изобретению. Наконец, перед слиянием нового энхансера трансляции, созданного авторами настоящего изобретения, с искусственным экзон/интроном его функциональность тестировали in vivo, показав, что он обладает такой же способностью усиливать экспрессию химерного гена, что и фрагмент Омега-TMV. Искусственный энхансер трансляции, созданный по заказу авторов изобретения, был назван Eureka (Фигура 2).
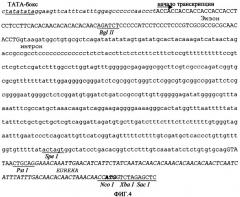
Для конструирования промоторной последовательности, заявленной в данной патентной заявке, сначала было создано ядро промотора, образованное консенсусным ТАТА-боксом (Joshi C.P. Nucleic Acids Res. 1987, 15:6643-6653), который был слит с областью от -24 до -4 (от сайта инициации транскрипции) 35S CaMV, а затем - областью от -5 до+27 промотора актина-1, которая, обеспечивает сайт инициации транскрипции и С- и А-богатую область. Область от +26 до +72 из сайта инициации транскрипции убиквитина-1 кукурузы была слита в прямом направлении, обеспечивая АС- и ТС-богатые области и давая в результате первый искусственный экзон, который был соединен со вторым экзоном актина-1 кукурузы на расстоянии 12 оснований перед 5'-сайтом сплайсинга его IVS2 интрона, включая его самого. Замена оснований, добавление или делеции были проведены вокруг этого соединения согласно предсказаниям компьютерного метода во избежание предполагаемых вторичных структур, которые могут воздействовать на созревание РНК. Искусственный интрон, созданный по заказу авторов изобретения, был составлен из 54 оснований интрона IVS2, слитого с 37 основаниями 5'-области первого интрона убиквитина-1 кукурузы, соответствующей основаниям от +89 до +126 из сайта инициации транскрипции, за которыми следуют 375 оснований из первого интрона актина-1 риса (положения от +103 до +477 из сайта инициации транскрипции этого гена), слитые с 33 основаниями из 3'-конца интрона убиквитина-1 кукурузы (положения от +1051 до 1083 из сайта инициации транскрипции), связанными со второй половиной интрона IVS2 актина-1 (положения от -52 до +5 его 3'-сайта инициации процессинга) и с химерной последовательностью длиной в 29 оснований, содержащей сайты рестрикции и консенсусную последовательность инициации трансляции (Lutcke H.A; Chow K.C; Mickel F.S; Moss K.A; Kern H.F; Scheele G.A. The EMBO Journal. 1987, 6:43-48). Последовательность ART экзон/интрон/экзон, искусственно созданная для авторов изобретения, показана на фигуре 3. Как только эффективность процессинга искусственной конструкции экзон/интрон/экзон была протестирована путем транзитной экспрессии как в клетках табака, так и в клетках риса, энхансер трансляции Eureka был слит с ее 3'-концом, соответствующим на фигуре 4 финальной структуре последовательности промотора объекта данного изобретения (промотор PARTE).
Следует особо подчеркнуть, что созданный авторами энхансерный элемент ART проявил более высокую эффективность в качестве энхансера экспресии гена, чем широко используемая конструкция первый экзон/интрон/экзон актина-1 риса; фрагмент Eureka является дополнительным энхансером ее активности.
В данной работе впервые были получены два искусственных очень эффективных генетических элемента, усиливающих экспрессию любой последовательности ДНК в клетках трансгенного растения любого класса, что свидетельствует о правильности взятых за основу теоретических принципов. Также впервые этот искусственный промотор с содержанием АТ ниже чем 52% адекватно работает в клетках двудольного растения, вызывая промоцию высокой IME экспрессии. Эта конструкция является полностью искусственной, высоко эффективной в качестве энхансера трансляции и с низкой степенью гомологии с лидерными последовательностями РНК-вирусов, что также является новым.
Различные последовательности энхансера транскрипции были слиты с 5'-последовательностью промотора согласно изобретению. Таким образом, область от -43 до -310 актина-1 риса (из сайта инициации транскрипции) была слита с 5'-концом промотора PARTE, как показано на фигуре 5, для получения области промотора APARTE, которая также имеет as-1-подобные элементы энхансера транскрипции (Benfey P.N; Chua N.H. Science, 1990, 250:959-966), и фрагментом в 556 оснований из 5'-области промотора убиквитина-1 кукурузы (от -299 до -855 из сайта инициации транскрипции) для получения в конечном итоге промотора U3ARTE, структура которого показана на фигуре 6.
Множество вариантов промоторных последовательностей было сконструировано из описанных генетических элементов (см. фигуру 7), и все они свидетельствуют о его функциональности в опытах in vivo, подтверждая синергитичный эффект экспрессии гена, превышающий таковой в случае всех использованных энхансерных и активаторных областей.
Элемент as-1, используемый в конструкциях согласно изобретению в качестве энхансера транскрипции (см. фигуру 9), является инновационной разработкой, потому что он менее чем на 50% гомологичен палиндромному энхансеру октопинсинтазы (Ellis J.G; Llewellyn D.J; Walker J.C; Dennis E.S; Peacock W.J. EMBO J. 1987, 6:3203-3208; EP0278659), не является идентичным (идентичность менее чем 85%) какому-либо из вариантов последовательности, заявленных в исследовании, проведенном Ellis et al. (Bouchez D; Tokuhisa J.G; Llewellyn D.J; Dennis E.S; Ellis J.g. EMBO J. 1989, 8:4197-4204; USPat. 5,837,849), и обнаруженные в нем TGACG-мотивы найдены в уникальном контексте фланкирующей последовательности.
Хотя ген актина-1 риса был описан и использован для экспрессии различных генов (McElroy D; Zhang W; Cao J; Wu R. Plant Cell 1990, 2:163-171; WO9109948), важно подчеркнуть, что в настоящей работе выявляется активность транскрипционного энхансера в его 5'-области и возможность его использования в качестве энхансера гетерологичной экспрессии. Подобным образом, хотя применение 5'-области энхансера транскрипции убиквитина-1 кукурузы и было заявлено (ЕР0342926), фрагмент в 556 оснований, используемый авторами изобретения, не содержит элементы «теплового шока», считавшиеся существенными для функционирования этого энхансера (расположены между положениями от -188 до -44 последовательности этого промотора), таким образом, это является оригинальным, и при этом не устраняется активность транскрипционного энхансера последовательности убиквитина, используемой авторами изобретения.
Промотор PARTE также был слит с маленьким фрагментом в 214 оснований, соответствующих области от -31 до -245 сайта инициации транскрипции гена gluB-1 риса (Takaiwa F; Oono K; Kato A. Plant Mol. Biol. 1991, 16:49-58), для получения новой области промотора GARTE (фигура 8). Опыты с транзитной экспрессией показали, что новый искусственный промотор GARTE является высокоэффективным для экспрессии ДНК-последовательностей эндосперма семян.
Таким образом, авторы полагают, что функциональная комбинация этих химерных 5'-транскрипционных энхансеров является новой и очень полезной для получения генетических элементов, позволяющих получить высокие уровни экспрессии последовательностей ДНК в клетках растений, независимо от класса, которому они принадлежат.
Очевидно, что другие 5'-регуляторные области различных промоторов могут быть cys-слиты с объектом этого изобретения для придания высоких уровней экспрессии и/или для получения экспрессии временной, органной или тканевой специфичности.
Специалист в области генной инженерии сможет использовать энхансеры ART и Eureka, следуя приведенным выше описаниям, в комбинации с любым элементом промотора транскрипции в растительных клетках для усиления транскрипции/трансляции любой последовательности ДНК в клетках однодольных или двудольных растений.
С учетом роста развития генной инженерии растений за последние два десятилетия становится очевидно, что промотор согласно изобретению, соединенный с любым геном и последовательностью терминатора транскрипции, может быть встроен в генетически трансформирующий вектор растительной клетки, и при помощи широко используемых методов и эффективных технологий можно получить трансгенные растения, способные экспрессировать интересующий ген.
В настоящей патентной заявке вектор генетической трансформации относится к молекуле ДНК (очищенной или содержащейся внутри бактериальной клетки или вируса), которая служит в качестве переносчика для введения в клетку растения любого фрагмента ДНК, предварительно в нее встроенного.
Описание чертежей
Фигура 1. Последовательности генов актина-1 риса (Act), убиквитина-1 кукурузы (Ubi) и синтазы сахарозы кукурузы (Shrun) из сайта инициации транскрипции. В верхней части показан первый экзон, а в нижней части подчеркнуты 5'-область первого интрона и местоположение повторов и последовательностей общих мотивов.
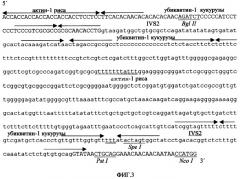
Фигура 2. Последовательность искусственного энхансера трансляции Eureka, где показаны ее релевантные элементы и сайты узнавания рестрикционных эндонуклеаз.
Фигура 3. Искусственная последовательность [конструкции] ART экзон/интрон/экзон, где показана природа каждого из составляющих ее фрагментов (в нижней части показан искусственный интрон; основания, встроенные для создания UUUUUAU-подобных последовательностей, подчеркнуты дважды; просто подчеркнуты и маркированы некоторые релевантные сайты узнавания рестрикционными эндонуклеазами).
Фигура 4. Первичная структура объекта данного изобретения (промотор PARTE), где показано ядро промотора (в нижней части выделен курсивом), слитое с областью [конструкции] ART экзон/интрон/экзон (основания интронов расположены в нижней части, экзонов - в верхней части) и с искусственным энхансером трансляции Eureka. Подчеркнуты некоторые релевантные сайты узнавания рестрикционными эндонуклеазами; ТАТА-бокс подчеркнут дважды, а кодон инициации трансляции выделен жирным шрифтом.
Фигура 5. Первичная структура промотора APARTE, где показана 5'-регуляторная область (область от -43 до -310 из сайта инициации транскрипции, расположена в верхней части и выделена курсивом) актина-1 риса, слитая с промотором PARTE (промотор расположен в нижней части и выделен курсивом, в нижней части расположен интрон, в верхней части расположены экзоны). Подчеркнуты и выделены жирным шрифтом некоторые релевантные сайты узнавания рестрикционной эдонуклеазой; ТАТА бокс подчеркнут дважды, а кодон инициации трансляции выделен жирным шрифтом.
Фигура 6. Первичная структура промотора U3ARTE, где показаны составляющие ее элементы: область от -299 до -855 из сайта инициации транскрипции гена ubi-1 кукурузы расположена в верхней части; as-1-подобный энхансер транскрипции расположен в верхней части и выделен жирным шрифтом; область от -43 до -310 из сайта инициации транскрипции гена act-1 риса расположена в верхней части и выделена курсивом; промотор PARTE расположен в нижней части (ТАТА бокс подчеркнут дважды, ART интрон выделен курсивом и сайт инициации трансляции просто подчеркнут).
Фигура 7. Варианты промотора с элементами энхансера объекта данного изобретения. A: 35SEureka; B: 35SART; C: 35SARTE; D: PARTE; E: APARTE; F: 2A1PARTE; G: 2APARTE; H: U3ARTE. Промотор 35S (1,3 п.н.); энхансер трансляции Eureka; ART экзон/интрон/экзон; ядро икусственного промотора; 5'-область активации (от -43 до -221) гена актина-1 риса; 5'-область активации (от -226 до -310) гена актина-1 риса; ASP (as-1-подобный энхансер); 5'-область активации (от -299 до -855) промотора убиквитина -1 кукурузы.
Фигура 8. Первичная структура промотора GARTE, где показаны составляющие ее элементы: ген gluB-1 риса, область от -31 до -245 из сайта инициации транскрипции, расположен в верхней части и выделен курсивом; промотор PARTE (промотор расположен в нижней части, некоторые релевантные сайты рестрикции подчеркнуты; ТАТА-бокс подчеркнут дважды; кодон инициации трансляции выделен жирным шрифтом).
Фигура 9. Карта pUC-GUSint.
Фигура 10. Карта PBPF Ω(омега) 7.
Фигура 11. Карта линкера pBPFA 19.
Фигура 12. Сравнение функциональности элементов ART и Eureka в клетках риса с помощью гистохимического окрашивания X-Gluc при помощи транзитной экспрессии различных генетических конструкций заякоренного гена GUSint, введенного при помощи метода биологической баллистики.
Хранение микроорганизмов
Плазмиды pC-EURGUSint; pC-ARTEGUSint; pGARTEGUSint и pC-U3ARTEGUSint были обработаны для защиты от микроорганизмов в соответствии с Будапештским договором и депонированы в Бельгийской Коллекции Микроорганизмов и Плазмид (BCCM/LMBP), Universiteit Gent, «Fiers-Schell-Van Montagu» building, Technogiepark 927, B-9052 Gent-Zwijnaarde, Belgica. Плазмиды pC-EURGUSint; pC-ARTEGUSint; pGARTEGUSint с присвоенными им номерами LMBP 4727; LMBP 4725; LMBP 4728, соответственно, и с датой 19 мая 2003 года, и pC-U3ARTEGUSint с номером 4791 от 25 ноября 2003 года.
Примеры
Пример 1. Конструкция составляющих элементов новой химерной системы для экспрессии ДНК-последовательностей в растительных клетках
Все синтезированные фрагменты ДНК были созданы с липкими концами к различным сайтам рестрикции под действием рестрикционных эндонуклеаз типа-II для упрощения правильного процесса клонирования.
а) клонирование энхансера трансляции Eureka.
Фрагмент ДНК из 86 пар оснований или нуклеотидов (п.н.), соответствующий энхансеру трансляции Eureka (SEQ ID NO:1), был клонирован в вектор pBluescript II SK (Stratagene, USA), предварительно переваренный рестрикционными ферментами PstI и SacI, с получением преимущества в виде липких концов для обоих ферментов при конструировании фрагмента синтетической ДНК. Полученная плазмида была названа pBS-Eureka.
b) создание искусственной области ART экзон/интрон/экзон.
Искусственная область ART экзон/интрон/экзон была сконструирована путем клонирования, последовательной сборки созданных фрагментов ДНК. Сначала фрагмент синтетической ДНК, называемый P35AcU (SEQ ID NO:2), который содержал ядро промотора, первый экзон и часть искусственного интрона был клонирован в вектор pBluescript II SK, рестрикционными ферментами EcoRI и SpeI с получением плазмиды pBS-AcU. После этого эта плазмида была переварена ферментами рестрикции SpeI и SacI и встроена во фрагмент I-U/Ac синтетической ДНК (SEQ ID NO:3), который кодирует часть искусственного интрона. Этим путем была получена плазмида pBS-AcUAc.
Далее, фрагмент синтетической ДНК I-Ac/U (SEQ ID NO:4), заякоривающий конец искусственного интрона, был вставлен в плазмиду pBS-AcUAc, переваренную рестрикционными ферментами BamHI и SacI, с получением плазмиды pBS-AcUAcU.
Когда фрагмент IniT (SEQ ID NO:5) был встроен в pBS-AcUAcU, переваренную ферментами SpeI/SacI, была укомплектована искусственная ART экзон/интрон/экзон (SEQ ID NO:6), соответствующая плазмиде pBS-ART, первичная структура которой между сайтами рестрикции EcoRI и SacI вектора PBluescript II показана в последовательности SEQ ID NO:7.
с) конструкция промотора PARTE
Для создания последовательности промотора, являющегося объектом данного изобретения (промотор PARTE), фрагмент ДНК, содержащий ядро промотора и область ART экзон/интрон/экзон (без ее 3'-области), был получен из плазмиды pbs-ART путем переваривания ее ферментами XhoI/PstI и встраивания ее в плазмиду pBS-Eureka, переваренную теми же самыми ферментами. Таким образом, авторы изобретения получили плазмиду pPARTE (Фигура 4, Фигура 7D), последовательность которой между сайтами EcoRI и SacI показана в последовательности SEQ ID NO:9.
Пример 2. Демонстрация функциональности элементов энхансера Eureka и ART в растительных клетках
а) функциональность трансляционного эхансера Eureka в клетках табака.
Для подтверждения силы энхансера Eureka в клетках риса и табака была создана серия вспомогательных генетических конструкций.
Репортерный ген UidA с интроном IV2 гена ST-LS1 картофеля, встроенным в сайт Sna BI (GUSint), был получен путем переваривания плазмиды pUC-GUSint (Фигура 9) под действием ферментов NcoI/SacI и клонирован в те же самые сайты плазмиды pBS-Eureka, давая вектор PbsEURGUSint. Последний был дополнительно переварен рестрикционными ферментами PstI, SacI и обработан S-1-нуклеазой, с получением плазмиды pBS-ΔEURGUSint, которая была переварена ферментами XhoI/KpnI, с образованием фрагмента ДНК, содержащего энхансер Eureka, слитый с геном GUSint, который был встроен в вектор pBPF Ω(омега) 7 (Фигура 10). Таким образом, авторы получили вектор pBPF-EUROGUSint (Фигура 7А), имеющий ген экспрессии GUSint под контролем 35S-промотора CaMV (версия 1.3 п.н.), энхансера Eureka и сигналов терминации транскрипции гена Agrobacterium tumefaciens nos (tNOS).
В качестве контроля для оценки экспрессии конструкции pBPF-EUROGUSint плазмида pBPF Ω-GUSint была сконструирована путем клонирования гена GUSint, полученного из плазмиды pUC-GUSint путем переваривания под действием ферментов SacI/Klenow и KpnI между сайтами SmaI и KpnI вектора pBPF Ω(омега)7. Эта плазмида подобна pBPF-EUROGUSint, за исключением наличия трансляционного энхансера Ω(омега), контролирующего GUSint вместо Eureka. Другая контрольная плазмида была сконструирована посредством элиминации энхансера омега плазмиды pBPF Ω(омега)-GUSint под действием ферментов XhoI/NcoI, обработки фрагментом Кленова и самолигирования плазмиды, с получением вектора pBPF-GUSint.
Плазмиды pBPF- Ω(омега)GUSint, pBPF-GUSint и pBPF-EUROGUSint были переварены под действием фермента HindIII для получения кассет экспрессии GUSint в растениях, они были клонированы в переваренный под действием фермента HindIII бинарный вектор pCAMBI2300, дающий начало бинарным векторам: pC- Ω(омега)7GUSint, pC-GUSint и pC-EUROGUSint, соответственно.
Полученные бинарные плазмиды были введены в штамм LBA4404 A. tumefaciens, авторы продолжили опыты по проверке функциональности энхансера Eureka путем транзитной экспрессии в клетках NT1 табака, следуя протоколу, описанному у An et al (An G. Plant Physiol. 1985, 79:568-570), с некоторыми модификациями. После четырех дней сокультивирования клеток табака с Agrobacterium, несущей каждый из бинарных векторов, клетки были собраны и обработаны, как описано у Jefferson (Jefferson R.A. 1988. Plant reporter genes: the GUS gene fusion system. In: J.K. Setlow (Ed), Genetic Engineering. Vol.10, Plenum Publishing Corporation. P.247-263), для определения их β-глюкоронидазной активности (GUS). Каждый эксперимент был повторен три раза, с пятью повторами для каждого. Результаты показаны в таблице 2.
| Демонстрация функциональности трансляционного энхансера Eureka в клетках табака | ||||||
| Таблица 2 | ||||||
| Эксперимент | Активность GUS (Pm4-MU/мин/мг общего белка) | Соотношение Eureka/ Ω(омега) | Среднее соотношение Eureka/ Ω(омега) | |||
| Контроль | pC-GUSint | pC- Ω(омега) 7GUSint | pC-EURGUSint | |||
| I | 0,31±0,01 | 1,93±1,17 | 7,15±2,26 | 7,50±2,60 | 1,04 | 1,00±0,33 |
| II | 1,10±0,28 | 2,11±0,18 | 8,56±1,60 | 11,22±2,80 | 1,31 | |
| III | 0,79±0,19 | 4,84±1,66 | 33,2±3,6 | 21,1±6,1 | 0,64 |
Как можно видеть из результатов, показанных в таблице 2, нет значительных различий между активностью энхансера Eureka по сравнению с таковой лидерной последовательности TMV омега, и это - первый пример полностью искусственного эффективного энхансера трансляции. Это также подтверждает теоретическую концепцию авторов, показывая, что можно сконструировать генетический элемент с сильно выраженными свойствами усиливать трансляцию последовательностей ДНК, слитых в прямом направлении с 3'-концом, комбинируя области последовательностей, богатых С- и А-, с последовательностями, гомологичными мотиву HCAYYY (H=C/T/A; Y=C/T).
b) фукциональность и