Рекомбинантная плазмидная днк pif tren, кодирующая полипептид интерферона альфа-2b человека, и штамм бактерий escherichia coli-продуцент полипептида интерферона альфа-2b человека
Иллюстрации
Показать всеИзобретение относится к генетической инженерии и может быть использовано для получения рекомбинантного полипептида интерферона альфа-2b человека. Конструируют in vitro рекомбинантную плазмидную ДНК, содержащую синтетический ген интерферона альфа-2b человека, тандем промоторов А2 и A3 из ранней области бактериофага Т7 и синтетический участок - усилитель трансляции, обуславливающие конститутивный биосинтез целевого белка в клетках трансформированного ею штамма Escherichia coli SGK25 /pIF TREN, с высоким выходом. 2 н.з.п ф-лы, 5 ил.
Реферат
Изобретение относится к биотехнологии, в частности к генетической инженерии, и представляет собой сконструированную in vitro рекомбинантную плазмидную ДНК, содержащую синтетический ген интерферона альфа-2b человека, тандем промоторов А2 и A3 из ранней области бактериофага Т7 и синтетический участок - усилитель трансляции, обуславливающие биосинтез полипептида интерферона альфа-2b человека, а также штамм Escherichia coli - продуцент этого полипептида.
Интерферон альфа-2b человека (IFα2b) является одним из, по крайней мере, 13 представителей семейства лейкоцитарных интерферонов человека [1, 2] - белков, различающихся по аминокислотному составу, но имеющих сходную биологическую активность. Интерферон альфа-2b человека представляет собой полипептид длиной 165 аминокислот и рассчетной массой около 18000 Да. Это один из основных иммуномодуляторов, продуцируемых, в основном, человеческими лейкоцитами в ответ на вирусную инфекцию. Проявляет антивирусную, антипролиферативную и стимулирующую NK-клетки активность [3]. Может быть использован в качестве лекарственных препаратов для лечения различных вирусных инфекций, включая грипп, гепатиты, а также в комбинированной терапии онкологических заболеваний.
Известны способы получения лейкоцитарного интерферона-альфа человека, основанные на использовании активированных лимфоцитов [4], а также рекомбинатного альфа-интерферона, получаемого в результате микробиологического синтеза [5]. Недостатком этих способов является низкий выход целевого продукта и, как следствие, высокая стоимость препаратов IFα.
Известны плазмидные конструкции и созданные на их основе штаммы E.coli, продуцирующие с довольно высоким выходом IFα2 человека [6, 7].
Наиболее близким к заявляемому техническому решению (прототипом) является способ, описанный в работе [7]. Штамм E.coli SS5 содержит рекомбинантную плазмидную ДНК pSS5, кодирующую рекомбинантный человеческий лейкоцитарный интерферон-альфа2, экспрессия которого находится под контролем лактозного, фага Т7 и триптофанового промоторов. Недостатком плазмиды pSS5 и штамма на ее основе является недостаточная оптимизация процесса транскрипции рекомбинантного гена интерферона. Из трех промоторов, контролирующих биосинтез интерферона, промотор фага Т7 в отсутствие индуктора (т.е. в условиях выращивания биомассы) репрессирован, а два других недостаточно сильны для обеспечения максимальной экспрессии целевого белка.
Технической задачей изобретения является увеличение уровня биосинтеза полипептида интерферона альфа-2b человека и создание более продуктивного штамма-продуцента.
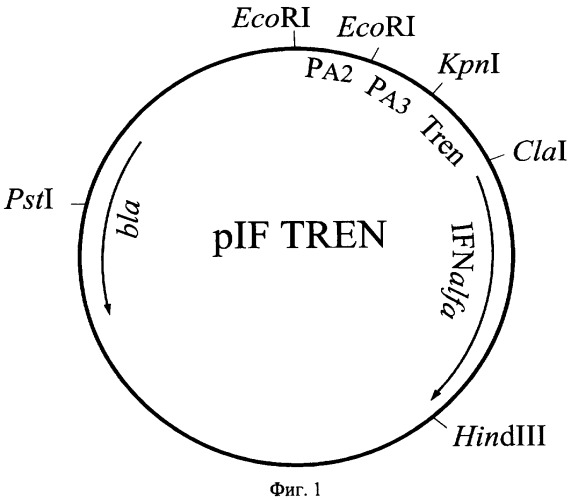
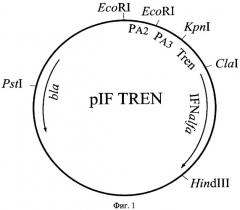
Поставленная задача решается путем конструирования плазмиды pIF TREN, кодирующей конститутивный синтез полипептида интерферона альфа-2b человека, и штамма Escherichia coli SGK25/pIF TREN, обеспечивающего синтез этого полипептида с уровнем экспрессии не ниже 40% суммарного клеточного белка. Высокий конститутивный уровень синтеза целевого полипептида обеспечивается тем, что плазмида pIF TREN обладает высокой копийностью, содержит тандем сильных промоторов А2 и A3 из ранней области бактериофага Т7 и синтетический участок - усилитель трансляции (TREN) гена 10 бактериофага Т7. Рекомбинантная плазмидная ДНК pIF TREN, кодирующая полипептид интерферона альфа-2b человека, характеризуется следующими признаками:
имеет молекулярную массу 2,40 Md (3,778 т.п.о.);
кодирует аминокислотную последовательность зрелого интерферона альфа-2b человека;
состоит из KpnI/HindIII - фрагмента плазмиды pTNF331 [8] длиной 3,170 т.п.о., содержащего тандем промоторов А2 и A3 из ранней области бактериофага Т7, терминатор транскрипции фага лямбда, ген bla β-лактамазы и участок ori инициации репликации; KpnI/ClaI - фрагмента плазмиды pTrcTEGFb размером 0,09 т.п.о., включающий участок усилителя трансляции TREN [9] и гена ifh α2b, фланкированного сайтами рестрикции ClaI и HindIII;
содержит тандем промоторов А2 и A3 из ранней области бактериофага Т7, синтитический усилитель трансляции TREN гена 10 бактериофага Т7, синтетический ген ifn α2b, терминатор транскрипции фага лямбда, ген bla β-лактамазы, определяющий устойчивость трансформированных плазмидой pIF TREN клеток к ампициллину, участок ori инициации репликации; уникальные сайты узнавания рестрикционными эндонуклеазами, имеющими следующие координаты: EcoRI - 1 и 111, Kpn I - 246, Cla I - 336 и 856, PstI - 816 и 3030, HindIII - 849.
Особенностью предложенной плазмидной конструкции является то, что ген интерферона находится под контролем тандема сильных конститутивных промоторов А2 и A3 из ранней области бактериофага Т7, а для усиления трансляции используется синтетический усилитель трансляции TREN, что в совокупности обеспечивает конститутивный синтез целевого белка с высоким выходом.
Для получения штамма-продуцента полипептида интерферона альфа-2b человека трансформируют компетентные клетки Escherichia coli штамма SGK 25 [12], созданного в ЗАО «Биокад» на основе штамма SG20050 [13], рекомбинантной плазмидой pIF TREN.
Полученный штамм Escherichia coli SGK25/pIF TREN характеризуется следующими признаками.
Морфологические признаки. Клетки мелкие, палочковидной формы, грамотрицательные, подвижные, размером 1×3-5 мкм, неспороносные.
Культуральные признаки. При росте на агаризованной LB-среде колонии круглые, гладкие, полупрозрачные, блестящие, серые, край ровный; диаметр колоний 1-3 мм; консистенция пастообразная. Рост в жидкой среде LB характеризуется равномерным помутнением среды.
Физиолого-биохимические признаки. Клетки штамма продуцента могут расти в диапазоне температур 20-42°С, при этом оптимум составляет 37°С. Наиболее благоприятные для роста значения рН находятся в интервале 6,8-7,2. При росте в аэробных условиях культура может усваивать азот как органических соединений (пептон, триптон, аминокислоты, дрожжевой экстракт), так и аммонийных солей. Углерод усваивается в форме углеводов, многоатомных спиртов (глицерин), аминокислот.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (до 200 мкг/мл), обусловленную наличием в плазмиде гена бета-лактамазы, а также к стрептомицину (25 мкг/мл) и тетрациклину (до 50 мкг/мл), связанную, соответственно, с наличием в хромосоме мутации rpsL и транспозона Tn10.
Способ, условия и состав среды для хранения штамма. LB-бульон с 15% глицерином, при температуре -70°С, в криовиалах.
Существенными отличиями заявляемого способа от прототипа являются использование более продуктивного нового штамма и оптимизация условий его культивирования. Штамм Е. coli SGK25/pIF TREN обеспечивает устойчивый конститутивный синтез полипептида интерферона альфа-2b человека, в количестве не менее 40% от суммарного клеточного белка, что обуславливает высокую технологичность процесса, т.к. выход рекомбинантного полипептида в оптимальном режиме культивирования составляет не менее 1000 мг на литр культуры с суммарной активностью (3-4)1011 мЕ.
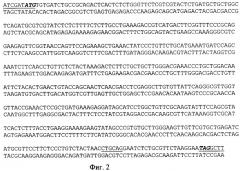
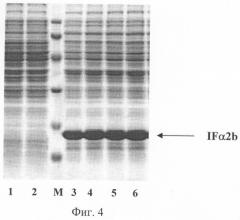
На фиг.1 представлена физическая карта рекомбинантной плазмиды pIF TREN, на фиг.2 - нуклеотидная последовательность гена интерферона альфа-2b человека; инициирующий и терминирующий кодоны выделены жирным шрифтом, подчеркнуты сайты рестриктаз: Hind III, PstI, Cla I; на фиг.3 - аминокислотная последовательность полипептида IFa2b, кодируемого рекомбинантной плазмидой pIF TREN; на фиг.4 - электрофореграмма лизатов клеток штамма-реципиента Е. coli SGK25 (дорожки 1,2), штамма-продуцента Е. coli SGK25/pIF TREN (дорожки 3-6) в 12,5%-ном полиакриламидном геле (М - белковые маркеры молекулярной массы, kDa: 14,5; 21,5; 31,0; 45,0; 66,0; 97,4); стрелкой указан полипептид IFα2b. На фиг.5 представлена хроматограмма выделенного интерферона альфа 2b, полученная на хроматографе "Waters" с использованием колонки С4 Symmetry (4,6×150) методом обратнофазовой ВЭЖХ. Сплошной линией указан градиент содержания ацетонитрила в элюирующем буфере.
Изобретение иллюстрируется следующими примерами.
Пример 1. Амплификация гена IFα2b с одновременным введением сайтов рестрикции ClaI и HindIII для последующего клонирования.
Амплификацию гена проводят в объеме 100 мкл, используя в качестве матрицы плазмиду pSKIfn (ЗАО «Биокад»), содержащую ген IFα2b. Реакционная смесь содержит 100 нг pSKIfn, по 50 пмолей праймеров
5'-TTAATATCGATATGTGTGATCTGCCGC и 5'-TATCTAAGCTTAAGTCGACTATTCC. смесь dNTP (по 0.2 mM каждого), 10 mM Трис-HCl, рН 8.8, 10 mM KCl, 2.5 mM MgSO4, 2.5 ед.акт. Pfu ДНК-полимеразы (фирмы Stratagene) и 1 ед.акт. Taq ДНК-полимеразы (фирмы Fermentas). Проводят 25 циклов по схеме: 95°С/40 сек, 50°С/40 сек, 72°С/1 мин. Продукты реакции анализируют электрофорезом в 1%-ном агарозном геле, полосу длиной около 530 п.о. вырезают, ДНК экстрагируют из геля. Продукт амплификации обрабатывают рестриктазами ClaI и HindIII в соответствии с методикой, описанной в работе [10], и выделяют из агарозного геля.
Пример 2. Конструирование экспрессионной плазмиды pIF TREN.
30 мкг плазмиды pTrcTEGFb [9] обрабатывают рестриктазами ClaI и Kpn I, фрагмент длиной 90 п.о., содержащий усилитель трансляции TREN выделяют из агарозного геля. 5 мкг плазмиды pTNF331 [8] обрабатывают рестриктазами Kpn I и HindIII и линеаризированную векторную часть выделяют из агарозного геля. Далее 1 мкг ClaI-Kpn I-фрагмента, 1 мкг линеанизированной векторной части и 0,5 мкг ПЦР-фрагмента, полученного на предыдущем этапе, лигируют в 20 мкл реакционной смеси по стандартной методике [10]. 5 мкл реакционной смеси используют для трансформации компетентных клеток XL-1 Blue (Stratagene, США). Трансформанты высевают на LB-arap, содержащий 100 мкг/мл ампициллина. Скрининг клонов проводят рестриктным анализом ClaI, Kpn I и HindIII. Полученную в результате рекомбинантную плазмиду анализируют HaeIII, Kpn I и HindIII. Структуру клонированного гена в отобранных клонах подтверждают определением нуклеотидной последовательности с использованием набора Cycle ReaderTM DNA Sequencing Kit (Fermentas, Литва), как описано в руководстве [11]. В результате получают экспрессионную плазмиду pIF TREN (фиг.1).
Пример 3. Получение штамма-продуцента полипептида интерферона альфа-2b человека.
Рекомбинантной плазмидной ДНК pIF TREN трансформируют компетентные клетки Escherichia coli SGK25 [12] и после выращивания рекомбинантных клонов на LB-агаре с ампициллином при 32°С получают штамм-продуцент полипептида интерферона альфа-2b человека.
Пример 4. Определение продуктивности штамма-продуцента полипептида интерферона альфа-2b человека.
Для определения продуктивности штамма SGK25/pIF TREN клетки одного клона выращивают при 32°С в комплексной среде (LB или SB) в колбах с объемом среды 40-100 мл/колбу на качалке при скорости вращения 180 об/мин в течение 16 часов. Пробы для анализа получают путем центрифугирования культуральной жидкости при 6000 об/мин в течение 5-10 мин.
Содержание рекомбинантного IF α2b определяют по отношению к суммарному клеточному белку. Для этого клетки суспендируют в 100 мкл буфера, содержащего 62,5 мМ Трис-HCl, рН 6,8, 10% глицерина, 2,3% SDS, 5% меркаптоэтанола, 0,001% бромфенолового синего. Смесь нагревают 5 минут на кипящей водяной бане и охлаждают до комнатной температуры. Образцы объемом 5,8 и 15 мкл подвергают электрофорезу в 12,5% SDS-ПААГ. По окончании электрофореза гель прокрашивают при помощи кумасси R-250. После отмывки красителя гель сканируют и проводят математическую обработку результатов с помощью программы "Gel-Pro".
По полученным данным рекомбинантный интерферон α2b составляет не менее 40% от суммарного белка клетки (фиг.4).
Пример 5. Определение продуктивности штамма-продуцента полипептида интерферона альфа-2b человека при масштабировании процесса культивирования.
Для определения продуктивности штамма SGK25/pIF TREN проводят наработку биомассы в 75литровом ферментере, с рабочим объемом среды 50 литров. Посевной материал получают по следующей схеме: клетки одного клона (свежеполученного или хранящегося в Банке клеток при температуре - 70°С) инкубируют в 2-4 мл LB среды в течение 4 часов, после чего пересевают в колбы.
Для засева ферментера используют 1 литр посевного материала, выращенного в колбах на LB среде с ампициллином в течение 8 часов при 32°С и 150 об/мин до поздней логарифмической фазы роста. Культивирование в ферментере проводят на богатой комплексной среде с ампициллином (100 мкг/мл) при температуре 32°С, без рН статирования. Концентрацию растворенного кислорода в диапазоне 40 (±10)% от насыщения поддерживают путем изменения скорости оборотов мешалки от 80 до 190 об/мин и подачи воздуха от 10 до 14 л/мин.
Ферментацию заканчивают при переходе культуры в стационарную фазу роста, что соответствует значениям оптической плотности 18-22 о.е.(λ=560 нм).
Насыщения поддерживают путем изменения скорости оборотов мешалки от 80 до 190 об/мин и подачи воздуха от 10 до 14 л/мин.
Ферментацию заканчивают при переходе культуры в стационарную фазу роста, что соответствует значениям оптической плотности 18-22 о.е.(λ=560 нм).
Для выделения рекомбинантного интерферона культуральную жидкость сепарируют и полученную биомассу суспендируют в охлажденном до 4°С лизирующем буфере (ЛБ) (ТрисHCl, NaCl, ЭДТА, PMSF, рН 8.0) в течение 30 минут. Полученую суспензию обрабатывают на french-press "AVP 2000" за один цикл и собирают в емкость с ледяным ЛБ. Охлажденную суспензию центрифугируют, супернатант (экстракт) отбрасывают, а осадок телец включения трижды отмывают. Отмытые тельца растворяют в буфере для восстановления дисульфидных связей, раствор центрифугируют, супернатант собирают и вносят в буфер для ренатурации (ТрисHCl, ЭДТА, Тритон Х-100). По окончании ренатурации раствор фильтруют через мембраны с размером пор 0,4 мкм, наносят на колонку с анионообменником, собирают элюат, проводят рН-фракционирование и дальнейшую очистку на катионообменнике.
Гомогенность выделенного IFα2b по данным ВЭЖХ составляет 92- 95%. (фиг.5).
Активность интерферона определяют на клетках MDBK стандартным способом по ингибированию цитопатического действия против 100 ТЦД50 вируса везикулярного стоматита. В качестве референс-стандарта использовали препараты OCO 01-1102 (106 ME/мл).
Содержание рекомбинантного IFα2b определяют тремя различными способами.
1. По отношению к суммарному клеточному белку.
Рекомбинантный интерферон α2b составляет не менее 40% от суммарного белка клетки.
2. По выходу рекомбинантного интерферона α2b. Выход интерферона α2b составляет не менее 1000 мг из 20 г биомассы, полученной с 1 л культуральной жидкости (КЖ).
3. По данным определения биологической активности.
Продуктивность заявляемого штамма составляет (3-4)·1011 ME/1 л КЖ.
Таким образом, заявляемое техническое решение позволяет получить полипептид со свойствами, идентичными свойствам природного интерферона альфа-2b человека,
биосинтез полипептида конститутивен и при этом уровень его синтеза составляет не менее 40% от суммарного клеточного белка за счет того, что ген интерферона альфа находится под контролем тандема промоторов А2 и A3 из ранней области бактериофага Т7 в составе высококопийной плазмиды, а трансляция белка увеличивается за счет синтетического усилителя трансляции. Все это при подобранных условиях культивирования позволяет значительно повысить технологичность и экономичность процесса получения рекомбинантного интерферона альфа-2b при одновременном увеличении выхода целевого продукта в 1,25 раза (на 25%) по сравнению с прототипом.
Источники информации
1. Goeddel D.V., Yelverton E., Ullrich A., Heyneker H.L., Miozzari G., Holmes W., Seeburg P.H., Dull T.J., May L., Stebbing N., Crea R., Maeda S., McCandliss R., Sloma A., Tabor J.M., Gross M., Familetti P.C., Pestka S. //Nature, 1980, v.287, p.411-417.
2. Goeddel D.V., Leung D.W., Dull T.J., Gross M., Lawn R.M., McCandliss R., Seeburg P.H., Ullrich A., Yelverton E., Gray P.W // Nature, 1981, v.290, p.20-26.
3. Kauppinen H-L., Hivronen S., Cantell К. // Methods in Enzymology, 1986, v.119, p.27-35.
4. Kauppinen H-L., Hivronen S., Cantell K. // Methods in Enzymology, 1986, v.119, p.39-47.
5. Thatcher D., Panayotatos N. // Methods in Enzymology, 1986, v.119, p.166-177.
6. Кравченко В.В., Гилева И.П., Сандахчиев Л.С., Петренко В.А., Коробко В.Г., Добрынин В.Н.// Рекомбинантная плазмидная ДНК pIF16, кодирующая полипептид со свойствами интерферона α2 человека и штамм E.coli SG20050 - продуцент полипептида со свойствами интерферона α2 человека. Патент РФ №2054041, 6 C12N, 15/21, С12Р, 21/02. БИ №4, 1996.
7. Черепанов П.А., Михайлова Т.Г., Черепанов П.П., Мартиненко Д.Л., Шевчук А.А., Федюкин B.C., Николаев Т.М., Толкачев Б.Б., Свентицкий Е.Н., Ураков Н.Н., Калинин Ю.Т., Денисов Л.А., Тяготин Ю.В. и др. Рекомбинантная плазмидная ДНК pSS5, кодирующая синтез рекомбинантного человеческого альфа-2b интерферона, штамм Escherichia coli SS5 - продуцент рекомбинантного человеческого альфа-2b интерферона и способ получения интерферона альфа-2b. Патент РФ №2165455, 7 C12N 15/21, C12N 1/21, С12Р 21/02, C12R 1:19, 2001.
8. Шингарова Л.П., Сагайдак Л.Н., Турецкая Р.Л., Недоспасов С.А., Есипов Д.С., Коробко В.Г.// Биоорган, химия, 1996, т.22, №4, с.243-251.
9. Шингарова Л.Н., Кашьяп С.К., Петровская Л.Е., Петренко Л.А., Пустошилова Н.М., Синичкина С.А., Коробко В.Г. // Биотехнология, 1998, №6, с.24-35.
10 Sambrook J., Fritsch E., Maniatis Т. // Molecular Cloning. A Laboratory manual. 2nd ed. Cold Spring Harbor, NY, 1989.
11 CycleReader DNA Sequencing Kit #K1711, Fermentas. Sequencing Protocol.
12 Паспорт штамма микроорганизма Escherichia coli SGK25. Номер ВКПМ В-8686.
13. Trisler P., Gottesman S. //J. BacterioL, 1984, v.160, Nol, p.184-191.
1. Рекомбинантная плазмидная ДНК pIF TREN, кодирующая полипептид интерферона альфа-2b человека с мол. м. 2,40 Md (3,778 т.п.о.), состоящая из KpnI/HindIII - фрагмента плазмиды pTNF331 длиной 3,170 т.п.о., содержащего тандем промоторов А2 и A3 из ранней области бактериофага Т7, терминатор транскрипции фага лямбда, ген bla β-лактамазы и участок ori инициации репликации; KpnI/ClaI - фрагмента плазмиды pTrcTEGFb размером 0,09 т.п.о., включающего участок усилителя трансляции TREN и гена IFa2b, фланкированного сайтами рестрикции Clal и HindIII; содержащая уникальные сайты узнавания рестрикционными эндонуклеазами, имеющими следующие координаты: EcoRI - 1 и 111, Kpn I - 246, Cla I - 336 и 856, PstI - 816 и 3030, HindIII - 849.
2. Штамм бактерий Escherichia coli SGK25 /pIF TREN - продуцент полипептида интерферона альфа-2b человека.