Способ извлечения урана из руд
Иллюстрации
Показать всеИзобретение относится к гидрометаллургическим способам переработки рудного сырья и может быть использовано для серно-кислотного агитационного, кучного и подземного выщелачивания урана при извлечении урана из руд. Способ включает выщелачивание урана и железа раствором серной кислоты с использованием в качестве окислителя трехвалентного железа, содержащегося в руде, затем ведут извлечение урана из раствора с получением раствора, содержащего двухвалентное железо, и регенерацию двухвалентного железа до трехвалентного окислением с получением оборотного раствора и его рециркуляцию на выщелачивание руды. При этом извлечение урана из раствора ведут сорбцией на анионите, полученный после сорбции раствор, содержащий двухвалентное железо, перед регенерацией в нем двухвалентного железа до трехвалентного подкисляют серной кислотой и регенерацию ведут облучением потоком ускоренных электронов при мощности поглощенной дозы 2,3-3,5 кГр/с в течение 1-6 мин. Техническим результатом изобретения является повышение экономичности, эффективности и экологической чистоты процесса. 3 з.п. ф-лы, 3 ил., 3 табл.
Реферат
Изобретение относится к гидрометаллургическим способам переработки рудного сырья и может быть использовано, в частности, для серно-кислотного агитационного (АВ), кучного (KB) и подземного (ПВ) выщелачивания урана.
Известны способы серно-кислотного выщелачивания с использованием в качестве окислителя урана сульфата трехвалентного железа /см., например, Ring R.J. Hydrometallurgia, 1980, 6, 89-101/. Производственная практика показывает, что выщелачивание является наиболее затратным переделом в общей схеме переработки урановых руд, поэтому эффективность этой операции определяет себестоимость конечной продукции.
Согласно современным представлениям об электрохимическом механизме растворения диоксида урана (уранинит, настуран и т.п.) под действием сульфата трехвалентного железа, чтобы выщелачивающая среда была максимально эффективной, все железо должно присутствовать в растворе в трехвалентной форме. В реальном растворе присутствие других ионов, в первую очередь ионов Fe2+, вызывает снижение скорости процесса вследствие возникновения конкурирующей адсорбции этих ионов на активных центрах поверхности уранового минерала. При большом количестве ионов Fe2+ в растворе требуется поддерживать избыток ионов Fe3+, чтобы обеспечить удовлетворительную скорость реакции.
На практике для окисления ионов двухвалентного железа в сернокислых растворах известны различные способы, в частности:
- применение сильных окислителей (пиролюзит, хлораты, азотная кислота и т.п.),
- молекулярным кислородом или кислородом воздуха:
при повышенной температуре и давлении в автоклаве,
при атмосферном давлении иногда с каталитическими добавками (азотистая кислота и др.).
Все указанные способы либо связаны с затратами химических реагентов, что приводит к загрязнению раствора посторонними примесями (ионами), либо требуют введения дополнительных операций, либо не обладают необходимой производительностью, что в итоге приводит к существенному увеличению стоимости передела.
Известен способ серно-кислотного агитационного выщелачивания урана с использованием в качестве окислителя соединений железа, содержащихся в самой руде. Сущность способа заключается в разделении потока исходной пульпы на два потока. В первом предварительно выщелачивают железо серной кислотой, нейтрализуют избыточную кислоту пульпой второго потока и окисляют железо кислородом воздуха при атмосферном давлении, затем еще раз подают кислоту (если требуется - с добавками диоксида марганца или трехвалентного железа). Эти операции проводятся в батарее из нескольких пачуков при температуре 60-80°С в течение более 12 ч /Ларин В.К., Литвиненко В.Г., Шелудченко В.Г. Совершенствование технологии гидрометаллургической переработки урановых руд. Горный журнал. 1999, №12, 59/. Однако вследствие низкой скорости процесса окисления железа кислородом воздуха в кислой среде указанный способ не обладает высокой эффективностью и требует значительных энергетических (сжатый воздух, пар) затрат.
Известен способ серно-кислотного выщелачивания урана из руд с использованием трехвалентного железа в качестве окислителя, включающий его химическую регенерацию. Этот способ включает приготовление выщелачивающих растворов, содержащих серную кислоту и нитрат-ионы, фильтрацию их через руду с переводом шестивалентного урана, двухвалентного железа и др. металлов в продукционные растворы, извлечение из них урана с получением маточных растворов и рециркуляцию этих растворов на выщелачивание руды.
Интенсификация процесса выщелачивания урана из руд методами KB или ПВ достигается путем использования циркулирующих растворов, в которых ионы Fe (II) окисляются до Fe (III), а последние уже выполняют роль непосредственного окислителя урана (IV) в уран (VI). Окисление Fe (II) в Fe (III) осуществляется в основном кислородом воздуха, барботируемого через циркулирующий раствор, при каталитическом участии азотистой кислоты и окислов азота, получаемых в результате разложения азотной кислоты, являющейся исходным азотсодержащим реагентом /патент РФ №2172792 С1, заявка 2000106961/02, заявл. 21.03.00, опубл. бюл. №24, 27.08.01. - прототип/.
Недостатками этого способа являются:
- использование в процессе нескольких реагентов, в частности азотной кислоты для образования окислителя и, как следствие, загрязнение продукционных растворов нитрат-ионами, снижающих сорбционную емкость анионитов по урану,
- выделение токсичных оксидов азота, образующихся при приготовлении выщелачивающих растворов, и необходимость их улавливания с применением специальной аппаратуры (колонных аппаратов с диспергаторами),
- использование в качестве реагента технического кислорода или менее эффективного кислорода воздуха для окисления образующихся оксидов азота и железа (II),
- отсутствие экологической чистоты вследствие невозможности полного улавливания токсичных оксидов азота,
-сложность в практической реализации и точности поддержания заданных технологических параметров.
Техническим результатом предлагаемого способа является повышение экономичности, эффективности и экологической чистоты процесса выщелачивания урана из руд серной кислотой с использованием в качестве окислителя рудного железа.
Этот результат достигается тем, что в способе извлечения урана из руд методами подземного или кучного и агитационного выщелачивания серной кислотой с использованием в качестве окислителя железа (III), содержащегося в руде, включающем выщелачивание урана и железа, извлечение урана сорбцией на анионите, получение оборотного раствора, регенерацию окислением Fe2+ до Fe3+ в этом растворе и его рециркуляцию на выщелачивание руды, причем оборотный раствор, содержащий двухвалентное железо, после доукрепления серной кислотой облучают потоком высокоэнергетических электронов при мощности поглощенной дозы 2,3-3,5 кГр/с в течение 1-6 мин. Оборотный раствор кучного или подземного выщелачивания, содержащий 0,5-5 г/л Fe2+, перед облучением подкисляют серной кислотой, идущей на выщелачивание урана, до концентрации 5-10 г/л. Осветленный оборотный раствор агитационного выщелачивания, полученный сгущением или гидроциклонированием сбросной пульпы, содержащий 5-15 г/л Fe2+, перед облучением подкисляют частью серной кислоты, необходимой для выщелачивания руды, до концентрации 10-20 г/л.
Нами разработаны основы «безреагентной» радиационно-химической технологии регенерации окислителя. Перевод ионов двухвалентного железа в трехвалентную форму без участия химических реагентов и принудительного нагревания обеспечивается за счет облучения раствора потоком ускоренных электронов. Установлено, что кратковременное (несколько минут) облучение модельных сернокислых растворов сульфата железа позволяет практически нацело окислять ионы двухвалентного железа до трехвалентного состояния в широком диапазоне (1-10 г/л) концентрации железа и серной кислоты. Разрабатываемая радиационно-химическая технология «безреагентной» регенерации окислителя эффективна для использования как в процессах KB и ПВ, так и при агитационном выщелачивании урана серной кислотой.
Радиационно-химическая технология в настоящее время является одной из наиболее прогрессивных. Производство линейных ускорителей промышленного типа освоено на предприятии Агенства по АЭ РФ (г.Санкт-Петербург) и на заводе Института ядерной физики им. Будкера СО РАН в г.Новосибирске. Эти установки нашли широкое применение для работы в круглосуточном режиме в природоохранных технологиях: для обработки промышленных сточных вод, стоков текстильного производства и животноводческих комплексов, питьевой воды, токсичных отходов и т.п. /XI Международное совещание по применению ускорителей заряженных частиц в промышленности и медицине (ICAA'05)/ Санкт-Петербург, октябрь 2005 г./.
Таким образом, экономичность, эффективность и экологичность процесса серно-кислотного извлечения урана из руд методами агитационного, кучного и подземного выщелачивания с использованием в качестве окислителя ионов трехвалентного железа достигается циркуляцией оборотных растворов после сорбционного извлечения урана и регенерации окислителя путем облучения этих растворов потоком ускоренных электронов и возвращении регенерированного окислителя в процесс выщелачивания урана.
Пример 1. Зависимость степени окисления двухвалентного железа от продолжительности облучения. Основными технологическими параметрами исследуемого процесса при заданном режиме облучения являются концентрации ионов железа и серной кислоты. Влияние указанных параметров на степень окисления ионов двухвалентного железа изучали в интервале концентраций Fe2+ 1-5 и кислоты 2-5 г/л, т.е. применительно к условиям процессов ПВ и KB урана из руд ( см. табл.1).
Степень окисления двухвалентного железа рассчитывали по изменению концентрации ионов двухвалентного железа в облученном и необлученном растворах:
(Feнеобл-Feобл)/Feнеобл·100[%].
Концентрацию серной кислоты определяли потенциометрическим титрованием, концентрацию железа трилонометрически (с сульфосалициловой кислотой) до и после облучения.
Исследуемые растворы в открытых полиэтиленовых банках емкостью 100 мл помещались на вращающийся столик (10 об/мин) рабочей камеры ускорителя, который юстировался относительно пучка таким образом, чтобы пучок попадал в центр облучаемого образца.
Эксперименты проводились при следующих энергетических параметрах:
- кинетическая энергия - 7 МэВ,
- средний ток - 25 мкА,
- плотность тока - 32 мкА/см2.
Мощность поглощенной дозы определялась из известного соотношения
Дм=ηIE/m,
где η - коэффициент, учитывающий долю поглощенного в образце пучка электронов, для водного раствора - 0,95, I - средний ток ускоренных электронов, Е - кинетическая энергия электронов, m - масса раствора.
Растворы после облучения оставались прозрачными. Облучение подкисленного (2,4 г/л, рН 1,6) раствора сульфата двухвалентного железа с концентрацией ˜0,8 г/л при мощности поглощенной дозы 3,46 кГр/с менее чем за минуту обеспечивает высокую степень окисления (˜87%). Практически полное окисление железа достигается всего за 1,5-3 мин (см. табл.1). При увеличении концентрации ионов двухвалентного железа до 5,2 г/л высокая степень окисления железа (на уровне 92%) достигается за 6 мин при снижении мощности поглощенной дозы до 2,3 кГр/с, т.е. почти в полтора раза.
Пример 2. Зависимость степени окисления двухвалентного железа от концентрации ионов железа и серной кислоты в облученном растворе.
Влияние указанных параметров на степень окисления ионов двухвалентного железа в облученных растворов изучали при концентрации Fe2+ 1-11 и кислоты в интервале 2-16 г/л (см. табл.2).
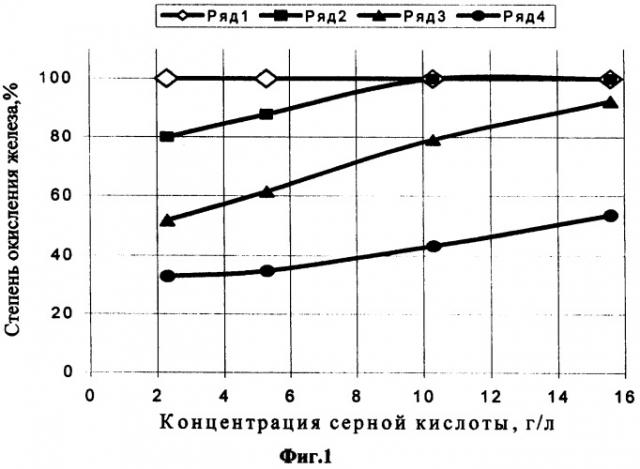
Как видно из данных табл.2, степень окисления железа в значительной мере зависит от исходной концентрации двухвалентного железа и серной кислоты в растворе. Но при концентрации железа (II) 1 г/л степень окисления достигает 100% независимо от кислотности раствора.
С повышением концентрации двухвалентного железа в исходном растворе от 1 до ˜11 г/л (см. табл.2) обнаруживается заметное влияние концентрации серной кислоты на степень окисления двухвалентного железа в результате облучения.
С повышением концентрации железа в исходных растворах до 2,5 г/л (см. №№5-8 табл.2) и концентрации кислоты 10-15 г/л степень окисления двухвалентного железа составляет 100%. При снижении концентрации кислоты (до 2-5 г/л) степень окисления железа несколько уменьшается (до 80-88 %).
| Таблица 1Зависимость степени окисления ионов двухвалентного железа от продолжительности облучения (τ) при различной мощности поглощенной дозы (Дм) | |||||||
| №№ оп. п.п. | τ, мин | Дм, кГр/с | Характеристика раствора | Степень окисления Fe, % | |||
| Концентрация, г/л | О-ВП, мВ | ||||||
| Fe3+ | Fe2+ | Н2SO4 | |||||
| Исх. | 0 | - | 0,44 | 0,82 | 2,4 | 390 | 0 |
| 1 | 0,8 | 3,46 | 1,15 | 0,11 | 1,9 | 480 | 86,6 |
| 2 | 1,5 | 1,21 | 0,05 | 1,9 | 500 | 93,9 | |
| 3 | 3,0 | 1,27 | н.о*) | 2,0 | 500 | 100 | |
| 4 | 6,0 | 1,27 | 2,5 | 590 | 100 | ||
| Исх. | 0 | - | 0,90 | 5,20 | 5,7 | 365 | 0 |
| 5 | 1,0 | 2,30 | 2,6 | 3,5 | 4,0 | 445 | 42,9 |
| 6 | 2,0 | 3,5 | 2,7 | 3,8 | 460 | 48,6 | |
| 7 | 3,0 | 4,2 | 2,0 | 2,9 | 475 | 61,5 | |
| 8 | 4,0 | 4,7 | 1,4 | 2,9 | 480 | 73,1 | |
| 9 | 6,0 | 5,7 | 0,4 | 2,5 | 500 | 92,0 | |
| *) н.о. - не обнаружено. |
Для получения аналогичного результата при увеличении концентрации железа до ˜5 г/л концентрация кислоты должна быть выше 10 г/л. При концентрации железа в исходном растворе более 10 г/л и высокой концентрации кислоты (˜16 г/л) степень окисления составляет ˜54 %. Увеличение продолжительности облучения до 6 мин при мощности дозы 3,5 кГр/с повышает степень окисления железа до 70-80%.
| Таблица 2Зависимость степени окисления железа (II) от концентрации железа и серной кислоты при мощности поглощенной дозы 2,3 кГр/с и продолжительности облучения 3 мин | |||||||||
| № оп. п.п. | Исходный раствор | Облученный раствор | Степень окисления Fe, % | ||||||
| Концентрация, г/л | O-ВП, мВ | Концентрация, г/л | O-ВП, мВ | ||||||
| Fe3+ | Fe2+ | H2SO4 | Fe3+ | Fe2+ | H2SO4 | ||||
| 1 | 0,2 | 1,0 | 2,5 | 360 | 1,2 | н.о. | 2,3 | 600 | 100 |
| 2 | 5,1 | 365 | 4,7 | 660 | |||||
| 3 | 10,6 | 360 | 9,1 | 675 | |||||
| 4 | 14,7 | 365 | 13,5 | 675 | |||||
| 5 | 3,5 | 2,5 | 2,2 | 345 | 5,5 | 0,5 | рН 1,8 | 460 | 80,0 |
| 6 | 5,3 | 350 | 5,7 | 0,3н.о. | 1,8 | 470 | 88,0 | ||
| 7 | 10,0 | 355 | 6,0 | 7,3 | 500 | 100 | |||
| 8 | 15,0 | 355 | 11,4 | 510 | |||||
| 9 | 0,9 | 5,4 | 2,2 | 355 | 3,7* | 2,4 | рН 2,0 | 435 | 51,9 |
| 10 | 5,2 | 5,7 | 4,2 | 2,0 | 3,4 | 470 | 61,5 | ||
| 11 | 5,3 | 10,7 | 5,1 | 1,1 | 7,2 | 490 | 79,2 | ||
| 12 | 5,3 | 15,8 | 5,8 | 0,4 | 12,2 | 515 | 92,4 | ||
| 13 | 2,0 | 10,3 | 2,4 | 370 | 5,5 | 6,9 | рН 2,0 | 425 | 33,0 |
| 14 | 1,7 | 10,6 | 5,0 | 375 | 5,5 | 6,9 | 3,7 | 430 | 34,9 |
| 15 | 1,6 | 10,6 | 9,8 | 375 | 6,5 | 6,0 | 6,3 | 445 | 43,4 |
| 16 | 1,6 | 10,8 | 15,8 | 375 | 7,5 | 5,0 | 9,1 | 460 | 53,7 |
| 17** | 1,6 | 10,6 | 9,8 | 375 | 9,0 | 3,2 | 5,5 | 470 | 69,8 |
| 18** | 1,6 | 10,8 | 15,8 | 375 | 10,2 | 2,2 | 8,6 | 490 | 79,6 |
| * - выпал осадок гидроокиси железа (III)** - продолжительность облучения 6 мин при Дм=3,5 кГр/с |
Процесс окисления ионов двухвалентного железа сопровождается соответствующим ростом величины О-ВП, достигающим значений 500-675 мВ при 100%-ной степени окисления. При рН˜2 вследствие недостатка свободной кислоты в растворе происходит термогидролитическое разложение незначительной части ионов сульфата трехвалентного железа и образования золя гидроксида. Полученные результаты - зависимость степени окисления (Н, %) железа (II) от концентрации серной кислоты (С, г/л) и железа (II) иллюстрирует фиг.1, где концентрации железа (II) в исходном растворе: ряд 1-1 г/л, ряд 2-2,5 г/л, ряд 3-5,3 г/л, ряд 4-10,6 г/л.
Эти зависимости позволяют определить полноту реакции окисления ионов двухвалентного железа применительно к оборотным растворам процесса серно-кислотного выщелачивания урана.
В табл.3 приведены примеры составов растворов, полученных после выщелачивания урана и железа различными способами (продуктивный раствор) и оборотного раствора - после регенерации окислителя путем подкисления серной кислотой и облучения потоком ускоренных электронов.
| Таблица 3 | ||||||||||
| Способ выщелачивания | Продуктивный раствор | Оборотный раствор | ||||||||
| концентрация, г/л | О-ВП, мВ | концентрация, г/л | О-ВП, мВ | |||||||
| U | H2SO4 | Fe+3 | Fe+2 | U | Н2SO4 | Fe+3 | Fe+2 | |||
| Подземное | 0,05 | 1,0 | 0,2 | 0,8 | 360 | 0,01 | 5 | 0,9 | 0,1 | 600 |
| Кучное | 0,4 | 5,0 | 0,9 | 5,3 | 355 | 0,02 | 10 | 5,1 | 1,1 | 500 |
| Агитацион | 0,8 | 10 | 1,6 | 10,8 | 375 | 0,02 | 20 | 10,2 | 2,2 | 500 |
Максимальная степень извлечения урана в растворе при данной кислотности имеет место при величине О-ВП раствора на уровне 500-600 мВ, т.е. при минимальной концентрации ионов двухвалентного железа.
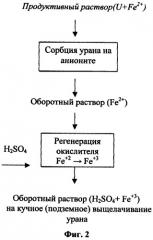
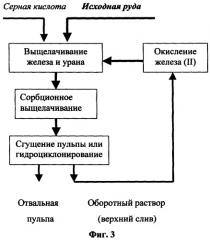
На основании полученных данных предлагаются принципиальные технологические схемы извлечения урана из рудного сырья серной кислотой при подземном, кучном (фиг.2) и агитационном (фиг.3) выщелачивании.
Продуктивные растворы после KB или ПВ урана серной кислотой с использованием в качестве окислителя железа, содержащегося в руде, поступают на сорбцию урана. Маточный раствор, в котором железо находится преимущественно в восстановленной форме, т.е. в виде двухвалентных ионов, является оборотным и после добавки кислоты, требующейся для выщелачивания урана, и регенерации окислителя возвращается на операцию выщелачивания. Операция регенерации, т.е. радиационно-химическое окисление ионов двухвалентного железа до трехвалентного состояния продуктами радиолиза, осуществляется облучением раствора потоком высокоэнергетических электронов, получаемых с помощью линейного ускорителя.
При агитационном выщелачивании схема (фиг.3) отличается тем, что на сорбцию урана поступает пульпа, а выделение оборотного раствора (верхнего слива) осуществляется путем сгущения или гидроциклонирования (или фильтрования) кислой пульпы. Сгущенная пульпа (нижний слив) направляется в отвал. В этом случае регенерация проводится при рН<2, для чего на операцию подается небольшая часть кислоты от поступающей на выщелачивание урана.
1. Способ извлечения урана из руд, включающий выщелачивание урана и железа раствором серной кислоты с использованием в качестве окислителя трехвалентного железа, содержащегося в руде, извлечение урана из раствора с получением раствора, содержащего двухвалентное железо, регенерацию двухвалентного железа до трехвалентного окислением с получением оборотного раствора и его рециркуляцию на выщелачивание руды, отличающийся тем, что извлечение урана из раствора ведут сорбцией на анионите, полученный после сорбции раствор, содержащий двухвалентное железо, перед регенерацией в нем двухвалентного железа до трехвалентного подкисляют серной кислотой и регенерацию ведут облучением потоком ускоренных электронов при мощности поглощенной дозы 2,3-3,5 кГр/с в течение 1-6 мин.
2. Способ по п.1 отличающийся тем, что выщелачивание ведут методами подземного, кучного или агитационного выщелачивания.
3. Способ по п.2, отличающийся тем, что оборотный раствор при кучном или подземном выщелачивании, содержащий 0,5-5 г/л двухвалентного железа, перед облучением подкисляют серной кислотой до концентрации 5-10 г/л.
4. Способ по п.2, отличающийся тем, что оборотный раствор при агитационном выщелачивании, содержащий 5-15 г/л двухвалентного железа, перед облучением подкисляют серной кислотой до концентрации 10-20 г/л.