Способ лечения и средства для него
Иллюстрации
Показать всеИзобретение относится к области медицины и касается способа модулирования роста клеток и, более точно, способа подавления роста неопластических клеток. Сущность изобретения включает способ понижающей регуляции (подавления) пролиферации неопластических клеток, которые были трансформированы в результате активации онкогена, эффективным количеством средства для подавления функциональной активности сфингозинкиназы и повышающей регуляции (активации) пролиферации этих клеток обработкой их средством для повышающей активации онкогенной активности сфингозинкиназы. Изобретение также касается способа диагностики неоплазии. Преимущество изобретения заключается в обнаружении нового маркера онкогенности, а именно факта онкогенной активности сфингозинкиназы. 6 н. и 33 з.п. ф-лы, 3 табл., 4 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области биотехнологии и медицины и, в частности, касается способа модулирования роста клеток и, более точно, способа подавления роста неопластических клеток. Настоящее изобретение может быть использовано, среди прочего, при терапевтическом и/или профилактическом лечении таких раковых заболеваний, как твердые опухоли: рак толстой кишки, желудка, легких, мозга, костей, пищевода, поджелудочной железы, молочной железы, яичников или матки, но не ограничивается ими.
Уровень техники
Развернутая библиография публикаций, на которые ссылается автор в настоящем описании, собрана в конце описания.
Ссылки на предшествующий уровень техники в настоящем описании не являются и не должны восприниматься как признание или предположение в любой другой форме, будто предшествующий уровень техники образует составную часть общепринятых знаний в Австралии.
Сфингозинкиназа является ключевым регуляторным ферментом в целом ряде клеточных реакций. Известно, что сфингозин-1-фосфат является важным вторичным посредником при передаче сигналов (Meyer et al., 1997). В различных типах клеток он обладает митогенным эффектом (Alessenko, 1998) и, по-видимому, запускает ряд важных регуляторных путей, включая предотвращение индуцированного церамидами апоптоза (Culliver et al., al., 1996), мобилизацию внутриклеточного кальция независимым от IP3 путем, стимуляцию синтеза ДНК, активацию протеинкиназного (МАР-киназного) пути, активируемого митогенами, активацию фосфолипазы D и регуляцию подвижности клеток (см. обзоры: Meyer et al., 1997; Spiegal et al., 1998; Igarashi, 1997).
Недавние исследования (Xia et al., 1998) показали, что сфингозин-1-фосфат является непременным промежуточным сигнальным соединением при воспалительных ответах эндотелиальных клеток на α-фактор некроза опухолей (αTNF). Несмотря на его очевидное значение, очень мало известно о механизмах, контролирующих уровень сфингозин-1-фосфата в клетках. Известно, что уровень сфингозин-1-фосфата в клетке в основном определяется его образованием из сфингозина под действием сфингозинкиназы и в меньшей степени его разрушением связанной с эндоплазматическим ретикулумом сфингозин-1-фосфатлиазой и сфингозин-1-фосфатфосфатазой (Spiegal et al., 1998). Базальные уровни сфингозин-1-фосфата в клетке обычно невелики, но могут быстро и временно возрастать, когда клетка подвергается воздействию митогенов. Такая реакция, по-видимому, коррелирует с увеличением активности сфингозинкиназы в цитозоле и может быть предотвращена добавлением ингибирующих сфингозинкиназу молекул N,N-диметилсфингозина и DL-трет-дигидросфингозина. Это означает, что сфингозинкиназа является важной молекулой, ответственной за регуляцию уровня сфингозин-1-фосфата в клетке. Таким образом, сфингозинкиназа играет главную и непременную роль в осуществлении эффектов, приписываемых сфингозин-1-фосфату в клетке.
Предполагается, что сфингозинкиназа играет роль в ряде клеточных активностей, включая воспаление, мобилизацию кальция, подвижность и экспрессию молекул адгезии. Однако точную природу регулируемых таким образом клеточных активностей, роль и механизм действия сфингозинкиназы в этом отношении только сейчас начинают понимать. Многие сигналы, ведущие к модуляции различных клеточных активностей, еще точно не определены. Выяснение таких сигнальных клеточных механизмов необходимо для разработки терапевтических и профилактических подходов к заболеваниям, в которых участвуют ошибочные или иным образом нежелательные клеточные активности.
В работе, которая привела к настоящему изобретению, авторы определили, что сигнальный каскад, стимулируемый одной из липидкиназ, сфингозинкиназой, играет важную роль в онкогенезе и, фактически, она сама по себе онкогенна, когда уровень ее активности слишком высок. Даже в свете предварительных данных, указывающих на роль сфингозинкиназы в различных клеточных активностях, онкогенное действие сфингозинкиназы неожиданно и полностью непредвиденно для этой молекулы. Установление связи между сфингозинкиназой и патогенезом рака дает возможность рационально разрабатывать терапевтический и/или профилактический режим для модуляции роста клеток, а также идентифицировать те молекулы, которые можно использовать для модуляции роста клеток.
Сущность изобретения
В настоящем описании и следующей за ней формуле изобретения, если по контексту не требуется иной смысл, слово "включает" и его варианты типа "включают" и "включающий" следует понимать как включение указанного предмета или стадии, либо группы предметов или стадий, без исключения любых других предметов или стадий либо групп предметов или стадий.
Один из вариантов настоящего изобретения предусматривает способ модуляции роста клеток, включающий обработку клеток эффективным количеством средства в течение времени и в условиях, достаточных для модулирования активности сфингозинкиназы.
Другой вариант настоящего изобретения предусматривает способ модуляции роста клеток, включающий обработку клеток эффективным количеством средства в течение времени и в условиях, достаточных для изменения уровня функциональной активности сфингозинкиназы.
Следующий вариант настоящего изобретения предусматривает способ модуляции размножения (пролиферации) клеток, включающий их обработку эффективным количеством средства в течение времени и в условиях, достаточных для изменения уровня функциональной активности сфингозинкиназы.
Следующий вариант настоящего изобретения предусматривает способ подавления (down-regulating) пролиферации клеток, включающий их обработку эффективным количеством средства в течение времени и в условиях, достаточных для подавления функциональной активности сфингозинкиназы.
Следующий вариант настоящего изобретения предусматривает способ усиления (up-regulating) пролиферации клеток, включающий их обработку эффективным количеством средства в течение времени и в условиях, достаточных для усиления функциональной активности сфингозинкиназы.
В следующем варианте настоящего изобретения предусматривается способ подавления пролиферации неопластических клеток, включающий их обработку эффективным количеством средства в течение времени и в условиях, достаточных для подавления функциональной активности сфингозинкиназы.
Следующий вариант настоящего изобретения предусматривает способ усиления пролиферации клеток, включающий их обработку эффективным количеством средства в течение времени и в условиях, достаточных для усиления функциональной активности сфингозинкиназы.
Следующий вариант настоящего изобретения предусматривает способ лечения и/или профилактики заболеваний, характеризующихся неконтролируемым ростом клеток у млекопитающих, который включает введение млекопитающим эффективного количества средства в течение времени и в условиях, достаточных для подавления функциональной активности сфингозинкиназы.
Следующий вариант настоящего изобретения касается лечения и/или профилактики неопластических заболеваний у млекопитающих способом, который включает введение млекопитающим эффективного количества средства в течение времени и в условиях, достаточных для подавления функциональной активности сфингозинкиназы.
Следующий вариант настоящего изобретения касается применения средства, способного модулировать функциональную активность сфингозинкиназы, при изготовлении медикамента для модулирования роста клеток у млекопитающих, в котором подавление функциональной активности сфингозинкиназы ведет к подавлению роста данных клеток, а усиление функциональной активности сфингозинкиназы ведет к усилению роста данных клеток.
Следующий вариант касается средств, предназначенных для модуляции функциональной активности сфингозинкиназы, при котором модулирование функциональной активности сфингозинкиназы ведет к модуляции роста клеток.
В следующем варианте настоящее изобретение касается фармацевтической композиции, включающей модуляторное средство, определенное выше, и один или несколько фармацевтически приемлемых носителей и/или разбавителей. Указанные модуляторные средства называются активными ингредиентами.
Следующий вариант настоящего изобретения касается модуляторных средств, определенных выше, при их применении в способе настоящего изобретения.
Следующий вариант настоящего изобретения касается способа диагностики, который основывается на скринировании (обследовании) лиц на присутствие сфингозинкиназы, либо мРНК или белка, либо специфических форм сфингозинкиназы, транскрибируемых и/или транслируемых в данной популяции клеток. Методика скринирования может быть направлена на количественный и/или качественный анализ сфингозинкиназы. Это особенно полезно, например, при определении того, будет ли данное лицо предрасположено или устойчиво к заболеваниям, при которых ненормальный, нежелательный или иным образом ненадлежащий рост клеток является компонентом заболевания, и/или будет ли оно предрасположено или устойчиво к развитию определенных форм ненормального, нежелательного или иным образом ненадлежащего роста клеток.
Перечень фигур
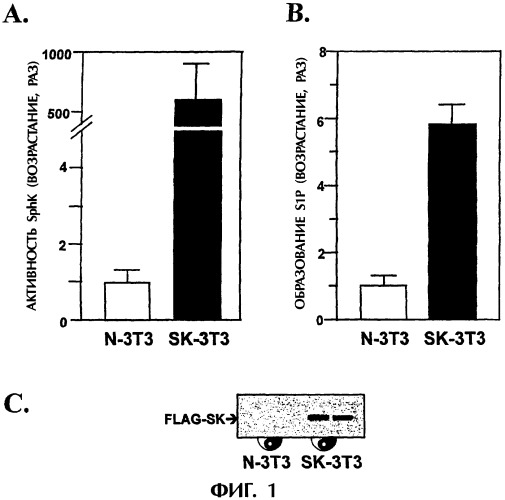
На фиг.1 графически представлена суперэкспрессия SphK в клетках NIH 3Т3. (А) Цитоплазматическую активность SphK измеряли в клетках, устойчиво трансфецированных pcDNA3-SphK-FLAG (SK-3T3) или исходным вектором (N-3T3). (В) Внутриклеточный уровень S1P измеряли в меченных [3H]-сфингозином образцах клеток SK-3T3 или N-3T3. (С) Белки в растворимой фракции лизированных клеток подвергали гибридизации с моноклональными антителами против FLAG (M2, Kodak).
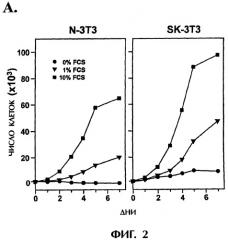
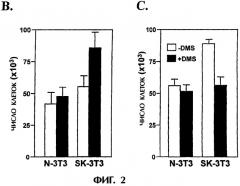
На фиг.2 графически представлено, как суперэкспрессия SphK усиливает пролиферацию клеток NIH 3Т3. (А) Кривые роста показывают, что клетки SK-3T3 (правая секция) размножаются быстрее, чем клетки N-3T3 (левая секция). Приведены средние значения из тройных измерений и близкие результаты были получены в трех независимых экспериментах. (В) Рост клеток при насыщающей плотности. Клетки подсчитывали при полном насыщении (белые столбцы) и через 24 часа после насыщения (черные столбцы), соответственно. (С) DMS ингибирует пролиферацию клеток при суперэкспрессии SphK. Равное число клеток SK-3T3 и N-3T3 культивировали в среде DMEM, содержащей 10% сыворотки, в присутствии или в отсутствие DMS (2,5 мкМ) в течение 5 дней. Среду заменяли каждый день. Данные в (В) и (С) представляют средние значения ±S.D. из трех независимых экспериментов по трем измерениям.
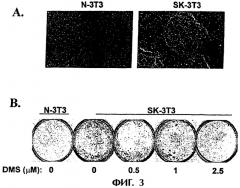
На фиг.3 показана суперэкспрессия SphK при трансформации клеток NIH ЗТЗ. (А) Образование очагов трансфецированных клеток NIH 3Т3. Культуры трансфецировали SphK (SK-3T3) или одним вектором (N-3T3) и фотографировали через 12 дней после транфекции (увеличение ×40). (В) Образование колоний на мягком агаре. Клетки SK-3T3 и N-3T3 культивировали в среде, содержащей 0,33% агара, и добавляли среду с различными концентрациями DMS через каждые 2 дня. Снимки получены после 2 недель культивирования и окрашивания МТТ. (С) Клетки NIH ЗТЗ трансфецировали V12-Ras или v-Src и измеряли активность SphK через 48 ч после трансфекции. (D) Анализ образования очагов проводили на клетках NIH 3Т3, трансфецированных V12-Ras, v-Src или SphK, в отсутствие или в присутствии DMS (2,5 мкМ) на протяжении 2 недель.
На фиг.4 показано, что суперэкспрессия SphK в клетках вызывает образование опухолей. (А) Фотография опухолей у мышей NOD/SCID, которым были введены клетки NIH 3Т3, трансфецированные SphK. (В) Морфология опухоли (вставка) и фиксированные в парафине срезы, окрашенные гематоксилином и эозином (увеличение ×60). (С) Экстракты целых клеток из трех отдельных опухолей (дорожки 4-6) и их периферических тканей (дорожки 1-3), клеток N-3T3 (дорожка 7) и SK-3T3 (дорожка 8) анализировали методом Westem-гибридизации. Верхнюю часть мембраны подвергали гибридизации с антителом против FLAG, а нижнюю - с антителом против актина (Santa Cruz).
Подробное раскрытие изобретения
Настоящее изобретение основывается, в частности, на установлении корреляции между клеточным ростом, в частности онкогенезом, и модуляцией уровня активности сфингозинкиназы. Установлении такой корреляции позволяет определить и рационально разработать методологию и препараты для применения в терапии, профилактике и диагностике заболеваний, характеризующихся ненормальным, нежелательным или иным образом ненадлежащим ростом клеток, в частности, неконтролируемой, индуцированной онкогенами пролиферации.
Соответственно, один из вариантов настоящего изобретения предусматривает способ модуляции роста клеток, включающий их обработку эффективным количеством некоего средства в течение времени и в условиях, достаточных для модулирования функциональной активности сфингозинкиназы.
Под "сфингозинкиназой" следует понимать все формы сфингозинкиназы и ее производных, гомологов, аналогов, эквивалентов или миметиков, или другие молекулы, обладающие функцией сфингозинкиназы, и молекулы нуклеиновой кислоты, кодирующие производные, гомологи, аналоги, эквиваленты или миметики сфингозинкиназы. К ним относятся, например, все белковые или нуклеотидные формы сфингозинкиназы или ее функциональных производных, гомологов, аналогов, эквивалентов или миметиков, включая, к примеру, любые изоформы, возникающие при альтернативном сплайсинге мРНК сфингозинкиназы, или мутанты или полиморфные варианты сфингозинкиназы. Следует также иметь в виду, что термин "нуклеотидная форма сфингозинкиназы" означает нуклеиновую кислоту, кодирующую сфингозинкиназу, и включает все регуляторные элементы сфингозинкиназы (типа промоторов или энхансеров), которые регулируют экспрессию сфингозинкиназы, включая регуляторные элементы, находящиеся в положениях, отличных от положения между сайтами инициации и терминации транскрипции в геномной ДНК, кодирующей сфингозинкиназу. Под "сфингозинкиназой" также следует понимать и все другие молекулы, обладающие функциональной активностью сфингозинкиназы. К таким молекулам относятся, например, эндогенно экспрессируемые молекулы, обладающие функциональной активностью сфингозинкиназы, или молекулы, которые были введены в организм и проявляют по меньшей мере одну из функций сфингозинкиназы. Эти молекулы могут быть рекомбинантными, искусственными или природными. Если не указано иначе, любые ссылки на модуляцию активности сфингозинкиназы включают модуляцию экспрессии нуклеиновой кислоты, кодирующей сфингозинкиназу, или функциональной активности продукта экспрессии сфингозинкиназы, и следует иметь в виду, что они также включают модуляцию экспрессии или функциональной активности, либо функционального эквивалента или производного сфингозинкиназы.
Под "модуляцией функциональной активности" сфингозинкиназы следует понимать усиление, подавление или любое другое изменение одной или нескольких функциональных активностей сфингозинкиназы. Она включает, к примеру, модуляцию проявления одной или более функциональных активностей сфингозинкиназы, модуляцию скорости, с которой данная активность проявляется, модуляцию степени, с которой такая активность проявляется, модуляцию количества активностей, способных проявиться, или модуляцию роли или степени, с которой проявляется любая из активностей, или природы активности. Изменения активности сфингозинкиназы могут осуществляться разными путями, включая посттрансляционную модификацию, связывание белков или других молекул, или трансляцию, но не ограничиваясь этим. Модуляцию активности следует также понимать как повышение или снижение концентрации сфингозинкиназы (например, при модуляции экспрессии сфингозинкиназы). В предпочтительном воплощении функциональная активность означает уровень активности сфингозинкиназы.
Соответственно, данное изобретение более предпочтительно касается способа модуляции роста клеток, включающего их обработку эффективным количеством некоего средства в течение времени и в условиях, достаточных для модулирования уровня функциональной активности сфингозинкиназы.
Как описано выше, настоящее изобретение основывается на установлении корреляции между функциональной активностью сфингозинкиназы и ростом клеток, в частности, онкогенной пролиферацией клеток. Не ограничивая настоящее изобретение какой-то одной теорией или механизмом действия, авторы обнаружили, что сигнальный каскад, стимулируемый одной из липидкиназ - сфингозинкиназой, играет важную роль в онкогенезе. В частности, конститутивная активация сфингозинкиназы при повышении экспрессии в клетках приводит к трансформации клеток и образованию опухолей, тем самым указывая на то, что липидкиназа дикого типа человека сама по себе онкогенна. Более того, сфингозинкиназа также участвует в трансформации, индуцированной Ras, но не v-Src. Наконец, ингибирование активности сфингозинкиназы с помощью ингибитора сфингозинкиназы обращает трансформацию не только в клетках с повышенным уровнем экспрессии сфингозинкиназы, но также и в Ras-трансформированных клетках. В этой связи "модуляцию" роста клеток следует понимать как усиление или подавление клеточного роста. Более точно, "подавление" роста клеток следует понимать как предотвращение, снижение или ингибирование иным способом одного или нескольких аспектов клеточного роста (включая индукцию апоптоза или гибели клеток другим способом), тогда как "усиление" роста клеток следует понимать в противоположном смысле. "Рост" клеток следует понимать в самом широком смысле, включая все аспекты деления/пролиферации и/или дифференцировки клеток. В особенно предпочтительном воплощении рост означает пролиферацию (размножение).
Согласно этому предпочтительному варианту предусматривается способ модуляции пролиферации клеток, включающий их обработку эффективным количеством некоего средства в течение времени и в условиях, достаточных для модулирования функциональной активности сфингозинкиназы.
Более предпочтительно, предусматривается способ подавления пролиферации клеток, включающий их обработку эффективным количеством некоего средства в течение времени и в условиях, достаточных для подавления функциональной активности сфингозинкиназы.
В другом предпочтительном варианте предусматривается способ усиления пролиферации клеток, включающий обработку клеток эффективным количеством некоего средства в течение времени и в условиях, достаточных для усиления функциональной активности сфингозинкиназы.
В самом предпочтительном варианте пролиферация представляет собой неконтролируемую пролиферацию, как в случае пролиферации, вызванной трансформацией клеток. Предпочтительно такая трансформация вызвана усилением активности онкогена типа Ras или онкогенным действием суперэкспрессии сфингозинкиназы.
Предпочтительно функциональная активность означает уровень функциональной активности сфингозинкиназы.
Следует иметь в виду, что "клетка" в контексте настоящего изобретения означает любой тип клеток, независимо от их происхождения. Например, клетка может быть клеткой естественного происхождения, нормальной или с отклонениями от нормы, либо она может быть искусственной, модифицированной или иным образом обработанной in vivo или in vitro, например, замороженной/оттаянной или генетически, биохимически или иным образом обработанной in vivo или in vitro (включая, к примеру, клетки, полученные в результате слияния двух различных типов клеток). Предпочтительно клетка представлена неопластической клеткой. Под "неопластической клеткой" подразумевается клетка с неконтролируемой пролиферацией. Неопластическая клетка может быть доброкачественной или злокачественной клеткой. Предпочтительно клетка является злокачественной. В одном из предпочтительных воплощений неопластическая клетка является злокачественной клеткой, пролиферация которой может привести к образованию твердых опухолей, например, злокачественной клеткой, происходящей из толстой кишки, желудка, легких, мозга, кости, пищевода или поджелудочной железы.
Согласно этому наиболее предпочтительному варианту, предусматривается способ подавления пролиферации неопластических клеток, включающий их обработку эффективным количеством средства в течение времени и в условиях, достаточных для подавления функциональной активности сфингозинкиназы.
Предпочтительно, неопластическая клетка является злокачественной клеткой, происходящей из толстой кишки, желудка, легких, мозга, кости, пищевода или поджелудочной железы, молочной железы, яичников или матки.
Более предпочтительно, когда злокачественная клетка становится трансформированной либо в результате усиления активности онкогена типа Ras, либо вследствие онкогенного действия суперэкспрессии сфингозинкиназы.
Еще более предпочтительно, когда фукнциональная активность означает уровень функциональной активности сфингозинкиназы.
Следует иметь в виду, что обработка клеток способом настоящего изобретения может проводиться ex vivo или in vivo. "Ex vivo" означает, что клетка была выделена из организма, и тогда модуляция ее роста может осуществляться in vitro. Например, клетка может не быть неопластической, при этом ее иммортализуют путем усиления активности сфингозинкиназы. В соответствии с предпочтительными вариантами настоящего изобретения клетка может быть неопластической клеткой, например злокачественной, локализованной in vivo (к примеру, в толстой кишке), и подавление ее роста будет осуществляться способом настоящего изобретения in vivo путем снижения уровня функциональной активности сфингозинкиназы. Следует также иметь в виду, что в случае указания специфического типа клеток, локализованных in vivo, например злокачественных клеток толстой кишки, такие клетки могут находиться в толстой кишке больного. Если первичная опухоль толстой кишки дает метастазы, то клетки толстой кишки могут находиться в другой части тела пациента. Например, они могут образовать вторичную опухоль (метастаз), находящийся, к примеру, в печени, лимфатическом узле или в кости.
Хотя предпочтительный способ заключается в подавлении пролиферации неопластических клеток, например, в качестве средства лечения рака, однако может быть желательно и усиление роста клеток. Например, может понадобиться иммортализировать популяцию клеток in vitro, чтобы облегчить их долговременное применение in vitro, к примеру, для облегчения роста in vitro таких тканей, как кожная ткань. В другом случае может понадобиться адаптировать клеточную линию к менее разборчивым условиям роста, например к росту при низком содержании сыворотки.
Согласно этому предпочтительному варианту, настоящее изобретение предусматривает способ усиления пролиферации клеток, включающий их обработку эффективным количеством некоего средства в течение времени и в условиях, достаточных для усиления функциональной активности сфингозинкиназы.
Предпочтительно функциональная активность означает уровень функциональной активности сфингозинкиназы.
Не ограничивая данный вариант настоящего изобретения какой-то одной теорией или механизмом действия, усиление пролиферации клеток предпочтительно заключается в трансформации клеток путем усиления онкогенного действия сфингозинкиназы.
В этом отношении "эффективное количество" означает количество, необходимое для того, чтобы по крайней мере частично достичь желаемого результата, или отсрочить возникновение, подавить развитие или полностью остановить развитие заболевания, подвергаемого лечению. Это количество зависит, конечно, от конкретного заболевания, подвергаемого лечению, от тяжести заболевания и индивидуальных параметров больного, включая возраст, физическое состояние, размер, вес и сопутствующее лечение. Эти факторы хорошо известны специалистам в этой области и могут быть учтены простым подбором. Обычно предпочтительно применять максимальные дозы, то есть наиболее высокие безопасные дозы по здравому врачебному суждению. Следует только иметь в виду, что можно вводить пониженные или переносимые дозы по медицинским показаниям, психологическим показаниям или практически по любым другим причинам.
Модуляция активности сфингозинкиназы путем введения средства в клетку может осуществляться одним из нескольких методов, включая, но никоим образом не ограничиваясь этим, введение в клетку средства (когда оно является белковой или небелковой молекулой), которое прямо или косвенно:
(i) модулирует экспрессию сфингозинкиназы;
(ii) модулирует функциональную активность продукта экспрессии сфингозинкиназы.
В этом случае модуляция функциональной активности сфингозинкиназы может осуществляться любым из нескольких методов, включая, но никоим образом не ограничиваясь этим, введение в клетку средства (когда оно является белковой или небелковой молекулой), которое прямо или косвенно:
(iii) модулирует синтез сфингозинкиназы;
(iv) действует как антагонист сфингозинкиназы;
(v) действует как агонист сфингозинкиназы (включая введение продукта экспрессии самой сфингозинкиназы или ее функционального эквивалента, производного, гомолога, аналога или миметика).
Такие белковые молекулы могут происходить из природных, рекомбинантных или искусственных источников, включая слитые белки или полученные, к примеру, при скринировании природных продуктов. Небелковые молекулы могут быть получены из природных источников, например, при скринировании природных продуктов, или могут быть синтезированы. В настоящем изобретении рассматриваются химические аналоги сфингозинкиназы, способные действовать как агонисты или антагонисты сфингозинкиназы. Химические агонисты не обязательно должны происходить из сфингозинкиназы, они могут иметь с нею лишь определенное конформационное сходство. Альтернативно, химические агонисты могут быть разработаны конкретно для воспроизведения определенных физико-химических свойств сфингозинкиназы. Антагонистами могут быть любые соединения, способные блокировать, ингибировать или иным образом предотвращать осуществление нормальных биологических функций сфингозинкиназы (например, N,N-диметилсфингозин или DL-трео-дигидросфингозин). К антагонистам относятся и моно-клональные антитела, специфические к сфингозинкиназе или к части сфингозинкиназы, и антисмысловые нуклеиновые кислоты, предотвращающие транскрипцию или трансляцию генов или мРНК в соответствующих клетках. Модуляция экспрессия также может осуществляться с помощью антигенов, РНК, рибосом, ДНК-ферментов, РНК-аптамеров, антител или молекул, пригодных для косупрессии.
Такие белковые или небелковые молекулы могут действовать как прямо, так и косвенно, модулируя экспрессию сфингозинкиназы или активность продукта экспрессии сфингозинкиназы. Молекула действует непосредственно, если она связывается с молекулой нуклеиновой кислоты или продукта экспрессии сфингозинкиназы, модулируя экспрессию или активность. Молекула действует косвенно, если она связывается с другой молекулой, отличной от нуклеиновой кислоты или продукта экспрессии сфингозинкиназы, причем эта другая молекула прямо или косвенно модулирует экспрессию или активность молекулы нуклеиновой кислоты или продукта экспрессии сфингозинкиназы. Соответственно, способ настоящего изобретения охватывает регуляцию экспрессии молекул нуклеиновой кислоты или функциональной активности продукта экспрессии сфингозинкиназы путем индукции каскада регуляторных процессов.
Не ограничивая действие настоящего изобретения какой-то одной теорией или механизмом действия, отметим тот факт, что сфингозинкиназа функционирует через сигнальный путь, который обычно называют сфингозинкиназным путем. "Сфингозинкиназный сигнальный путь" определяется как путь, функционирующий посредством сфингозинкиназы. При косвенной модуляции функциональной активности сфингозинкиназы следуте иметь в виду, что цель изобретения достигается модулированием активности компонентов сфингозинкиназного сигнального пути, действующих до или после сфингозинкиназы, в той мере, в какой они составляют часть этого пути. Например, модуляцию "сфингозинкиназной активности" можно осуществить посредством:
(i) модуляции каталитической активности сфингозинкиназы путем конкуренции за субстрат (к примеру, сфингозин или АТФ);
(ii) влияния на каталитическую активность сфингозинкиназы через аллостерические механизмы (при связывании с сайтами этой молекулы, отличными от сайтов связывания субстрата);
(iii) влияния на активацию фермента, например, при изменении:
- посттрансляционной ковалентной модификации - фосфорилирования, модификации липидов,
- нековалентного присоединения необходимого коактиватора - белка, липида или иона,
- субклеточной локализации фермента.
К "производным" относятся фрагменты, части, порции, мутанты, варианты и миметики из природных, искусственных или рекомбинантных источников, включая слитые белки. К частям или фрагментам относятся, к примеру, активные участки сфингозинкиназы. Производные можно получить путем вставки, делеции или замены аминокислот. Производные, полученные в результате вставки аминокислот, включают слияния со стороны амино и/или карбоксильного конца, а также вставки одной или нескольких аминокислот внутри последовательности. Варианты, возникшие в результате аминокислотных вставок, включают такие, у которых в заранее определенный сайт белка вставлена одна или несколько аминокислот, хотя возможны и вставки в случайные сайты с последующим скринированием конечного продукта. Варианты с делециями характеризуются удалением одного или более аминокисотных остатков из последовательности. Варианты с заменой аминокислот характеризуются тем, что удаляется по меньшей мере один аминокислотный остаток и на его место вставляется остаток другой аминокислоты. Примером вариантов с заменой аминокислоты служат консервативные замены аминокислот. Консервативные замены аминокислот в обычных случаях включают замены внутри следующих групп: глицин и аланин; валин, изолейцин и лейцин; аспарагиновая кислота и глутаминовая кислота; аспарагин и глутамин; серин и треонин; лизин и аргинин; фенилаланин и тирозин. Добавления к аминокислотным последовательностям включают слияния с другими пептидами, полипептидами или белками.
Термин "гомологичный" следует понимать как молекулы нуклеиновой кислоты или белка сфингозинкиназы, происходящие из видов, отличных от рассматриваемых видов.
Химические и функциональные эквиваленты молекул нуклеиновой кислоты или белка сфингозинкиназы следует понимать, как молекулы, обладающие хотя бы одной из функциональных активностей этих молекул, и они могут быть получены из любого источника, например, синтезированы химическим путем или идентифицированы при скринировании, к примеру, природных продуктов.
К производным относятся и фрагменты с определенными эпитопами или части целого белка, слитые с пептидами, полипептидами или другими белковыми или небелковыми молекулами.
Рассматриваемые в настоящем изобретении аналоги включают, не ограничиваясь этим, модификации боковых цепей, включение искусственных аминокислот и/или их производных во время синтеза пептида, полипептида или белка, и использование поперечных сшивок и других методов, накладывающих конформационные ограничения на белковые молекулы или их аналоги.
Производные последовательностей нуклеиновых кислот могут быть получены аналогичным образом посредством единичных или множественных замен нуклеотидов, делеций и/или вставок, включая слияние с другими молекулами нуклеиновых кислот. К производным молекул нуклеиновых кислот настоящего изобретения относятся олигонуклеотиды, праймеры для ПЦР, антисмысловые молекулы, молекулы, пригодные для косупрессии, и слитые молекулы нуклеиновых кислот. К производным нуклеотидных последовательностей также относятся вырожденные варианты.
Рассматриваемые в настоящем изобретении примеры модификаций боковой цепи включают модификации аминокислотных групп: восстановительное алкилирование при реакции с альдегидом с последующим восстановлением NaBH4; амидирование с помощью метилацетимидата; ацилирование уксусным ангидридом; карбамоилирование аминогрупп цианатом; тринитробензилирование аминогрупп с помощью 2,4,6-тринитробензолсульфоновой кислоты (TNBS); ацилирование аминогрупп янтарным ангидридом и тетрагидрофталевым ангидридом; и пиридоксилирование лизина пирдоксаль-5-фосфатом с последующим восстановлением NaBH4.
Гуанидиновые группы остатков аргинина могут быть модифицированы путем образования продуктов гетероциклической конденсации с такими реагентами, как 2,3-бутандион, фенилглиоксаль и глиоксаль.
Карбоксильные группы могут быть модифицированы путем активации карбодиимидом с образованием О-ацилизомочевины и последующей дериватизацией, например, до соответствующего амида.
Сульфгидрильные группы могут быть модифицированы такими методами, как карбоксиметилирование иодуксусной кислотой или иодацетамидом; окисление пероксимуравьиной кислотой до цистеиновой кислоты; образование смешанных дисульфидов с другими тиоловыми соединениями; реакция с малеимидом, малеиновым ангидридом или другим замещенным малеимидом; образование ртутных производных с помощью 4-хлормеркурибензоата, 4-хлормеркурифенилсульфоновой кислоты, фенилмеркурихлорида, 2-хлормеркури-4-нитрофенола и других ртутных соединений; карбамоилирование цианатом при щелочных значениях рН.
Триптофановые остатки могут быть модифицированы, например, окислением с помощью N-бромсукцинимида или алкилированием индольного кольца с помощью 2-гидрокси-5-нитробензилбромида или сульфенилгалоидов. Тирозиновые остатки, с другой стороны, могут быть модифицированы нитрованием тетранитрометаном с образованием 3-нитротирозинового производного.
Модификацию имидазольного кольца остатков гистидина можно осуществить алкилированием с производными иодуксусной кислоты или N-карбоэтоксилированием с помощью диэтилпирокарбоната.
Примеры включения искусственных аминокислот и производных в процессе синтеза белка включают, не ограничиваясь этим, использование норлейцина, 4-амино-масляной кислоты, 4-амино-3-гидрокси-5-фенилпентановой кислоты, 6-аминогексановой кислоты, t-бутилглицина, норвалина, фенилглицина, орнитина, саркозина, 4-амино-3-гидрокси-6-метилгептановой кислоты, 2-тиенилаланина и/или D-изомеров аминокислот. Список искусственных аминокислот, предусмотренных настоящим изобретением, приведен в Таблице 1.
| Таблица 1 | |||
| Нестандартная аминокислота | Код | Нестандартная аминокислота | Код |
| α-аминомасляная кислота | Abu | L-N-метилаланин | Nmala |
| α-амино-α-метилбутират | Mgabu | L-N-метиларгинин | Nmarg |
| аминоциклопропанкарбоксилат | Cpro | L-N-метиласпарагин | Nmasn |
| аминоизомасляная кислота | Aib | L-N-метиласпарагиновая к-та | Nmasp |
| аминонорморнилкарбоксилат | Norb | L-N-метилцистеин | Nmcys |
| циклогексилаланин | Chexa | L-N -метилглутамин | Nmgin |
| циклопентилаланин | Cpen | L-N-метилглутаминовая к-та | Nmglu |
| D-аланин | Dal | L-N-метилгистидин | Nmhis |
| D-аргинин | Darg | L-N-метилизолейцин | Nmile |
| D-аспарагиновая кислота | Dasp | L-N-метиллейцин | Nmleu |
| D-цистеин | Dcys | L-N-метиллизин | Nmlys |
| D-глутамин | Dgin | L-N-метилметионин | Nmmet |
| D-глутаминовая кислота | Dglu | L-N-метилнорлейцин | Nmnle |
| D-гистидин | Dhis | L-N-метилнорвалин | Nmnva |
| D-изолейцин | Dile | L-N-метилорнитин | Nmorn |
| D-лейцин | Dieu | L-N-метилфенилаланин | Nmphe |
| D-лизин | Dlys | L-N-метилпролин | Nmpro |
| D-метионин | Dmet | L-N-метилсерин | Nmser |
| D-орнитин | Dom | L-N-метилтреонин | Nmthr |
| D-фенилаланин | Dphe | L-N-метилтриптофан | Nmtrp |
| D-пролин | Dpro | L-N-метилтирозин | Nmtyr |
| D-серин | Dser | L-N-метилвалин | Nmval |
| D-треонин | Dthr | L-N-метилэтилглицин | Nmetg |
| D-триптофан | Dtrp | L-N-метил-t-бутилглицин | Nmtbug |
| D-тирозин | Dtyr | L-N-норлейцин | Nle |
| D-валин | Dval | L-норвалин | Nva |
| D-α-метилаланин |