Способ получения мезопористых наноструктурированных пленок диоксида титана и способ иммобилизации на них ферментов
Иллюстрации
Показать всеИзобретение может быть использовано в биотехнологии при иммобилизации ферментов на мезопористых наноструктурированных пленках диоксида титана с целью получения фотобиокатализаторов. Способ получения мезопористых наноструктурированных пленок диоксида титана включает нанесение на твердую подложку водосодержащей композиции на основе диоксида титана, содержащей стабилизатор и порообразующий полимер, последующую сушку и кальцинирование. Для приготовления водосодержащей композиции используют порошок нанокристаллов диоксида титана со средним размером частиц от 6 до 25 нм и с удельной поверхностью 50-300 м2/г, который смешивают со стабилизатором и подвергают ультразвуковому дезагрегированию. Затем добавляют порообразующий полимер в количестве 10-30% от массы диоксида титана и водный раствор ПАВ до массового соотношения TiO2:Н2О=1:1-10. Полученную пасту гомогенизируют ультразвуком, наносят на подложку, сушат при комнатной температуре и кальцинируют в присутствии воздуха или кислорода при температуре 400-600°С. В способе иммобилизации фермента адсорбируют фермент на поверхности полученной наноструктурированной мезопористой пленки диоксида титана в среде буферного раствора при рН меньше 8. Изобретение позволяет обеспечить толщину получаемых пленок не менее 2 мкм для иммобилизации на них достаточного количества фермента для эффективного протекания фотобиокаталитических процессов. 6 з.п. ф-лы, 6 табл, 4 ил.
Реферат
Изобретение относится к способам получения мезопористых наноструктурированных пленок диоксида титана (TiO2) и к способам иммобилизации на них ферментов с целью получения фотобиокатализаторов и может быть использовано в биотехнологии.
Исследованию процессов получения и свойств мезопористых наноструктурированных пленок TiO2 в настоящее время уделяется большое внимание, так как пленки TiO2 обеспечивают комплексным фотобиокатализаторам сочетание высокой каталитической активности и стабильности в водной среде (Beydoun D. et al., Journal of Nanoparticle, Research 1,1999, p.39-458).
Известно, что полупроводники, в частности TiO2, являются катализаторами фотохимических реакций как в дисперсном виде (на основе кристаллической модификации TiO2 анатаза) (RU 2275238, B01J 21/06, C01G 23/053, 27.04.2006; RU 2151632, B01D 53/86, B01J 21/06, 27.06.2000; RU 2259866, B01D 53/86, B01J 21/06, 10.09.2005), так и в виде тонких пленок, нанесенных на светопрозрачную подложку (стекло) (US 6939611, В32В 9/00, B01J 23/00, 06.09.2005; US 6387844, B01J 23/00, B01J 21/08, B01J 21/12, B32B 17/06, B32B 19/00, 14.05.2002). Дисперсные материалы из-за плотной структуры имеют незначительную удельную поверхность и, следовательно, низкую сорбционную и каталитическую активность. Для создания мезопористых пленок TiO2 (на прозрачных стеклянных подложках) применяют различные методы: пиролитический, плазмохимический, гидротермальный, погружения-вытягивания, тиснения-печатания, CVD-метод.
Известен способ получения мезопористых пленок WO3-TiO2, включающий перемешивание в течение 2 часов смеси WC16 и Ti(OBu)4 (тетрабутилоксид титана) в растворе порообразующего полимера в этаноле, нанесение полученного золь-геля на подложку из электропроводящего стекла, испарение растворителя на воздухе, выдерживание в течение суток при 45°С для застывания и обжиг при 350°С (Yidong Lu et al., Langmuir, 2005, v.21, No.9, p.4071-4076).
Этим способом получают композитную пленку - в ней содержатся наночастицы двух соединений: TiO2 и WO3. Метод дорогостоящий, трудно достигается толщина пленки порядка 10 мкм, к тому же эффект WO3 на иммобилизацию ферментов не известен.
В патенте US 6653356, С01G 23/047, опубл. 25.11.2003, для получения наноструктурированных пленок TiO2 осуществляют флоккулирование наночастиц TiO2 из раствора сульфата титана, которые затем диспергируют в полярном растворителе до образования золь-геля, пригодного для формирования пленки.
Данный метод получения TiO2 пленок не был разработан для целей иммобилизации на них ферментов и адсорбционные свойства полученных пленок не исследовались. Известно, что характеристики пленки, влияющие на ее адсорбционные свойства: структура пленки, размер пор, кристаллическая фаза, удельная поверхность и поверхностный заряд наночастиц, существенно зависят от метода и условий ее получения (рН среды, концентрация и природа ионов солей и примесей).
Наиболее близким к предлагаемому способу получения мезопористых наноструктурированных пленок TiO2 является способ, описанный в патенте США №6803077, B05D 3/02, B05D 1/18, опубл. 12.10.2004 (прототип). Данный способ включает следующие стадии: а) получение золь-геля TiO2; b) нанесение золь-геля TiO2 на подложку; с) обработка подложки с нанесенным покрытием при температуре 400-800°С. Указанный золь-гель TiO2 получают высокотемпературным гидролизом алкоксида титана в спиртовом растворе (этанол, пропанол, изопропанол) в присутствии стабилизатора (триэтаноламин, диэтаноламин, ацетилацетон, диэтиленгликоль, уксусная кислота, трифторуксусная кислота или их смеси) и темплата (порообразующего трехблочного сополимера эфиров этиленоксида и пропиленоксида молекулярной массы 1000-10000 при содержании в золь-геле от 5 до 35%). Концентрация алкоксида титана в растворе 0,01-3 М, молярное соотношение стабилизатора и алкоксида титана 0,05-3:1. Стадию b) (нанесение золь-геля на подложку) осуществляют методом погружения. В качестве подложки используют обычное, кварцевое или боросиликатное стекло, керамику или нержавеющую сталь. Получают пленки TiO2 толщиной от 0,01 до 2 мкм с размером пор от 2 до 50 нм.
Существенным недостатком способа-прототипа является недостаточная толщина получаемых пленок. При толщине пленок TiO2 менее 2 мкм суммарное количество иммобилизованного фермента недостаточно для эффективного использования этих пленок для целей фотокатализа, фотобиокатализа, фотоэлектрокатализа. Оптимальная толщина пористых пленок для этих целей близка к 10 мкм. Важным недостатком этого способа получения пленок является невозможность контролирования размеров наночастиц, образующих структуру пленки, так как нанокристаллы TiO2 формируются на стадии высокотемпературной обработки - кальцинирования, что приводит к широкому разбросу размеров наночастиц, уменьшению процента оптически активной кристаллической фазы TiO2 (анатаза) и относительно высокому проценту аморфной фазы, что снижает эффективность использования получаемых пленок в фотобиокаталитических процессах.
Известны способы иммобилизации ферментов путем их адсорбции на поверхности различных носителей, в том числе на поверхности твердых пористых неорганических носителей: углеродных (RU 2279475, C12N 11/14, C12N 9/26, С12Р 19/02, 10.07.2006; RU 2224020, C12N 11/14, C12N 9/26, С12Р 19/02, 20.02.2004; RU 2167197, C12N 11/14, С12Р 19/02, 20.05.2001) или минеральных (RU 2007456, C12N 11/14, А23К 1/165, 15.02.1994; RU 1473358, C12N 11/00, C12N 11/14, 20.02.2000).
Известные способы иммобилизации ферментов решают проблему повышения стабильности использованных в них ферментов, но они не позволяют получать фотобиокатализаторы.
Наиболее близким к предлагаемому способу иммобилизации ферментов на мезопористых наноструктурированных пленках TiO2 является способ иммобилизации фермента глюкоамилазы на твердом гранулированном углеродном носителе, приготовленном из технической сажи и имеющем мезопористую структуру со средним диаметром пор 300-400 Å (30-40 нм) и объемом пор 0,7-0,9 см3/г, путем адсорбции фермента на поверхности указанного мезопористого углеродного носителя при температуре 20°С в течение 18 часов в среде 0,05 М ацетатного буфера (рН 4,6) и последующей промывки буферным раствором (RU 2281328, C12N 11/14, C12N 9/26, С12Р 19/02, 10.08.2006 - прототип). Величина адсорбции глюкоамилазы составляет 8-13 мг белка на 1 г адсорбента.
Способ иммобилизации ферментов, выбранный за прототип, решает проблему повышения стабильности используемого фермента, но он не позволят получать фотобиокатализаторы.
Задачей изобретения является разработка такого способа получения мезопористых наноструктурированных пленок TiO2, который обеспечит образование мезопористой структуры из наночастиц TiO2 определенного размера, обладающей свойствами пористого фотоэлектрохимического электрода и выраженной способностью связывать ферменты. Способ должен обеспечить также толщину получаемых пленок не менее 2 мкм, что позволит иммобилизовать на них достаточное количество фермента для эффективного протекания фотобиокаталитических процессов.
Задачей изобретения является также разработка способа иммобилизации на полученных мезопористых наноструктурированных пленках TiO2 ферментов, позволяющего получать различные фотобиокатализаторы для биотехнологических нужд.
Решение поставленной задачи достигается предлагаемым способом получения мезопористых наноструктурированных пленок TiO2 на твердой подложке путем нанесения на подложку водосодержащей композиции на основе диоксида титана, включающей стабилизатор и порообразующий полимер, с последующими сушкой и кальцинированием, в котором согласно изобретению для приготовления водосодержащей композиции на основе диоксида титана используют порошок нанокристаллов диоксида титана со средним размером частиц от 6 до 25 нм и с удельной поверхностью 50-300 м2/г, который смешивают со стабилизатором и подвергают ультразвуковому дезагрегированию, затем добавляют порообразующий полимер в количестве 10-30% от массы диоксида титана и водный раствор ПАВ до массового соотношения TiO2:Н2О=1:1-10, полученную пасту гомогенизируют ультразвуком, наносят на подложку, сушат при комнатной температуре и кальцинируют в присутствии воздуха или кислорода при температуре 400-600°С.
В качестве твердой подложки можно использовать стекло, стекло с токопроводящим покрытием, керамику или металл.
В качестве стабилизатора можно использовать соединение, выбранное из группы: азотная кислота, уксусная кислота, ацетилацетон.
В качестве порообразующего полимера можно использовать полиэтиленгликоль или ацетилцеллюлозу.
Концентрация раствора ПАВ может составлять 0,1-2,0%.
Решение поставленной задачи достигается также предлагаемым способом иммобилизации фермента на поверхности твердого носителя адсорбцией в среде буферного раствора при рН меньше 8, в котором фермент адсорбируют на поверхности наноструктурированной мезопористой пленки диоксида титана, полученной из порошка нанокристаллов диоксида титана вышеописанным предлагаемым способом.
Адсорбцию фермента можно осуществлять при значениях рН буферного раствора от 5,0 до 8,0
Принципиальным отличием предлагаемого способа получения мезопористых наноструктурированных пленок TiO2 от известного (прототипа) является использование для нанесения на твердую подложку не коллоидного раствора золь-геля, а водосодержащей пасты, приготовленной из дешевых промышленных нанокристаллических порошков TiO2 с хорошо охарактеризованными свойствами (от известных производителей), что позволило исключить высокоэнергоемкую стадию гидротермального синтеза TiO2 из алкоксида титана, избежать неопределенности в размерах нанокристаллов и в свойствах кристаллической фазы и позволило получать пленки нужной толщины - до нескольких десятков микрон.
Для определения оптимальных условий осуществления заявляемого способа и их влияния на структуру и адсорбционные свойства получаемых пленок TiO2 были проведены экспериментальные исследования следующих параметров процесса:
1) тип и размер наночастиц, из которых готовилась паста для формирования пленки;
2) молекулярная масса и процентное содержание порообразующего полимера;
3) тип стабилизатора;
4) условия механической обработки препаратов частиц при приготовлении пасты;
5) условия операции кальцинирования пленки.
Исследовались известные порошки нанокристаллов TiO2 фирм Degussa, Германия (Aeroxide P25) и Таука, Япония (ТКР). Свойства порошков TiO2 приведены в таблице 1.
| Таблица 1. | ||||
| Физико-химические характеристики промышленных нанокристаллических порошков TiO2, использованных для получения пленок. | ||||
| TiO2 | Средний размер, нм | Удельная поверхность, м2/г | Кристаллическая фаза | |
| 2 | Aeroxide P25 | 25 | 50 | анатаз (85%) рутил (15%) |
| 3 | ТКР101 | 6 | 300 | анатаз (>92%) |
| 4 | ТКР 102 | 15 | 100 | анатаз (>90%) |
| 5 | ТКР 103 | 6 | 280 | анатаз (>95%) |
Все исследованные порошки позволили получать пленки с хорошими адсорбционными свойствами.
Для оценки сорбционной способности пленок использовали белки и ферменты, обладающие различными молекулярным весом, размером молекулы и изоэлектрической точкой (ИЭТ) (см. таблицу 2).
| Таблица 2. | |||
| Свойства белков и ферментов, используемых для оценки сорбционной способности мезопористых пленок TiO2 | |||
| Белок | Молекулярная масса, Да | Площадь поперечного сечения, нм2 | ИЭТ |
| Бычий сывороточный альбумин (БСА) | 66338 | 22,72 | 4,8 |
| Цитохром с (cyt с) | 12800 | 7 | 10,5 |
| Гидрогеназа (ГДГ) | 68000 | 45 | 4,2 |
| Алкоголь дегидрогеназа (АДГ) | 151000 | 5,4 | |
| Ферредоксин-NADP-редуктаза (FNR) | 34000 |
Сорбция белков на пленках осуществлялась выдерживанием пленок в водном буферном растворе белка при температуре 4°С в течение 1-12 суток. Стандартные условия: 0,05 М ТРИС буфер, рН 7.2, концентрация белка 0,1-5·10-5 М.
Оценка сорбции осуществлялась спектрофотометрически по убыли оптической плотности раствора белка, инкубированного с пленкой. Спектры поглощения регистрировали на спектрофотометре СФ-2000 в кварцевой кювете (1 см или 1 мм в зависимости от концентрации белка).
Основные исследования сорбционной способности полученных пленок были проведены при использовании БСА, молекулярный вес, размер и заряд которого близки аналогичным характеристикам фермента гидрогеназы.
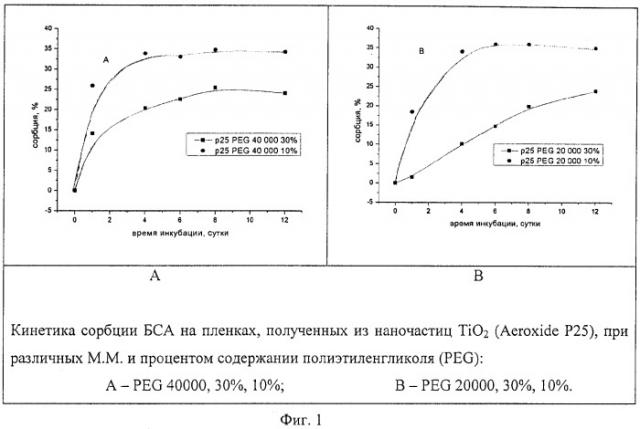
На фиг.1 представлены кинетические кривые процесса сорбции БСА на пленках, полученных из порошка Aeroxide P25 в присутствии 30% и 10% полиэтиленгликоля (ПЭГ) (от массы TiO2) с молекулярной массой 40000 и 20000.
В таблице 3 приведены результаты кинетических исследований (на примере БСА) при использовании ПЭГ с другими молекулярными массами.
| Таблица 3. | |
| Зависимость сорбционной емкости пленок, полученных из наночастиц (Aeroxide P25), от М.М. и процентного содержания ПЭГ (PEG). | |
| Тип пленки | Сорбция БСА нмоль/см2 пленки |
| Р25, PEG 40000, 30% | 1,4 |
| Р25, PEG 40000, 10% | 1,9 |
| Р25, PEG 20000, 30% | 1,6 |
| P25, PEG 20000, 10% | 2,1 |
| P25, PEG 8000, 30% | 0,7 |
| P25, PEG 8000, 10% | 0,8 |
| P25, PEG 4000, 30% | 1,5 |
| P25, PEG 4000, 10% | 1,3 |
Полученные результаты позволили установить, что оптимальной молекулярной массой ПЭГ является 20000-40000 при содержании 10-30% от массы TiO2.
Существенной стадией предлагаемого способа получения пленок является дезагрегирование наночастиц в промышленном порошке TiO2. При исследовании влияния типа стабилизатора при дезагрегировании нанокристаллических порошков TiO2 использовали ацетилацетон (АсАс), уксусную кислоту (АсОН), разбавленную азотную кислоту, тетраметиламмоний гидроксид (ТМАОН). В таблице 4 приведены полученные результаты.
| Таблица 4. | ||||
| Сорбция БСА на пленках TiO2, полученных из наночастиц различного размера, при использовании различных стабилизирующих соединений. | ||||
| Тип пленки | Стабилизирующий агент | сорбция, % * | 5 суток сорбции, нмоль/см2 | 10 суток сорбции, нмоль/см2 |
| ТКР101 | АсАс | 20,53 | 3,99 | 4,75 |
| ТКР101 | АсОН | 14,42 | 2,99 | 3,13 |
| ТКР 101 | HNO3 | 17,87 | 3,05 | 3,82 |
| ТКР 102 | АсАс | 27,12 | 4,37 | 4,68 |
| ТКР 102 | HNO3 | 21,00 | 3,17 | 2,35 |
| Р25 | АсОН | 21,94 | 3,79 | 3,92 |
| Р25 | 0,75 М HNO3 | 25,08 | 4,04 | 4,18 |
| ТКР 102 | ТМАОН | 19,12 | 2,92 | 2,97 |
| ТКР 101 | ТМАОН | 17,55 | 3,21 | 3,24 |
| Р25 | 0,1 M HNO3 | 31,35 | 4,058 | 4,19 |
| * по отношению к массе белка в исходном растворе |
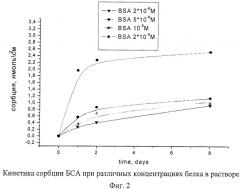
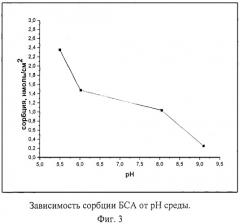
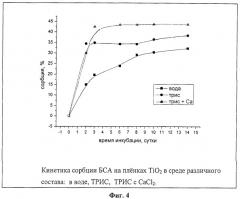
При выборе оптимальных условий иммобилизации ферментов на полученных пленках исследовалась кинетика сорбции (на примере БСА) в зависимости от концентрации белка в растворе, от состава и рН среды. Полученные результаты представлены в таблицах 5, 6 и на фиг.2-4.
Как видно из приведенных данных, оптимальной концентрацией белка при его иммобилизации на пленках TiO2 является 0,5-5-10-5 М при значении рН буферного раствора 5,0-8,0. В присутствии хлорида кальция сорбция идет быстрее.
| Таблица 5. | |
| Влияние концентрации БСА в растворе на эффективность сорбции белка*. | |
| Концентрация БСА, М | Сорбция БСА, нмоль/см2 |
| 5·10-5 | 3,18 |
| 2·10-5 | 2,53 |
| 10-5 | 1,00 |
| 5·10-6 | 1,15 |
| 2·10-6 | 0,93 |
| *Пленки выдерживались в 3 мл раствора БСА в трис-буфере (0,05 М, рН 7,2) |
| Таблица 6. | ||
| Влияние рН буферного раствора на сорбцию БСА. | ||
| рН | буфер | сорбция, нмоль/см2 |
| 5,5 | MES+трис | 2,35 |
| 6,02 | MES+трис | 1,47 |
| 8,05 | трис | 1,03 |
| 9,1 | трис | 0,25 |
Предлагаемый способ получения мезопористых наноструктурированных пленок TiO2 осуществляют следующим образом.
Навеску промышленного порошка TiO2 смешивают со стабилизатором и подвергают дезагрегированию в ультразвуковом диспергаторе мощностью от 100 Вт до 4 кВт. В качестве стабилизатора можно использовать органические соединения из группы: дикетоны, кислоты, диолы, триолы, амины, их смеси или неорганические соединения - азотную кислоту. После дезагрегирования смесь разбавляют 0,1-2,0% водным раствором ПАВ (детергент вносится для повышения смачиваемости поверхности подложки) при массовом отношении TiO2 к воде от 1:1 до 1:10. Для контролирования пористой структуры пленки используют порообразующие добавки, которыми служат известные полимеры: полиэтиленоксид (полиэтиленгликоль), полипропиленоксид, их эфиры, их сополимеры, ацетилцеллюлоза. Полимер добавляется в количестве 10-30% от массы TiO2. После внесения всех компонентов смесь гомогенизируют ультразвуком. Полученную пасту наносят на твердую подложку: стекло, стекло с токопроводящим покрытием, керамика или металл (титановая фольга, лист нержавеющей стали, никелевая фольга). Толщина слоя пасты на поверхности подложки задается прокладками, которые предварительно закрепляются на подложке. Слой пасты равномерно распределяют между прокладками, сушат при комнатной температуре и удаляют прокладки. Затем органические соединения выжигают при температуре от 400°С до 600°С. Выжигание проводится в присутствии воздуха или кислорода, предпочтительно в токе воздуха или кислорода. Полученную на твердой подложке мезопористую наноструктурированную пленку TiO2 можно использовать для иммобилизации на ней ферментов.
Приводим примеры осуществления изобретения.
А. Получение мезопористых наноструктурированных пленок TiO2.
Пример 1
2 г Промышленного порошка Aeroxide P25 (средний размер частиц 25 нм, удельная поверхность 50 м2/г) смешивают с 0,3 мл 0,1 М раствора азотной кислоты, подвергают дезагрегированию в ультразвуковом диспергаторе мощностью 300 Вт в течение 15 мин. Полученную однородную массу разбавляют 2 мл 0,1%-ного раствора ПАВ (Тритон X100) и добавляют 0,2 г полиэтиленгликоля (ПЭГ) с молекулярной массой 20000, массовое соотношение TiO2:Н2О=1:1,15. Гомогенизируют ультразвуком при мощности 600 Вт в течение 15 минут. Полученную пасту равномерно наносят на стекло с токопроводящим покрытием (SnO2) (с использованием прокладки для получения пленки заданной толщины - 10 мкм) и высушивают при комнатной температуре. Удаляют прокладку. Затем выжигают органические вещества при 450°С в течение 30 мин в токе воздуха.
Пример 2
Пленку получали аналогично примеру 1 только с использованием при дезагрегировании порошка TiO2 0,75 М азотной кислоты. Толщина пленки 10 мкм, подложка из обычного стекла.
Пример 3
2 г Промышленного порошка ТКР 102 (средний размер частиц 15 нм, удельная поверхность 100 м2/г) смешивают с 0,3 мл 0,1 М раствора азотной кислоты, подвергают дезагрегированию в ультразвуковом диспергаторе мощностью 300 Вт, 15 мин. Полученную однородную массу разбавляют 2 мл 0,1%-ного водного раствора ПАВ (Тритон X100), добавляют 0,2 г полиэтиленгликоля с молекулярной массой 20000 (массовое соотношение TiO2:Н2О=1:1,15. Гомогенизируют ультразвуком при 600 Вт в течение 15 минут. Пасту равномерно наносят на подложку из обычного стекла с использованием прокладки для получения пленки толщиной 10 мкм, высушивают при комнатной температуре, удаляют прокладку и выжигают органические вещества при 450°С в течение 30 мин в токе воздуха.
Пример 4
Пленку получали аналогично примеру 3 только с использованием в качестве стабилизатора при дезагрегировании порошка TiO2 0,3 мл 0,05 М уксусной кислоты. Толщина пленки 10 мкм, подложка из обычного стекла.
Пример 5
К 2 г Промышленного порошка ТКР 101 (средний размер частиц 6 нм, удельная поверхность 300 м2/г) добавляют 0,3 мл уксусной кислоты в концентрации 0,05 М и подвергают дезагрегированию в ультразвуковом диспергаторе мощностью 100 Вт в течение 25 мин. Разбавляют 15 мл 0,5%-ного водного раствора ПАВ (Тритон XI00) и добавляют 0,6 г промышленной ацетилцеллюлозы, массовое соотношение TiO2:Н2О=1:7,65. Обрабатывают в ультразвуковом диспергаторе мощностью 600 Вт в течение 25 мин. Полученную пасту равномерно наносят на подложку из кварцевого стекла (с использованием прокладки для получения пленки толщиной 4 мкм), высушивают при комнатной температуре, удаляют прокладку и выжигают органические вещества при 500°С в течение 20 мин в токе кислорода.
Пример 6
2 г Промышленного порошка ТКР 103 (средний размер частиц 6 нм, удельная поверхность 280 м2/г) смешивают с 0,4 мл ацетилацетона, подвергают дезагрегированию в ультразвуковом диспергаторе мощностью 100 Вт, 25 мин. Полученную однородную массу разбавляют 4 мл 2%-ного водного раствора ПАВ (Тритон X100), добавляют 0,4 г полиэтиленгликоля с молекулярной массой 40000, массовое соотношение TiO2:Н2О=1:2. Гомогенизируют ультразвуком (600 Вт, 15 минут). Пасту равномерно наносят на керамическую подложку с использованием прокладки для получения пленки толщиной 8 мкм, высушивают при комнатной температуре. Органические вещества выжигают в течение 60 мин при 400°С в токе воздуха.
Пример 7
2 г Промышленного порошка Aeroxide P25 (средний размер частиц 25 нм, удельная поверхность 50 м2/г) смешивают с 0,4 мл 0,1 М азотной кислоты, подвергают дезагрегированию в ультразвуковом диспергаторе мощностью 100 Вт в течение 25 мин, разбавляют 19 мл 1%-ного водного раствора ПАВ (Тритон X100), добавляют 0,6 г полиэтиленгликоля с молекулярной массой 20 000, массовое соотношение TiO2:Н2О=1:9,7. Гомогенизируют ультразвуком (600 Вт, 30 мин). Пасту равномерно наносят на титановую подложку с использованием прокладки для получения пленки толщиной 8 мкм, высушивают при комнатной температуре, органические вещества выжигают в течение 30 мин при 600°С в токе воздуха.
Б. Иммобилизация ферментов на мезопористых наноструктурированных пленках TiO2.
Пример 8
Иммобилизацию гидрогеназы на пленке TiO2 толщиной 10 мкм и площадью 2,2 см, полученной по примеру 1 (подложка из стекла с токопроводящим покрытием) осуществляли адсорбцией в среде буферного раствора (ТРИС, 0,05 М, рН 8,0) при концентрации гидрогеназы 5,5·10-5 М при температуре 4°С в течение 5 суток. Полученный фотобиокатализатор промывали буферным раствором от остатков гидрогеназы. Величина адсорбции гидрогеназы составила 1,08 нмоль/см2 пленки (0,073 мг/см2).
Пример 9
Иммобилизацию гидрогеназы на пленке TiO2 толщиной 10 мкм и площадью 2,2 см2, полученной по примеру 2 (подложка из обычного стекла), осуществляли адсорбцией в среде буферного раствора (ТРИС, 0,05 М, рН 8,0) при концентрации гидрогеназы 0,55·10-5 М при температуре 4°С в течение 5 суток. Полученный фотобиокатализатор промывали буферным раствором от остатков гидрогеназы. Величина адсорбции гидрогеназы составила 2,3 нмоль/см2 пленки (0,156 мг/см2).
Пример 10.
Иммобилизацию гидрогеназы на пленке TiO2 толщиной 10 мкм и площадью 3,0 см2, полученной по примеру 2 (подложка из обычного стекла), осуществляли адсорбцией в среде буферного раствора (MES+ТРИС, 0,05 М, рН 5,5) при концентрации гидрогеназы 2·10-5 М при температуре 4°С в течение 5 суток. Полученный фотобиокатализатор промывали буферным раствором от остатков гидрогеназы. Величина адсорбции гидрогеназы составила 2,35 нмоль/см2 пленки (0,159 мг/см2).
Пример 11
Иммобилизацию гидрогеназы на пленке TiO2 толщиной 10 мкм и площадью 1,6 см2, полученной по примеру 3, осуществляли адсорбцией в среде буферного раствора (ТРИС, 0,05 М, рН 7,2) при концентрации гидрогеназы 5,5·10-6 М при температуре 4°С в течение 8 суток. Полученный фотобиокатализатор промывали буферным раствором от остатков гидрогеназы. Величина адсорбции гидрогеназы составила 0,156 нмоль/см2 пленки (0,011 мг/см2).
Пример 12
Иммобилизацию гидрогеназы на пленке TiO2 толщиной 10 мкм и площадью 2,07 см2, полученной по примеру 4, осуществляли адсорбцией в среде буферного раствора (ТРИС, 0,05 М, рН 7,2), при концентрации гидрогеназы 5,5·10-5 М при температуре 4°С в течение 2 суток. Полученный фотобиокатализатор промывали буферным раствором от остатков гидрогеназы. Величина адсорбции гидрогеназы составила 0,135 нмоль/см2 пленки (0,008 мг/см2).
Пример 13
Иммобилизацию алкогольдегидрогеназы на пленке TiO2 толщиной 4 мкм и площадью 2,01 см2, полученной по примеру 5, осуществляли адсорбцией в среде буферного раствора (ТРИС, 0,05 М, рН 7,2) при концентрации фермента 5·10-5 М при температуре 4°С в течение 8 суток, промывали буферным раствором. Величина адсорбции алкогольдегидрогеназы составила 1,18 нмоль/см2 пленки (0,178 мг/см2).
Пример 14
Иммобилизацию ферредоксин-NADP-редуктазы на пленке TiO2 толщиной 8 мкм и площадью 1,08 см2, полученной по примеру 6, осуществляли адсорбцией в среде буферного раствора (ТРИС, 0,05 М, рН 7,2) при концентрации фермента 2·10-5 М при температуре 4°С в течение 8 суток, промывали буферным раствором. Величина адсорбции ферредоксин-NADP-редуктазы составила 1,33 нмоль/см2 пленки (0,045 мг/см2).
Пример 15
Иммобилизацию ферредоксин-NADP-редуктазы на пленке TiO2 толщиной 8 мкм и площадью 1,06 см2, полученной по примеру 7, осуществляли адсорбцией в среде буферного раствора (ТРИС, 0,05 М, рН 7,2) при концентрации фермента 2·10-5 М при температуре 4°С в течение 8 суток, промывали буферным раствором. Величина адсорбции ферредоксин-NADP-редуктазы составила 1,35 нмоль/см2 пленки (0,046 мг/см2).
Таким образом, предложен способ получения мезопористых наноструктурированных пленок TiO2, обладающих ярковыраженной способностью связывать ферменты. Способ обеспечивает толщину получаемых пленок от 2 мкм до 10 мкм, что позволяет иммобилизовать на пористых пленках TiO2 достаточное количество фермента для эффективного протекания фотобиокаталитических процессов. Разработан способ иммобилизации на полученных мезопористых наноструктурированных пленках TiO2 ферментов, позволяющий получать различные фотобиокатализаторы для биотехнологических нужд.
1. Способ получения мезопористых наноструктурированных пленок диоксида титана на твердой подложке путем нанесения на подложку водосодержащей композиции на основе диоксида титана, включающей стабилизатор и порообразующий полимер, с последующими сушкой и кальцинированием, отличающийся тем, что для приготовления водосодержащей композиции на основе диоксида титана используют порошок нанокристаллов диоксида титана со средним размером частиц от 6 до 25 нм и с удельной поверхностью 50-300 м2/г, который смешивают со стабилизатором и подвергают ультразвуковому дезагрегированию, затем добавляют порообразующий полимер в количестве 10-30% от массы диоксида титана и водный раствор ПАВ до массового соотношения TiO2:Н2О=1:1-10, полученную пасту гомогенизируют ультразвуком, наносят на подложку, сушат при комнатной температуре и кальцинируют в присутствии воздуха или кислорода при температуре 400-600°С.
2. Способ по п.1, отличающийся тем, что в качестве твердой подложки используют стекло, стекло с токопроводящим покрытием, керамику или металл.
3. Способ по п.1, отличающийся тем, что в качестве стабилизатора используют соединение, выбранное из группы: азотная кислота, уксусная кислота, ацетилацетон.
4. Способ по п.1, отличающийся тем, что в качестве порообразующего полимера используют полиэтиленгликоль или ацетилцеллюлозу.
5. Способ по п.1, отличающийся тем, что используют 0,1-2,0%-ный раствор ПАВ.
6. Способ иммобилизации фермента на поверхности твердого носителя адсорбцией в среде буферного раствора при рН меньше 8, отличающийся тем, что фермент адсорбируют на поверхности наноструктуриванной мезопористой пленки диоксида титана, полученной из порошка нанокристаллов диоксида титана способом по любому из пп.1-5.
7. Способ иммобилизации фермента по п.6, отличающийся тем, что адсорбцию фермента осуществляют при значениях рН буферного раствора от 5,0 до 8,0.