Применение циклических биоизостеров производных пуриновой системы для лечения расстройств, вызванных нарушениями нитрергической и дофаминергической систем
Иллюстрации
Показать всеИзобретение относится к применению в медицине или ветеринарии соединений, имеющих общую структурную формулу
R1=-H, -NH2, -Br, -Cl, -ОН, -СООН,
B=-N=, -CH=, Z=-CH=, -N=,
A=-N= при B=-N=, Z=-CH-,
A=-CH- при B=-N=, Z=-CH-,
A=-CH- при B=-N=, Z=-N=,
A=-CH- при В=-СН=, Z=-CH=,
A=-CH= при В=-СН=, Z=-N=.
Структуры приведенной формулы активны в отношении нитрергической и дофаминергической систем организма млекопитающего, включая человека. Данные соединения могут быть использованы в качестве нейропротекторов, для улучшения когнитивной функции и нормализации психофизиологического состояния, для лечения последствий, вызванных злоупотреблением веществами, а также для лечения широкого спектра заболеваний, включающих нервно-психические, сердечно-сосудистые, иммунные, воспалительные и гастроинтестинальные расстройства. Технический результат - применение известных и новых соединений для воздействия на нитрергическую и дофаминергическую системы в лечебных целях. 12 з.п. ф-лы, 4 ил., 3 табл.
Реферат
Область техники
Изобретение относится к медицине, в частности к лекарственным средствам, обладающим направленным действием на важнейшие медиаторные системы организма, в частности для лечения различных заболеваний, связанных с нарушениями нитрергической и дофаминергической систем организма. К таким расстройствам относятся неврологические, нервно-психические и сердечно-сосудистые заболевания и расстройства, вызванные злоупотреблением веществами, в частности наркотиками, нарушения когнитивной функции и психофизиологического состояния.
Предшествующий уровень техники
Известно, что целый ряд заболеваний нервной системы и сердечно-сосудистых заболеваний, в частности злоупотребление веществами - наркотиками, алкоголем, никотином и другими веществами, а также различные психические расстройства связаны с нарушением функционирования нейромедиаторных систем. Состояние этих важных систем в существенной степени обусловливает психофизиологическое состояние человека и практически все функции центральной и периферической нервной системы в норме и при патологии. К этим системам, в частности, относятся нитрергическая и дофаминергическая системы.
Оксид азота NO - низкомолекулярный газ свободнорадикальной природы - легко проникает через клеточные мембраны и компоненты межклеточного вещества, выполняя при этом важную роль в самых различных физиологических процессах. Влияние NO на состояние клетки в значительной степени зависит от количества газа. В небольших количествах, продуцируемых в основном нейрональной и эндотелиальной изоформами NO-синтазы, действие NO в основном связано с влиянием на гемовую группу растворимой формы фермента гуанилатциклазы. Активированный фермент синтезирует циклический гуанозин монофосфат (далее цГМФ), который регулирует работу мембранных ионных каналов, процессы фосфорилирования белков, активность фосфодиэстеразы и другие реакции. В больших концентрациях, продуцируемых макрофагальной изоформой NO-синтазы, NO может оказывать на клетки токсический эффект, связанный как с прямым действием на Fe-содержащие ферменты, так и с образованием сильного окислителя - свободнорадикального соединения пероксинитрита (ONOO-), который образуется при взаимодействии NO с супероксидрадикалом (О2 -). Токсический эффект оксида азота проявляется прежде всего в ингибировании митохондриальных ферментов, что приводит к снижению выработки аденозинтрифосфата (далее АТФ), а также ферментов, участвующих в репликации ДНК. Способность пероксинитрита и непосредственно NO повреждать ДНК приводит к активации защитных механизмов, в частности активации фермента поли(АДФ-рибоза) синтетазы, что, в свою очередь, приводит к снижению уровня АТФ и может приводить к гибели клетки.
NO синтезируется в клетке из L-аргинина ферментом NO-синтазой (далее NOC), превращающим L-аргинин в NO и цитруллин. Этот синтетический путь реализуется, в частности, в сердечно-сосудистой и центральной нервной системе (далее ЦНС), где NO выполняет функцию сигнальной молекулы, включая нейромедиаторную функцию. Нейромедиаторная функция NO заключается в том, что он синтезируется при возбуждении нейрона и, диффундируя в соседние клетки, активизирует в них образование цГМФ, способного влиять на проводимость ионных каналов, и таким образом, изменять электрогенез нейронов. Наряду с этим NO в центральной нервной системе осуществляет новый, не синаптический и не опосредованный рецепторами, путь межнейронных коммуникаций (Kiss J.P., Vizi E.S., Nitric oxide: a novel link between synaptic and nonsynaptic transmission. Trends Neurosci., 2001, Apr., 24 (4): 211-5).
Влияние нитрергической системы на функции центральной нервной системы осуществляется как непосредственно, так и опосредованно через другие нейромедиаторные системы. Например, глутамат и его рецепторы опосредуют важнейшие функции центральной нервной системы, включая память, а также влияют на развитие депрессии и антидепрессантную активность. NO и синтаза оксида азота являются важными компонентами системы передачи сигнала в глутаматергическом синапсе (Paul I.A., Skolnick P. Glutamate and depression: clinical and preclinical studies. Ann. N Y Acad. Sci., 2003, Nov; 1003: 250-72). Показано, что активность моноаминоксидазы - ключевого фермента метаболизма моноаминов в мозге связана с количеством NO в клетке (Girgin Sagin F., Sozmen E.Y., Ersoz В., Mentes G. Link between monoamine oxidase and nitric oxide. Neurotoxicology, 2004, Jan., 25 (1-2): 91-9).
NO влияет на функцию моноаминергических транспортеров (Vizi E.S. Role of high-affinity receptors and membrane transporters in nonsynaptic communication and drug action in the central nervous system. Pharmacol. Rev., 2000, Mar., 52 (1): 63-89). NO облегчает высвобождение многих моноаминов, особенно дофамина, а также в случае необходимости блокирует пресинаптический обратный захват дофамина. Таким образом, NO увеличивает продолжительность жизни дофамина в синапсе. В связи с участием дофамина в двигательных и психологических процессах нитрергические влияния на эти процессы привлекают все большее внимание (Liu Y. Nitric oxide influences dopaminergic processes. Adv. Neuroimmunol., 1996, 6 (3): 259-64).
NO опосредует многие поведенческие и нейроэндокринные реакции организма, в частности агрессивное и импульсивное поведение. NO играет важную роль в функционировании серотониновых рецепторов мозга (Chiavegatto S., Nelson R.J. Interaction of nitric oxide and serotonin in aggressive behavior. Horm. Behav., 2003, Sep., 44 (3): 233-41). Моноаминергические системы и система NO гипоталамуса, лимбических и стволовых структур принимают участие в регуляции полового поведения, контролируют предпочтение партнера, сексуальное желание, эрекцию, копуляцию, эякуляцию, организм и сексуальное удовлетворение) (Pfaus J.G. Neurobiology of sexual behavior. Curr. Opin. Neurobiol., 1999, Dec., 9 (6): 751-8).
Известно, что NO выполняет важную роль в формировании зависимости от различных препаратов, включая опиоиды, этанол, психостимуляторы и никотин. В частности, NO принимает участие в проявлении и развитии симптомов отмены наркотического вещества. Например, активизация опиатного рецептора μ3 сопровождается высвобождением NO в клетках эндотелия, гранулоцитах, моноцитах и микроглии (Stefano G.B. Autoimmunovascular regulation: morphine and anandamide and ancondamide stimulated nitric oxide release. J.Neuroimmunol., 1998, Mar., 15, 83 (1-2): 70-6), NO играет важную роль в развитии зависимости от соединений различных классов, вызывающих зависимость. Таким образом, модуляция системы NO может быть потенциальной терапевтической мишенью для лечения зависимостей разного рода (Tayfun Uzbay I., Oglesby M.W. Nitric oxide and substance dependence. Neurosci. Biobehav. Rev., 2001, Jan., 25 (1): 43-52).
NO участвует в регуляции нейротрансмиссии в центральной нервной системе, в частности, опосредуя несинаптические взаимодействия, регулируя моноаминергические системы - дофаминергическую, норадренергическую. Таким образом, дисфункция системы NO непосредственно связана с основными нейропсихиатрическими заболеваниями, например депрессией, болезнью Паркинсона и другими (Kiss J.P. Role of nitric oxide in the regulation of monoaminergic neurotransmission. Brain Res. Bull., 2000, Aug., 52 (6): 459-66).
Повышенный уровень моноаминоксидазы, окислительный стресс, эксайтотоксичность и избыточный синтез NO характерны для нейродегенеративных заболеваний, таких как болезнь Альцгеймера и болезнь Паркинсона, инсульт и другие (Mandel S., Grunblatt E., Riederer P., Gerlach M., Levites Y., Youdim M.B. Neuroprotective strategies in Parkinson's disease: an update on progress. CNS Drugs, 2003, 17 (10): 729-62).
В основе развития зависимостей и психозов лежит поведенческая сенситизация, опосредованная активацией дофаминовых рецепторов D1, а также NMDA-рецепторов с последующим повышением активности NOC (Ujike H. Advanced findings on the molecular mechanisms for behavioral sensitization to psychostimulants. Nippon Yakurigaku Zasshi., 2001, Jan., 117 (1): 5-12).
Избыточное высвобождение NO из кровеносных сосудов, периваскулярных нервных окончаний или мозга считают молекулярным механизмом, запускающим спонтанные боли при мигрени (Olesen J., Jansen-Olesen I. Nitric oxide mechanisms in migraine. Pathol. Biol., Paris, 2000, Sep., 48 (7): 648-57).
Дофамин (далее DA) - важнейший нейромедиатор и нейромодулятор, который играет важную роль в организме. В центральной нервной системе DA участвует в контроле движения, когнитивных функций, эмоциональности, нейроэндокринной секреции и функции клеток сетчатки. На периферии DA участвует в регуляции гомеостаза, сосудистого тонуса и секреции гормонов. В центральной нервной системе дофаминовые рецепторы широко представлены в различных областях мозга (Missale С., Nash S.R., Robinson S.W., Jaber M., Caron M.G. Dopamine receptors: from structure to function. Physiol. Rev., 1998, Jan., 78 (1): 189-225). Различные физиологические функции DA опосредованы, по крайней мере, пятью семействами рецепторов DA: D1-D5. Дисфункция этих рецепторов наблюдается при различных расстройствах и заболеваниях центральной нервной системы, в частности болезни Паркинсона (Zawilska J.B. Dopamine receptors-structure, characterization and function. Postepy, Hig. Med. Dosw., 2003, 57 (3): 293-322).
Дофаминовый сигналинг в определенных отделах мозга является ключевым элементом развития наркотической зависимости (Fagen Z.M., Mansvelder H.D., Keath J.R., Mc.Gehee D.S. Short - and long-term modulation of synaptic inputs to brain reward areas by nicotine. Ann., NY Acad. Sci., 2003, Nov., 1003: 185-95). Взаимодействие с рецепторами DA лежит в основе острых эффектов амфетамина и кокаина (Ujike H. Molecular biology of drug dependence and behavioral sensitization. Seishin Shinkeigaku Zasshi., 2002, 104 (11): 1055-68; Wolf M.E., Mangiavacchi S., Sun X. Mechanisms by which dopamine receptors may influence synaptic plasticity. Ann. NY Acad. Sci., 2003, Nov., 1003: 241-9). Дофаминовые агонисты опосредуют зависимость от алкоголя, никотина и стимуляторов (Kosten T.R., George T.P., Kosten T.A. The potential of dopamine agonists in drug addiction. Expert Opin. Investig. Drugs, 2002, Apr., 11 (4): 491-9).
Существует гипотеза, что нарушения дофаминергической системы лежат в основе шизофрении (Pearlson G.D., Neurobiology of schizophrenia. Ann. Neurol., 2000, Oct., 48 (4): 556-66). Дофаминовая гипотеза шизофрении постулирует дисбаланс корковой/подкорковой дофаминовой системы и нарушения функционирования дофаминовых рецепторов D1 (Abi-Dargham A., Moore H. Prefrontal DA transmission at D1 receptors and the pathology of schizophrenia. Neuroscientist, 2003, Oct., 9 (5): 404-16). Наряду с шизофренией этиология и других психотических заболеваний связана с нарушением регуляции дофаминовой системы мозга (Conley R.R., Kelly D.L. Current status of antipsychotic treatment. Curr. Drug Target CNS. Neurol. Disord., 2002, Apr., 1 (2): 123-8).
Дофаминовые механизмы опосредуют этиологию и проявления тревожности (Taylor D.P., Riblet L.A., Stanton H.C., Eison A.S., Eison M.S., Temple DL Jr., Dopamine and antianxiety activity. Pharmacol. Biochem. Behav., 1982, 17, Suppl. 1: 25-35), и многие препараты с антипсихотическим действием модулируют активность дофаминовых рецепторов D2 (Kapur S., Mamo D. Half a century of antipsychotics and still a central role for dopamine D2 receptors. Prog. Neuropsychopharmacol. Biol. Psychiatry, 2003, Oct., 27 (7): 1081-90).
Таким образом, в развитии многих патологий нарушения нитрергической системы непосредственно связаны с нарушениями дофаминергической системы. Эти патологии включают химические зависимости - расстройства, вызванные злоупотреблением веществами, такие как зависимости от наркотиков, алкоголя и никотина, нарушения сна, сексуальные расстройства, включая сексуальные дисфункции, гастроинтестинальные нарушения, психозы, аффективные расстройства, неорганические психозы, расстройства личности, психиатрические расстройства настроения, шизофрению и шизоаффективные расстройства, полидипсию, биполярные расстройства, дисфорическую манию, тревожность и связанные с ней заболевания, ожирение, бактериальные инфекции центральной нервной системы, такие как менингит, нарушения обучения, нарушения памяти, болезнь Паркинсона, депрессию, экстрапирамидальные побочные эффекты нейролептиков, гипоталамо-гипофизарные расстройства, сосудистые и сердечно-сосудистые заболевания, дистонию, дискинезии, гиперкинезии, деменцию, ишемию, двигательные нарушения, гипертензию и заболевания, вызванные гиперактивной иммунной системой, такие как аллергии и воспаления, у млекопитающих, включая человека.
Разработка лекарственных препаратов для лечения расстройств, вызванных нарушениями функции нитрергической и дофаминергической систем, путем нормализации этих систем является весьма актуальной задачей.
Известны трициклические амины с центральной дофаминергической активностью (US, 4612316, А), а также дигидропиридин карбоксамиды, дигидрохинолин и изохинолин карбоксамиды (US, 4727079, А), новые производные аминотриазолов и аминооксазолов (US, 4904676, А), обладающие мозг-специфичной дофаминергической активностью.
Известно применение бензотиопиранопиридинонов для индукции антипсихотической, антидепрессантной и антидофаминергической активности у теплокровных животных (US, 4547507, А).
Известно применение фенолдопам 4',8-бис-гидросульфата и его солей в качестве препаратов с про-дофаминергической активностью (US, 4600714, А).
Предложено применение (1,2,5,6-тетрагидро-1-алкил-3-пиридинил)-2-тиазоламинов и 4-(гексагидро-1-алкил-3-пиридинил)-2-тиазоламинов с предполагаемой антипсихотической активностью для лечения психозов, повышенного кровяного давления, болезни Паркинсона, гиперпролактинемии, сексуальных расстройств и акромегалии (US, 46508054, А).
Известны замещенные 1-(алкоксифенил)пиперазины - частичные агонисты дофамина, которые предложено использовать для лечения нарушений регуляции дофамина и лечения болезни Паркинсона, шизофрении и наркомании (US, 5281594, А).
Предложены производные бензимидазолона с центральной дофаминергической активностью (US 5889010, A; US, 5883094, А), а также N,N'-двухзамещенные производные бензимидазолона (US, 6521623, А), которые, возможно, могут быть применены для лечения широкого спектра заболеваний нервной системы.
В упомянутых аналогах представлены только данные связывания соответствующих соединений с рецепторами дофамина, но ни в одном случае не доказано наличие специфической терапевтической активности в моделях на животных или в клинических испытаниях.
Раскрытие изобретения
Целью настоящего изобретения является создание лекарственного средства для коррекции нарушений нитрергической и дофаминергической систем и расстройств, вызванных нарушениями этих систем, в частности заболеваний нервной и сердечно-сосудистой систем, включая расстройства, вызванные злоупотреблением веществами, нарушения когнитивной функции и психофизиологического состояния.
При создании настоящего изобретения была поставлена задача выявления биологически активных соединений, обладающих способностью нормализовать работу как нитрергической, так и дофаминергической систем, путем регулирования уровня NO в клетке за счет коррекции активности различных изоформ NO-синтазы, а также путем связывания избыточно образующихся активных форм азота, в частности пероксинитрита или NO-радикала.
В качестве биологически активных соединений, обладающих необходимыми для решения указанной задачи свойствами, были рассмотрены циклические биоизостеры производных пуриновой системы, имеющие общую структурную формулу
R1=-H, -NH2, -Br, -Cl, -ОН, -СООН,
B=-N=, -CH=, Z=-CH=, -N=,
A=-N= при B=-N=, Z=-CH-,
А=-СН= при В=-N=, Z=-СН-,
А=-СН= при В=-N=, Z=-N=,
А=-СН= при В=-СН=, Z=-СН=,
А=-СН= при В=-СН=, Z=-N=,
и их фармакологически приемлемые соли, обладающие нормализующим действием на внутриклеточные процессы, в частности на нитрергические механизмы клеток (РСТ/RU 03/00346). Авторы предположили, что конденсированные пиридазиндионовые системы обладают специфической нейротропной активностью, при этом положительный эффект связан с нормализацией указанными соединениями нарушенных функций нитрергической и дофаминергической систем.
Механизмы влияния циклических биоизостеров производных пуриновой системы на нитрергическую систему могут включать изменение рН в клетке, влияющее на активность синтазы оксида азота, непосредственное взаимодействие этих соединений с оксидом азота и пероксинитритом в клетке и вне клетки, что оказывает влияние как на нитрергическую систему в целом, так и на свободнорадикальный гомеостаз биологического объекта. Указанные соединения могут также дифференцированно модулировать активность различных изоформ синтазы оксида азота, что в значительной степени обеспечивает изменение функционального состояния клеток, органов, тканей, и, в конечном итоге, целого организма. Влияние соединений согласно изобретению на дофаминовую систему может быть оказано за счет изменения распределения электронной плотности в белковых молекулах дофаминовых рецепторов или за счет изменения свойств окружающих рецепторы мембран. Дополнительное влияние этих соединений на другие типы рецепторов, например аденозиновые, может опосредованно модулировать активность дофаминовых рецепторов.
Были исследованы производные пиридо[2,3-d]-6Н-пиридазин-5,8-диона, циклического биоизостера производных пуриновой системы, в которых пиридиновое кольцо сконденсировано с пиридазиндионовым кольцом, имеющие общую формулу
атом Li, Na, К,
R1=-Н, -NH2, -Br, -ОН, -СООН,
в частности:
7-(β-D-рибофуранозил)пиридо[2,3-d]-6Н-пиридазин-5,8-диона натриевая соль (1),
4-амино-7-(β-D-рибофуранозил)пиридо[2,3-d]-6Н-пиридазин-5,8-диона натриевая соль (2),
3-бром-7-(β-D-рибофуранозил)пиридо[2,3-d]-6Н-пиридазин-5,8-диона натриевая соль (3),
4-гидрокси-7-(β-D-рибофуранозил)пиридо[2,3-d]-6Н-пиридазин-5,8-диона динатриевая соль (4),
3-карбокси-7-(β-D-рибофуранозил)пиридо[2,3-d]-6Н-пиридазин-5,8-диона динатриевая соль (5),
пиридо[2,3-d]-6Н-пиридазин-5,8-диона литиевая соль (6),
пиридо[2,3-d]-6Н-пиридазин-5,8-диона натриевая соль (7),
пиридо[2,3-d]-6Н-пиридазин-5,8-диона калиевая соль (8).
А также были исследованы производные бензо[d]-3Н-пиридазин-1,4-диона, циклического биоизостера производных пуриновой системы, в которых бензольное кольцо сконденсировано с пиридазиндионовым кольцом, имеющие общую формулу
атом Li, Na, К,
R1=-Н, -NH2, -Cl, -ОН, -СООН,
в частности:
2-(β-D-рибофуранозил)бензо[d]-3Н-пиридазин-1,4-диона натриевая соль (9),
5-амино-2-(β-D-рибофуранозил)бензо[d]-3Н-пиридазин-1,4-диона натриевая соль (10),
6-амино-2-(β-D-рибофуранозил)бензо[d]-3Н-пиридазин-1,4-диона натриевая соль (11),
5-хлор-2-(β-D-рибофуранозил)бензо[d]-3Н-пиридазин-1,4-диона натриевая соль (12),
5-гидрокси-2-(β-D-рибофуранозил)бензо[d]-3Н-пиридазин-1,4-диона динатриевая соль (13),
5-амино-бензо[d]-3Н-пиридазин-1,4-диона литиевая соль (14),
5-амино-бензо[d]-3Н-пиридазин-1,4-диона натриевая соль (15),
6-амино-бензо[d]-3Н-пиридазин-1,4-диона калиевая соль (16),
5-гидрокси-бензо[d]-3Н-пиридазин-1,4-диона динатриевая соль (17),
6-карбокси-бензо[d]-3Н-пиридазин-1,4-диона динатриевая соль (18).
Были также исследованы производные пиразино[2,3-d]-6Н-пиридазин-5,8-диона, циклического биоизостера производных пуриновой системы, в которых пиразиновое кольцо сконденсировано с пиридазиндионовым, имеющие общую формулу
атом Li, Na, К,
R1=-Н, -NH2, -Br, -ОН, -СООН,
в частности:
7-(β-D-рибофуранозил)пиразино[2,3-d]-6Н-пиридазин-5,8-диона натриевая соль (19),
2-амино-7-(β-D-рибофуранозил)пиразино[2,3-d]-6Н-пиридазин-5,8-диона натриевая соль (20),
3-амино-7-(β-D-рибофуранозил)пиразино[2,3-d]-6Н-пиридазин-5,8-диона натриевая соль (21),
3-бром-7-(β-D-рибофуранозил)пиразино[2,3-d]-6Н-пиридазин-5,8-диона натриевая соль (22),
2-гидрокси-7-(β-D-рибофуранозил)пиразино[2,3-d]-6Н-пиридазин-5,8-диона динатриевая соль (23),
2-карбокси-7-(β-D-рибофуранозил)пиразино[2,3-d]-6Н-пиридазин-5,8-диона динатриевая соль (24),
пиразино[2,3-d]-6Н-пиридазин-5,8-диона литиевая соль (25),
пиразино[2,3-d]-6Н-пиридазин-5,8-диона натриевая соль (26),
3-бром-пиразино[2,3-d]-6Н-пиридазин-5,8-диона калиевая соль (27),
2-амино-пиразино[2,3-d]-6Н-пиридазин-5,8-диона натриевая соль (28).
Также были исследованы производные пиримидо[4,5-d]-6Н-пиридазин-5,8-диона, циклического биоизостера производных пуриновой системы, в которой пиримидиновое кольцо сконденсировано с пиридазиндионовым кольцом, имеющие общую формулу
атом Li, Na, К,
R1=-H, -NH2, -Br, -ОН, -СООН,
в частности:
7-(β-D-рибофуранозил)пиримидо[4,5-d]-6Н-пиридазин-5,8-диона натриевая соль (29),
2-амино-7-(β-D-рибофуранозил)пиримидо[4,5-d]-6Н-пиридазин-5,8-диона натриевая соль (30),
4-амино-7-(β-D-рибофуранозил)пиримидо[4,5-d]-6Н-пиридазин-5,8-диона натриевая соль (31),
2-бром-7-(β-D-рибофуранозил)пиримидо[4,5-d]-6Н-пиридазин-5,8-диона натриевая соль (32),
4-гидрокси-7-(β-D-рибофуранозил)пиримидо[4,5-d]-6Н-пиридазин-5,8-диона натриевая соль (33),
4-карбокси-7-(β-D-рибофуранозил)пиримидо[4,5-d]-6Н-пиридазин-5,8-диона натриевая соль (34),
пиримидо[4,5-d]-6Н-пиридазин-5,8-диона литиевая соль (35),
2-амино-пиримидо[4,5-d]-6Н-пиридазин-5,8-диона натриевая соль (36),
4-бром-пиримидо[4,5-d]-6Н-пиридазин -5,8-диона калиевая соль (37).
Соединения 1-8, являющиеся производными пиридо[2,3-d]-6Н-пиридазин-5,8-диона, получали конденсацией орто-дикарбоксизамещенных пиридинов с гидразин гидратом в среде уксусной кислоты (Taguchi Hiroshi. A new fluorometric assay method for guinolinic acid. Analitic Biochemistry, 1983, 131 (1), p.194-197).
Соединения 9-18, являющиеся производными бензо [d]-3Н-пиридазин-1,4-диона (фталазиндиона), получали конденсацией орто-фталевой кислоты с гидразингидратом в среду уксусной кислоты (Huntress E.H., Stanley L.N., Parker A.S. The preparation of 3-Aminophtalhydrazide for use in the Demonstration of Chemiluminescence, J, Am. Chem. Soc., 1994, v.56, p.241-242).
Соединения 19-28, являющиеся производными пиразино[2,3-d]-6Н-пиридазин-5,8-диона, получали конденсацией орто-дикарбоксизамещенных пиразинов гидразингидратом в среде уксусной кислоты (Zyczynska - Baloniak I., Czajka R., Zinkowska E., Synthesis of Derivatives of 4-Hydroxypyrazine-[2,3-d]pyridazine-1-one. Polish Journal of Chemistry. 1978, v.52, p.2461-2465; Kormendy K., Ruff P. Pyridazines condensed with a Heteroring. Ш., Acta Chimika Hungarika. 1990, 127 (2), p.253-262). Соединения 29-37, являющиеся производными пиримидо[4,5-d]-6Н-пиридазин-5,8-диона, получали конденсацией орто-дикарбоксизамещенных пиримидинов с гидразингидратом с среде уксусной кислоты (Yurugi S., Hieda M. Studies on the synthesis of N- Heterocyclic Compounds. Chemistry, Pharmaceutic Bull., 1972, v.20 (7), p.1522-1527, ibid., p.1513-1521).
Поставленная задача была решена выявлением биологической активности указанных выше циклических биоизостеров пуриновой системы и их фармакологически приемлемых солей на нитрергические и дофаминергические механизмы клеток организма, имеющих нарушения таких систем.
В дальнейшем изобретение поясняется следующими примерами, не ограничивающими предмет изобретения, иллюстрирующими в экспериментах in vivo на моделях различных патологий эффект применения указанных соединений при расстройствах, вызванных нарушением нитрергической и дофаминергической систем организма животных.
1. Влияние соединений согласно изобретению на расстройства, вызванные морфиновой абстиненцией.
Были исследованы эффекты воздействия соединений №1, 4, 6, 10, 11, 18, 21, 24, 26, 32, 35, 37 согласно изобретению на поведенческие показатели, а также на нитрергическую систему мозга животных, у которых по известной модели, признанной также моделью героиновой абстиненции человека, было смоделировано состояние физической зависимости от морфина - морфиновой абстиненции.
Физическую зависимость от морфина моделировали на 27 группах самцов-крыс Wistar массой 250-350 г возраста 6 месяцев:
- животным группы №1 (n=7) морфин не вводили, и они являлись контролем,
- животным группы №2 (n=7) - вводили морфина гидрохлорид до достижения выраженного абстинентного синдрома,
- животным групп №3-14 (n=7) вводили одно из соединений пиридопиридазиндионового ряда - 1, или 4, или 6 согласно изобретению (группы №3, 4, 5), или одно из соединений бензопиридазиндионового ряда - 10, или 11, или 18 согласно изобретению (группы №6, 7, 8), или одно из соединений пиразинопиридазиндионового ряда - 21, или 24, или 26 согласно изобретению (группы №9, 10, 11), или одно из соединений пиримидинопиридазиндионового ряда - 32, или 35, или 37 (группы №12, 13, 14),
- животным групп №15-26 (n=7) вводили морфина гидрохлорид до создания выраженного абстинентного синдрома и затем: в каждой группе - по одному из соединений согласно изобретению по схеме, аналогичной для групп №3-14.
Инъекции морфина гидрохлорида осуществляли внутрибрюшинно по модифицированной схеме: в течение 6 дней два раза в сутки (в 10 ч 00 и 20 ч 00) в возрастающих дозах от 10-100 мг/кг: 1 день - по 10 мг/кг, 2 день - по 20 мг/кг, 3 день - по 40 мг/кг, 4 день - по 60 мг/кг, 5 день - по 80 мг/кг, 6 день - по 100 мг/кг. Инъекции соединений согласно изобретению проводили трижды внутримышечно в дозе 20 мг/кг в течение суток, следующих за последней дозой морфина. (Dum J, Blasig J, Herz A: Buprenorphine: demonstration of physical dependence liability. Eur. J. Pharmacol., 1981, V.70, p.293-300.; Rahman S., Ali Khan R., Kumar A. Experimental study of the morphine de-addiction properties of Delphinium denudatum Wall, BMC Complement Altern. Med., 2002, V.29, p.1-6). Через 36 часов после последней инъекции в группах оценивали двигательные и вегетативные признаки поведения животных по признакам, являющимся специфическими признаками абстиненции, в тесте «открытое поле» (арена диаметром 120 см и высотой стенок 40 см).
Выраженность абстинентного синдрома оценивали в течение 5 мин по ряду специфических для синдрома отмены двигательных признаков: отряхивание по типу «мокрой собаки», корчи, жевание, скрип зубами, встряхивание передними лапами, и вегетативных признаков: диарея, птоз, ринорея, пилоэрекция, диспноэ, писк при дотрагивании, агрессивность (Blasig J., Herz A., Reinhold К., Zieglgansberger S. Development of physical dependence on morphine in respect to time and dosage and quantification of the precipitated withdrawal syndrome in rats. Psychopharmacologia, Berlin, 1973, V.33, p.19-38; Rahman S., Alt Khan R., Kumar A. Experimental study of the morphine de-addiction properties of Delphinium denudatum Wall, BMC Complement Altern. Med., 2002, V.29, p.1-6.). Наблюдаемые признаки регистрировали количественно (если это было возможно) с дальнейшим присвоением каждому признаку индекса (зависящего от специфичности признака) и подсчетом суммы баллов. Выраженность абстинентного синдрома представляли в виде суммы баллов. Результаты обрабатывали с применением непараметрического статистического анализа с использованием теста Манна-Уитни.
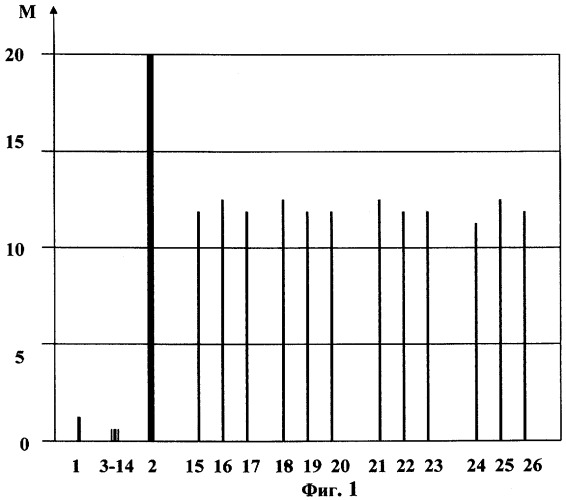
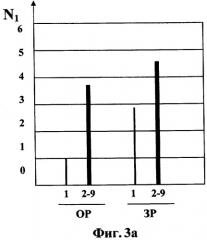
На Фиг.1 показана диаграмма влияния морфина и соединений согласно изобретению на поведенческие реакции изучаемых животных, на которой влияние оценено по усредненной для ряда соединений сумме М баллов на основе указанных индексов признаков абстинентного синдрома для животных групп №1-27.
В табл.1 приведены усредненные относительные данные.
| Таблица 1Влияние соединений согласно изобретению на развитие морфиновой абстиненции | ||||||
| Специфические признаки абстиненции | Индекс | Достоверные различия (критерий Хигреч - квадрат) в проявлении признаков абстиненции | ||||
| Контроль - морфин | Морфин-(Морфин + соединение 1, или 4, или 6) | Морфин-(Морфин + соединение 10, или 11,или 18) | Морфин-(морфин + соединение 21, или 24,или 26) | Морфин-(морфин + соединение 32, или 35, или 37) | ||
| отряхивание «мокрой собаки» | 2 | 0,0002 | 1,0000 | 0,7562 | 0,7821 | 1,0000 |
| корчи | 2 | 0,0507 | 0,7821 | 0,7546 | 0,3456 | 0,5578 |
| жевание | 2 | 0,0308 | 0,1888 | 0,1032 | 0,1975 | 0,1888 |
| скрип зубами | 2 | 0,1266 | 0,7144 | 0,8652 | 0,2994 | 0,7003 |
| встряхивание передними лапами | 2 | 0,0180 | 0,7821 | 0,8217 | 0,6745 | 0,9321 |
| писк при дотрагивании | 1 | 0,0053 | 0,1888 | 0,1342 | 0,1968, | 0,2035 |
| диарея | 1 | 0,0075 | 0,0046 | 0,0032 | 0,0067 | 0,0001 |
| птоз | 2 | 0,0053 | 0,0201 | 0,0320 | 0,0105 | 0,0232 |
| ринорея | 3 | 0,2994 | 0,3017 | 0,4032 | 0,2131 | 0,2935 |
| пилоэрекция | 2 | 0,5770 | 0,1847 | 0,2567 | 0,2567 | 0,2345 |
| диспноэ | 2 | 0,0053 | 0,0722 | 0,0834 | 0,0567 | 0,0685 |
| агрессивность | 1 | 0,5770 | 0,8327 | 0,8456 | 0,7921 | 0,8456 |
Из табл.1 видно, что из признаков, характеризующих развитие абстинентного синдрома, соединения согласно изобретению наиболее эффективно купировали диарею, птоз и диспноэ. При этом они влияли и на судорожную активность, вызванную отменой морфина.
Таким образом, удалось выявить определенные компоненты морфиновой абстиненции, чувствительные к коррекции соединениями согласно изобретению.
2. Влияние соединений согласно изобретению на нитрергические показатели в мозге.
2.1. Получение материала для биохимических исследований
После вышеописанных экспериментов у крыс изымали мозг и сразу помещали их в ледяной 0,9%-ный раствор хлорида натрия. Из мозга после охлаждения выделяли следующие структуры: кору больших полушарий, гиппокамп, средний мозг, стриатум, ствол мозга, гипоталамус и мозжечок. Выделенную ткань гомогенизировали в гомогенизаторе Potter S в течение 3 мин при 1500 об/мин в 4-5 объемах 20 мМ HEPES (рН 7,5) при 4°С. Супернатанты центрифугировали 30 мин при 11000 g при 4°С, и часть полученных супернатантов отбирали для определения нитратов и нитритов (NOx -), а в оставшуюся часть добавляли охлажденный 20 мМ HEPES (рН 7,5), содержащий 0,5 мМ этилендиаминтетраацетат (EDTA), 1 мМ дитиотреитол (DDT), 1 мМ фенилметилсульфонилфторид (FMSF), апротинин и лейпептин в концентрации по 5 мкг/мл, и использовали для определения активности фермента синтазы оксида азота (NOC).
2.2. Определение нитратов/нитритов (NOx -)
Для оценки интенсивности метаболизма оксида азота крыс проводили количественное определение стабильных метаболитов оксида азота - нитритов и нитратов (NOx -) флюориметрическим методом по интенсивности флюоресценции нафтотриазола, продукта реакции 2,3-диаминонафталина (DAN) и нитрита в кислой среде (Misko Т.К., Schilling R.J., Salvemini D. et al. A fluorometric assay for the measurement of nitrite in biological samples. Anal. Biochem., 1993, V.214, p.11-16) с модификациями (Lei В., Adachi N., Nagaro Т., Arai Т. Measurement of total nitric oxide metabolite (NO(x)(-)) levels in vivo. Brain, Res. Protoc., 1999, V.4, p.415-419).
Депротеинизированные при 100°С супернатанты мозга помещали в нитрит-регенерирующую систему, содержащую 0,125 Ед/мл нитратредуктазы, 25 мкМ NADFN и 25 мкМ FAD, приготовленных в 20 мМ Трис-HCl буфере рН 7,6 и инкубировали 30 мин при 37°С. Для окисления NADFN использовали систему лактатдегидрогеназа (LDG)/пируват. Затем добавляли 316,0 мкМ раствора ДАН в 0,62 М HCl и инкубировали 10 мин в темноте. Для стабилизации флюоресценции образовавшегося нафтотриазола добавляли 280 мМ NaOH. Интенсивность флюоресценции измеряли на спектрофлюориметре Hitachi F-3000 при длине волны возбуждения 365 нм и эмиссии 405 нм. Для расчета концентрации NOx - в мозге был использован стандартный раствор нитрата натрия. Концентрацию NOx - выражали в нмоль/мг белка.
2.3. Определение активности синтазы оксида азота
Активность синтазы оксида азота (NOC) определяли радиометрическим методом по скорости накопления L-цитруллина в реакции окисления [3H]L-аргинина, катализируемой NOC (Bredt and Snyder. Nitric oxide mediates glutamate-linked enhancement of cGMP levels in the cerebellum. Proc. Natl. Acad. Sci., USA, 1989, V.86, p.9030-9033). Образование L-цитруллина в этой реакции эквивалентно биосинтезу оксида азота.
Реакцию инициировали добавлением супернатанта мозга в реакционную среду, содержащую 2 мкКи/мл [3H]L-аргинина, 20 мМ HEPES (рН 7.4), 0,2 мМ CaCl2 5 мкМ FAD, 5 мкМ ФМН, 1 мМ NADFN, 50 мкМ ВН4 при исследовании супернатантов мозга. После 15-60 минут инкубации при 37°С в образцы добавляли суспензию Dowex 50WX8-400 (Na+-форма), которая сорбирует непрореагировавший [3H]L-аргинин, но не [3H]L-цитруллин. После сорбции радиоактивность образцов определяли на сцинцилляционном счетчике SL-4000 ("Intertechnique"). Активность Са2+-зависимой и Са2+-независимой изоформ NOC определяли по разнице скоростей образования [3H]L-цитруллина в трех параллельных образцах, содержащих 2 мМ EDTA (хелатор Са2+), 2 мМ EDTA+ 2 мМ L-NAME (ингибитор всех изоформ NOC) и без ингибиторов. Активность фермента выражали в пмоль [3H]L-цитруллина, накопленного за 1 мин на мг белка в супернатанте.
2.4. Количественное определение белка
Содержание белка в пробах определяли по методу Бредфорда (Bradford М. М. А rapid and sensitive method for quantitation of microgram quantities of protein using the principle of protein binding. Anal. Biochem., 1976, V.72, p.248-254) с использованием красителя Кумасси голубого. Статистический анализ проводили методами, адекватными для конкретной выборки. Данные представлены в виде среднего ± ошибка среднего.
| Таблица 2Влияние морфина и соединений согласно изобретению на показатели нитрергической системы в мозге | |||||||
| Показатель в отделе мозга | Группа №1 (контроль) | Группа №2 (морфин) | Группы №3-14 (Соединение из группы 1, 4, 6, 10, 11, 18, 21, 24, 26, 32, 35, 37) | Группы №15-17 (Морфин + соединение 1, или 4, или 6 | Группы №18-20 (Морфин + соединение 10, или 11, или 18) | Группы №21-23 (Морфин + соединение 21, или 24, или 26) | Группы №24-27 (Морфин + соединение 32, или 35, или 37) |
| Нитриты, нмоль/мг белка: | |||||||
| кора больших полушарий | 4,63±0,29 | 5,31±0,29 | 4,31±0,37 | 4,72±0,37 | 4,93±0,39 | 4,62±0,27 | 4,84±0,31 |
| мозжечок | 6,37±0,64 | 6,07±0,42 | 6,66±0,63 | 5,46±0,44 | 5,85±0,47 | 5,76±0,49 | 5,93±0,54 |
| ствол | 8,24±1,02 | 7,63±0,96 | 6,31±0,58 | 6,57±0,72 | 6,99±0,82 | 7,07±0,85 | 6,87±0,81 |
| стриатум | 7,25±0,66 | 4,92±0,43 | 6,11±0,29 | 3,57±0,42 | 3,57±0,42 | 3,57±0,42 | 3,57±0,42 |
| гиппокамп | 4,39±0,23 | 6,45±0,69 | 6,47±0,72 | 5,44±0,43 | 5,24±0,49 | 5,27±0,41 | 5,31±0,33 |
| средний мозг | 5,66±0,19 | 9,41±1,20 | 6,65±0,70 | 5,50±0,48 | 5,75±0,39 | 5,99±0,58 | 5,95±0,52 |
| гипоталамус | 6,57±0,50 | 4,62±0,71 | 6,77±0,83 | 6,57±0,88 | 6,91±0,58 | 6,87±0,75 | 6,77±0,46 |
| Активность NOC, пмоль/мин/мг белка: | |||||||
| стриатум | 1,73±0,07 | 1,19±0,14 | 1,26±0,08 | 1,24±0,08 | 1,29±0,09 | 1,21±0,10 | 1,34±0,09 |
| средний мозг | 2,18±0,09 | 3,08±0,09 | 2,60±0,29 | 1,83±0,23 | 1,99±0,29 | 2,03±0,31 | 1,89±0,27 |
| гиппокамп | 2,55±0,12 | 3,10±0,20 | 3,09±0,16 | 2,70±0,14 | 2,51±0,19 | 2,33±0,11 | 2,65±0,15 |
| гипоталамус | 5,37±0,20 | 3,42±0,54 | 5,45±0,24 | 5,26±0,28 | 5,36±0,33 | 5,47±0,32 | 5,56±0,34 |
Как видно из результатов, приведенных в табл.2, в мозге морфин оказывал специфическое влияние на накопление нитритов и активность NOC: в стриатуме и гипоталамусе наблюдалось снижение нитрергических показателей, а в среднем мозге и гиппокампе - их повышение (Р<0,05; Р=0,1 для нитритов в гипоталамусе, Т-тест). Соединения согласно изобретению купировали нарушенную морфином активность NOC в гипоталамусе, среднем мозге и гиппокампе.
Выводы
Таким образом, при синдроме отмены морфина соединения согласно изобретению, введенные трехкратно в дозе 3×20 мг/кг внутримышечно, оказывают следующие эффекты:
- купируют развитие абстинентного синдрома, прежде всего такие компоненты нарушений поведения, как диарея, птоз и диспноэ,
- улучшают психофизиологическое состояние за счет антидепрессивного действия при ингибировании абстинентного синдрома,
- оказывают дифференцированное и специфическое влияние на различные изоформы синтазы оксида азота, осуществляя коррекцию нарушенных нитрергических механизмов в отделах мозга.
Эти данные свидетельствуют о перспективности применения соединений согласно изобретению для лечения расстройств, вызванных злоупотреблением веществами, в частности наркотиками.
3. Влияние соединений согласно изобретению на расстройства половой функции, связанных с нарушениями дофаминергической системы.
Один из механизмов, регулирующих половую функцию млекопитающих, связан с функционированием дофаминергической системы мозга. Известно, что неселективный агонист D1/D2 рецепторов апоморфин в низких дозах вызывает эрекцию пениса у грызунов (Giuliano F., Allard J. Dopamine and male sexual function. Eur. UroL, 2001, 40 (6), 601-608; Giuliano F., Allard J., Rampin O. et. al. Pro-erectile effect of systemic apomorphine: existence of a spinal site action. J. UroL, 2002, 167 (1), 402-406; Brien S.E., Smallegange С., Gofton W.T., et. al. Development of a rat model of sexual performance anxiety: effect of behavioral and pharmacological hyperadrenergic stimulation on apomorphine-induced erections. Int. J. Impot. Res., 2002, 14 (2), 107-115.). В связи с этим проведено исследование влияния соединений согласно изобретению на апоморфин-зависимую эрекцию у крыс.
В эксперименте использовали 9 групп взрослых крыс-самцов линии Вистар массой 350-450 г, содержавшихся при нормальном световом режиме. В эксперименте участвовали крысы с нормальным (неинвертированным) световым циклом. Для исследования влияния соединений на половую функцию были отобраны низкопотентные животные - с одной эрекцией. Контрольную группу №1 (n=7) составили животные, не инъецированные соединениями согласно изобретению. Животным групп №2-9 (n=7) одно из соединений согласно изобретению, выбранное из группы соединений 2, 8, 9, 15, 19, 25, 31, 36, вводили внутрибрюшинно курсом: 5 инъекций в дозе по 10 мг/кг с интервалом между инъекциями 48 часов. Апоморфин растворяли в 0,1%-ном водном растворе аскорбиновой кислоты и затем вводили всем подкожно в дозе 0,1 мг/кг через 24-28 часов после последней инъекции соединений согласно изобретению. Регистрацию половой активности проводили индивидуально для каждого животного сразу после введения апоморфина; время регистрации 20 мин. Регистрировали: время наступления первой эрекции, временные