Способ количественного определения арбутина в растениях семейства грушанковых
Иллюстрации
Показать всеИзобретение относится к области фармации, а именно к фармакогнозии и фармацевтической химии. Способ количественного определения арбутина в растениях семейства грушанковых включает экстракцию сырья, приготовление раствора для фотоколориметрии и расчет содержания арбутина. При этом проводят двухступенчатую экстракцию сырья, введение в водное извлечение ацетата свинца и удаление осадка. При приготовлении раствора для фотоколориметрии проводят реакцию взаимодействия арбутина с диазотированным сульфанилом, полученным отдельно на холоду. Количественное содержание арбутина рассчитывают по формуле:
где D - оптическая плотность исследуемого раствора; 0,938 - коэффициент пересчета на безводный арбутин; 25 - общий объем исследуемого раствора, мл; 100 - объем мерной колбы, мл; w - влажность сырья, %; - удельный показатель поглощения арбутина при длине волны 490 нм, равный 221,5; а - навеска сырья, г; b - объем извлечения, взятый для анализа, мл. Изобретение позволяет повысить точность и сократить время анализа. 2 табл.
Реферат
Предлагаемое изобретение относится к области фармации, а именно к фармакогнозии и фармацевтической химии, и может применяться в количественном определении арбутина в растениях семейства грушанковых.
Известно использование количественного определения содержания арбутина в сырье.
Проводили количественное определение арбутина в листьях бадана толстолистного. При расчете количественного содержания арбутина использовался калибровочный график, построенный по ГСО арбутина. Для этого 0,5 г (точная навеска) измельченных листьев бадана толстолистного помещали в колбу на 100 мл, заливали 50 мл воды и кипятили в течение 5 мин. Извлечение фильтровали в мерную колбу на 100 мл. Сырье в колбе заливали 25 мл воды и кипятили 20 мин, после чего извлечение фильтровали в ту же колбу, сырье переносили на фильтр и дважды промывали горячей водой по 10 мл, присоединяя промывную жидкость к фильтрату. Затем к извлечению добавляли 3 мл раствора основного ацетата свинца, перемешивали и после охлаждения доводили водой до метки. Колбу помещали на кипящую водяную баню до полной коагуляции осадка. Горячую жидкость фильтровали в сухую колбу. От избытка основного ацетата свинца освобождались добавлением 0,8 г сульфата натрия. Раствор фильтровали (раствор А).
0,08 г сульфацила натрия растворяли в 10 мл воды, прибавляли 10 мл 0,1 н. соляной кислоты, объем доводили до 100 мл (раствор Б).
В пробирку вносили 2 мл раствора Б, 2 мл 0,02% водного раствора нитрита натрия, оставляли на 3 мин, затем прибавляли 0,5 мл раствора А, 0,04 мл 10% водного раствора гидроксида натрия, объем доводили водой до 6 мл и выдерживали на теплой водяной бане в течение 1 мин. Через 20 мин измеряли оптическую плотность на фотоколориметре ФЭК-56 (зеленый светофильтр).
Количественное содержание арбутина определяли по калибровочному графику, для построения которого брали от 0,1 до 1,2 мл 0,03% водного раствора арбутина. Подчиняемость закону Бугера-Ламберта-Бера отмечается в диапазоне концентраций 22,0-60,5 мкг/мл (Горбунцова Н.М., Федосеева Л.М., Горбикова О.А. Количествественное определение арбутина в листьях бадана толстолистного // Алтайский гос. унив-т - Актуальные проблемы фармации: Сб. науч. статей, Барнаул, 1995. - С.196-199).
Нижним пределом обнаружения арбутина является концентрация 14,0 мкг/мл.
Количественное содержание арбутина в листьях бадана рассчитывали по формуле:
где А - количество арбутина, определенное по калибровочному графику,
q - навеска сырья, г,
Va - объем аликвоты,
b - влажность, %.
Недостатком способа является необходимость затрачивать время на построение калибровочного графика, необходимость иметь в наличии ГСО арбутина (для построения калибровочного графика), использование обычной пробирки вместо мерной посуды, что снижает точность результатов анализа.
Наиболее близким к предлагаемому способу является фотоколориметрическое определение арбутина с использованием удельного показателя поглощения арбутина, по которому получали водное извлечение из листьев растений семейства вересковых в соотношении 0,5:100 при кипячении с обратным холодильником. Флавоноиды и полифенольные окисляемые вещества осаждали, добавляя насыщенный раствор основного ацетата свинца, и выдерживали на кипящей водяной бане до полной коагуляции. Избыток основного ацетата свинца осаждали сульфатом натрия. Извлечение фильтровали в сухую колбу.
Раствор для фотоколориметрии готовили следующим образом: в пробирку вносили 2 мл 0,08% раствора сульфацила натрия, 2 мл 0,02% раствор нитрита натрия, через 3 мин добавляли 0,5 мл извлечения, 0,04 мл 10% раствора гидроксида натрия и доводили объем раствора водой до 6 мл. Пробирку с полученным раствором нагревали на теплой (40-50°С) водяной бане 1 мин и через 20 мин определяли оптическую плотность раствора на фотоколориметре КФК-2 при длине волны 490 нм, кювета с длиной рабочего слоя 1 см. Раствор сравнения - вода. Удельный показатель поглощения арбутина при длине волны 490 нм равен 221,5. Количественное содержание арбутина в сырье рассчитывали по формуле:
где D - оптическая плотность исследуемого раствора;
0,938 - коэффициент пересчета на безводный арбутин;
6 - общий объем исследуемого раствора, мл;
100 - объем колбы;
- удельный показатель поглощения арбутина при длине волны 490 нм, равный 221,5;
а - навеска сырья;
b - объем извлечения, взятый для анализа
(см. Замчалкина М.Н., Трубникова А.А. Фотоколориметрическое определение арбутина в траве двух представителей семейства вересковых // Состояние и перспективы современного лекарствоведения. Ярославль, 1997. - Ярос. Мед. Академ. МЗ РФ - С.53-54).
Недостатком этого способа являются: неполная экстракция арбутина при анализе различных видов сырья, использование обычной пробирки (6 мл) для приготовления раствора для фотоколориметрии вместо мерной колбы (25 мл), что снижает точность результатов анализа. Для приготовления раствора для фотоэлектроколориметрии проводится последовательно две реакции.
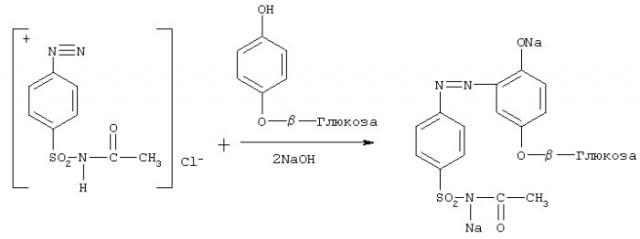
1. Сначала в пробирке проводится реакция диазотирования сульфацила натрия при добавлении нитрита натрия. Эта реакция протекает в кислой среде. Реакция по этой методике протекает 3 минуты при комнатной температуре с образованием диазотированного сульфанила:
Реакция диазотирования (I)
2. Затем в этой же пробирке проводится реакция азосочетания арбутина с диазотированным сульфанилом в щелочной среде при нагревании (40-50°С) на водяной бане 1 минуту:
Реакция азосочетания (II)
Техническим результатом предлагаемого способа является повышение достоверности и точности результата количественного определения арбутина в растительном сырье, а также сокращение времени анализа.
Новым в достижении технического результата является то, что используют двухступенчатую экстракцию сырья, что позволяет максимально более полно выделить арбутин.
Новым является также то, что увеличивают объем раствора для фотоколориметрии, что повышает точность способа.
Новым является также и то, что диазотированный сульфанил, используемый для реакции азосочетания, готовится отдельно по методике, предусматривающей охлаждение реакционной смеси, что придает устойчивость образующейся соли диазония. Кроме того, это позволяет в дальнейшем реакцию азосочетания проводить при комнатной температуре. При приготовлении раствора для фотоколориметрии проводят одну реакцию. Это реакция азосочетания арбутина с диазотированным сульфанилом (реакция II). Все это позволяет повысить достоверность результатов анализа.
Новым является и то, что в расчетной формуле используют значение W - потеря в массе при высушивании сырья в процентах, т.е. расчет ведется на абсолютно сухое сырье с учетом влажности, что также повышает точность конечного результата.
Сопоставительный анализ с прототипом показывает, что предлагаемый способ отличается от известного тем, что используют двухступенчатую экстракцию сырья, при приготовлении раствора для фотоколориметрии проводят только реакцию азосочетания арбутина с диазотированным сульфанилом, образование которого проводят отдельно на холоду, объем испытуемого раствора увеличивают в 4 раза, а количественное содержание арбутина проводят по формуле: что соответствует критерию "новизна".
Новая совокупность признаков позволяет повысить достоверность и точность результатов анализа, а также сократить время анализа, что соответствует критерию "промышленная применимость".
Способ осуществляют следующим образом.
Пробу сырья (грушанки круглолистной или ортилии однобокой) измельчают до размера частиц, проходящих сквозь сито с отверстиями диаметром 1 мм. Около 0,5 г (точная навеска) измельченных листьев помещают в колбу вместимостью 100 мл, прибавляют 50 мл воды и нагревают на плитке, поддерживая слабое кипение в течение 30 мин. Горячее извлечение фильтруют в мерную колбу вместимостью 100 мл через бумажный фильтр диаметром 7 мм, избегая попадания частиц сырья на фильтр. В колбу с сырьем повторно прибавляют 25 мл воды очищенной и кипятят 20 мин. Горячее извлечение вместе с сырьем переносят на тот же фильтр и остаток на фильтре дважды промывают горячей водой (по 10 мл). К фильтрату прибавляют 3 мл раствора ацетата свинца основного, перемешивают и по охлаждении доводят объем фильтрата водой очищенной до метки. Колбу помещают на кипящую водяную баню и выдерживают до полной коагуляции осадка. Горячую жидкость полностью отфильтровывают в сухую колбу через бумажный фильтр диаметром 10 см, прикрывая воронку часовым стеклом. От избытка свинца освобождаются добавлением насыщенного раствора сульфата натрия - 2 мл, образовавшийся осадок отфильтровывают через бумажный фильтр в сухую колбу вместимостью 100 мл. Готовят диазотированный сульфанил. Для этого 7 г сульфацил-натрия растворяют в 50 мл воды в мерной колбе вместимостью 100 мл, прибавляют 9 мл концентрированной хлористоводородной кислоты и доводят объем раствора водой до метки; 1 мл полученного раствора помещают в мерную колбу вместимостью 100 мл, ставят на лед, прибавляют 50 мл воды, 0,2 мл 10% раствора натрия нитрита, перемешивают и доводят объем раствора водой до метки. Раствор применяют свежеприготовленным.
В мерную колбу вместимостью 25 мл переносят 1 мл полученного фильтрата, прибавляют 2,5 мл диазотированного сульфанила и 0,16 мл 10% раствора гидроксида натрия и доводят объем раствора очищенной водой до метки, перемешивают (реакция идет при комнатной температуре, что дает более устойчивое окрашенное соединение) и через 20 мин измеряют оптическую плотность на фотоколориметре КФК-2 при длине волны 490 нм в кювете с длиной рабочего слоя 10 мм, используя в качестве раствора сравнения воду. Количественное содержание арбутина рассчитывают по формуле:
где D - оптическая плотность исследуемого раствора;
0,938 - коэффициент пересчета на безводный арбутин;
25 - общий объем исследуемого раствора, мл;
100 - объем колбы;
W - влажность сырья, %;
- удельный показатель поглощения арбутина при длине волны 490 нм, равный 221,5
а - навеска сырья, г;
b - объем извлечения, взятый для анализа.
Приводим пример расчета определения количественного содержания арбутина, на примере, травы ортилии однобокой:
где D - 0,22 - оптическая плотность исследуемого раствора;
а - 0,5020 - точная навеска исследуемого сырья;
b -1 мл - объем извлечения, взятый для анализа;
W - 10% - влажность сырья;
Результаты количественного определения содержания арбутина в растениях семейства грушанковых (Pyrolaceae) и статистическая обработка полученных данных приведены в таблицах 1 и 2.
| Таблица 1 | ||||||||
| Результаты количественного определения содержания арбутина в листьях грушанки круглолистной (Pyrola rotundifolia). | ||||||||
| Методика | f | S2 | S | Р | t (p, f) | Δx | Е | |
| Прототип | 5 | 8,59 | 0,31717 | 0,56318 | 95 | 2,57 | 0,59 | 6,87 |
| Предлагаем. способ | 5 | 8,68 | 0,17927 | 0,42339 | 95 | 2,57 | 0,44 | 5,07 |
| Таблица 2 | ||||||||
| Результаты количественного определения содержания арбутина в траве ортилии однобокой (Orthilia secunda). | ||||||||
| Методика | f | S2 | S | Р | t (p, f) | Δx | Е | |
| Прототип | 5 | 5,13 | 0,14 | 0,3742 | 95 | 2,57 | 0,41 | 7,9 |
| Предлагаем. способ | 5 | 5,2 | 0,112 | 0,3347 | 95 | 2,57 | 0,35 | 6,7 |
Как видно из таблиц, количество найденного арбутина в сырье грушанки круглолистной и ортилии однобокой выше, чем по прототипу, что объясняется применением двукратной экстракции и получением более стабильной соли диазония. Относительная ошибка (Е) по предлагаемому способу ниже (5,07% и 6,7%), чем по прототипу (6,87% и 7,9%) за счет увеличения объема раствора для фотоколориметрии и использования для этого мерной колбы.
Способ количественного определения арбутина в растениях семейства грушанковых путем экстракции сырья, приготовления раствора для фотоколориметрии и расчета содержания арбутина, отличающийся тем, что проводят двухступенчатую экстракцию сырья, введение в водное извлечение ацетата свинца и удаление осадка, при приготовлении раствора для фотоколориметрии проводят реакцию взаимодействия арбутина с диазотированным сульфанилом, полученным отдельно на холоду, а количественное содержание арбутина рассчитывают по формуле
,
где D - оптическая плотность исследуемого раствора;
0,938 - коэффициент пересчета на безводный арбутин;
25 - общий объем исследуемого раствора, мл; 100 - объем мерной колбы, мл;
w - влажность сырья, %;
- удельный показатель поглощения арбутина при длине волны 490 нм, равный 221,5;
а - навеска сырья, г;
b - объем извлечения, взятый для анализа, мл.