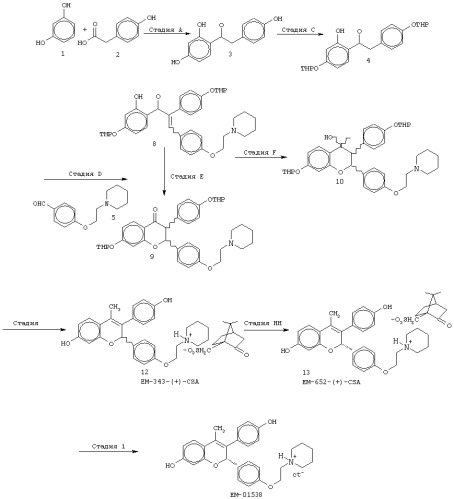
Способы лечения и/или подавления прироста массы
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и касается нового соединения и фармацевтической композиции, включающей это соединение. Композиция предназначена для лечения или предупреждения инсулинорезистентности у восприимчивых теплокровных животных, включая людей, и включает селективный модулятор рецептора эстрогена ЕМ-652.HCl в терапевтически эффективном количестве. Композиция позволяет эффективно лечить или предупреждать развитие инсулинорезистентности у теплокровных млекопитающих, в том числе и у человека. 2 н. и 3 з.п. ф-лы, 13 табл., 8 ил.
Реферат
Эта заявка испрашивает приоритет предварительной заявки на патент США No. 60/142407, поданной 6 июля 1999.
Область техники
Данное изобретение относится к способу лечения и/или профилактики ожирения (особенно абдоминального ожирения) и к способу лечения или подавления супрессии приобретения аномальной инсулинорезистентности у восприимчивых теплокровных животных, включая людей. Способы включают введение соединений общей формулы 1, приводимой ниже, или фармацевтических композиций на их основе. В других вариантах осуществления способы включают введение селективного модулятора рецептора эстрогена ("СМРЭ", "SERM") в сочетании с предшественником полового стероидного гормона.
Предшествующий уровень техники
Ожирение, состояние, характеризуемое избыточной жировой массой тела, представляет общеизвестный фактор риска для развития многих заболеваний, таких как сердечно-сосудистые заболевания, гипертензия, диабет и рак молочной железы. Кроме того, персональный внешний вид составляет существенную часть комфортного благополучия большинства людей.
Обычными способами лечения ожирения, такими как разнообразные диеты (включая диеты с ограничением в питании), программы, обеспечивающие потерю излишней массы, и физическая нагрузка, для многих людей удается достичь успеха с разной степенью конечного результата. Однако остается потребность в других способах для тех, кто испытывает неудовлетворенность в результатах при использовании способов (лечения) предшествующего уровня техники, или способах, используемых в качестве дополнения к способам предшествующего уровня техники.
За последнее время для лечения или профилактики ожирения были предложены некоторые агонисты/антагонисты эстрогена: Ралоксифен (Raloxifene) и родственные соединения в европейской патентной заявке № 0659423А1; агонисты эстрогена, имеющие бензотиофеновое ядро, в европейской патентной заявке № 0716855А2; 3,4-дифенилхроманы в международной заявке № PCT/DK96/00011; агонист/антагонист нафтилэстрогена в международной заявке № PCT/IB95/00286.
Сообщалось также, что Тамоксифен (Tamoxifen), другой агонист/антагонист эстрогена, предотвращает увеличение массы тела, индуцированное сульпиридом, у крыс-самок (Baptista et al., Pharmacol., Biochem. Behav. (1997), 57(1/2), 215-222). Кроме того, сообщалось, что тамоксифен имитирует действие эстрадиола на потребление корма, массу тела и структуру тела у крыс (Wade et al., American Journal of Physiology 1993, 33(6), R1219-1223).
Кроме того, ДГЭА (DHEA) оказывает полезное действие при лечении и/или для профилактики ожирения. У взрослых крыс Sprague-Dawley, Шварц (см. Kent, Geriatrics 37: 157-160, 1982) наблюдал уменьшение массы тела с 600 до 550 г под действием ДГЭА без влияния потребления пищи. Шварц (Cancer 39: 1129-1132, 1979) наблюдал, что мыши линии С3Н, получавшие ДГЭА (450 мг/кг, 3 раза в неделю), прибавляют в весе значительно меньше и стареют быстрее, чем контрольные животные, и имеют меньше жира и более активны. Уменьшение массы тела достигалось без потери аппетита или ограничения пищи. Кроме того, ДГЭА может предотвратить прирост массы тела у животных, имеющих склонность к ожирению в зрелом возрасте (см. Kent, Geriatrics 37:157-160, 1982).
Введение ДГЭА тощим крысам Zucher приводило к уменьшению массы тела, несмотря на увеличение приема пищи. Животные, подвергнутые лечению, имели меньшие жировые прослойки, в целом, тем самым указывая на то, что ДГЭА увеличивает пищевой метаболизм, что приводит к меньшему приросту массы тела и уменьшению накопления жира (Svec et al., Proc. 2nd Int. Conf. Cortisol and Anti-Cortisols, Las Vegas, Nevada, USA, p. 56 abst., 1997).
Было установлено, что ожирение приостанавливается у Аvy мутантной мыши (Yen et al., Lipids 12: 409-413, 1977) и у крысы Zucker (Cleary and Zisk, Fed. Proc. 42: 536, 1983). Мыши линии СЗН, подвергнутые лечению ДГЭА, выглядели моложе, чем контрольные (Schwartz, Cancer Res. 39: 1129-1132, 1979).
Абдоминальный жир ассоциируется с метаболическими факторами риска развития коронарной болезни молочной железы (Imbault et al. Metabolism 1999, 48 (3), 355 - 62; Ledoux et al. (CMAJ 1997, 157 Suppl. 1; 46-53).
Сущность изобретения
Соответственно, цель данного изобретения состоит в обеспечении уменьшения жировой ткани, в частности абдоминального жира.
Другая цель данного изобретения заключается в достижении уменьшения риска развития коронарной болезни сердца и других заболеваний и состояний, для которых развитие ожирения и появление превышающей норму жировой ткани являются факторами риска.
В одном варианте осуществления данное изобретение заключается в разработке нового способа лечения или подавления прироста массы тела у восприимчивых теплокровных животных, включая людей, и этот указанный способ включает введение субъекту, при необходимости такого лечения или подавления, терапевтически эффективного количества, с или без фармацевтического разбавителя или носителя, по крайней мере, одного соединения общей формулы I:
где R1 и R2 независимо выбраны из группы, состоящей из водорода, гидроксила, -ОМ (причем М выбран из группы, состоящей из прямого или разветвленного C1-C4 алкила, прямого или разветвленного С3 - С4 алкенила, прямого или разветвленного С3 - С4 алкинила) и части, превращаемой in vivo в гидроксил, где G представляет -Н или -СН3; и где R3 обозначает тип (заместителя), выбранный из группы, состоящей из пирролидинила, пиперидино, морфолино и NRaRb (причем Ra и Rb представляют, независимо, водород, прямой или разветвленный C1-C6 алкил, прямой или разветвленный С3 - С6 алкенил и прямой или разветвленный С3 - С6 алкинил).
Способ лечения или подавления развития ожирения, включающий введение субъекту, при необходимости такого лечения или подавления, терапевтически эффективного количества соединения или его фармацевтически приемлемой соли нижеследующей общей формулы:
где R1 и R2 независимо выбраны из группы, состоящей из водорода, гидроксила, -ОМ (причем М выбран из группы, состоящей из прямого или разветвленного C1-C4 алкила, прямого или разветвленного С3 - С4 алкенила, прямого или разветвленного С3 - С4 алкинила) и части, превращаемой in vivo в гидроксил, где G представляет -Н или -СН3; и где R3 обозначает заместитель, выбранный из группы, состоящей из пирролидинила, пиперидино, морфолино и NRaRb (причем Ra и Rb представляют, независимо, водород, прямой или разветвленный C1-C6 алкил, прямой или разветвленный С3 - С6 алкенил и прямой или разветвленный С3 - С6 алкинил), где R1 или R2 не являются пивалоилокси группой.
В другом варианте осуществления селективный модулятор рецептора экстрогена или его фармацевтически приемлемую соль вводят для уменьшения абдоминального жира или уменьшения накопления абдоминального жира.
В другом варианте осуществления для лечения ожирения или подавления прироста массы помимо селективного модулятора рецептора эстрогена (СМРЭ, SERM) вводят предшественник полового стероидного гормона (например, дегидроэпиандростерон, дегидроэпиандростерон сульфат, андрост-5-ен-3b, 17b-диол). Человек, в возрасте пятидесяти или свыше лет, как полагают, хорошо реагирует на комбинированную терапию, вероятно из-за того, что уровни предшественника имеют тенденцию с возрастом нежелательно снижаться.
Таким образом, в данном аспекте, изобретение обеспечивает способ лечения или подавления прироста массы, включающий введение субъекту, при необходимости такого подавления или лечения, терапевтически эффективного количества, с или без фармацевтического разбавителя или носителя, по крайней мере, одного СМРЭ (SERM) и эффективного количества, по крайней мере, одного предшественника полового стероидного гормона, выбранного из группы, состоящей из дегидроэпиандростерона, дегидроэпиандростерон сульфата, андрост-5-ен-3b, 17b-диола и соединений, превращаемых in vivo в любой из упомянутых выше предшественников.
В другом аспекте изобретение обеспечивает способ лечения или уменьшения риска развития инсулинорезистентности, включающий введение субъекту, при необходимости такого лечения или уменьшения, терапевтически эффективного количества, по крайней мере, одного СМРЭ. В некоторых вариантах осуществления изобретения в качестве части комбинированной терапии вводят также эффективное количество, по крайней мере, одного предшественника полового стероидного гормона, выбранного из группы, состоящей из дегидроэпиандростерона, дегидроэпиандростерон сульфата, андрост-5-ен-3b, 17b-диола и соединений, превращаемых in vivo в тот или другой из них.
В другом аспекте, изобретение обеспечивает набор для лечения ожирения, имеющий первый контейнер, который включает, по крайней мере, один СМРЭ, и второй контейнер, который включает, по крайней мере, один предшественник полового стероидного гормона, выбранный из группы, состоящей из дегидроэпиандростерона, дегидроэпиандростерон сульфата, андрост-5-ен-3b, 17b-диола и соединений, превращаемых in vivo в тот или другой.
Кроме того, в одном или нескольких контейнерах может быть предусмотрен фармацевтический наполнитель, носитель или разбавитель и они могут включать консерванты и другие добавки, известные в данной области. Вышеупомянутые вспомогательные вещества могут быть включены с любым активным компонентом, используемым в любом варианте воплощения описанных здесь различных изобретений.
Используемый здесь селективный модулятор рецептора эстрогена (СМРЭ, SERM) представляет соединение, которое либо непосредственно, либо через свой активный метаболит функционирует как антагонист рецептора эстрогена ("антиэстроген") в ткани молочной железы, кроме этого, это соединение оказывает эстрогенподобное действие на жир тела, на костную ткань и на уровни холестерина в сыворотке (т.е. уменьшая сывороточный холестерин). Нестероидальные соединения, которые функционируют как антагонисты рецептора эстрогена in vitro либо в ткани молочной железы человека, либо в ткани молочной железы крысы (в частности, если соединение действует как антиэстроген на человеческие клетки рака молочной железы), вероятно, функционируют как СМРЭ (SERM). К нестероидным антиэстрогенам, которые были испытаны и, как было установлено, функционируют как СМРЭы (SERMs), относятся ЕМ-800, ЕМ-652, ЕМ-652. HCl (ЕМ-01538), Ра-локсифен, Тамоксифен, Идоксифен, Торимефен, LY 353381, LY 335563, GW 5638 и Дролоксифен (описанные ниже более подробно). СМРЭы (SERMs), в соответствии с любым вариантом воплощения изобретения, предпочтительно вводят при той же самой дозе, как это известно в области применения этих соединений в качестве антиэстрогенов.
Не вдаваясь в теоретические рассуждения, считается, что СМРЭы (SERMs), многие из которых предпочтительно имеют два ароматических кольца, связанные одним-двумя углеродными атомами, предположительно взаимодействуют с рецептором эстрогена посредством вышеупомянутой части молекулы, которая лучше всего распознается рецептором. Кроме того, такие СМРЭы имеют боковые цепи, которые могут селективно проявлять антагонистические свойства в ткани молочной железы и внутриматочной ткани без проявления существенных антагонистических свойств в других тканях, в частности костной. Таким образом, СМРЭы могут функционировать, в соответствии с желанием, как антиэстрогены в молочной железе и эндометрии, проявляя при этом неожиданно и в соответствии с желанием эстрогенподобную активность по отношению к жиру тела.
Кроме того, изобретение включает, в соответствии с желанием, подавление дополнительного прироста массы тела или, в соответствии с желанием, обеспечение уменьшения массы тела, даже если при этом масса, отвечающая норме, не достигается.
Используемый здесь термин ожирение подразумевает избыток жировой ткани, который ведет к увеличению массы тела. Способы профилактики и лечения согласно изобретению включают ингибирование прироста массы тела и индуцирование потери массы тела. Изобретение включает лечение тучных людей, уменьшая их массу до (и поддерживая массу при) отвечающего норме значения. Кроме того, изобретение включает профилактику ожирения для людей, которые являются восприимчивыми к развитию такого заболевания. Пациентами, заинтересованными в данном изобретении, являются те, которые имеют избыточную массу тела (по сравнению с установленными в медицине нормами) или люди с повышенным риском приобрести избыточную массу тела.
Кроме того, в соответствии с изобретением СМРЭ может быть использован для понижения уровней триглицеридов в крови. Например, предполагается, что ЕМ-800 (описанный здесь) является эффективным для этой цели.
В другом варианте воплощения для осуществления изобретения разработаны новые соединения и фармацевтические композиции на их основе.
Пациентом, нуждающимся в таком лечении или снижении риска возникновения указанного заболевания или состояния, является тот, у кого либо диагностировано такое заболевание, либо тот, кто является предрасположенным к развитию такого заболевания. Изобретение, в частности, полезно для индивидуумов, которые вследствие наследственности, факторов окружающей среды или другого признанного фактора риска имеют более высокий риск приобрести состояния, к которым имеет отношение данное изобретение, чем население в целом.
За исключением тех случаев, где оговорено особо, предпочтительная доза активных соединений данного изобретения идентична как для применения в терапевтических целях, так и профилактических. Доза каждого активного компонента, обсуждаемого здесь, является тождественной, независимо от заболевания, подлежащего лечению (или профилактике).
В тех случаях когда рассматриваются два или несколько различных активных средств как часть комбинированной терапии (например, ингибитор фермента и антиандроген), применяют множество различных соединений, а не одно соединение, имеющее разнообразные активности.
Если не оговорено особо, термин "соединение" и любая ассоциированная молекулярная структура могут включать любые возможные его стереоизомеры в форме рацемической смеси или в оптически активной форме.
Если не оговорено особо или там, где очевидно из контекста, дозы, указанные здесь, относятся к массе активных соединений, не включая фармацевтические наполнители, разбавители, носители или другие компоненты, хотя такие дополнительные компоненты включаются, в соответствии с желанием, как показано в прилагаемых примерах. Любая лекарственная форма (капсула, таблетка, инъекция или т.п.), обычно используемая в фармацевтической промышленности, пригодна для использования здесь, а термины "наполнитель", "разбавитель" или "носитель" включают такие неактивные компоненты, которые обычно входят, наряду с активными компонентами, в состав таких лекарственных форм в промышленности. Например, используют обычные капсулы, пилюли, энтерально - активные покрытия, твердые или жидкие разбавители или наполнители, ароматизаторы, консерванты или т.п.
В некоторых вариантах воплощения используют пролекарства активных компонентов, обсуждаемых здесь (т.е. соединения, которые превращаются in vivo в активные компоненты). Как известно в фармацевтической промышленности, многие функциональные группы превращаются in vivo в функциональные группы активных соединений, дискутируемых здесь. Смотри, например, Chapter 5 "Design and Application of Prodrugs", A Textbook of Drug Design & Development, Bundgaard & Larsen, Ed., Harwood Academic Publishers GmbH (Chur, Switzerland, 1991). Пролекарства зачастую могут обеспечить лучшую биологическую доступность, устойчивость при хранении и/или легкость получения соответствующих активных соединений.
Все активные компоненты, используемые в любой из обсуждаемых здесь терапий, могут быть включены в рецептуру фармацевтических композиций, которые, кроме этого, содержат один или несколько других активных компонентов. Альтернативно, они могут быть введены, каждый, раздельно, но по возможности одновременно так, чтобы пациент, в конечном счете, имел повышенные уровни каждого активного компонента в крови или получил пользу в другом отношении от каждого из активных компонентов (или стратегий) одновременно. В некоторых предпочтительных вариантах воплощения изобретения, например, один или несколько активных компонентов должны быть объединены в рецептуру одной фармацевтической композиции. В других вариантах воплощения изобретения обеспечивается набор, который включает, по крайней мере, два отдельных контейнера, где содержимое, по крайней мере, двух отдельных контейнеров, где содержимое, по крайней мере, одного контейнера отличается, полностью или частично, от содержимого, по крайней мере, одного другого контейнера в отношении активных компонентов, содержащихся в них. В комбинированных терапиях изобретения используют два или несколько различных контейнеров. Комбинированные терапии, изложенные здесь, также включают использование одного активного компонента комбинации для получения лекарственного средства для лечения (или профилактики) рассматриваемого заболевания, и это лечение или профилактика, кроме этого, включает другой активный компонент или стратегию комбинации.
Абдоминальный жир считается отличным от общего ожирения тела, и он может иметь место при отсутствии ожирения. Кроме того, считают, что абдоминальный жир представляет более высокий фактор риска для возникновения заболевания сердца. Абдоминальный жир положительно реагирует на данное изобретение.
Предпочтительные СМРЭы изобретения, например, СМРЭы вышеуказанной формулы I, не оказывают нежелательных эстрогенных действий в эндометрии, очень важное улучшение по сравнению с терапиями с участием СМРЭ, используемыми в некоторых способах предшествующего уровня техники.
СМРЭы, используемые в изобретении, как полагают, благоприятным образом понижают уровни триглицеридов в крови и, к тому же, инсулинорезистентность.
В предпочтительных вариантах воплощения изобретения, обсуждаемых здесь, действие СМРЭ усиливается ДГЭА или подобным предшественником полового стероидного гормона.
Не вникая в подробности теоретического разъяснения, в основе одного из объяснений синергического действия, получаемого при комбинировании СМРЭов и предшественников, могут лежать, по крайней мере, частичные различия в их механизмах действия.
Например, ДГЭА, по-видимому, повышает пищевой обмен, не подавляя аппетит. ЕМ-652.HCl, СМРЭ, вероятно, подавляет потребление пищи.
Краткое описание чертежей
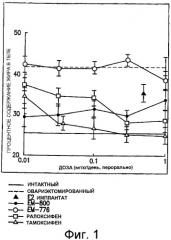
Фиг. 1. Показывает действие 35-недельного лечения в зависимости от увеличения доз (0,01, 0,03, 0,1, 0,3, 1 мг/кг, перорально, один раз в день) СМРЭов ЕМ-800, ралоксифена, тамоксифена и неактивного энантиомера, ЕМ-776 (энантиомер ЕМ-800) на содержание общего жира у овариэктомированной крысы. Данные выражены как среднее ± SEM (стандартная ошибка средней). **: Р < 0,01 эксперимент против соответствующего контроля.
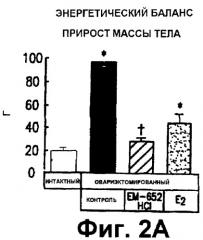
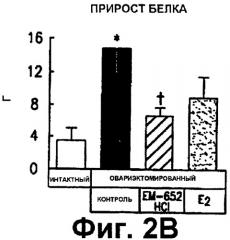
Фиг. 2. Показывает действие 20-дневного лечения на прирост массы тела (А), увеличение белка (В) и увеличение жира (С) у интактных крыс; овариэктомированных крыс; овариэктомированных крыс, подвергнутых лечению СМРЭ ЕМ-652.HCl или эстра-диолом. Данные выражены в граммах (г) как среднее ± SEM. * р < 0,05 против интактной группы; + р < 0,05 против OVX + Е2 группа (для ЕМ-652.HCl группы только).
Фиг. 3. Показывает действие 20-дневного лечения на суммарное потребление корма для интактных крыс, овариэктомированных крыс и овариэктомированных крыс, подвергнутых лечению ЕМ - 652. HCl или эстрадиолом. Данные выражены в граммах (г).
Фиг. 4. Показывает действие 20-дневного лечения на энергию тела (организма) в виде белков (А) и энергию тела в виде жира (В) для интактных крыс, овариэктомированных крыс и овариэктомированных крыс, подвергнутых лечению ЕМ-652.HCl или эстрадиолом. Данные выражены в килоджоулях (кДж, Kj) как среднее ± SEM. * р < 0,05 против интактной группы; +р < 0,05 против OVX + Е2 группа (для только ЕМ-652.HCl группы).
Фиг. 5. Демонстрирует действие 20-дневного лечения на уровни сывороточного инсулина и уровни сывороточной глюкозы для интактных крыс; овариэктомированных крыс и овариэктомированных крыс, подвергнутых лечению ЕМ-652.HCl или эстрадиолом. Данные выражены в нмоль/л как среднее ± SEM. *р < 0/05 против интактной группы.
Фиг. 6. Демонстрирует действие 20-дневного лечения на характеристики белой жировой ткани: масса паховой (А) и забрюшинной (С) жировой ткани (данные выражены в граммах (г) как среднее ± SEM); активность липопротеинлипазы паховой (В) и забрюшинной (D) белой жировой ткани (данные выражены в мкЕ/г белка как среднее ± SEM; * р < 0, 05 против интактной группы; + р < 0,05 против OVX + Е2 группы (только для ЕМ-652.HCl группы), для интактных крыс; овариэктомированных крыс и овариэктомированных крыс, подвергнутых лечению ЕМ-652.HCl или эстрадислом.
Фиг. 7. Демонстрирует действие 20-дневного лечения на характеристики межлопаточной бурой жировой ткани (бурый жир): (А) масса бурой жировой ткани (данные выражены в граммах (г) как среднее ± SEM, * р < 0,05 против интактной группы; + р < 0,05 против OVX + E2 группы (только для ЕМ-652.HCl группы); (В) содержание белка (данные выражены в % массы ткани как среднее ± SEM; * р < 0,05 против интактной группы; + р < 0,05 против OVX + E2 группы (только для ЕМ-652.HCl группы) и (С) активность липопротеинлипазы (данные выражены в мкЕ/г белка).
Фиг. 8. Демонстрирует действие 20-дневного лечения на массу камбаловидной мышцы (данные выражены в граммах (г) как среднее ± SEM) и липопротеинлипазу (данные выражены в мкЕ/г белка как среднее ± SEM; * р < 0,05 против интактной группы); для интактных крыс, овариэктомированных крыс и овариэктомированных крыс, подвергнутых лечению эстрадиолом и ЕМ-652.HCl.
Подробное описание изобретения
Предпочтительно введение фармацевтической композиции, содержащей фармацевтически приемлемый носитель, разбавитель или носитель и терапевтически эффективное количество селективного модулятора рецептора эстрогена, имеющего нижеследующую общую формулу I:
где R1 и R2 независимо выбраны из группы, состоящей из водорода, гидроксила, -ОМ (причем М выбран из группы, состоящей из прямого или разветвленного C1-C4 алкила, прямого или разветвленного С3 - С4 алкенила, прямого или разветвленного С3 - С4 алкинила) и части, превращаемой in vivo в гидроксил; где G представляет -Н или -СН3; где R3 обозначает тип (заместителя), выбранный из группы, состоящей из пирролидинила, пиперидино, морфолино и NRaRb (причем Ra и Rb представляют, независимо, водород, прямой или разветвленный C1-C6 алкил, прямой или разветвленный С3 - С6 алкенил и прямой или разветвленный С3 - С6 алкинил), и предшественник полового стероидного гормона, выбранного из группы, состоящей из дегидроэпиандростерона, дегидроэпиандростерон сульфата, андрост-5-ен-3b, 17b-диола и соединений, превращаемых in vivo в тот или другой.
СМРЭ вышеупомянутой формулы I обеспечивает неожиданное преимущество, заключающееся в небольшом или полном отсутствии эстрогенного действия на эндометрий, в отличие от СМРЭов, известных из предшествующего уровня техники.
Предпочтительно, чтобы СМРЭ изобретения представлял оптически активное соединение и содержал больше, чем 50% стереоизомера, имеющего абсолютную конфигурацию S на углероде 2.
Кроме того, по причинам стабильности и растворимости в воде (биологическая доступность) предпочтительно, чтобы СМРЭ изобретения представлял соль соединения формулы I и кислоты, выбранной из группы, состоящей из уксусной кислоты, адипиновой кислоты, бензолсульфоновой кислоты, бензойной кислоты, камфорсульфоновой кислоты, лимонной кислоты, фумаровой кислоты, иодисто-водородной кислоты, бромисто-водородной кислоты, хлористо-водородной кислоты, гидрохлортиазидиновой кислоты, гидроксинафтойной кислоты, молочной кислоты, малеиновой кислоты, метансульфоновой кислоты, метилсерной кислоты, 1,5-нафталиндисульфоновой кислоты, азотной кислоты, пальмитиновой кислоты, пивалиновой кислоты, фосфорной кислоты, пропионовой кислоты, янтарной кислоты, серной кислоты, винной кислоты, терефталевой кислоты, п-толуолсульфокислоты и валериановой кислоты.
Одним предпочтительным соединением изобретения является ЕМ-800, раскрытое в РСТ/СА96/00097 (WO 96/26201). Структура молекулы ЕМ-800 представляет:
Другим более предпочтительным соединением изобретения является ЕМ-652.HCl (также называемый ЕМ-01538):
ЕМ-652.HCl обеспечивает дополнительные преимущества по сравнению с другими СМРЭами, такими как ЕМ-800, потому что он не содержит пивалоильных групп, которые могут повысить риск, связанный с уменьшением уровней сывороточного карнитина.
Другие предпочтительные СМРЭы изобретения включают Тамоксифен ((Z)-2-[4-(1,2-дифенил-1-бутенил)]-N,N-диметилэтанамин) (доступный от Zeneca, UK), Торемифен (доступный от Orion-Farmos Pharmaceutical, Finland, or Schering-Plough), Дролоксифен и СР-336156 (цис-1R-[4'-пирролидино-этоксифенил]-23-фенил-6-гидрокси-1,2,3,4-тетрагидронафталин D-(-)-тартратная соль) (Pfizer Inc., USA, описанная в патенте США 5889042) (также называемая Ласофоксифен), Ралоксифен (Eli Lilly and Co., USA), LY 335563 и LY 353381 (Eli Lilly and Co., USA, описанные в международных публикациях WO 98/45287, WO 98/45288 и WO 98/45286), Идоксифен (SmithKline Beecham, USA), Левормелоксифен (3,4-транс-2,2-диметил-3-фенил-4-[4-(2-(2-(пирролидин-1-ил)этокси)фенил]-7-метоксихроман) (Novo Nordisk, A/S, Denmark), который описан Shalmi et al. в международных публикациях WO 97/25034, WO 97/25035, WO 97/25037, WO 97/25038; и Korsgaard et al. WO 97/25036), GW5638 (описан Willson at al., Endocrinology, 138(9), 3901-3911, 1997) и производные индола (раскрытые Miller et al. ЕР 0802183А1) и TSE 424 и ERA 923, разработанные Wyeth Ayerst (США) и раскрытые в патенте Японии 10036347 (American home products corporation) и нестероидальные производные эстрогена, описанные в WO 97/32837. Другие СМРЭы изобретения изложены в: WO 99/07377; WO 98/48806; ЕР 0823437А2; ЕР 0838464А1; ЕР 0835867А1, ЕР 0835868А1; ЕР 0792641А1; ЕР 0873992А1 и ЕР 0895989А1.
Можно использовать любой СМРЭ, когда требуется достичь эффективности (как рекомендовано производителем для лечения и/или профилактики остеопороза или рака молочной железы). Соответствующие дозы известны в данной области. Согласно изобретению может быть использован любой другой коммерчески доступный нестероидный антиэстроген. Может быть использовано любое соединение, имеющее активность, подобную СМРЭам (например, Ралоксифен).
СМРЭы, применяемые в соответствии с изобретением, предпочтительно вводят в диапазоне доз от 0,01 до 10 мг/кг массы тела в день (предпочтительно от 0,05 до 1,0 мг/кг), причем при пероральном введении для человека средней массы тела предпочтительно 60 мг в день, особенно 20 мг в день, или в диапазоне доз от 0,003 до 3,0 мг/кг массы тела в день (предпочтительно от 0,015 до 0,3 мг/кг массы тела), причем 20 мг в день, особенно 10 мг в день, предпочтительно для человека средней массы тела при парентеральном введении (т.е., внутримышечном, подкожном или чрескожном введении). Предпочтительно СМРЭы вводят вместе с фармацевтически приемлемым разбавителем или носителем, как изложено ниже.
Предпочтительными предшественниками половых стероидных гормонов являются дегидроэпиандростерон (ДГЭА, DHEA) (доступный от Diosynth Inc., Chicago, Illinois, USA), его пролекарства (доступные от Steraloids, Wilton, New Hampshire, USA), 5-андростен-3b, 17b-диол и его пролекарства, андрост -5-ен-3b, 17b-диол 3-ацетат и андрост-5-ен-3b,17b-диол дигемисукцинат (доступные от Steraloids, Wilton, New Hampshire USA).
Предшественник полового стероидного гормона может быть представлен в виде спиртового геля, содержащего от 2,0 до 10% триглицерида каприловой - каприновой кислот (Neobee M-5); от 10 до 20% гексиленгликоля; от 2,0 до 10% диэтиленгликоль монометилового эфира (Transutol); от 2,0 до 10% Циклометикона (Dow Corning 345); от 1,0 до 2% бензилового спирта и от 1,0 до 5,0% гидроксипрогтолцеллюлозы (Klucel HF).
Кроме того, носитель (для либо СМРЭ, либо предшественника) может включать различные добавки, обычно используемые в фармацевтической промышленности. Например, могут присутствовать ароматизирующие вещества, антиоксиданты, отдушки, желирующие вещества, загустители, такие как карбоксиметилцеллюлоза, поверхностно-активные вещества, стабилизаторы, средства для смягчения, красители и другие подобные средства. Когда активные компоненты вводят трансдермально, место нанесения на кожу следует менять для того, чтобы избежать избыточной локальной концентрации активного компонента и возможной сверхстимуляции кожи и сальных желез андрогенными метаболитами предшественника полового стероидного гормона.
В фармацевтической композиции для перорального применения, ДГЭА или другой предшественник предпочтительно присутствует в концентрации в диапазоне от 5 до 98% масс. относительно общей массы композиции, более предпочтительно от 50 до 98% масс., в частности от 80 до 98% масс. Может быть использован один предшественник, такой как ДГЭА, в качестве единственного активного компонента, или альтернативно можно использовать множество предшественников и/или их аналогов (например, комбинацию ДГЭА, ДГЭА - С (DHEA-S), 5-диола, или комбинацию двух или нескольких соединений, превращаемых in vivo в ДГЭА, ДГЭА - С или 5-диол или комбинацию ДГЭА или 5-диола и одного или нескольких их аналогов, которые превращаются в ДГЭА или 5-диол in vivo, и т.д.). Уровень ДГЭА в крови является конечным критерием адекватной дозы с учетом индивидуального варьирования, обусловленного различием в абсорбции и обмене веществ.
Предпочтительно лечащему врачу следует, особенно в начале лечения, следить за общей реакцией индивидуального пациента и уровнями ДГЭА в сыворотке (по сравнению с предпочтительными сывороточными концентрациями, изложенными выше), и контролировать общую реакцию пациента на лечение, регулируя дозы, по мере необходимости, в тех случаях, когда метаболизм данных пациентов или реакция на лечение становится атипичной.
Лечение в соответствии с изобретением применимо на протяжении неопределенного периода времени. Предполагают, что лечение ДГЭА и/или 5-диолом или другим предшественником будет просто поддерживать уровни ДГЭА в пределах диапазона, подобного тому, который имеет место, от природы, у женщин перед менопаузой (концентрация в сыворотке между 4 и 10 микрограммами на литр), или который имеет место, от природы, у молодых взрослых мужчин (концентрация в сыворотке между 4 и 10 микрограммами на литр).
Соединение - СМРЭ и/или предшественник полового стероидного гормона могут быть также введены пероральным путем и могут быть включены в рецептуру таблеток или капсул для перорального введения вместе с обычными фармацевтическими наполнителями, например высушенной распылением лактозой, микрокристаллической целлюлозой и стеаратом магния.
Активное вещество может быть включено в состав таблеток или ядер драже путем смешения с твердыми, измельченными в порошок веществами-носителями, такими как цитрат натрия, карбонат кальция или двухкальциевый фосфат, и связующими, такими как поливинилпирролидон, желатин или производные целлюлозы, кроме того, возможно добавление смазок, таких как стеарат магния, лаурилсульфат натрия, "Carbowax" или полиэтиленгликоль. Конечно, в случае форм для перорального введения можно добавить вещества, улучшающие вкус.
В качестве дополнительных форм можно использовать твердые капсулы, например, из твердого желатина, а также закрытые мягкие желатиновые капсулы, включающие размягчитель или пластификатор, например глицерин. Твердые капсулы содержат активное вещество предпочтительно в форме гранулята, например, в смеси с наполнителями, такими как лактоза, сахароза, маннит, крахмалы, такие как картофельный крахмал или амилопектин, производные целлюлозы или сильно диспергированные кремниевые кислоты. В мягких желатиновых капсулах активное вещество предпочтительно растворено или суспендировано в подходящих жидкостях, таких как растительные масла, или жидких полиэтиленгликолях.
Возможны формы в виде лосьона, мази, геля или крема и их следует тщательно втирать в кожу так, чтобы не было явно видно никакого избытка, и кожу в области нанесения не следует мыть до тех пор, пока большая часть препарата не проникнет внутрь кожи, предпочтительно, по крайней мере, на протяжении 4 часов и более предпочтительно, по крайней мере, 6 часов.
Можно использовать трансдермальный пластырь для доставки предшественника или СМРЭ в соответствии с известными способами. Обычно его применяют на протяжении значительно более длительного периода времени, например от 1 до 4 дней, однако обычно активный компонент контактирует с меньшей площадью поверхности, позволяя медленную и постоянную доставку активного компонента.
Целый ряд трансдермальных систем доставки лекарственных средств, которые были разработаны и которые находят применение, пригодны для доставки активного компонента данного изобретения. Скорость высвобождения обычно контролируется диффузией через матрицу или проходом активного компонента через регулирующую мембрану.
Механические аспекты трансдермальных устройств общеизвестны для крысы (модель), и они изложены, например, в патентах США 5162037, 5154922, 5135480, 4666441, 4624665, 3742951, 3797444, 4568343, 5064654, 5071644, 5071657, описания которых включены здесь в качестве уровня техники. Дополнительные материалы известного уровня техники имеются в европейском патенте 0279982 и заявке на патент Великобритании 2185187.
Устройство может быть любым из общепризнанных в данной области типов, включая трансдермальные устройства доставки на основе адгезивной матрицы и трансдермальные устройства на основе резервуара. Устройство может включать содержащие лекарственное средство матрицы, включающие волокна, которые абсорбируют активный компонент и/или носитель. В устройстве типа резервуара резервуар может быть ограничен полимерной мембраной, непроницаемой для носителя и активного компонента.
В трансдермальном устройстве устройство, само по себе, поддерживает контакт активного компонента с желаемой локализованной поверхностью кожи. В таком устройстве вязкость носителя для активного компонента имеет меньшее значение, чем в случае крема или геля. Система растворителя для трансдермального устройства может включать, например, олеиновую кислоту, лактат линейного спирта и дипропиленгликоль или другие системы растворителя, известные в данной области. Активный компонент может быть растворен или суспендирован в носителе.
Для прикрепления к коже трансдермальный пластырь может монтироваться на хирургическом лейкопластыре, имеющем отверстие, перфорированное в середине. Вышеуказанный адгезив предпочтительно покрывают съемной прокладкой, чтобы защитить его до использования. Обычный материал, подходящий для удаления, включает полиэтилен и бумагу, покрытую полиэтиленом и предпочтительно покрытую силиконом для простоты удаления. В случае применения устройства прокладку, предназначенную для удаления, снимают и адгезив прикрепляют к коже пациента. В патенте США 5135480, раскрытие сущности которого включено в качестве уровня техники, Bannon et al. описывают альтернативное устройство, имеющее неадгезивное средство для обеспечения устройства для кожи.
Кроме того, можно использовать чрескожные системы доставки или системы доставки через слизистую оболочку данного изобретения в качестве новой и улучшенной системы доставки лекарственного средства для профилактики и/или лечения ожирения.
ПРИМЕРЫ ЭФФЕКТИВНОСТИ СПОСОБОВ ИЗОБРЕТЕНИЯ
Пример 1
Эффект 35-недельного лечения соединениями изобретения на общий жир тела и массу тела овариэктомированной (OVX) крысы.
ВЕЩЕСТВА И СПОСОБЫ
Животные и лечение
Были использованы крысы-самки Sprague-Dawley (Crl:CD(SD)Br) (Charles River Laboratory, St-Constant, Canada) в возрасте десяти-двенадцати недель, весом приблизительно 225-250 г в начале лечения. Животные были подвергнуты акклиматизации к условиям окружающей среды (температура: 22 ± 3°С; влажность: 50 ± 20%; циклы фотопериода: 12 ч свет - 12 ч темнота, освещение с 07:15 ч) в течение 1 недели перед началом эксперимента. Животных размещали по три в клетку и предоставляли свободный доступ к водопроводной воде и гранулированной сертифицированной пище для грызунов (Lab Diet 5002, Ralston Purina, St-Louis, МО). Эксперимент проводили на оборудовании, одобренном Канадским Советом по уходу за животными в соответствии с руковод