Фармацевтическая композиция для назального всасывания
Иллюстрации
Показать всеИзобретение относится к лекарственным средствам и касается фармацевтической композиции для назального всасывания, включающей биологически активный кислый полипептид с изоэлектрической точкой 7 или ниже; носитель, который является нерастворимым или слаборастворимым в воде и имеет средний размер частицы 100 мкм или меньше; и добавку для диспергирования и закрепления полипептида на поверхности носителя, который является нерастворимым или слаборастворимым в воде, где средний размер частицы указанной добавки меньше среднего размера носителя и находится в области от 1 мкм до 20 мкм. Композиции по изобретению демонстрируют улучшенную биодоступность биологически активного полипептида. 5 з.п. ф-лы, 4 ил., 11 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к фармацевтической композиции для назального всасывания и, более конкретно, к фармацевтической композиции для назального всасывания, которая содержит в качестве активного ингредиента биологически активный кислый полипептид с изоэлектрической точкой 7 или ниже и добавки, которые усиливают биодоступность пептида.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Биологически активные полипептиды представляют собой высокомолекулярные соединения, обладающие различными специфическими фармакологическими активностями, и представляют собой соединения, весьма полезные для использования в области медицины для различных целей. Например, известен глюкагоноподобный пептид I (далее в настоящем документе упоминается как GLP-1), пептидный гормон, происходящий из предшественника глюкагона (проглюкагона) (Bell et al., Nature, 304, 368, 1983). Проглюкагон, который был идентифицирован у млекопитающих, представляет собой белок-предшественник, состоящий из 160 аминокислот и вырабатываемый А-клетками панкреатических островков (островков Лангерганса) и L-клетками кишечника. В поджелудочной железе проглюкагон преобразовывается преобразующим ферментом в глюкагон и главный проглюкагоновый фрагмент, в то время как в кишечнике проглюкагон преобразовывается по-другому, с образованием глицентина, GLP-1, и глюкагоноподобного пептида-2 (далее в настоящем документе упоминается как GLP-2) (Mojsovr et al., J. Biol. Chem., 261, 11880, 1986).
Пептид, образованный аминокислотами 72-108 проглюкагона (эквивалентный GLP-1), активен в отношении усиления секреции инсулина. Также GLP-1(7-37), который образуется в результате удаления первых 6 N-концевых аминокислот из GLP-1, и GLP-1(7-36)NH2, который образуется в результате амидирования GLP-1(7-37) по позиции 36, являются наиболее эффективными промоторами секреции инсулина среди ранее известных промоторов секреции инсулина (Mojsov et al., J. Clin. Invest., 79, 616, 1987). Они также активны в отношении подавления секреции глюкагона. Было показано, что GLP-1 секретируется из L-клеток кишечника в кровоток в форме GLP-1(7-36)NH2 (Gutniak et al., N. Engl. J. Med., 326, 1316, 1993).
GLP-1(7-36)NH2 немедленно секретируется из L-клеток кишечника в ответ на раздражитель в виде проглатывания пищи и действует на поджелудочную железу, способствуя секреции инсулина. В то же время он уменьшает секрецию глюкагона, увеличивает экспрессию мРНК в инсулин-секретирующих клетках, уменьшает глюконеогенез в печени и подавляет активность желудочно-кишечного тракта. Это предполагает жизненно важную роль GLP-1, включая GLP-1(7-36)NH2, как инкретина (стимулятора секреции инсулина), который отвечает требованиям энергетического метаболизма в организме человека.
Обладая описанными выше биологическими активностями, пептиды находят свое применение в качестве лекарственного средства для лечения диабета. Конкретно, GLP-1(7-36)NH2 можно вводить перед приемом пищи для подавления подъема после приема пищи уровня глюкозы в крови, так что он может действовать как эффективный терапевтический агент для пациентов с диабетом II типа. Лекарственные средства на основе сульфонилмочевины, которые обладают сходной активностью в отношении усиления секреции инсулина, связаны с риском возникновения чрезмерно низкого уровня глюкозы в крови, поскольку указанные лекарственные средства проявляют свою активность вне зависимости от уровня глюкозы в крови. В случае введения в течение продолжительного периода времени указанные лекарственные средства могут также сделать инсулин-продуцирующие клетки менее активными. Напротив, поскольку активность GLP-1(7-36)NH2 в отношении усиления секреции инсулина регулируется механизмом обратной связи, отражающим концентрацию глюкозы в крови, GLP-1(7-36)NH2 редко вызывает возникновение чрезмерно низкого уровня глюкозы в крови. Кроме того, GLP-1(7-36)NH2 стимулирует инсулин-продуцирующие клетки. Таким образом, в настоящее время существует резкий контраст между GLP-1(7-36)NH2 и лекарственными средствами на основе сульфонилмочевины при клиническом использовании в качестве лекарственного средства для лечения диабета.
Различные активности GLP-1(7-36)NH2, включая подавление глюконеогенеза в печени, активацию инсулин-продуцирующих клеток, усиление захвата сахара мышцами, подавление активности желудочно-кишечного тракта и подавление аппетита через центральную нервную систему, дали основания ожидать, что, помимо его активности в отношении коррекции уровней глюкозы в крови после приема пищи, введение GLP-1(7-36)NH2 в течение продолжительного периода времени может нормализовать и активировать целостность системного метаболизма глюкозы и уменьшать ожирение, один из главных факторов диабета.
Другим пептидом, который имеет сходную с GLP-1(7-36)NH2 эндокринную активность (т.е. стимулирует секрецию инсулина), является эксендин-4, который был выделен из ядозуба (вида рептилии), и структура которого была установлена. Указанный пептид является менее чувствительным к деградации в плазме крови по сравнению с GLP-1(7-36)NH2 и, следовательно, способен сохранять свою активность в отношении усиления секреции инсулина в течение продолжительного периода времени. Как в случае GLP-1(7-36)NH2, известно, что эксендин-4 индуцирует дифференцировку/неогенез β-клеток.
Поскольку 8-я позиция GLP-1(7-37) и GLP-1(7-36)NH2 расщепляется дипептидилпептидазой IV (DPP-IV), существующей в живом организме, производное, в котором Ala в 8-й позиции замещен аминокислотой, которая нелегко расщепляется, такой как Val, т.е. [Val8]-GLP-1(7-37), и производное, в котором GLP-1 модифицирован жирной кислотой для удлинения видимого полупериода существования в плазме крови путем контролирования скорости растворения, т.е. [Lys26, ε-NH{γ-Glu(N-α-пальмитоил)}]-GLP-1(7-37), как надеются, имеют то же самое действие. С другой стороны, недавние исследования показали, что GLP-1(9-37), который расщеплен в 8-й позиции, обладает тем же понижающим уровень глюкозы в крови действием (Deacon et al., Am. J. Physiol. Endocrinol. Matb. 282, 873-879, 2002). Благодаря данному открытию, нет необходимости подтверждать преимущество замены аминокислотного остатка GLP-1(7-36)NH2 в 8-й позиции и модификации GLP-1(7-36)NH2 жирной кислотой для продления видимого полупериода существования в плазме крови.
Желудочный ингибирующий полипептид (далее в настоящем документе упоминается как GIP), пептид, который стимулирует секрецию инсулина глюкозозависимым образом, отличается от GLP-1 и эксендина-4 в том, что пептид, помимо способности усиливать секрецию инсулина, может усиливать секрецию глюкагона.
Из указанных пептидных инкретинов GLP-1(7-36)NH2 имеет аминокислотную последовательность, общую для млекопитающих, и считается идеальным лекарственным средством для лечения диабета. Однако GLP-1(7-36)NH2 плохо всасывается из желудочно-кишечного тракта в силу своей пептидной природы. Это в значительной степени мешает разработке пептида в качестве лекарственного средства для лечения диабета.
Как известно, помимо перорального введения, пептид можно вводить через кожу путем подкожной инъекции. Однако долгосрочные подкожные инъекции должны контролироваться врачами, а учитывая обременительность и боли в местах инъекций, инъекция не является удобным путем для долгосрочного введения лекарственного средства для лечения диабета. Хотя пептид может эффективно корректировать высокие уровни глюкозы в крови, когда его вводят после каждого приема пищи, подкожные инъекции 3 раза в день очевидно не являются практичным путем для введения пептида. Кроме того, маловероятно, что самостоятельные инъекции инсулина, которые производят не только пациенты с диабетом I типа, но также пациенты с диабетом II типа, будут производиться в комбинации с самостоятельными инъекциями композиции GLP-1.
Для того, чтобы решить описанные выше проблемы, были предприняты попытки абсорбировать GLP-1(7-36)NH2 через слизистую оболочку ротовой полости в форме препарата типа пластыря (Gutniak et al., Diabetes care, 20, 1874, 1997). Данная конкретная форма введения, однако, включает использование усилителей всасывания, в данном примере таурохолата натрия, который представляет собой тип желчной кислоты и вызывает сильное раздражение. В результате раздражение является неизбежным, и слизистая оболочка может быть повреждена, что делает данный способ введения непригодным для долгосрочного введения.
Таким образом, на данный момент времени не существует практичной неинъекционной методики введения GLP-1(7-36)NH2 и других пептидных инкретинов, которая была бы безопасной, обеспечивала бы высокую биодоступность и была бы удобной для частой доставки лекарственного средства. Все еще существует потребность в разработке подобной методики.
В отличие от низкомолекулярных соединений, биологически активные полипептиды не вводятся эффективным образом никаким путем введения, кроме инъекции. Главными причинами этого является тот факт, что биологически активные полипептиды подвергаются расщеплению пищеварительными ферментами, присутствующими в желудке и тонком и толстом кишечнике или в абсорбирующих эпителиях данных органов, носовой полости и легких, и что полипептиды, благодаря своей большой молекулярной массе, не транспортируются посредством обычных путей транспортировки. По указанным причинам недавно были предложены назальные пептидные препараты, предназначенные для назального всасывания, в качестве жизнеспособной неинъекционной методики для введения пептидов. Обычно указанный назальный пептидный препарат вводят распылением раствора пептида с помощью ингалятора в носовую полость в присутствии усилителей всасывания. Одна проблема данного подхода состоит в том, что среди различных известных биологически активных полипептидов некоторые пептиды, включая GLP-1(7-36)NH2, которые имеют изоэлектрическую точку (далее упоминается как pI) в кислом или нейтральном диапазоне, имеют тенденцию становиться нестабильными в кислом или нейтральном растворе.
Например, в результате наблюдений авторов настоящего изобретения было установлено, что в то время как раствор GLP-1(7-36)NH2 при назальном введении крысам и другим животным до некоторой степени всасывается, пептид становится нерастворимым, когда раствор хранится более нескольких десятков часов (см. ссылочный пример, ниже). Таким образом, препарат в виде раствора является неудобным для использования с фармацевтической композицией, даже если она представляет собой такой тип, в котором пептид растворяют каждый раз, когда используется препарат.
Подобно этому, известно, что глюкагон и инсулин имеют изоэлектрическую точку в кислом или нейтральном диапазоне рН и становятся нерастворимыми или кристаллизуются в кислом или нейтральном растворе. Известно, что многие подобные пептиды имеют изоэлектрическую точку в кислом или нейтральном диапазоне рН и, таким образом, становятся нерастворимыми или кристаллизуются в кислом или нейтральном растворе. Следовательно, практически невозможно вводить данные пептиды интраназально в форме препарата кислого или нейтрального раствора.
С другой стороны, ожидается, что кислые биологически активные полипептиды будут хорошо растворяться в щелочном (основном) растворителе. Однако, когда кислые биологически активные полипептиды подвергались воздействию основного раствора, кислый биологически активный полипептид не только становился чувствительным к деградации, такой как гидролиз, которая также может иметь место в кислой среде, но также приобретал тенденцию к рацемизации. В результате его химическая стабильность снижалась. Как кислые, так и основные биологически активные полипептиды могут подвергаться указанным побочным реакциям. Известно, например, что казеин (pI = около 4,6), основный биологически активный полипептид, становится нестабильным, когда его аминокислотные остатки аспарагиновой кислоты, фенилаланина, глутаминовой кислоты и аланина претерпевают рацемизацию в основном растворе (Friedman et al., J. Food Sci., 47, 760-764, 1982). Органические кислоты включают разнообразные материалы, включая уксусную кислоту и масляную кислоту, каждая из которых является биологическим соединением, и длинноцепочечные карбоновые кислоты, такие как октановая кислота и декановая кислота, каждая из которых является пищевым веществом. Многие из указанных органических кислот можно использовать в фармацевтической композиции в качестве добавок. С другой стороны, многие органические основания, такие как серотонин и дофамин, как известно, обладают фармакологической активностью. Щелочные металлы, такие как натрий, во многих случаях не подходят в качестве добавки в фармацевтической композиции, поскольку они часто делают затруднительным подбор рН композиции и имеют тенденцию образовывать соль с кислым пептидом, влияя, таким образом, на свойства пептида. По указанным причинам не является предпочтительным, принимая во внимание химическую стабильность и выбор добавочных компонентов, представлять кислый биологически активный полипептид в форме щелочного раствора.
Как описывалось выше, не является предпочтительным представлять кислые биологически активные полипептиды ни в форме кислого или нейтрального раствора, ни в форме щелочного раствора. Таким образом, кислые биологически активные полипептиды не подходят для применения в препаратах в виде растворов для назального введения.
Для определенных типов биологически активных полипептидов, таких как инсулин, кальцитонин, паратироидный гормон (PTH), гормон роста человека (HGH) и гормон гипоталамуса (LH-RH), в качестве альтернативы назальному препарату в форме раствора были предложены порошкообразные препараты для назального всасывания. Многие соединения испытывались на возможность их использования в качестве носителя для указанных порошкообразных препаратов для назального введения, и были предложены различные порошкообразные композиции с использованием нескольких различных носителей для назального введения биологически активных полипептидов.
В ходе исследований было установлено, что вещества, которые являются нерастворимыми или малорастворимыми в воде, но могут растворяться в воде в кислых условиях, могут служить высокоэффективными носителями для порошкообразного препарата для назального введения биологически активных полипептидов. Например, были предложены фармацевтические композиции для назального введения, в которых в качестве носителя используется соединение поливалентного металла, такое как гидроксиапатит и карбонат кальция (выложенная заявка на патент Японии № Hei 8-27031), вещества, обладающие способностью восстанавливать или защищать слизистую оболочку, в частности, слизистую оболочку желудка (выложенная заявка на патент Японии № Hei 9-255586), или порошкообразные зерна (выложенная заявка на патент Японии № 2000-239187).
Однако один порошкообразный препарат, который был изготовлен диспергированием и адсорбцией GLP-1(7-36)NH2 на носителе, таком как соединение поливалентного металла, показал биодоступность GLP-1(7-36)NH2, составляющую у собак приблизительно 4% и у обезьян - 1% или менее, при назальном введении указанным животным. Таким образом, назальное всасывание препарата было менее чем удовлетворительным.
Биологически активные полипептиды, такие как GLP-1(7-36)NH2, чьи изоэлектрические точки находятся в кислом или нейтральном диапазоне рН, обладают низкой растворимостью в кислом или нейтральном диапазоне рН и, даже будучи растворены в растворе, имеют тенденцию к агрегации. Указанные полипептиды не могут достигать достаточной биодоступности не только при назальном введении в форме раствора, но даже при назальном введении в форме порошкообразного препарата. Таким образом, еще предстоит установить эффективный неинъекционный путь для введения данных пептидов.
Композиция для назального введения, состоящая из циклического пептида и композиции поливалентного металла в качестве носителя, описана в WO 01/52894 A2. Описано также, что можно добавлять усилитель всасывания, такой как рисовая мука и крахмал, а размеры частиц указанного усилителя должны предпочтительно составлять 250 мкм или менее, более предпочтительно от 20 до 180 мкм. Тем не менее, в указанном источнике нет описания, касающегося способа улучшения биодоступности путем добавления усилителя приблизительно с тем же размером частиц, что и у носителя, к биологически активному кислому полипептиду с изоэлектрической точкой 7 или ниже по настоящему изобретению.
Соответственно, целью настоящего изобретения является создание фармацевтической композиции, которая делает возможным назальное введение биологически активных полипептидов с изоэлектрической точкой в кислом или нейтральном диапазоне рН. Указанные полипептиды имеют плохую биодоступность при пероральном введении или при введении другими неиъекционными путями, имеют низкую растворимость в кислом или нейтральном диапазоне рН и имеют тенденцию агрегировать, даже когда они растворены в растворе. Фармацевтическая композиция является безопасной и достигает высокой биодоступности, в то же время не вызывая раздражения.
Пытаясь найти пути достижения указанной цели, авторы настоящего изобретения изучали возможные добавки в качестве потенциального компонента композиции для назального введения пептидов. Сначала изучали крахмал, чтобы установить, может ли он в качестве добавки помочь стабилизировать пептид.
Крахмал, пищевое вещество, имеющееся в избытке в зерновых, представляет собой материал, который можно безопасно использовать в качестве добавки в композиции для назального всасывания. Крахмал состоит из амилозы, которая составлена из глюкозных единиц, соединенных α-1,4-связями, с образованием прямой цепи, и амилопектина, который включает α-1,6-связи и, таким образом, является разветвленным.
Соединение поливалентного металла используется в качестве носителя в комбинации с несколькими различными типами крахмала, содержащими амилозу и амилопектин в различных пропорциях, в качестве добавок для изготовления фармацевтических композиций для назального всасывания. Каждую фармацевтическую композицию изучали на предмет ее назальной всасываемости. Также изучалось влияние размера частиц крахмала в качестве добавки для фармацевтической композиции на усиление назального всасывания.
В результате авторы настоящего изобретения установили, что введением следующей назальной порошкообразной композиции в носовую полость может достигаться улучшенное назальное всасывание и может, таким образом, обеспечиваться эффективное клиническое лечение. Указанную композицию изготавливают однородным диспергированием и закреплением кислого биологически активного полипептида, такого как GLP-1(7-36)NH2, на поверхности порошкообразного или кристаллического соединения поливалентного металла в качестве носителя, который является нерастворимым или малорастворимым в воде и имеет средний размер частиц 100 мкм или менее, такого как соединение двухвалентного металла или металла с более высокой валентностью, например соединения кальция, с использованием добавки, такой как рисовая мука (порошок Domyo-ji), кукурузный крахмал, картофельный крахмал и их прежелатинизированный или частично прежелатинизированный крахмал, каждый из которых содержит амилопектин и амилозу в определенной пропорции.
Авторы настоящего изобретения также установили, что в случае использования нерастворимого в воде крахмала в качестве добавки и соединения поливалентного металла, такого как карбонат кальция, со средним размером частиц 100 мкм или менее, в качестве носителя, нерастворимый в воде крахмал с размером частиц меньше, чем у носителя, демонстрирует замечательный эффект усиления всасывания кислого пептида, такого как GLP-1(7-36)NH2. Настоящее изобретение было завершено на основе данных открытий.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соответственно, настоящее изобретение относится к фармацевтической композиции для назального всасывания, включающей биологически активный кислый полипептид с изоэлектрической точкой 7 или ниже, носитель, который является нерастворимым или малорастворимым в воде, и добавку для диспергирования и закрепления полипептида на поверхности носителя.
Настоящее изобретение относится также к фармацевтической композиции для назального всасывания, включающей биологически активный полипептид с изоэлектрической точкой 7 или ниже, т.е. в нейтральном или кислом диапазоне рН, соединение поливалентного металла в качестве носителя и добавку для диспергирования и закрепления полипептида на поверхности носителя.
Конкретный вариант фармацевтической композиции по настоящему изобретению для назального всасывания содержит, вместе с добавкой, имеющей средний размер частиц от 1 мкм до 20 мкм, эффективную дозу биологически активного полипептида с изоэлектрической точкой в нейтральном или кислом диапазоне рН таким образом, что полипептид является однородно диспергированным и закрепленным на поверхности порошкообразного или кристаллического соединения поливалентного металла в качестве носителя, имеющего средний размер частиц 100 мкм или менее.
Другой конкретный вариант фармацевтической композиции по настоящему изобретению для назального всасывания содержит пептидный инкретин, соединение поливалентного металла в качестве носителя, и, более конкретно, настоящее изобретение относится к композиции, содержащей носитель, который является нерастворимым или малорастворимым в воде, вместе с соединением поливалентного металла в форме тонкоизмельченного порошка или в кристаллической форме, имеющим средний размер частиц 100 мкм или менее, и добавку для диспергирования и закрепления пептидного инкретина на поверхности носителя со средним размером частиц от 1 мкм до 20 мкм.
Средний размер частиц добавки представляет средний размер частиц нерастворимой в воде или малорастворимой в воде композиции крахмала на поверхности носителя, когда композицию изготавливают способом по настоящему изобретению с использованием включения крахмала с прежелатинизированным крахмалом или компонентами, включая прежелатинизированный крахмал.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
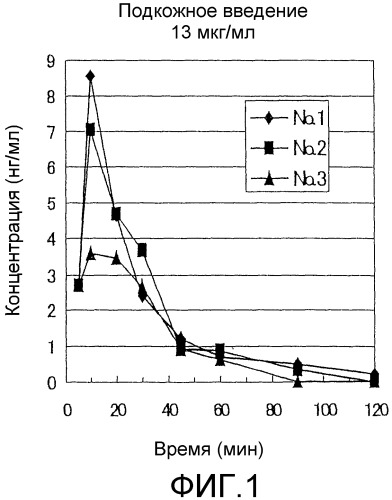
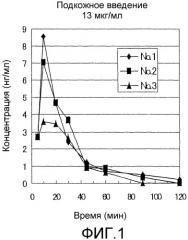
Фиг.1 представляет собой график, показывающий изменения в плазменных концентрациях GLP-1(7-36)NH2 в примере 2 после подкожного введения.
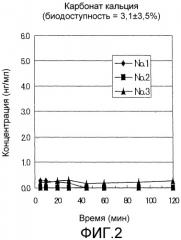
Фиг.2 представляет собой график, показывающий изменения с течением времени в плазменных концентрациях GLP-1(7-36)NH2 в примере 2 после назального введения композиций, не содержащих добавок.
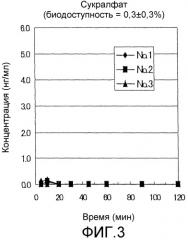
Фиг.3 представляет собой график, показывающий изменения с течением времени в плазменных концентрациях GLP-1(7-36)NH2 в примере 2 после назального введения композиций, не содержащих добавок, с использованием сукралфата в качестве носителя.
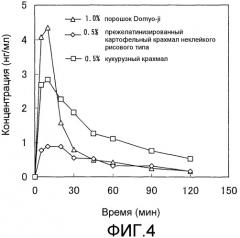
Фиг.4 представляет собой график, показывающий изменения с течением времени в плазменных концентрациях GLP-1(7-36)NH2 в примере 2 после назального введения композиций, содержащих добавки.
ЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Как описано выше, настоящее изобретение относится к фармацевтической композиции для назального всасывания, которая имеет высокую биодоступность и делает возможным назальное введение биологически активных полипептидов, имеющих изоэлектрическую точку 7 или ниже, которые демонстрируют низкую растворимость в кислом или нейтральном диапазоне рН и имеют тенденцию к агрегации, даже когда они растворены в растворе. Указанные полипептиды имеют низкую биодоступность и не подходят для перорального введения или введения посредством других неинъекционных путей. В одном конкретном, предпочтительном варианте осуществления настоящее изобретение относится к фармацевтической композиции для назального всасывания, содержащей производные GLP-1, такие как GLP-1, амид GLP-1, GLP-1(7-36)NH2, GLP-1(9-36)NH2, GLP-1(9-37), GLP-1(7-37), [Val8]-GLP-1(7-36)NH2, [Val8]-GLP-1(7-37), [Lys26, ε-NH{γ-Glu(N-α-пальмитоил)}]-GLP-1(7-37) и GLP-2, эксендин-3, эксендин-4, глюкагон, желудочный ингибирующий пептид (GIP) или инсулин.
Высокая биодоступность фармацевтической композиции для назального всасывания по настоящему изобретению обеспечивается благодаря биологически активным полипептидам, диспергированным и закрепленным на поверхностях носителя стабильным и однородным образом с помощью добавки.
В случае использования бета- или частично прежелатинизированных, нерастворимых в воде или малорастворимых в воде крахмалов в качестве добавок, использование рисового крахмала и кукурузного крахмала с малым средним размером частиц может увеличить площадь поверхности и может улучшить элюирование, и, таким образом, может быть улучшено всасывание. Следовательно, добавки со средним размером частиц от 1 мкм до 20 мкм предпочтительно используются для улучшения всасывания по настоящему изобретению.
Таким образом, добавкой для использования в настоящем изобретении может быть любая добавка, которая позволяет биологически активному полипептиду диспергироваться и закрепляться на поверхностях носителя стабильным и однородным образом. Например, крахмалы, содержащие амилопектин и амилозу, как независимо, так и в определенной пропорции, могут быть использованы в качестве указанной добавки. Крахмалы, полученные из риса, кукурузы и т.п., обычно классифицируются на крахмалы "неклейкого рисового" типа, содержащие амилопектин и амилозу в соотношении приблизительно от 7:3 до 8:2, и крахмалы "клейкого рисового" типа, состоящие практически только из амилопектина. Конкретно, примеры добавок для использования в настоящем изобретении включают рисовую муку, рисовый крахмал, кукурузный крахмал, картофельный крахмал, бета-крахмал, такой как рисовый бета-крахмал (неклейкого рисового типа), рисовый бета-крахмал (клейкого рисового типа), кукурузный бета-крахмал (неклейкого рисового типа), кукурузный бета-крахмал (клейкого рисового типа) и картофельный бета-крахмал (неклейкого рисового типа); прежелатинизированный рисовый крахмал (неклейкого рисового типа), прежелатинизированный рисовый крахмал (клейкого рисового типа), прежелатинизированный кукурузный крахмал (неклейкого рисового типа), прежелатинизированный кукурузный крахмал (клейкого рисового типа), прежелатинизированный картофельный крахмал (неклейкого рисового типа), прежелатинизированный пшеничный крахмал (неклейкого рисового типа) и их частично прежелатинизированный крахмал.
Несмотря на свою небольшую растворимость в воде, крахмалы можно желатинизировать нагреванием с водой, что вызывает утрату кристаллической структуры. Как полностью желатинизированный крахмал (прежелатинизированный крахмал или альфа-крахмал), так и частично прежелатинизированный крахмал можно использовать в качестве добавки по настоящему изобретению.
Рисовую муку изготавливают размалыванием белков рисовых семян, которые остаются после удаления из семян шелухи и зародышей. Рисовая мука содержит много крахмала и широко используется в пищу и в фармацевтических добавках. В настоящем изобретении рисовая мука, не прошедшая тепловую обработку, которая состоит из бета-крахмала, является предпочтительной по сравнению с прошедшей тепловую обработку рисовой мукой, содержащей прежелатинизированный крахмал (альфа-крахмал) или частично прежелатинизированный крахмал, однако прошедшую тепловую обработку рисовую муку можно также использовать. Одним примером предпочтительной рисовой муки является порошок Domyo-ji, содержащий прежелатинизированный рисовый крахмал. Кроме того, в настоящем изобретении можно использовать не только кукурузный крахмал, состоящий из бета-крахмала, но также частично прежелатинизированный или прежелатинизированный кукурузный крахмал (альфа-крахмал).
Помимо этого, в качестве добавки в назальных композициях по настоящему изобретению можно использовать смеси указанных крахмалов.
Также в качестве добавки в назальных композициях по настоящему изобретению можно использовать олигосахариды, карбоксивиниловый полимер, повидон, гидроксипропилцеллюлозу (НРС), ксантановую камедь, пектин, альгинат натрия, порошкообразную аравийскую камедь и желатин.
Биологически активные полипептиды, используемые в композиции для назального всасывания по настоящему изобретению, представляет собой такие полипептиды, которые имеют изоэлектрическую точку (pI) 7 или ниже. Указанные полипептиды обладают низкой растворимостью в кислом или нейтральном диапазоне рН и имеют тенденцию агрегировать, даже когда они растворены в растворе.
Примеры предпочтительных биологически активных полипептидов показаны ниже, вместе с соответствующими им изоэлектрическими точками:
GLP-1 (pI=5,05); амид GLP-1 (pI=5,47); GLP-1(7-36)NH2 (pI=6,76); GLP-1(7-37) (pI=5,53); GLP-1(9-36)NH2 (pI=4,68); GLP-1(9-37) (pI=4,87); [Val8]-GLP-1(7-36)NH2 (pI=6,76); [Val8]-GLP-1(7-37) (pI=5,53); [Lys26, ε-NH{γ-Glu(N-α-пальмитоил)}]-GLP-1(7-37) (pI=4,57); GLP-2 (pI=4,45); эксендин-3 (pI=4,96); эксендин-4 (pI=4,96); глюкагон (pI=6,75) и желудочный ингибирующий пептид (GIP) (pI=6,92); инсулин (pI=5,39).
Другие биологически активные полипептиды, которые можно вводить назально, также можно использовать; ниже приводятся примеры (далее pI обозначает изоэлектрическую точку, М.м. обозначает молекулярную массу, и все соединения получены от людей, за исключением эксендина-3 и эксендина-4):
кальцитонин (pI: 6,72, М.м.: 3420,88), катакальцин (pI: 5,26, М.м.: 2436,62), холецистокинин-12 (pI: 3,93, М.м.: 1535,71), холецистокинин-8 (pI: 3,56, М.м.: 1064,20), предшественник кортикотропина-липотропина (pI: 5,22, М.м.: 8469,32), кортикотропиноподобный промежуточный пептид (pI: 3,91, М.м.: 2309,51), липотропин-β (pI: 6,17, М.м.: 9805,94), липотропин-γpI: 4,66, М.м.: 6074,57), меланотропин-β (pI: 5,57, М.м.: 2204,40), кортиколиберин (pI: 5,09, М.м.: 4758,49), эндотелин-1 (pI: 4,54, М.м.: 2495,94), эндотелин-2 (pI: 4,54, М.м.: 2550,9), эндотелин-3 (pI: 5,38, М.м.: 2647,09), пептид, связанный с галаниновым сигналом (pI: 4,49, М.м.: 6671,52), гастрин-71 (pI: 5,17, М.м.: 8066,88), гастрин-34 (pI: 4,25, М.м.: 3867,26), гастрин-17 (pI: 3,40, М.м.: 2116,24), желудочный ингибирующий пептид (pI: 6,92, М.м.: 4983,59), полипептид, связанный с глицентином (pI: 4,13, М.м.: 3384,50), глюкагон (pI: 6,75, М.м.: 3482,79), глюкагоноподобный пептид-1 (pI: 5,05, М.м.: 4167,02), амид глюкагоноподобного пептида-1 (pI: 5,47, М.м.: 4111,50), амид глюкагоноподобного пептида-1(7-36) (pI: 6,76, М.м.: 3297,68), глюкагоноподобный пептид-1(7-37) (pI: 5,53, М.м.: 3355,71), амид [Val8]-глюкагоноподобного пептида-1(7-36) (pI: 6,76, М.м.: 3326,74), [Val8]-глюкагоноподобный пептид-1(7-37) (pI: 5,53, М.м.: 3383,87), [Lys26, ε-NH{γ-Glu(N-α-пальмитоил)}]-GLP-1(7-37) (pI: 4,57, М.м.: 3751,2), GLP-1(9-36)NH2 (pI: 4,68, М.м.: 2933,2), GLP-1(9-37) (pI: 4,87, М.м.: 3090,4), глюкагоноподобный пептид-2 (pI: 4,21, М.м.: 3922,35), эксендин-3 (pI: 4,96, М.м.: 4202,63), эксендин-4 (pI: 4,96, М.м.: 4186,60), β-цепь инсулина (pI: 6,90, М.м.: 3429,96), α-цепь инсулина (pI: 3,79, М.м.: 2383), инсулин (pI: 5,39, М.м.: 5807,6), прогонадолиберин-I (pI: 5,63, М.м.: 7893,83), гонадолиберин-II (pI: 6,92, М.м.: 1254,33), пептид-I, связанный с гонадолиберином (pI: 4,67, М.м.: 6370,11), нейромедин С (pI: 6,92, М.м.: 1121,28), А-цепь инсулиноподобного белка (INSL) (pI: 6,36, М.м.: 3542,16), пептид Е, связанный с мотилином (pI: 4,72, М.м.: 7433,47), лейцин-энкефалин (pI: 5,52, М.м.: 555,63), метионин-энкефалин (pI: 5,52, М.м.: 573,66), лейморфин (pI: 6,21, М.м.: 3351,68), окситоцин (pI: 5,51, М.м.: 1010,19), нейрофизин-1 (pI: 4,94, М.м.: 9600,88), нейрофизин-2 (pI: 5,05, М.м.: 9787,07), копептин (pI: 4,11, М.м.: 4021,46), нейромедин В (pI: 6,74, М.м.: 1133,29), нейромедин N (pI: 5,52, М.м.: 617,79), нейропептид Y (pI: 6,76, М.м.: 4272,72), нейропептид AF (pI: 6,05, М.м.: 1979,18), пептид, связанный с PACAP (pI: 5,38, М.м.: 4800,32), панкреатический гормон (pI: 6,26, М.м.: 4182,74), панкреатический икозапептид (pI: 6,01, М.м.: 2235,44), пептид YY (pI: 6,77, М.м.: 4310,80), тиролиберин (pI: 6,74, М.м.: 380,40), нейрохинин А (pI: 6,74, М.м.: 1134,32), урокортин (pI: 5,58, М.м.: 4697,29), уротензин II (pI: 4,37, М.м.: 1390,59), кишечный пептид (РНМ-27) (pI: 6,75, М.м.: 2986,43) и кишечный пептид-42 (pI: 6,76, М.м.: 4552,18).
Помимо описанных выше, композицией по настоящему изобретению может быть любой биологически активный пептид, который можно вводить назально.
В настоящем изобретении носитель для биологически активного полипептида и добавки включает носители, нерастворимые или малорастворимые в воде. Например, можно использовать соединения поливалентного металла с валентностью 2 или выше, выбранные из соединений алюминия, соединений кальция, соединений магния, соединений кремния, соединений железа или соединений цинка.
Конкретно, примеры каждого типа соединений поливалентного металла приводятся ниже.
Соединение алюминия включает высушенный гель гидроксида алюминия, хлоргидроксиалюминий, синтетический силикат алюминия, легкий оксид алюминия, коллоидный водный силикат алюминия, гидроксид алюминия-магния, гидроксид алюминия, гель гидроксида алюминия, сульфат алюминия, дигидроксиацетат алюминия, стеарат алюминия, природный силикат алюминия, моностеарат алюминия и сульфат алюминия-калия.
Соединение кальция включает апатит, гидроксиапатит, карбонат кальция, динатрий-эдетат кальция, хлорид кальция, цитрат кальция, глицерофосфат кальция, глюконат кальция, силикат кальция, оксид кальция, гидроксид кальция, стеарат кальция, третичный фосфат кальция, лактат кальция, пантотенат кальция, олеат кальция, пальмитат кальция, D-пантотенат кальция, альгинат кальция, безводный фосфат кальция, гидрофосфат кальция, дигидрофосфат кальция, ацетат кальция, сахарат кальция, сульфат кальция, моногидрофосфат кальция, пара-аминосалицилат кальция и биологически кальцифицированные соединения.
Соединение магния включает L-аспартат магния, хлорид магния, глюконат магния, алюмосиликат магния, силикат магния, оксид магния, гидроксид магния, стеарат магния, карбонат магния, алюмометасиликат магния, сульфат магния, силикат магния-натрия и синтетический силикат магния-натрия.
Соединение кремния включает водный диоксид кремния, легкую безводную кремниевую кислоту, синтетический гидротальцит, диатомит и диоксид кремния. Соединение железа включает сульфат железа. Соединение цинка включает хлорид цинка, стеарат цинка, оксид цинка и сульфат цинка.
Указанные соединения поливалентных металлов можно использовать как индивидуально, так и в виде смеси двух или более соединений. Из соединений поливалентных металлов соединения кальция, такие как гидроксиапатит, карбонат кальция или лактат кальция, давали благоприятные результаты.
Если средний размер частиц соединения поливалентного металла слишком велик, то распыление соединения ухудшается, а частицы быстро осаждаются. Наоборот, если средний размер частиц слишком мал, то частицы с трудом задерживаются в носовой полости и вдыхаются в бронхи и легкие. Таким образом, предпочтительно чтобы соединение поливалентного металла имело средний размер частиц от 10 до 100 мкм, более предпочтительно от 20 до 60 мкм, так что соединение металла может эффективно оставаться в носовой полости.
Несмотря на то что количество биологически активного полипептида в композиции по настоящему изобретению для получения эффективной дозы полипептида может варьироваться в зависимости от многих факторов, включая тип выбранного активного вещества, тип заболевания, по поводу которого проводится лечение, желаемое количество введений, возраст пациентов, вес тела, тяжесть симптомов, путь введения, желательные эффекты и другие факторы, предпочтительно, чтобы в случае, например, амида GLP-1(7-36) композицию по настоящему изобретению вводили назально в такой дозе, которая может доставить от 50 до 5000 мкг амида GLP-1(7-36).
Конкретно, эффективную дозу биологически активного полипептида в сухом виде смешивают с носителем (например, соединением поливалентного металла, включая соединение кальция, соединение алюминия, соединения магния, соединение кремния, соединение железа и соединение цинка) и добавкой. Носитель, нерастворимый или малорастворимый в воде, берут в форме порошка или в кристаллической форме, и он имеет средний размер частиц 250 мкм или менее предпочтительно 100 мкм или менее, и более предпочтительно от 20 до 60 мкм. Альтернативно, компоненты можно во влажном состоянии смешивать друг с другом в воде или в органическом растворителе, таком как этанол, а затем высушивать. При таких способах биологически активный полипептид однородно диспергируется и закрепляется на поверхностях носителя, в результате чего получают фармацевтическую композицию для назального всасывания по настоящему изобретению.
Фармацевтическая композиция для назального всасывания по настоящему изобретению вполне может содержать носители, которые широко используются для изготовления лекарственных средств, включая смаз