Основные непептидные антагонисты брадикинина и их фармацевтические композиции
Иллюстрации
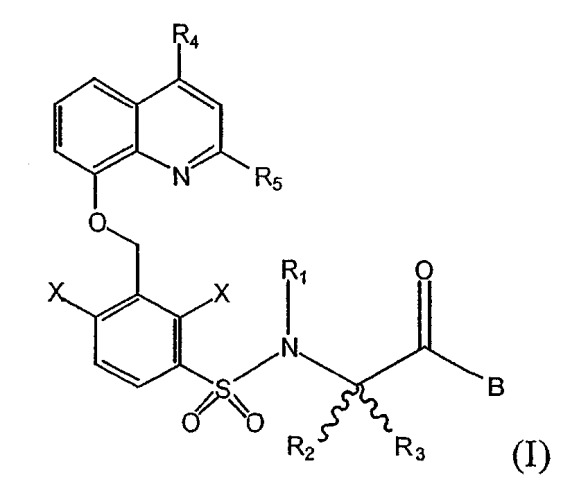
Показать всеОписываются соединения общей формулы (I), в которой R1 означает атом водорода или С1-С4алкильную группу; R2 и R3, которые могут быть одинаковыми или различными, представляют С1-С4алкильную группу, или R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют циклическую алифатическую группу, содержащую 3-7 атомов углерода; R4 и R5, которые могут быть одинаковыми или различными, означают атом водорода или С1-С4алкильную группу; Х выбран из группы, включающей галоген; В содержит, по меньшей мере, одну аминогруппу с основными характеристиками или тетраалкиламмонийную группу и может быть выбран из группы, включающей NR6Y, и из остатков:
Непептидные соединения формулы (I) обладают активностью специфических антагонистов В2-рецепторов брадикинина (ВК). Описываются также промежуточные соединения, фармацевтические композиции, а также применение соединения формулы (I) для получения фармацевтических композиций для лечения нарушений, когда требуется применение антагониста брадикинина. 5 н. и 6 з.п. ф-лы.
Реферат
Область изобретения
Настоящее изобретение касается непептидных основных соединений и их производных, обладающих активностью специфических антагонистов В2-рецепторов брадикинина (BK). Антагонисты рецепторов BK представляют новый класс лекарственных средств, которые можно применять при всех состояниях, в которые вовлечены указанные рецепторы.
Более конкретно, настоящее изобретение касается непептидных соединений, которые демонстрируют высокую аффинность и антагонистическую активность относительно В2-рецептора, имеющих общую формулу (I):
в которой
R1 означает атом водорода или C1-C4алкильную группу;
R2 и R3, которые могут быть одинаковыми или различными, означают C1-C4алкильную группу, или R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют циклическую алифатическую группу, содержащую 3-7 атомов углерода, или гетероциклическую алифатическую группу, содержащую 3-7 атомов, один или два из которых выбраны из группы N, O, S и другие являются атомами C;
R4 и R5, которые могут быть одинаковыми или различными, означают атом водорода или C1-C4алкильную группу;
X выбран из группы, включающей галоген, OR1, SR1, CN, C1-C4алкил;
B содержит, по меньшей мере, одну аминогруппу с основными характеристиками или тетраалкиламмонийную группу и может быть выбран из группы, включающей -NR6(CH2)nNHCOY, NR6(CH2)nN(R6)-Y, NR6(CH2)nN(Y)2, NR6Y, N(Y)2, N(Y)(CH2)pY1, и из остатков:
R6 означает атом водорода, C1-C4алкил;
n=1-12;
Y выбран из водорода, (CH2)pY1, (CH2)pNR6Y1, (CH2)pN(Y1)2, NR5R6, -NR6(CH2)qY1 или из следующих остатков:
;
T выбран из группы: -NR7R8, -NR14R18R19, -OR6;
R7 и R8, которые могут быть одинаковыми или различными, означают атом водорода, С1-C4алкильную группу, циклогексильную группу, или NR7R8 вместе представляют группу, выбранную из: i) гуанидина, необязательно замещенного 1 или 2 C1-C4алкильными или циклогексильными группами, ii) 5-7-членного азотсодержащего гетероцикла, необязательно включающего другой гетероатом, выбранный из О, N, S;
Y1 выбран из группы, включающей NR7R8, NR14R18R19, или из следующих остатков:
Z выбран из группы, включающей H, C1-C6алкил, OR6, SR6, CF3, OCOR6, COR10, NHCOR6, SO2R6, SOR6, CO2R6, N(R6)2, Cl, Br, NO2, NH2, CN, F, имидазол, фенил, амидин, гуанидин, гуанидилметил;
R9 выбран из группы, включающей водород, -(CH2)q-L, где L выбран из группы -OH, -NR5R6, -NR14R18R19, амидина, необязательно замещенного 1 или 2 C1-C4алкильными группами, гуанидина, необязательно замещенного 1 или 2 C1-C4алкильными группами;
R10 выбран из группы, включающей OR6, NR6R12;
R11 выбран из группы, включающей водород, -(CH2)q-L, -(CH2)p-NR4-(CH2)q-L;
R12 означает атом водорода, C1-C6алкил, COR6;
R13 выбран из группы, включающей H, C1-C6алкил, -(CH2)pW(CH2)qY1, Y, -COY, -CH2-Y;
R15 выбран из группы, включающей водород или линейные или разветвленные C1-C4алкильные группы;
группа -NR16R17 представляет собой 5-7-членный азотсодержащий алифатический гетероцикл, необязательно включающий другой гетероатом, выбранный из O, S, N;
группа -NR14R18R19 представляет собой четвертичную аммонийную группу, в которой R14 выбран из группы, включающей линейные или разветвленные C1-C4алкильные группы, R18 и R19, которые могут быть одинаковыми или различными, представляют собой линейные или разветвленные C1-C4алкильные группы, или -NR18R19 представляет собой 5-7-членный азотсодержащий гетероцикл, необязательно включающий другой гетероатом, выбранный из O, N, S;
W=CH2, O, S, NR4, N(R4)2;
p=1-6, q=1-6.
Настоящее изобретение включает также соответствующие фармакологически приемлемые соли с неорганическими или органическими кислотами, выбранными из группы: хлористоводородной, бромистоводородной, йодистоводородной, серной, фосфорной, уксусной, трифторуксусной, пропионовой, щавелевой, яблочной, малеиновой, янтарной, малоновой, аспарагиновой, глутаминовой кислоты, и возможные геометрические изомеры, оптические изомеры, обусловленные наличием хиральных центров, или их смеси, включая рацематы. Символ означает, что конфигурация асимметрических атомов углерода может быть S или R. Известно, что при физиологических рН амины присутствуют главным образом в протонированной форме, то есть в виде четвертичного аммония, таким образом, данное изобретение включает также аналоги, в которых азот аминогруппы находится в виде тетраалкиламмонийной соли, т.е. аналоги, в которых постоянно присутствует четвертичный азот, не зависящий от pH.
Предшествующий уровень техники
Брадикинин (BK) принадлежит к кининам и формам, вместе с каллидином и T-кинином образующим подгруппу кининов, присутствующих у млекопитающих. Кинины играют важную роль в качестве медиаторов боли и воспаления как в центральной, так и в периферической нервной системе. Они имеют пептидную природу, и брадикинин, в частности, представляет собой нонапептид (H-Arg1-Pro2-Pro3-Gly4-Phe5-Ser6-Pro7-Phe8-Arg9-OH), продуцируемый организмом при физиопатологических состояниях.
Существует два типа рецепторов кининов B1 и B2. Основная характеристика рецептора B1 заключается в том, что он является более индукционным, чем конститутивным. Он экспрессируется в тканях при воспалительных или стрессовых состояниях. С другой стороны, B2 является конститутивным рецептором, обычно присутствующим во всех тканях и готовым детектировать действие медиатора при воспалительных процессах. Каскад ферментативных процессов, который индуцирует образование и разложение кининов, подробно описан в обзоре Bhoola и др. (Bhoola H.D., Figueroa CD., Worthy K., Bioregulation of Kinins: Kallikreins, Kininogens and Kininases, Pharmacological Rev. 1992; 44:4-80). Брадикинин и каллидин высвобождаются из своих белковых предшественников (известных как кининогены) под действием протеолитических ферментов, называемых кининогеназами. Среди них главную роль играют калликреины, которые, однако, могут оказывать действие только в течение короткого времени после высвобождения предшественником, так как быстро разлагаются рядом циркулирующих ферментов и мембран, в общем определяемые как кининазы. Одна из данных кининаз расщепляет брадикинин по C-концевому аргинину, образуя, таким образом, des-Arg-BK, который действует как агонист рецептора B1.
Активация рецепторов брадикинина B1 и В2 индуцирует релаксацию мышц сосудов с последующей гипотензией, повышение проницаемости сосудов, сокращение гладких мышц кишечника и дыхательного тракта, стимуляцию ноцицепторных нейронов, изменение ионной эпителиальной секреции, продуцирование нитроксида и высвобождение цитокинов лейкоцитами и эйкозаноидами из различных типов клеток. Как следствие, антагонистические соединения рецепторов BK можно считать новым классом лекарственных средств, предположительно активных при различных нарушениях. Возможными терапевтическими применениями для указанных антагонистов являются воспалительные, аллергические и аутоиммунные нарушения, такие как астма и хронический бронхит (также вызываемый раздражителями), аллергический, вазомоторный и вирусный ринит, обструктивное заболевание легких (COPD), ревматоидный артрит, хронические воспалительные заболевания кишечника (болезнь Крона и язвенный колит), гломерулонефрит, псориаз, сыпь, острый и хронический цистит; дегенеративные нарушения, характеризующиеся фиброзом, такие как цирроз печени, гломерулопатия и фиброз легких, артериосклероз; благодаря их болеутоляющей активности, при лечении острой и хронической боли, например при ожогах, сильной головной боли, укусах насекомых, хронической боли у раковых пациентов; при нарушениях сердечно-сосудистой системы, таких как септический, аллергический и посттравматический шок, и циррозе печени при гепаторенальном синдроме; в качестве противораковых агентов и агентов против ангиогенеза при лечении гипотензии и алопеции.
В литературе известны различные пептидные и непептидные антагонисты В2-рецепторов брадикинина.
После открытия в 1985 году первого антагониста В2-рецепторов брадикинина, NPC-567, был синтезирован ряд пептидных антагонистов, многие из которых, такие как икатибант (HOE-140) и брадикор (Deltibant, CP-0127), уже находятся в клинической фазе исследования.
Первый непептидный B2-антагонист брадикинина синтезировал Sterling Winthrop в 1993 г., WIN 64338. Однако указанное соединение демонстрирует низкую активность связывания с В2-рецептором человека. Очень интересная активность продемонстрирована хинолиновыми и имидазопиридиновыми производными, заявленными Fujisawa, который, начиная с 1996 г., публиковал фармакологические данные и исследования, касающиеся нового непептидного антагониста FR 173657 и его аналогов. Данное соединение представляло первостепенную важность в поиске новых непептидных B2-антагонистов благодаря своей селективности, силе действия и активности после перорального приема. После публикации патентов Fujisawa аналогичные структуры были заявлены в патентах Fournier и Hoechst. Соединения в работах Fournier также имеют хинолин, связанный с дихлорбензолом; замещенный сульфонамид соединяет данную часть молекулы с ароматическим кольцом (необязательно замещенным амидином) посредством основного линкера (например, пропилендиамина, пиперазина). Fournier объявил в мае 1998 г. начало клинической фазы I для непептидного B2-антагониста LF 16.0687 (обзор: Altamura M. и др., Regulatory Peptides, 1999, 80, 13-26).
Ввиду возможных преимуществ непептидных антагонистов (ферментативной и метаболической стабильности, высокой биодоступности) над пептидными антагонистами желателен поиск новых непептидных антагонистов В2-рецепторов.
Подробное описание изобретения
Целью настоящего изобретения является обеспечение новых непептидных антагонистов, обладающих пониженной конформационной свободой. Настоящее изобретение раскрывает новые соединения непептидной природы, а именно линейные или циклические сульфонамидопроизводные α,α-дизамещенных аминокислот общей формулы (I), где R1, R2, R3, R4, R5, X и B имеют значения, определенные выше.
Присутствие данной конкретной категории аминокислот вызывает ограничения молекулярной конформации, допуская, таким образом, модуляцию и оптимизацию взаимодействия с рецептором посредством введения подходящих фармакофорных групп.
Данные соединения характеризуются высокой аффинностью и антагонистической активностью относительно В2-рецептора человека и значительной метаболической стабильностью.
Соединения настоящего изобретения являются оригинальными в сравнении с соединениями, заявленными в патентной литературе (WO 97/24349, WO 98/03503), в свете исследований мутагенеза, которые подтверждают различное взаимодействие с В2-рецептором, а также конформационных исследований, подкрепленных экспериментами по молекулярному моделированию и ЯМР-анализом, которые служат доказательством определенной, отличной конформации по сравнению с аналогами, не содержащими α,α-дизамещенных аминокислот. В частности, сравнительное исследование соединений настоящего изобретения и аналогов, не содержащих α,α-дизамещенных аминокислот, показывает, что различные значения углов кручения Φ и Ψ наблюдают уже, начиная с промежуточных соединений.
Настоящее изобретение также касается аналогов, в которых амин находится в виде тетраалкиламмонийного соединения, что является состоянием, аналогичным состоянию аминов при физиологических рН, когда осуществляется их активность.
В определениях C1-C4алкильная группа означает группу, выбранную из метила, этила, н-пропила, изопропила, н-бутила и t-бутила; C1-C6алкильная группа означает группу, выбранную из метила, этила, н-пропила, изопропила, н-бутила, н-пентила, н-гексила; циклическая алифатическая группа, содержащая 3-7 атомов углерода, означает группу, выбранную из циклопропила, циклобутила, циклопентила, циклогексила и циклогептила; алифатическая гетероциклическая группа, содержащая 3-7 атомов, означает группу, выбранную из пирролидина, необязательно замещенного по N C1-C4алкильной группой, пиперидина, необязательно замещенного по N C1-C4алкильной группой, тетрагидрофурана, тетрагидропирана, тетрагидротиопирана; 5-7-членная алифатическая гетероциклическая группа означает группу, выбранную из пирролидина, пиперидина, пиперазина, морфолина, тиоморфолина, азепина, диазепина, оксазепина.
Более конкретно, настоящее изобретение касается соединений общей формулы (I), в которой:
R1 означает атом водорода или C1-C4алкильную группу;
R2 и R3, которые могут быть одинаковыми или различными, представляют C1-C4алкильную группу, или R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют циклическую алифатическую группу, содержащую 3-7 атомов углерода, или гетероциклическую алифатическую группу, содержащую 3-7 атомов, один или два из которых выбраны из группы N, O, S и другие являются атомами C;
R4 и R5, которые могут быть одинаковыми или различными, означают атом водорода или C1-C4алкильную группу;
X выбран из группы, включающей галоген, OR1, SR1, CN, C1-C4алкил;
B содержит, по меньшей мере, одну аминогруппу с основными характеристиками или тетраалкиламмоний и может быть выбран из группы, включающей:
R6 означает атом водорода, C1-C6алкил;
Y выбран из водорода, (CH2)pY1, (CH2)pNR6Y1, (CH2)pN(Y1)2, NR5R6, -NR6(CH2)рY1 или из следующих остатков:
T выбран из группы -NR7R8, -NR14R18R19, -OR6;
R7 и R8, которые могут быть одинаковыми или различными, означают атом водорода, С1-C4алкильную группу, или NR7R8 представляет собой группу, выбранную из: i) гуанидина, необязательно замещенного 1 или 2 C1-C4алкильными или циклогексильными группами, ii) 5-7-членного азотсодержащего гетероцикла, необязательно включающего другой гетероатом, выбранный из О, N, S;
Y1 выбран из группы, включающей NR7R8, NR14R18R19, или из следующих остатков:
Z выбран из группы, включающей H, C1-C6алкил, OR6, SR6, CF3, OCOR6, COR10, NHCOR6, SO2R6, SOR6, CO2R6, N(R6)2, Cl, Br, NO2, NH2, CN, F, имидазол, фенил, амидин, гуанидин, гуанидилметил;
R9 выбран из группы, включающей водород, -(CH2)q-L, где L выбран из -OH, -NR5R6, -NR14R18R19, амидина, необязательно замещенного 1 или 2 C1-C4алкильными группами, гуанидина, необязательно замещенного 1 или 2 C1-C4алкильными группами;
R10 выбран из группы, включающей OR6, NR6R12;
R11 выбран из группы, включающей водород, -(CH2)q-L, -(CH2)p-NR4-(CH2)q-L;
R12 означает атом водорода, C1-C6алкил, COR6;
R13 выбран из группы, включающей H, C1-C6алкил, -(CH2)pW(CH2)qY1, Y, -COY, -CH2-Y;
R14 выбран из группы, включающей линейные или разветвленные C1-C4алкильные группы;
R15 выбран из группы, включающей водород или линейные или разветвленные C1-C4алкильные группы;
группа -NR16R17 представляет собой 5-7-членный азотсодержащий алифатический гетероцикл, необязательно включающий другой гетероатом, выбранный из O, S, N;
группа -NR14R18R19 представляет собой четвертичную аммонийную группу, в которой R14 выбран из группы, включающей линейные или разветвленные C1-C4алкильные группы, R18 и R19, которые могут быть одинаковыми или различными, представляют собой линейные или разветвленные C1-C4алкильные группы, или -NR18R19 представляет собой 5-7-членный азотсодержащий гетероцикл, необязательно включающий другой гетероатом, выбранный из O, N, S;
W=CH2, O, S, NR4, N(R4)2;
p=1-6, q=1-6.
Класс предпочтительных соединений составляют соединения общей формулы (I), в которой:
B выбран из группы, включающей остатки:
Y выбран из (CH2)pY1, (CH2)pNR6Y1, (CH2)pN(Y1)2, NR5R6 или из следующих остатков:
в которых T выбран из группы -NR7R8, -OR6;
и другие заместители являются такими, как определено выше.
Особо предпочтительный класс соединений составляют соединения, в которых:
R1 означает атом водорода или метил;
R2 и R3, которые могут быть одинаковыми или различными, выбраны из метила и этила, или R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют циклическую алифатическую группу, содержащую 3-7 атомов углерода;
R4 и R5, которые могут быть одинаковыми или различными, означают атом водорода или метил;
X означает атом хлора;
B означает группу, выбранную из:
в которых R13 означает Н, или Y=Y1, где Y1 означает
R11 выбран из группы, включающей водород, -(CH2)q-L, -(CH2)p- -NR4-(CH2)q-L, где L выбран из -OH, -NR5R6, амидина, необязательно замещенного 1 или 2 C1-C4алкильными группами, гуанидина, необязательно замещенного 1 или 2 C1-C4алкильными группами; и другие заместители являются такими, как определено выше.
Еще один класс особо предпочтительных соединений общей формулы (I) составляют соединения, в которых:
R2 и R3, которые могут быть одинаковыми или различными, выбраны из метила или этила, или R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют циклическую алифатическую группу, содержащую 3-7 атомов углерода;
R4 и R5, которые могут быть одинаковыми или различными, представляют собой водород или метил;
X означает атом хлора;
B содержит, по меньшей мере, две аминогруппы с основными характеристиками, в свободном виде или в виде соли, и выбран из группы:
в которых R13 означает COY, CH2Y, -(CH2)pW(CH2)qY1,
Y означает группу (CH2)pY1 или выбран из:
где T выбран из -NR7R8, -OR6;
R7 и R8, которые могут быть одинаковыми или различными, представляют собой атом водорода, C1-C4алкильную группу, или NR7R8 означает группу, выбранную из: i) гуанидина, необязательно замещенного 1 или 2 C1-C4алкильными или циклогексильными группами, ii) 5-7-членного азотсодержащего гетероцикла, необязательно включающего другой гетероатом, выбранный из O, N, S;
Y1 выбран из группы, включающей -NR7R8, и из остатков
R9 выбран из группы, включающей водород, -(CH2)q-L, где L выбран из группы -NR5R6, амидина, необязательно замещенного 1 или 2 C1-C4алкильными группами, гуанидина, необязательно замещенного 1 или 2 C1-C4алкильными группами;
и другие заместители являются такими, как определено выше.
Второй класс предпочтительных соединений общей формулы (I), содержащих, по меньшей мере, один тетраалкиламмоний, составляют соединения, в которых:
R1 означает атом водорода или метил;
R2 и R3, которые могут быть одинаковыми или различными, выбраны из метила или этила, или R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют циклическую алифатическую группу, содержащую 3-7 атомов углерода;
R4 и R5, которые могут быть одинаковыми или различными, представляют собой водород или метил;
X означает атом хлора;
B выбран из группы, включающей NR6Y, и из остатков:
Y выбран из Y, COY, (CH2)pY1, NR6(CH2)qY1 и из остатков:
T выбран из группы -NR7R8, -NR14R18R19, -OR6;
Y1 выбран из группы, включающей -NR7R8, -NR7R8R14, или из следующих остатков:
и другие заместители являются такими, как определено выше.
Соединения общей формулы (I) можно получать хорошо известными синтетическими способами.
В качестве примера приведен особо интересный для целей данного изобретения способ: соединения общей формулы (I), которая определена выше и в которой B означает группу можно получить конденсацией в присутствии подходящего конденсирующего агента промежуточного соединения общей формулы (II)
с ацилирующей группой, такой как 2,6-диаминогексановая кислота, которая доступна коммерчески. Соединение (1) (промежуточное соединение общей формулы (II), в которой R1=H) можно получить согласно схеме, приведенной далее.
Соединение (1) получают путем ряда взаимодействий, показанных на схеме 1. Первая стадия заключается в образовании сульфонамидо-связи (4), получаемой конденсацией промежуточных соединений (2) и (3). Данное взаимодействие проводят при комнатной температуре, предпочтительно в смеси ацетонитрил/вода (2:1) в присутствии NaHCO3. Указанное взаимодействие происходит с обменом хлор-бром в положении бензила: полученную смесь продуктов используют, как есть, на следующей стадии. Затем проводят взаимодействие смеси галогеновых производных с дизамещенным гидроксихинолином (5), в присутствии карбоната калия (K2CO3) и йодида калия (KI), в ацетоне при кипячении с обратным холодильником, получая сложно-эфирное производное (6). Сложный метиловый эфир формулы (6), в которой R14=CH3, гидролизуют в основных условиях до карбоновой кислоты (7), которую затем конденсируют с Boc-пиперазином (8), получая промежуточное соединение (9). Указанную реакцию конденсации проводят согласно методике, известной в синтезе пептидов, используя гидроксибензотриазол для активации карбоксильного компонента, конденсирующий агент, такой как 1-этил-3-(3'-диметилпропил)карбодиимид, и некоторое количество третичного амина, диизопропилэтиламина, соответствующее трем эквивалентам по сравнению с конденсирующим агентом. Наконец, получают соединение (1), отщепляя Boc-группу от промежуточного соединения (9) при помощи раствора хлористоводородной кислоты (4н.) в диоксане и выделяя свободный амин вместо гидрохлорида.
Соединение формулы (2) получают, как описано в J. Fluorine Chemistry, 2000, 101:85-89.
Соединение формулы (5), а именно 2,4-диметил-8-гидроксихинолин (R4=R5=CH3), получают, как раскрыто в WO 96/40639.
В случае, когда R1 означает алкильную группу, в частности метил, проводят алкилирование сульфонамидогруппы соединения (6); для примера на схеме 2 показано получение промежуточного соединения (7), в котором R1=метил.
Сульфонамидный азот можно алкилировать в диметилформамиде, используя метилиодид в качестве алкилирующего агента и карбонат калия (K2CO3) в качестве основания.
Все соединения общей формулы (I) можно получить подходящим образом, заменяя методику схемы 2 обычными реакциями ацилирования или алкилирования по атому азота в промежуточных соединениях, таких как соединение (1) или его аналоги.
Промежуточные соединения и конечные соединения настоящего изобретения выделяют и очищают, используя обычные методики, такие как экстракция, кристаллизация, хроматография, осаждение и подобные.
В случае, когда промежуточные соединения и конечные продукты содержат асимметрический атом углерода, если конфигурация (R,S) не определена, соединения представляют собой рацемические соединения или рацематы.
В настоящем изобретении использованы следующие сокращения: ДХМ=дихлорметан; MeOH=метанол; ТГФ=тетрагидрофуран; ДМСО=диметилсульфоксид; ДМФА=диметилформамид; AcOEt=этил ацетат; AcOH=уксусная кислота; TFA=трифторуксусная кислота; pTsOH=паратолуолсульфоновая кислота; PPA=полифосфорная кислота; NBS=Nα-бромсукцинимид, bpo=пероксид бензоила; Boc=трет-бутоксикарбонил; HOBt=1-гидроксибензотриазол; HOAt=1-гидрокси-7-азабензотриазол; EDC=1-этил-3-(3'-диметилпропил)карбодиимид; DIPEA=диизопропилэтиламин; ТСХ=тонкослойная хроматография; ЯМР=ядерный магнитный резонанс; FCC=колоночная флэш-хроматография; tR=время удерживания.
Промежуточные соединения и конечные продукты настоящего изобретения характеризуют, применяя метод аналитической ВЭЖХ: колонка Symmetry 300, C18, 5 мкм, 250×4,6 мм, используя в качестве элюентов A (0,1% TFA в H2O) и B (0,1% TFA в ацетонитриле) с градиентом от 20 до 80% B за 20 мин, λ=220 нм. Для соединений, охарактеризованных методом ядерного магнитного резонанса (ЯМР), приведены величины протонных химических сдвигов, а также мультиплетность сигналов и количество протонов (в скобках).
Соединения данного изобретения применяют для лечения всех тех нарушений, при которых должна быть блокирована или снижена активация рецепторов брадикинина. Они особенно подходят для лечения воспалительных, аллергических и аутоиммунных нарушений, таких как астма и хронический бронхит, аллергический, вазомоторный и вирусный ринит, обструктивное заболевание легких (COPD), ревматоидный артрит, хронические воспалительные заболевания кишечника (болезнь Крона и язвенный колит), гломерулонефрит, псориаз, сыпь, острый и хронический цистит, цирроз печени, гломерулопатия и фиброз легких, артериосклероз, острая и хроническая боль, септический, аллергический и посттравматический шок, цирроз печени при гепаторенальном синдроме, гипотензия, алопеция, или в качестве противораковых агентов и агентов против антиангиогенеза.
Для применения при лечении соединения данного изобретения готовят подходящим образом вместе с фармацевтически приемлемыми носителями/эксципиентами. Предпочтительны фармацевтические формы, подходящие для перорального введения, такие как таблетки, капсулы, гранулы, порошки, растворы, суспензии, сиропы или подобное. Такие фармацевтические препараты можно получить по обычным методикам, используя ингредиенты, известные в данной области, такие как лиганды, дезинтегранты, лубриканты, наполнители, стабилизаторы, разбавители, красители, вкусовые агенты, смачивающие агенты и другие эксципиенты, известные специалистам в данной области. Композиции для перорального приема включают также формы с длительным высвобождением, такие как таблетки или гранулы с энтеросолюбильным покрытием. Твердые композиции для перорального применения можно получить обычными способами смешивания, заполнения или прессования. Жидкие препараты для перорального применения могут быть в виде, например, водных или маслянистых суспензий или растворов, эмульсий, сиропов или могут представлять собой сухой продукт для восстановления перед применением при помощи воды или другого подходящего носителя.
Дозировку можно менять в зависимости от возраста и общего состояния пациента, природы и тяжести заболевания или нарушения и способа и типа введения. Как правило, в случае перорального введения пациенту - взрослому человеку соединения настоящего изобретения обычно вводят при общей дневной дозе в диапазоне от 1 до 1000 мг, предпочтительно от 5 до 300 мг, в виде одной дозы или разделенных доз.
Следующие примеры иллюстрируют данное изобретение более подробно.
Пример 1
(Промежуточное соединение формулы (4), в которой R2=CH3, R3=CH2CH3, R14=CH3) Метил-(R)-2-(2,4-дихлор-3-бромметилбензолсульфонамидо)-2-метилбутаноат
В раствор (R)-метил-2-(метиламино)-2-метилбутаноата (30 мг, 0,18 ммоль) в ДМФА (2 мл) добавляют 69 мкл (0,40 ммоль) DIEA; затем 125 мг (0,369 ммоль) 2,4-дихлор-3-бромметилбензолсульфонилхлорида (2) при 0°C. Систему оставляют нагреваться при комнатной температуре; по прошествии примерно 30 мин взаимодействия pH раствора меняется от основного до сильно кислого. Взаимодействие контролируют методом ТСХ: наблюдают исчезновение пятна 2,4-дихлор-3-бромметилбензолсульфонилхлорида и образование конечного продукта. ДМФА выпаривают при пониженном давлении и неочищенную реакционную смесь очищают на хроматографической колонке (FCC), элюируя 100% хлороформом и получая при этом 49 мг продукта в виде бесцветного масла с 63% выходом.
ВЭЖХ: tR=21,84 мин; МС: [M+NH4]+=449,0; 1H ЯМР (CDCl3): 8,00 (д, 1H, J=9,0 Гц); 7,46 (д, 1H, J=9,0 Гц); 4,90 (с, 2H); 3,70 (с, 3H); 2,01-1,88 (м, 1H); 1,82-1,68 (м, 1H); 1,36 (с, 3H); 0,74 (т, 3H, J=8,4 Гц).
Пример 2
(Промежуточное соединение формулы (6), в которой R4=R5=CH3, R2=CH3, R3=CH2CH3, R14=CH3)
Метил-(R)-2-[2,4-дихлор-3-(2,4-диметил-8-хинолиноксиметил)бензолсульфонамидо]-2-метилбутаноат.
К раствору продуктов, полученных, как описано в примере 1 (49 мг, 0,283 ммоль), в безводном ацетоне (10 мл) добавляют 110 мг (0,283 ммоль) 2,4-диметил-8-гидроксихинолина, 58 мг KI (0,349 ммоль), предварительно высушенного над фосфорным ангидридом при 75°C, и, наконец, 80 мг (0,579 ммоль) K2CO3. Раствор кипятят с обратным холодильником в течение примерно пяти с половиной часов до полного исчезновения (контроль методом ВЭЖХ) исходных продуктов. После охлаждения при комнатной температуре реакционную смесь распределяют между AcOEt (50 мл) и буферным раствором с pH 4 (90 мл). Органическую фазу отделяют и промывают буферным раствором (50 мл); водные фазы объединяют и подвергают обратной экстракции, используя примерно 50 мл AcOEt. Наконец, органическую фазу промывают водой и насыщенным раствором соли, сушат над сульфатом натрия, фильтруют и выпаривают досуха; неочищенный продукт очищают методом FCC, элюируя смесью гексан/AcOEt (2:1) и получая 79 мг (выход: 53%) метил-(R)-2-[2,4-дихлор-3-(2,4-диметил-8-хинолиноксиметил)бензолсульфонамидо]-2-метилбутаноата, в виде светло-желтого масла.
ВЭЖХ: tR=16,19 мин; МС: [M+H]+=525,1; 1H ЯМР (CDCl3): 8,02 (д, 1H, J=8,6 Гц); 7,60 (д, 1H, J=8,4 Гц); 7,47 (д, 1H, J=8,6 Гц); 7,36 (т, 1H, J=8,0 Гц); 7,21 (т, 1H, J=7,6 Гц); 7,11 (с, 1H); 6,00 (с, 1H); 5,66 (дд, 2H, J1=14,8 Гц, J2=10,7 Гц); 2,64 (с, 3H); 2,62 (с, 3H); 2,05-1,90 (м, 1H, J=42,3 Гц); 1,83-1,71 (м, 1H, J=28,7 Гц); 1,47 (с, 3H); 0,78 (т, 3H, J=7,4 Гц).
Соединения приведенных далее примеров получают аналогично.
Пример 3
(Промежуточное соединение формулы (6), в которой R4=R5=CH3, R2=CH3, R3=CH2CH3, R14=CH3)
Метил-(S)-2-[2,4-дихлор-3-(2,4-диметил-8-хинолиноксиметил)бензолсульфонамидо]-2-метилбутаноат.
ВЭЖХ: tR=16,19 мин; МС: [M+H]+=525,0; 1H ЯМР (CDCl3): 8,01 (д, 1H, J=8,6 Гц); 7,60 (д, 1H, J=8,4 Гц); 7,47 (д, 1H, J=8,6 Гц); 7,37 (т, 1H, J=7,8 Гц); 7,12 (т, 1H, J=7,6 Гц); 6,00 (с, 1H); 5,65 (дд, 2H, J1=8 Гц, J2=10,7 Гц); 3,69 (с, 3H); 2,65 (с, 3H); 2,10-1,89 (м, 1H); 1,83-1,69 (м, 1H); 1,37 (с, 3H); 0,78 (т, 3H, J=7,4 Гц).
Пример 4
(Промежуточное соединение формулы (6), в которой R4=R5=CH3, R2=R3=CH3, R14=C(CH3)3)
трет-Бутил-2-[2,4-дихлор-3-(2,4-диметил-8-хинолиноксиметил)бензолсульфонамидо]-2-метилпропаноат.
ВЭЖХ: tR=14,27 мин; МС: [M+H]+=553,1; 1H ЯМР (CDCl3): 8,05 (д, 1H, J=8,6 Гц); 7,61 (д, 1H, J=8,4 Гц); 7,47 (д, 1H, J=8,6 Гц); 7,38 (т, 1H, J=7,9 Гц); 7,21 (д, 1H, J=7,6 Гц); 7,13 (с, 1H); 6,09 (с, 1H); 5,67 (с, 2H); 2,67 (с, 3H); 2,63 (с, 3H); 1,45 (с, 9H); 1,40 (с, 6H).
Пример 5
(Промежуточное соединение формулы (6), в которой R4=H, R5=CH3, R2=CH3, R3=CH2CH3, R14=C(CH3)3)
трет-Бутил-2-[2,4-дихлор-3-(2-метил-8-хинолиноксиметил)бензолсульфонамидо]-2-метилпропаноат.
МС: [M+H]+=539,0; 1H ЯМР (CDCl3): 8,08 (д, 1H, J=8,6 Гц); 8,03 (д, 1H, J=8,4 Гц); 7,51 (д, 1H, J=8,6 Гц); 7,46 (д, 1H, J=7,1 Гц); 7,39 (т, 1H, J=7,6 Гц); 7,35-7,23 (м, 2H); 6,12 (с, 1H); 5,71 (с, 2H); 2,75 (с, 3H); 1,48 (с, 9H); 1,43 (с, 6H).
Пример 6
(Промежуточное соединение формулы (6), в которой R4=R5=CH3, R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют циклопентил, R14=CH3)
Метил-1-[2,4-дихлор-3-(2,4-диметил-8-хинолиноксиметил)]бензолсульфонамидо-1-циклопентанкарбоксилат.
ВЭЖХ: tR=11,16 мин; МС: [M+H]+=537,0; 1Н ЯМР (ДМСО): 8,64 (с, 1H); 8,03 (д, 1H, J=8,6 Гц); 7,79-7,29 (м, 5H); 5,59 (с, 2H); 3,56 (с, 3H); 2,89-2,57 (м, 6H); 1,98-1,85 (м, 4H); 1,60-1,48 (м, 2H); 1,48-1,38 (м, 2H).
Пример 7
(Промежуточное соединение формулы (6), в которой R4=H, R5=CH3, R2 и R3 вместе с атомом углерода, к которому они присоединены, образуют циклопентил, R14=CH3)
Метил-1-[2,4-дихлор-3-(2-метил-8-хинолиноксиметил)]бензолсульфонамидо-1-циклопентанкарбоксилат.
ВЭЖХ: tR=15,43 мин; МС: [M+H]+=523,2; 1H ЯМР (CDCl3): 8,07-8,01 (м, 2H, J1=1,6 Гц, J2=8,6 Гц); 7,54 (д, 1H, J=8,6 Гц); 7,49-7,38 (м, 2H); 7,31 (д, 1H, J=8,4 Гц); 7,25 (дд, 1H, J1=7,5 Гц; J2=1,2 Гц); 5,70 (с, 2H); 5,48 (с, 1H); 3,66 (с, 3H); 2,73 (с, 3H); 2,21-2,10 (м, 2H); 2,01-1,91 (м, 2H); 1,75-1,65 (м, 4H).
Пример 8
(Промежуточное соединение формулы (6'), в которой R1=CH3, R2 и R3вместе с атомом углерода, к которому они присоединены, образуют циклопентан)
Метил-1-[2,4-дихлор-3-(2,4-диметил-8-хинолиноксиметил)]-1-N'-метилбензолсульфонамидо-1-циклопентанкарбоксилат.
К раствору метил-1-[2,4-дихлор-3-(2,4-диметил-8-хинолиноксиметил)]бензолсульфонамидо-1-циклопентанкарбоксилата (50 мг, 0,093 ммоль) в 5 мл ДМФА добавляют CH3I (19,2 мл, 0,306 ммоль) и 29 мг K2CO3 (0,186 ммоль) при 0°C в атмосфере азота. После перемешивания при комнатной температуре в течение примерно 3 ч реакционную смесь выливают в 50 мл буферного раствора с pH 4,2, затем экстрагируют AcOEt (3×30 мл). Далее органическую фазу промывают водой и насыщенным раствором соли, сушат над сульфатом натрия, фильтруют и выпаривают при пониженном давлении, получая 52 мг (0,093 ммоль) требуемого продукта в виде коричневого твердого вещества с количественным выходом. ВЭЖХ: tR=13,56 мин; МС: [M+H]+=551,4; 1H ЯМР (CDCl3): 8,07 (д, 1H, J=8,6 Гц); 7,64 (д, 1H, J=8,6 Гц); 7,17 (с, 1H); 5,69 (с, 2H); 3,78 (с, 3H); 3,35 (с, 3H); 2,72 (д, 6H, J=44,9 Гц); 2,24 (м, 2H); 1,93 (м, 2H); 1,63 (м, 4H).
Пример 9
(Промежуточное соединение формулы (7), в которой R4=R5=CH3, R2=CH3, R3=CH2CH3)
(R)-2-[2,4-дихлор-3-(2,4-диметил-8-хинолиноксиметил)бензолсульфонамидо]-2-метилбутаноат лития.
К раствору продукта, описанного в примере 4 (79 мг, 0,15 ммоль), в смеси ТГФ/MeOH/H2O (3:2:1, 6 мл) добавляют 23 мг (0,96 ммоль) LiOH. Реакционную смесь перемешивают при комнатной температуре в течение примерно 18 ч, затем повышают температуру до 45°C