Способ диагностики системного воспалительного ответа организма при критических состояниях
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к области интенсивной терапии и реаниматологии. Способ обеспечивает оптимизацию диагностики системного воспалительного ответа (СВО) организма при критических состояниях. Выделяют лимфоциты периферической крови по градиенту плотности, определяют фазово-контрастной микроскопией нарушения мембран-цитоскелетных взаимоотношений в лимфоцитах, регистрируют выраженность повреждения плазматической мембраны лимфоцитов в состоянии блеббинга, рассчитывают показатели индекса блеббинга лимфоцитов и суммарного блеббинга лимфоцитов, причем суммарный блеббинг лимфоцитов вычисляют при сложении лимфоцитов в состоянии начального блеббинга, характеризующегося наличием мелких везикул на мембране до 1/3 радиуса клетки, и лимфоцитов в состоянии терминального блеббинга, характеризующегося наличием крупных пузырей мембраны более 1/3 радиуса клетки, а индекс блеббинга лимфоцитов получают при умножении лимфоцитов в состоянии терминального блеббинга на 100, разделенное на суммарный блеббинг лимфоцитов, и при повышении суммарного блеббинга лимфоцитов выше 30%, значении индекса блеббинга лимфоцитов свыше 37 усл.ед. диагностируют системный воспалительный ответ организма при критическом состоянии. 3 табл., 3 ил.
Реферат
Изобретение относится к медицине, а именно к области интенсивной терапии и реаниматологии.
В последние годы во всем мире, в том числе и в России, увеличивается количество операций на сердце с искусственным кровообращением. Операция аортокоронарного шунтирования является наиболее часто выполняемой операцией. Ранний послеоперационный период у пациентов, оперированных в условиях искусственного кровообращения, всегда характеризуется развитием системного воспалительного ответа.
В основе патогенеза сепсиса лежит формирование реакции генерализованного воспаления, инициированной инфекционным агентом. Неконтролируемый выброс эндогенных медиаторов воспаления и недостаточность механизмов, ограничивающих их повреждающее действие, являются причинами органосистемных расстройств. Поэтому рассмотрение сепсиса в виде системной реакции на инфекционный очаг точно отражает суть происходящих изменений. Развитие отдаленных пиемических очагов - лишь один из клинических вариантов течения сепсиса, определяемый характером микрофлоры и особенностями организма больного. Изменение взглядов на генез сепсиса самым непосредственным образом сказывается и на подходах к лечению больных.
У пациентов с сепсисом системный воспалительный ответ (СВО) всегда участвует в формировании синдрома полиорганной недостаточности. Удаление медиаторов при гемофильтрации и плазмаферезом определяет благотворный клинический эффект за счет удаления медиаторов воспаления (Рыбакова О.Б. Сравнительная эффективность гемодиализа и гемодиафильтрации в лечении терминальной хронической почечной недостаточности / Автореферат диссертации на соискание ученой степени к.м.н. Москва, 2003, Мусселиус С.Г. Низкопоточные методы детоксикации при неотложных состояниях // Актуальные проблемы экстракорпоральной гемокоррекции в медицине критических состояний. Новосибирск, 2005).
Актуальной остается проблема ранней, достоверной экспресс-диагностики СВО.
Известен способ диагностики СВО, базирующийся при наличии у больного 2 из 4 облигатных признаков СВО: 1) температура выше +38°С или ниже +36°С; 2) частота сердечных сокращений больше 90 уд/мин; 3) частота дыхания больше 20 в мин или парциальное давление углекислого газа в артериальной крови ниже 32 мм рт.ст.; 4) лейкоцитоз выше 12×109, или лейкопения ниже 4-109, или обнаружение больше 10% палочкоядерных (незрелых) лейкоцитов в лейкоцитарной формуле крови ("Consensus Conference of American College of Chest Physicians/Society Critical Care Medicine (ACCP/SCCM)", 1992).
Недостатки данного способа: 1) у больных с миелотоксическим агранулоцитозом или апластической анемией не может быть использован подсчет числа лейкоцитов; 2) определение частоты сердечного ритма не может быть использовано у больных с нарушением ритма, 3) гипертермия не всегда служит показателем сепсиса. Таким образом, специфичность используемых критериев сепсиса низка, в связи с чем возможна неверная диагностика сепсиса.
Существует способ определения С-реактивного белка в периферической крови как маркера белков острой фазы воспаления (Н.Baumann & J.Gauldie: The acute phase response. Immunologic Today, S74-80, No 2, 1994).
Недостатками способа определения С-реактивного белка являются низкая специфичность (повышение уровня С-реактивного белка характерно для многих состояний: ревматизм, острые бактериальные, грибковые, паразитарные и вирусные инфекций, эндокардит, ревматоидный артрит, туберкулез, перитонит, инфаркт миокарда, состояние после тяжелых операций, злокачественные новообразования с метастазами), а также потребность в специализированном дорогостоящем оборудовании и реагентах для проведения количественной оценки уровня С-реактивного белка в периферической крови.
Наиболее близким к предлагаемому является: способ определения уровня липополисахаридсвязывающего протеина (ЛПС-СП) (Скопинцев М.А. Патогенетические аспекты формирования системного воспалительного ответа у больных внебольничной пневмонией., автореферат на соиск. учен, степ. канд. мед. наук. Кемерово, 2006, 23 с.).
Недостатками способа определения уровня ЛПС-СП является то, что взаимодействие CD14 и липополисахаридсвязывающего протеина приводит к клеточному сигналу и продукции провоспалительных цитокинов, этот путь распознавания считается ключевым компонентом легочной защиты от граммотрицательных бактерий, но не отражает патогенез формирования системного воспалительного ответа при других критических состояниях.
Известно, что клетки периферической крови одними из первых реагируют на развитие СВО, а также сами являются непосредственными участниками патогенеза, будучи вовлеченными в секрецию про- и антивоспалительных медиаторов, межклеточные взаимодействия, развитие эндотелиальной дисфункции, иммунного ответа. Важным компонентом событий, происходящих при активации и повреждении клеток, являются структурно-функциональные изменения клеточных мембран, обеспечивающих как оптимизацию эффекторных механизмов при стимуляции клеточных сигнальных систем, так и прямое повреждающее действие патогенных факторов на клеточные мембраны.
Блеббинг плазматической мембраны развивается как при физиологической стимуляции некоторых видов клеток (иммунокомпетнтные клетки, нейроны), так и при повреждении многих видов клеток. Он проявляется образованием на клеточной поверхности пузыреподобных выпячиваний, в генезе которых - нарушения мембран-цитоскелетных взаимодействий, примембранный энергетический и ионный дисбаланс, окислительный стресс, активация ряда сигнальных каскадных внутриклеточных путей [Hagmann J., Burger M.M., Dagan D. // "Regulation of plasma membrane blebbing by the cytoskeleton". J. Cell Biochem., 1999, 73, p.488-499. Deschesnes R.G., Huot J., Valerie K., et all. // "Involvement of p38 in apoptosis-associated membrane blebbing and nuclear condensation", Mol. Biol. Cell, 2001, 12, p.1569-1582]. Блеббинг - универсальный биологический феномен, одно из основных начальных проявлений повреждения клетки (в том числе при апоптозе и некрозе), а также морфологическое проявление повреждения клетки, вызванного гипоксией, интоксикацией, действием вирусов, но не приводящего к клеточной гибели [Gores GJ., Herman В., Lemasters J.J. // Hepatology. 1990. V.271. P.4138]. Блеббинг плазматической мембраны - потенциально обратимое состояние [Brooks S.F., Gibson A., Rubin L.L. // Soc. Neurosci. Abstr. 1993. V.19. P.885., Gliksman N., Parson S., Salmon E. // J. Cell Biol. 1992. V.119. P.1271., Hargreaves AJ. / f Adv. in Molecul. and Cell Biology. 1997. V.20. P.119. Mitchison T.J., Cramer L.P. // Cell. 1996. V.84. P.371].
Патофизиологическое значение блеббинга определяется не только возможным разрушением клеток, но и попаданием во внеклеточное пространство мембранных микрочастиц, представляющих собой фрагменты клеточных везикул, и обеспечивающих, по современным представлениям, некоторые важные виды межклеточных взаимодействий, в том числе между клетками крови и эндотелия при развитии эндотелиальной дисфункции и системной воспалительной реакции (Marja J., VanWijk E., VanBavel A. et al. Microparticles in cardiovascular diseases. Cardiovascular Research 59 (2003) 277-287, Forlow SB, McEver RP, Nollert MU. Leukocyte-leukocyte interactions mediated by platelet microparticles under flow. Blood 2000; 95(4): 1317-1323, Sims PJ, Wiedmer T, Esmon CT et al. Assembly of the platelet prothrombinase complex is linked to vesiculation of the platelet plasma membrane. Studies in Scott syndrome: an isolated defect in platelet procoagulant activity. J Biol. Chem. 1989; 264(29): 17049-17057).
Задача изобретения - оптимизация диагностики СВО организма при критических состояниях.
Поставленную задачу решают за счет того, что выделяют лимфоциты периферической крови по градиенту плотности, определяя фазово-контрастной микроскопией нарушения мембран-цитоскелетных взаимоотношения в лимфоцитах, регистрируя выраженность повреждения плазматической мембраны лимфоцитов в состоянии блеббинга, расчитывая показатели индекса блеббинга лимфоцитов и суммарного блеббинга лимфоцитов, причем суммарный блеббинг лимфоцитов вычисляют при сложении лимфоцитов в состоянии начального блеббинга, характеризирующегося наличием мелких везикул до 1/3 радиуса клетки и лимфоцитов в состоянии терминального блеббинга, характеризирующегося наличием крупных пузырей мембраны более 1/3 радиуса клетки, а индекс блеббинга лимфоцитов получают при умножении лимфоцитов в состоянии терминального блеббинга на 100, разделенное на суммарный блеббинг лимфоцитов, и при повышении суммарного блеббинга лимфоцитов выше 30%, значении индекса блеббинга лимфоцитов свыше 37 усл.ед. диагностируют системный воспалительный ответ организма при критическом состоянии.
Способ диагностики СВО осуществляют следующим образом. Забор венозной крови в объеме 5 миллилитров осуществляют толстой иглой из локтевой вены пациента в пластмассовую пробирку с рисками, содержащую 0,15 мл гепарина; кровь тщательно перемешивают с гепарином в пробирке. В отдельную пластмассовую пробирку вносят 2 миллилитра фиколл-верографина (Pharmacia Chemical, Uppsala, Sweden) с плотностью ρ=1.077. Осторожно по стенке пробирки медленно дозатором наслаивают 4 миллилитра ресуспензированной крови. Пробирка закрывают крышкой, центрифугируют при комнатной температуре в течение 15 минут со скоростью 3000 оборотов в минуту. После центрифугирования на границе раздела фаз пастеровской пипеткой собирают лимфоцитарное кольцо в отдельную пластмассовую пробирку. Пробирку с выделенным лимфоцитарным кольцом центрифугируют при комнатной температуре в течение 5 минут со скоростью 3000 оборотов в минуту. После центрифугирования удаляют супернатант, к осадку добавляют 500 мкл фосфатного буфера (рН 7,4) или раствор Хенкса в таком же объеме, тщательно ресуспезируют дозатором с большим наконечником. На предварительно обезжиренное предметное стекло наносят 50 мкл суспензии, поверх аккуратно, стараясь препятствовать образованию пузырей, наносят покровное стекло; излишки удаляют фильтровальной бумагой; перед микроскопированием наносят на покровное стекло небольшое количество масла. Микроскопируют с использованием фазово-контрастной насадки при увеличении не менее 900 раз. В поле зрения микроскопа регистрируют лимфоциты - клетки округлой формы размером 9-10 микрометров. По морфологии цитоплазматической мембраны дифференцируют следующие виды лимфоцитов:
1) интактные клетки (с визуально неизмененной плазматической мембраной, круглая, ровная поверхность); 2) клетки в состоянии начального блеббинга (мелкие везикулы на мембране - до 1/3 радиуса клетки); 3) клетки в состоянии терминального блеббинга (крупные пузыри мембраны - более 1/3 радиуса клетки); 4) некротизированные лимфоциты (с разрушенной мембраной) (Михуткина СВ., Салмина А.Б. Сычев А.В. и др. Блеббинг плазматической мембраны тимоцитов и апоптоз связаны с нарушением емкостного входа СА2+ в клетки // Бюллетень экспериментальной медицины, 2004: 137(6): 623-632).
Расчет проводят по нескольким полям зрения на 100 лимфоцитов, рассчитывая количество лимфоцитов в состоянии начального блеббинга (Бн) и терминального блеббинга (Бт), определяя их как суммарный блеббинг (Бс). Отношение количества лимфоцитов в состоянии Бт по отношению к количеству всех лимфоцитов в состоянии Бс оценивают как индекс блеббинга лимфоцитов (ИБЛ) и расценивают его как показатель выраженности системного воспалительного ответа организма при критическом состоянии. ИБЛ вычисляют по формуле: ИБЛ=Бт·100/Бс и при повышение Бс выше 30% от всех лимфоцитов в состоянии блеббинга и повышение ИБЛ выше 37 расценивают как СВО организма на критическое состояние.
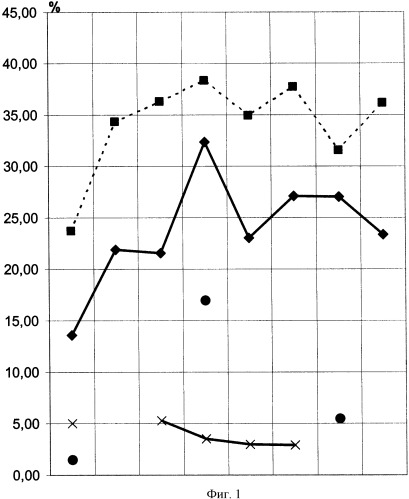
Исследования состояния плазматической мембраны лимфоцитов периферической крови проведены в двух группах пациентов: у пациентов, оперированных по поводу ИБС, операция проведена в условиях искусственного кровообращения (ИК) - 45 пациентов, и у пациентов с гнойно-септическими заболеваниями. Исследование состояния плазматической мембраны у пациентов, оперированных по поводу ИБС, осуществляли перед операцией, через час после ИК, на второй, третий, седьмой и десятый дни послеоперационного периода. Результаты исследования представлены в таблице №1. Статистический анализ полученных результатов включал методы статистического описания и проверки статистических гипотез. В пределах каждой выборки определяли среднее арифметическое, среднее квадратичное отклонение, ошибку среднего. При условии соответствия нормальному закону распределения оценку достоверности различий осуществляли с использованием t-критерия Стьюдента и Т-теста. Статистическая обработка результатов произведена с помощью пакетов прикладных программ STATISTICA v. 6.0 [StatSoft-Russia, 1999] и BIOSTATISTICA.
| Таблица №1.Исследования состояния плазматической мембраны лимфоцитов у пациентов, оперированных в условиях ИК. | |||||||
| Группы исследования | Неизменные лимфоциты | Блеббинг лимфоцитов периферической крови | IL-6 | ЛИИ | |||
| Начальный | Терминальный | Суммарный | Индекс блеббинга | ||||
| Контрольная группа | 86,40 | 10,20 | 3,40 | 13,60 | 23,70 | 1,52 | 4,99 |
| До ИК | 78,10* | 13,42 | 8,48 | 21,9* | 34,31*** | ||
| 1 час ИК | 78,44* | 13,56 | 8,00 | 21,56* | 36,31*** | 5,24 | |
| 1 сутки после ИК | 67,64* | 19,52 | 12,84 | 32,36* | 38,32*** | 16,98 | 3,5 |
| 2 сутки после ИК | 76,95** | 15,10 | 7,95 | 23,05** | 34,90** | 3 | |
| 3 сутки после ИК | 72,89* | 16,58 | 10,53 | 27,11* | 37,67** | 2,9 | |
| 7 сутки после ИК | 73* | 18,22 | 8,78 | 27* | 31,58 | 5,47 | |
| 10 сутки после ИК | 76,63* | 14,63 | 8,74 | 23,37* | 36,16** | ||
| Примечание: * - достоверно относительно показателя уровня контрольной группы при p<0,001 (Mann-Whitney); ** - достоверно относительно показателя уровня контрольной группы при p<0,001 (Т-тест); *** - достоверно относительно показателя уровня контрольной группы при p<0,05 (Т-тест). |
Данные таблицы №1 проиллюстрированы на фиг.1 (Исследования состояния плазматической мембраны лимфоцитов у пациентов, оперированных в условиях ИК), по оси абсцисс - лимфоциты в процентах, по оси ординат - даты исследования.
Показатели лейкоцитарного индекса интоксикации (ЛИИ) по Кальф-Калифу даны в абсолютных значениях. Данные уровня интерлейкина-6 в ммоль/л. Такие изменения плазматической мембраны лимфоцита периферической крови как Бс отмечен, ИБЛ - отмечен - . Параллельно определялся уровень интерлейкина-6 (IL-6) - отмечен - ; уровень ЛИИ - отмечен - .Подъем кривых и характеризуют изменения плазматической мембраны лимфоцита периферической крови в виде увеличения Бс и ИБЛ, они наиболее выражены непосредственно перед операцией (первый этап), продолжая увеличиваться во время проведения ИК (второй этап). Наибольшее значение Бс и ИБЛ приходится на первые сутки после операции, что соответствует показателям уровня интерлейкина-6 в периферической крови, показатели интерлейкина-6 не имеют достоверности. Изменения в показателях ЛИИ не информативны.
Наиболее показательные данные получены при определении ИБЛ периферической крови на этапах исследования, в сочетании показателей Бс и ИБЛ можно определить начало развития СВО при критических состояниях. Повышение Бс лимфоцитов периферической крови выше 30% от всех лимфоцитов и повышение ИБЛ выше 37 расценивался как СВО организма на критическое состояние, в данном случае в результате проведения большой операции в условиях искусственного кровообращения.
У 29 пациентов с абдоминальным гнойно-септическим заболеванием исследование проводили дискретно, параллельно определяя тяжесть состояния пациентов по шкале APACHE II. Сепсис встречался у 26 пациентов, синдром полиорганной недостаточности развился у 13 пациентов. У пациентов с гнойно-септическими заболеваниями не отмечено корреляционной связи между выраженностью блеббинга с определением тяжести состоянии по шкале APACHE II, что объясняется инертностью оценки тяжести состояния по шкале. Вместе с тем, у большинства пациентов отмечено однонаправленное изменение в показателях, полученных при оценке состояния по шкале APACHE II, и ИБЛ с разницей во времени на сутки и более.
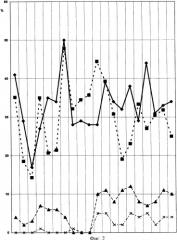
ПРИМЕР №1. В таблице №2 представлены показатели суммарного блеббинга, индекса блеббинга в соответствии с определением состояния пациента по шкале APACHE II у пациента с панкреонекрозом.
| Таблица №2.Показатели состояния пациента с панкреонекрозом по шкале APACHE II и состояние плазматической мембраны лимфоцитов периферической крови. | |||
| Дата исследования | Суммарный блеббинг | Индекс блеббинга | APACHE II |
| 8.03 | 41 | 35,14 | 4 |
| 9.03 | 29 | 18,52 | 2 |
| 10.03 | 17 | 14,29 | 3 |
| 13.03 | 27 | 35,00 | 7 |
| 14.03 | 35 | 20,69 | 6 |
| 15.03 | 34 | 21,43 | 6 |
| 16.03 | 50 | 47,83 | 4 |
| 17.03 | 28 | 32,14 | 0 |
| 21.03 | 29 | 34,48 | 0 |
| 22.03 | 28 | 35,71 | 0 |
| 29.03 | 28 | 44,44 | 10 |
| 31.03 | 39 | 39,29 | 11 |
| 3.04 | 34 | 30,77 | 8 |
| 5.04 | 32 | 19,05 | 11 |
| 6.04 | 38 | 23,08 | 12 |
| 7.04 | 29 | 33,33 | 8 |
| 10.04 | 44 | 27,03 | 7 |
| 4.04 | 31 | 30,43 | 8 |
| 11.04 | 33 | 31,82 | 11 |
| 13.04 | 34 | 25,00 | 10 |
| контрольная группа | 13,60 | 23,70 | 0 |
На фиг.2 (ПРИМЕР №1. Показатели состояния пациента с панкреонекрозом по шкале РАСНЕ II и состояние плазматической лимфоцитов периферической крови) представлен график изменения плазматической мембраны лимфоцита периферической крови у пациента с панкреонекрозом соответственно таблице №2, за исключением контрольной группы. Суммарный блеббинг лимфоцитов отмечен кривой , индекс блеббинга отмечен кривой . Состояние пациента оценивалась по шкале APACHE II обозначено - . Изменения плазматической мембраны лимфоцита периферической крови наиболее выражены после санирующих операций, первое и третье снижение кривых и соответствует снижению уровня суммарного блеббинга и индекса блеббинга и коррелирует со стабилизацией состояния, зафиксированного по шкале APACHE II, кривая . Повышение кривых и произошло после переливания чужеродного белка (донорской плазмы, эритроцитарной взвеси). После проведения в барокамере сеанса гипербарической оксигенации (ГБО) отмечено повышение второй и третьей кривых и . Изменения кривой происходят перед изменением кривой , что повышает диагностическую значимость индекса блеббинга для диагностики системного воспалительного ответа организма при критических состояниях.
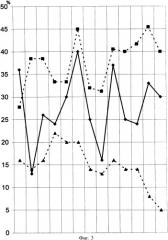
ПРИМЕР №2. В таблице №3 представлены изменения плазматической мембраны лимфоцита периферической крови у пациента с диагнозом: Абсцесс селезенки, поддиафрагмальный абсцесс. ДВС-синдром.
| Таблица №3Показатели состояния пациента с абсцессом брюшной полости по шкале APACHE II и состояние плазматической мембраны лимфоцитов периферической крови. | |||
| Дата исследований | Суммарный блеббинг | Индекс блеббинга | APACHE II |
| 20.04.06 | 36 | 27,78 | 16 |
| 21.04.06 | 13 | 38,46 | 14 |
| 24.04.06 | 26 | 38,46 | 16 |
| 25.04.06 | 24 | 33,33 | 22 |
| 25.04.06 | 30 | 33,33 | 20 |
| 27.04.06 | 40 | 45,00 | 20 |
| 03.05.06 | 25 | 32,00 | 14 |
| 04.05.06 | 16 | 31,25 | 13 |
| 05.05.06 | 37 | 40,54 | 16 |
| 10.05.06 | 25 | 40,00 | 14 |
| 11.05.06 | 24 | 41,67 | 14 |
| 17.05.06 | 33 | 45,45 | 8 |
| 18,05,06 | 30 | 40,00 | 5 |
| контрольная группа | 13,60 | 23,70 | 0 |
На фиг.3 (ПРИМЕР №2. Показатели состояния пациента с абсцессом брюшной полости по шкале APACHE II и состояние плазматической лимфоцитов периферической крови) представлены кривые в соответствии с таблицей №3, за исключением контрольной группы. Маркировка суммарного блеббинга, индекса блеббинга и шкалы APACHE II аналогично фиг.2.
Первое снижение кривых и произошло после проведения санирующей операции - лапаротомия, спленэктомия, санация и дренирование брюшной полости. Повышение этих же кривых произошло после переливания чужеродного белка, в данном случае это свежеразмороженная одногруппная плазма, что и увеличило уровень суммарного блеббинга лимфоцитов периферической крови и индекса блеббинга. Следующий подъем данных кривых отмечен при высокой лихорадке до 39,2°С и после переливания отмытых одногруппных эритроцитов. Переливание свежеразмороженной одногруппной плазмы повторно увеличивает уровень блеббинга лимфоцитов периферической крови. Изменения кривой , соответствующими показателям по шкале APACHE II, происходят вслед за изменениями кривой , соответствующие индексу блеббинга. При ухудшении состояния отмечено последнее повышение кривых и , пациенту проводится операция - дренирование поддиафрагмального абсцесса.
Таким образом, способ регистрации состояния плазматической мембраны лимфоцитов периферической крови является достаточно чувствительным способом, позволяющим регистрировать СВО организма и оценивать его динамику при критических состояниях.
К достоинствам предлагаемого способа также относится возможность осуществления экспресс-диагностики СВО, не требующей дорогостоящего оборудования и расходных материалов.
Способ диагностики системного воспалительного ответа организма при критических состояниях, заключающийся в выделение лимфоцитов периферической крови по градиенту плотности, определении фазово-контрастной микроскопией нарушения мембран-цитоскелетных взаимоотношений в лимфоцитах, регистрации выраженности повреждения плазматической мембраны лимфоцитов в состоянии блеббинга, расчете показателей индекса блеббинга лимфоцитов и суммарного блеббинга лимфоцитов, причем суммарный блеббинг лимфоцитов вычисляют при сложении лимфоцитов в состоянии начального блеббинга, характеризующегося наличием мелких везикул на мембране до 1/3 радиуса клетки и лимфоцитов в состоянии терминального блеббинга, характеризующегося наличием крупных пузырей мембраны более 1/3 радиуса клетки, а индекс блеббинга лимфоцитов получают при умножении лимфоцитов в состоянии терминального блеббинга на 100, разделенное на суммарный блеббинг лимфоцитов, и при повышении суммарного блеббинга лимфоцитов выше 30%, значении индекса блеббинга лимфоцитов свыше 37 усл.ед. диагностируют системный воспалительный ответ организма при критическом состоянии.