Липосомальная доставка соединений, основанных на витамине е
Иллюстрации
Показать всеИзобретение относится к медицине, к созданию и применению аэрозольных распыляемых композиций для лечения заболеваний или расстройств, лечение которых требует снижения клеточной пролиферации и/или индукции клеточного апоптоза у пациента, таких как неопластические, аутоиммунные, вирусные заболевания. Композиция содержит в качестве действующего вещества основанное на витамине Е соединение, имеющее структурную формулу
где R1 представляет собой карбоновую кислоту;
R2 и R3 представляют собой водород или R4;
R4 является метилом и R5 является алкилом или
где R1 представляет собой водород или карбоновую кислоту;
R2 и R3 представляют собой водород или R4;
R4 является метилом и R5 является алкенилом.
Изобретение обеспечивает улучшенную доставку указанного соединения ингаляционным путем с усилением его антипролиферативной активности. 3 н. и 56 з.п. ф-лы, 26 ил., 6 табл.
Реферат
Перекрестная ссылка на родственную заявку
Настоящая патентная заявка, не являющаяся предварительной, основывается на полезных результатах, полученных ранее и описанных в предварительных патентных заявках Соединенных Штатов: заявка No. 60/416602, зарегистрированная 15 октября 2002, которая в настоящее время аннулирована, заявка No. 60/406807, зарегистрированная 29 августа 2002, которая в настоящее время аннулирована, и заявка No. 60/342156, зарегистрированная 19 декабря 2001, которая в настоящее время аннулирована.
Область техники
Данное изобретение относится к области фармакологии и лечению раковых заболеваний. Точнее, настоящее изобретение относится к доставке липосомальных препаратов на основе соединений витамина Е, как к эффективному способу лечения и профилактики рака.
Уровень техники
Контроль регуляции выживания (жизнеспособность) и гибели (апоптоз) представляет собой чрезвычайно сложный процесс, в котором участвует множество внутриклеточных путей передачи сигнала и множество взаимодействующих генных продуктов. Раковые клетки могут проявлять повышенную экспрессию генов и их продуктов, способствующих клеточной пролиферации, увеличению количества раковых клеток. Помимо повышения экспрессии генов, ответственных за выживание, раковые клетки осуществляют регуляцию по типу отрицательной связи генов и их продуктов, которые контролируют сигналы гибели, приводящие к аккумуляции и повышенному метастазированию угрожающих жизни раковых клеток. Сочетание нерегулируемой клеточной пролиферации и супрессии путей передачи сигналов, индуцирующих гибель клеток, приводят как к росту раковых клеток, так и к их выживанию.
Увеличение числа клеток или зависит, или не зависит от баланса экспрессии отрицательных и положительных регулирующих рост генных продуктов, и присутствия или отсутствия функциональных путей передачи сигнала к клеточной гибели. Отрицательные регулирующие рост гены вносят вклад в блокировку клеток в клеточном цикле. Положительные регулирующие рост гены стимулируют клетки к росту на протяжении клеточного цикла. Гены, участвующие в апоптозе, могут быть либо проапоптическими, либо антиапоптическими, и динамический баланс между ними определяет, клетка живет или умирает.
Существует широкий ряд патологических состояний, связанных с клеточной пролиферацией, для которых требуются новые стратегии и средства. Такие патологические состояния могут охватить почти все типы клеток, проявляющие способность к аномальной клеточной пролиферации или аномальному ответу на сигналы клеточной гибели. Среди типов клеток, которые проявляют признаки патологического или аномального роста, находятся фибробласты, эндотелиальные клетки и эпителиальные клетки сосудов. Таким образом, новые методы требуются для лечения локальных или распространяющихся патологических состояний во всех или почти во всех органах и тканях индивидуумов.
В большинстве случаев злокачественные опухоли, являются ли они специфическими для мужчин, такие как рак предстательной железы или яичка, или специфическими для женщин, такие как рак грудной железы, яичника или шейки матки, или они в равной степени поражают и мужчин и женщин, такие как рак печени, кожи или легких, со временем подвергаются генетическим изменениям и эпигенетическим изменениям, приводящим, в конечном счете, к образованию высоко метастатических и трудно излечиваемых опухолей. Хирургическое удаление локализованных опухолей может оказаться эффективным только в случае, когда опухоль не распространяется за пределы первичного поражения. Если опухоль распространяется на другие ткани и органы, хирургические процедуры должны сопровождаться другими более специфическими процедурами, способствующими удалению пораженных или злокачественных клеток. Большинство общепринятых дополнительных процедур для лечения пораженных или злокачественных клеток, таких как химиотерапия или облучение, не направлено только на опухолевые клетки и, хотя они оказывают соразмерно более высокое деструктивное действие на злокачественные клетки, часто воздействуют до некоторой степени на нормальные клетки.
Некоторые природные соединения витамина Е и некоторые производные витамина Е применяли в качестве проапоптических средств и ингибиторов синтеза ДНК и, тем самым, эффективных противораковых средств. Структурно витамин Е состоит из головной группы хроманола и алкильной боковой цепи. Имеется восемь основных природных форм витамина Е: альфа (α), бета (β), гамма (γ) и дельта (δ) токоферолы и α, β, γ и δ токотриенолы. Токоферолы отличаются от токотриенолов тем, что они имеют насыщенную фитильную боковую цепь, а не ненасыщенную изопренильную боковую цепь. Четыре формы токоферолов и токотриенолов отличаются количеством метильных групп в хроманольной головной группе (α имеет три, β имеет две и δ имеет одну), как показано в таблице 1.
| Таблица 1 | |||
| Общая структура токоферолов и токотриенолов | |||
| R1 | R2 | R3 | |
| Альфа (α) | СН3 | СН3 | СН3 |
| Бета (β) | СН3 | Н | СН3 |
| Гамма (γ) | H | СН3 | СН3 |
| Дельта (δ) | H | Н | СН3 |
Некоторые исследования касаются высокой противоопухолевой активности RRR-α-токоферилсукцината (сукцинат витамина Е; VES), гидролизуемого сложноэфирного производного RRR-α-токоферола. Исследователи Prasad и Edwards-Prasad были первыми, описавшими способность сукцината витамина Е, а не других форм витамина Е, вызывать морфологические изменения и ингибирование роста клеток меланомы В-16 мыши, и предположили, что сукцинат витамина Е может быть благоприятным терапевтическим противоопухолевым средством (1). Дополнительные исследования показали, что сукцинат витамина Е является эффективным ингибитором роста широкого ряда типов эпителиальных раковых клеток, включая клетки грудной железы, простаты, легких и ободочной кишки, а также гемопоэтические, лейкозные и лимфоидные клетки in vitro (2-7).
Недавние исследования показали, что сукцинат витамина Е при внутрибрюшинном введении (i.p.) проявляет противоопухолевую активность на животных, являющихся моделями ксенотрансплантации и аллотрансплантации (8-11), что свидетельствует о возможной терапевтической активности данного препарата. Было показано, что при i.p. или пероральном (р.о.) введении сукцинат витамина Е проявляет ингибиторную активность по отношению к раку кардиального отдела желудка у мыши, индуцированному канцерогеном [бензо(а)пиреном], что свидетельствует о потенциале сукцината витамина Е как антиканцерогенного средства (12). Исследования показали, что сукцинат витамина Е вызывает зависимые от концентрации и времени ингибирование роста раковых клеток посредством блокировки синтеза ДНК индукцию клеточной дифференцировки и индукцию апоптоза (5, 6, 10, 13-15, неопубликованные данные).
Ингибирование клеточной пролиферации включает в себя блокировку GO/G1 клеточного цикла, опосредованную, отчасти, MAP киназами МЕК1 и ERK1, и активацию ключевого регуляторного белка клеточного цикла р21(waf1/cip1) (30). Индукция дифференцировки характеризуется морфологическими изменениями, повышенной передачей сигнала бета-казеина, экспрессией липидов молока, повышенным уровнем белка цитокератина 18 и регуляцией по типу обратной связи белка Her2/neu (13). Дифференцировка опосредуется, частично, путем активации MEK1, ERK1/2 и фосфорилирования белка c-Jun (13, 14). Из множества реакций передачи сигнала апоптоза, модулированных RRR-α-токоферолсукцинатом, особенно заслуживающей внимания является его способность превращать не чувствительные к Fas/Fas лиганду опухолевые клетки в Fas/Fas лигандчувствительные клетки, и его способность превращать опухолевые клетки, не отвечающие на трансформирующий фактор роста (TGF-α), в клетки, чувствительные к TGF-α, причем обе восстановленные реакции сходятся на JNK/c-Jun с последующей транслокацией белка Вах к митохондриям, индукцией перехода через проницаемую мембрану митохондрий, высвобождением цитохрома с в цитоплазму, активацией каспаз 9 и 3, расщеплением поли (ADP-рибоза)полимеразы (PARP) и апоптозом (15, 29, 31).
Сукцинат витамина Е заслуживает внимания не только в связи с его индукцией торможения роста опухолевых клеток, но также в связи с отсутствием токсичности по отношению к нормальным клеткам и тканям (2-7, 11). Применение негидролизуемого производного сукцината витамина Е показало, что оно является интактным соединением и ни один из его продуктов расщепления (а именно, RRR-α-токоферол или янтарная кислота) не являются ответственными за антипролиферативную активность (4). Таким образом, полагают, что антипролиферативное действие указанного производного витамина Е объясняется свойствами, отличными от антиоксидантных.
RRR-α-токоферилсукцинат (VES) является производным RRR-α-токоферола, структура которого была модифицирована путем образования сложноэфирной связи с сукцинильным фрагментом вместо гидроксильного фрагмента в положении 6 хромана. Указанный сукцинатный фрагмент, связанный сложноэфирной связью с RRR-α-токоферолом, оказался самой эффективной формой витамина Е, влияющей на биологическую способность запускать апоптоз и ингибировать синтез ДНК. Данная форма витамина Е вызывает апоптоз опухолевых клеток, в то же время не проявляет апоптотического действия по отношению к нормальным клеткам. Форма витамина Е с сукцинильным фрагментом является эффективным противораковым средством и в то же время интактным агентом; однако клеточные и тканевые эстеразы, которые могут отщеплять сукцинатный фрагмент, таким образом превращая сукцинатную форму RRR-α-токоферола в свободный RRR-α-токоферол, делают указанное соединение неэффективным как противораковое средство. RRR-α-токоферол не проявляет ни антипролиферативную, ни проапоптическую биологическую активность в клетках эпителиального или иммунного происхождения.
Конструирование соединений, основанных на RRR-альфа-токофероле или RRR-альфа-токотриеноле, модифицированных в С6 положении первого кольца головной группы хроманола альфа-токоферола или альфа-токотриенола посредством образования эфирной связи, поможет создать соединения с сильными противораковыми свойствами. Клеточные эстеразы не обнаружены в клетках; таким образом, такие соединения будут оставаться интактными в клеточной культуре, а также in vivo. В патенте США 6417223 использовали коммерчески доступный чистый RRR-α-токоферол в качестве исходного материала, из которого синтезировали аналоги витамина Е. Модификации были сделаны к трем частям молекулы RRR-α-токоферола: к 6-ому углероду фенольного кольца в хромане, к хроману, состоящему из фенольного и гетероциклического кольца или к фитильному остатку. В RRR-α-токофероле к 6-ому углероду фенольного кольца присоединен гидроксильный (-ОН) фрагмент, который является важным для проявления антиоксидантной активности.
Проверка аналогов витамина Е на их способность индуцировать апоптоз широкого ряда раковых клеток человека, а не нормальных клеток человека, а также анализ структуры и функции аналогов показывают, что основанные на токофероле аналоги, полная длина которых составляет 29 Å от донора Н-связи до конца фитильного остатка, которая имеет длину 17 Å, содержащие полностью метилированное замкнутое фенольное кольцо, насыщенное замкнутое гетероциклическое кольцо и негидролизуемый фрагмент уксусной кислоты, присоединенный к С6 фенольного кольца эфирной связью, проявляют самую мощную противораковую активность (фиг.1).
Способ доставки терапевтических средств, доставляются ли они пероральным путем, с пищей, через зонд, подкожным, внутрибрюшинным, местным, внутривенным, внутримышечным, респираторным путем и т.д., оказывает большое влияние на уровни и распределение в тканях лекарственных средств. Патент США No. 6090407 описывает противораковые препараты паклитаксел и камптотецин, которые могут быть включены в липосомы с целью доставки к дыхательным путям индивидуума посредством распыления. Введение указанных противораковых лекарственных препаратов посредством липосомальной ингаляции представляет собой более быстрое и более эффективное средство доставки, чем внутримышечная инъекция или пероральное введение.
Применение липосомального аэрозоля для доставки растительного алкалоида 9-нитрокамптотецина является наилучшим способом торможения роста раковых клеток молочной железы (28), ободочной кишки и легких человека, пересаженных иммунонекомпетентным голым мышам, по сравнению с доставкой 9-нитрокамптотецина посредством внутримышечной инъекции. Уровни 9-нитрокамптотецина при доставке в легкие, печень и головной мозг в виде липосомального аэрозоля в течение тридцати минут составили 310 нг/г, 192 нг/г и 61 нг/г соответственно, в то время как уровни 9-нитрокамптотецина при внутримышечной доставке в легкие, печень и головной мозг в течение тридцати минут составили 2-4 нг/г, 136 нг/г и 0 соответственно (16). Кроме того, указанный способ доставки, по-видимому, является высокоэффективным способом, направленным против метастазирования меланомы и остеосаркомы в легкие мышей (18). Аэрозольная доставка лекарственных средств имеет огромную важность, поскольку она является высокоэффективной и хорошо переносится человеком (19). Таким образом, способ доставки лекарственных средств посредством липосомального аэрозоля является эффективным способом достижения более высоких уровней и большего распределения в тканях лекарственных препаратов.
Кроме того, изобретатели признают необходимость в создании других эффективных способов липосомальной доставки противораковых препаратов, основанных на витамине Е, которые способствуют более продолжительному удерживанию, созданию более высокой концентрации лекарственного препарата, снижению системной токсичности и уменьшению требований к дозированию. Таким образом, предыдущий уровень техники отличается недостаточностью эффективных средств доставки индивидууму противораковых лекарственных средств, основанных на витамине Е, посредством липосом. Точнее, аэрозольная липосомальная доставка или введение через желудочный зонд липосомальных композиций противораковых лекарственных средств, основанных на витамине Е, является желательным. Настоящее изобретение осуществляет эту давнишнюю потребность и желание в данной области.
Краткое описание сущности изобретения
В одном аспекте настоящего изобретения представлен способ лечения заболевания, ассоциированного с пролиферацией клеток, заключающий в себе стадию доставки композиции, содержащей основанное на витамине Е противораковое соединение, которое содержится в везикуле, доставляемой индивидууму при необходимости такого лечения, где соединение имеет структурную формулу
где R1 представляет собой водород или карбоновую кислоту; R2 и R3 представляют собой водород или R4; R4 является метилом и R5 является алкилом или алкенилом.
В другом аспекте настоящего изобретения разработана везикула для доставки основанного на витамине Е противоракового соединения, как описано в данном тексте.
Другие и добавочные аспекты, в особенности общий полезный результат и преимущества настоящего изобретения, будут очевидны из следующего описания представленных предпочтительных аспектов изобретения, данных с целью раскрытия изобретения.
Краткое описание чертежей
Для того чтобы суть изобретения, в котором вышеперечисленные особенности, преимущества и цели, а также другие характеристики, которые станут очевидными, была раскрыта и понята в деталях, более подробное описание изобретения кратко суммировано со ссылкой на определенные аспекты изобретения, которые иллюстрированы посредством прилагаемых чертежей. Указанные чертежи составляют часть описания. Однако следует заметить, что прилагаемые чертежи иллюстрируют предпочтительные аспекты изобретения и поэтому не рассматриваются как ограничивающие сферу изобретения.
На фиг.1 представлена модель аналогов R,R,R-α-токоферола, изображающая структурные элементы, которые требуются для проявления мощной противораковой активности. Группа R1 боковой цепи у С6 должна иметь такую длину, чтобы полная длина молекулы не превышала 29 Å.
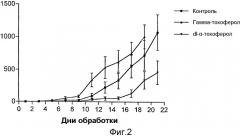
На фиг.2 представлены результаты сравнения противоракового действия природных альфа- и гамма-токоферолов, природного альфа-токотриенола, фракции, обогащенной токотриенолом (TRF), синтетических токоферолов и синтетических производных токоферола по отношению к 66 cl.4 GFP опухолевым клеткам молочной железы.
На фиг.3А-3D представлены данные по апоптозу, индуцированному α-ТЕА. Фиг.3А: 66 cl.4-GFP клетки молочной железы мыши обрабатывали 10 мкг/мл α-ТЕА или сукцината витамина Е (положительный контроль) или не обрабатывали и культивировали в течение 3 дней. Клетки собирали, ядра метили флуоресцентным красителем DAPI, связывающимся с ДНК, и клетки проверяли, используя флуоресцентный микроскоп Zeiss ICM 405 (×400) с фильтром 487701. Ядра клеток с конденсированным хроматином или фрагментированные ядра подсчитывали как апоптические. Данные представлены из многочисленных экспериментов. Фиг.3В/3С: анализ клеток с окрашенными DAPI ядрами показывает, что α-ТЕА индуцирует апоптоз в зависимости от концентрации и времени. Данные представлены как средние величины ± стандартное отклонение трех экспериментов. Фиг.3D: дополнительное доказательство в пользу индукции апоптоза посредством α-ТЕА с помощью расщепления поли(ADP-рибоза)полимеразы (PARP). Клетки 66 cl.4-GFP обрабатывали 5, 10 или 20 мкг/мл α-ТЕА в течение 48 часов, клеточные лизаты анализировали на присутствие продукта расщепления PARP (р84) с помощью иммунного анализа вестерн-блоттинга. Данные представлены из 3 отдельных экспериментов.
На фиг.4А и 4В показано, что α-ТЕА индуцирует 66 cl. 4 клетки к апоптозу in vivo. Индукцию апоптоза посредством α-ТЕА определяли, используя 5 мкм опухолевые срезы, полученные от мышей после обработки липосомальным α-ТЕА/аэрозолем и от контрольной группы мышей (N=4), обработанных липосомальным аэрозолем. Апоптические клетки определяли, используя набор ApopTag In Situ Apoptosis Detection kit (Intergen, Purchase, NY). На фиг.4А представлены данные сравнения количества апоптических ядер после обработки липосомальным аэрозолем с α-ТЕА и после обработки контрольной группы аэрозолем. На фиг.4 В представлены положительно окрашенные апоптические клетки в опухолевых срезах у мышей, обработанных липосомальным аэрозолем с α-ТЕА и контрольных обработанных аэрозолем мышей.
На фиг.5 представлены результаты ингибирования клонального роста 66 cl.4-GFP посредством α-ТЕА. Обработка 66 cl.4-GFP клеток (помещали 600 клеток/культуральный планшет) посредством α-ТЕА при 1,25, 2,5 и 5 мкг/мл в течение 10 дней приводила к торможению образования колоний. Клетки окрашивали метиленовым голубым и количество колоний в обработанной и контрольной группах подсчитывали.
На фиг.6 графически представлен вес тела balb/c мышей, которым имплантировали 66 cl.4 GFP опухолевые клетки молочной железы мыши и которых обрабатывали липосомальной композицией с α-ТЕА, доставляемой посредством аэрозоля. Вес животного проверяли, начиная с девятого дня после имплантации опухолевых клеток.
На фиг.7 графически представлены уровни α-ТЕА в сыворотке и ткани balb/c мышей через 0, 2, 6 или 24 часа по окончании обработки липосомальным/α-ТЕА 1 аэрозолем.
На фиг.8 графически представлен вес опухолей у balb/c мышей, которым имплантировали 66 cl.4 GFP опухолевые клетки молочной железы мыши и которых обрабатывали липосомальной композицией с α-ТЕА, доставляемой посредством аэрозоля. Вес опухолей проверяли, начиная с девятого дня после имплантации опухолевых клеток.
На фиг.9А и 9В графически представлены результаты торможения роста опухолей и микрометастазов посредством липосомального аэрозоля с α-ТЕА. Фиг.9А: 66 cl.4-GFP клетки в количестве 2×105/мышь вводили в паховую область в точке, находящейся на одинаковом расстоянии между 4-м и 5-м сосками. Через девять дней после инокуляции опухоли мышей (10/группу) не обрабатывали или обрабатывали ежедневно липосомальным α-ТЕА/аэрозолем или аэрозолем только в течение 17 дней. Объем опухоли/мышь определяли при двухдневных интервалах. Объем опухоли (мм3) выражали как средние величины ± стандартная ошибка. Фиг.9В: при вскрытии трупа количество флуоресцирующих метастазов в левой доле легкого после обработки мышей липосомальным α-ТЕА/аэрозолем (8 мышей), аэрозолем только (10 мышей) и у необработанных мышей (10 мышей) определяли с помощью флуоресцентного микроскопа Nik-on (TE-200; 200X) и с использованием программы Image Pro-Plus S.E. для определения размера микрометастазов. Данные представлены как средние величины ± стандартная ошибка.
На фиг.10 графически представлены результаты ингибирования опухолевого роста 66 cl.4 GFP опухолевых клеток молочной железы посредством липосомального α-ТЕА и липосомального сукцината витамина Е (VES), доставляемых посредством распыления аэрозоля.
На фиг.11 графически представлен вес опухолей у balb/c мышей, которым имплантировали 66 cl.4 GFP опухолевые клетки молочной железы мыши и которых обрабатывали липосомальной композицией с α-ТЕА, доставляемой посредством желудочного зонда. Вес опухолей проверяли, начиная с девятого дня после имплантации опухолевых клеток. Фиг.11 отличается от фиг.8 только тем, что мышей обрабатывали ежедневно через желудочный зонд посредством 5 мг α-ТЕА в арахисовом масле или арахисового масла только и обрабатывали в течение только 13 дней.
На фиг.12А и 12В показано, что α-ТЕА, введенный через желудочный зонд, не ингибирует рост опухоли на участке инокуляции, но ингибирует микрометастазы легкого. Объем опухоли и размеры и количество микрометастазов были описаны в подписи к фиг.9А и 9В.
На фиг.13 графически представлены результаты ингибирования опухолевого роста 66 cl.4 GFP опухолевых клеток молочной железы посредством липосомального α-ТЕА и липосомального сукцината витамина Е (VES), доставляемых через желудочный зонд.
На фиг.14А и 14В графически представлены результаты ингибирования метастазов легкого (фиг.14А) и метастазов лимфатического узла (фиг.14В) опухолевых клеток 66 cl.4 GFP молочной железы посредством липосомального α-ТЕА и липосомального сукцината витамина Е (VES), доставляемых через желудочный зонд.
На фиг.15 графически представлены результаты ингибирования опухолевого роста MDA-MB-435 раковых клеток молочной железы посредством липосомального α-ТЕА, доставляемого через желудочный зонд.
На фиг.16А-16С показано апоптическое действие α-ТЕА или комбинации α-ТЕА/цисплатина на А2780 цисплатинчувствительную клеточную линию и на цисплатиннечувствительные ср-70 раковые клетки яичника человека. Фиг.16А: апоптическое действие in vitro α-ТЕА на А2780 линии клеток и ср-70 линии раковых клеток яичника человека. Фиг.16В: α-ТЕА восстанавливает чувствительность цисплатина к ср-70 in vitro. Фиг.16С: ингибирование роста опухоли посредством как α-ТЕА, так и комбинации α-ТЕА с цисплатином на А2780 и ср-70 in vivo. Данные in vivo показывают, что α-ТЕА превращает цисплатин-нечувствительные клетки ср-70 в цисплатинчувствительные и что комбинации α-ТЕА + цисплатин снижают рост ср-70 клеточных ксенотрансплантатов яичника у голых мышей.
На фиг.17 показано действие α-ТЕА, метилселеноцистеина и транс-ресвератрола на рост злокачественной опухоли MDA-MB-435 GFP FL молочной железы in vivo.
Подробное описание изобретения
В одном аспекте настоящего изобретения разработан способ лечения заболевания, связанного с клеточной пролиферацией, включающий стадию доставки композиции, содержащей основанное на витамине Е противораковое соединение, которое содержится в везикуле, доставляемой индивидууму при необходимости такого лечения, где соединение имеет структурную формулу
где R1 представляет собой водород или карбоновую кислоту; R2 и R3 представляют собой водород или R4; R4 является метилом и R5 является алкилом или алкенилом.
Во всех аспектах данного варианта осуществления изобретения противораковыми соединениями, основанными на витамине Е, могут быть токоферол, такой как β-токоферол, γ-токоферол, δ-токоферол или 2,5,7,8-тетраметил-(2R-(4R,8R,12-триметилтридецил)хроман-6-илокси)уксусная кислота. Кроме того, противораковыми соединениями, основанными на витамине Е, могут быть токотриенол, такой как α-токотриенол, β-токотриенол, γ-токотриенол, δ-токотриенол, или фракция, обогащенная токотриенолом, или синтетическое соединение, основанное на витамине Е, такое как dl-α-токоферол, ацетат dl-α-токоферола, никотинат dl-α-токоферола или фосфат dl-α-токоферола.
В данном варианте осуществления изобретения везикула, как средство доставки, может представлять собой липосому, содержащую липид, наночастицу, микросферу или ниосому. Характерным примером подходящего липида в липосоме является 1,2-дилауроил-sn-глицеро-3-фосфохолин. Предпочтительным примером является липосома с конечной концентрацией противоракового соединения, основанного на витамине Е, в липосоме, то есть не выше чем 20,0 мг/мл. Основанное на витамине Е соединение/везикула для доставки может быть доставлено посредством аэрозольного распыления, аэрозольного ингалятора, желудочного зонда, перорального приема внутрь, перорально с помощью мягкой гелевой капсулы, чрескожного пластыря, подкожной инъекции, внутривенной инъекции, внутримышечной инъекции или внутрибрюшинной инъекции. Предпочтительным средством доставки является липосомальный аэрозоль, доставляемый посредством струйного распылителя.
В аспекте данного варианта осуществления изобретения способ также может заключать в себе стадию введения второй композиции противоракового средства, содержащегося в доставляемой везикуле. Вторая композиция может быть введена в комбинации с основанным на витамине Е соединением/доставляемой везикулярной композицией или последовательно за последней. Когда композиции вводят совместно, основанное на витамине Е соединение и противораковое лекарственное средство могут находиться в одной и той же доставочной везикуле. Характерными примерами противораковых лекарственных средств являются 9-нитрокамптотецин, цисплатен, паклитаксел, доксирубицин или целекоксиб.
Противораковые соединения, основанные на витамине Е, согласно настоящему изобретению оказывают антипролиферативное действие, выражающееся в апоптозе, ингибировании синтеза ДНК, ингибировании клеточного цикла или клеточной дифференцировки. В данном варианте осуществления изобретения количественный и/или качественный анализ антипролиферативного действия может быть осуществлен путем обнаружения биомаркера. Предпочтительным примером биомаркера является маркер KI-67 клеточной пролиферации. В качестве альтернативы может быть применен иммуногистохимический анализ.
Доставка соединений, основанных на витамине Е, или других противораковых соединений согласно настоящему изобретению может быть применена для лечения неопластических заболеваний и отличных от неопластических заболеваний. Характерными примерами неопластических заболеваний являются рак яичника, рак шейки матки, рак эндометрия, рак мочевого пузыря, рак легкого, рак молочной железы, рак простаты, рак яичка, глиома, фибросаркома, ретинобластома, меланома, саркома мягкой ткани, остеосаркома, рак ободочной кишки, карцинома почки, рак поджелудочной железы, базально-клеточная карцинома и плоскоклеточная карцинома. Характерными примерами заболеваний, отличных от неопластических заболеваний, являются заболевания, выбранные из группы, состоящей из псориаза, доброкачественных пролиферативных кожных заболеваний, ихтиоза, папилломы, повторного стеноза, склеродермии и гемангиомы и лейкоплакии.
Способы согласно настоящему изобретению могут быть применены для лечения заболеваний, отличных от неопластических заболеваний, которые развиваются вследствие неспособности выбранных клеток подвергаться нормальной запрограммированной клеточной гибели или апоптозу. Характерными примерами заболеваний и расстройств, которые имеют место вследствие неспособности клеток к гибели, являются аутоиммунные заболевания. Аутоиммунные заболевания отличаются деструкцией самих клеток иммунной системы, тканей и органов. Характерная группа аутоиммунных заболеваний включает в себя аутоиммунный тиреоидит, рассеянный склероз, тяжелую псевдопаралитическую миастению, системную красную волчанку, герпетиформный дерматит, глютеновую болезнь и ревматоидный артрит. Настоящее изобретение не ограничивается аутоиммунными заболеваниями, но включает в себя все расстройства с иммунным компонентом, таким как воспалительный процесс, участвующий в образовании бляшек в сердечно-сосудистой системе, или кожное поражение, вызванное ультрафиолетовым облучением.
Способы согласно настоящему изобретению могут быть применены для лечения расстройств и заболеваний, которые развиваются вследствие вирусных инфекций. Характерными примерами заболеваний и расстройств, которые происходят вследствие вирусных инфекций, являются болезни, обусловленные вирусом иммунодефицита человека (HIV). Поскольку соединения, основанные на витамине Е, действуют на внутреклеточных апоптических сетях передачи сигнала, доставочная везикула, такая как липосомальный аэрозоль, содержащий противораковые соединения, основанные на витамине Е, согласно настоящему изобретению, обладает способностью воздействовать на передачу сигнала любого типа внешнего клеточного сигнала, такого как цитокины, вирусы, бактерии, токсины, тяжелые металлы и т.д.
В другом варианте осуществления настоящего изобретения разработана везикула для доставки противоракового соединения, основанного на витамине Е, содержащегося в везикуле. В аспекте данного варианта осуществления изобретения везикула также может содержать противораковое лекарственное средство. В предпочтительном аспекте доставочная везикула представляет собой липосому, в которой отношение противоракового соединения, основанного на витамине Е, к липиду составляет приблизительно 1:3 (мас.:мас). Противораковые соединения, основанные на витамине Е, противораковые лекарственные средства, типы везикул и способы доставки могут быть такими, как описано выше.
Следующие определения даны с целью облегчения понимания изобретений, описанных в данном тексте. Любые термины, которые не четко определены, должны интерпретироваться соответственно значению термина в данной области.
Употребляемые в данном тексте термины "аэрозоль", "желудочный зонд", "липосома", "везикула для доставки" и "везикула" будут включать в себя различные химические композиции для приготовления препаратов везикула/липосома и различные методологии в отношении рассеивания аэрозоля или пероральной доставки указанных препаратов.
Употребляемый в данном тексте термин "индивидуум" будет относиться к животным и человеку.
Употребляемый в данном тексте термин "биологически ингибирующий" или "ингибирование" роста сингенных опухолевых трансплантатов будет включать в себя частичное или полное ингибирование роста и также подразумевает включение уменьшения скорости пролиферации или роста опухолевых клеток. Доза композиции согласно настоящему изобретению, оказывающая биологический ингибирующий эффект, может быть определена путем оценки действия тестируемого элемента на рост целевых злокачественных клеток или клеток с нарушенной пролиферацией в тканевой культуре, рост опухоли у животных и клеточной культуре или любым другим способом, известным квалифицированным специалистам в данной области.
Употребляемый в тексте термин "ингибирование метастазов" будет включать в себя частичное или полное ингибирование миграции опухолевых клеток от первичного участка к другим органам, особенно к легким, как описано выше. Доза композиции согласно настоящему изобретению, оказывающая биологический ингибирующий метастазы эффект, может быть определена путем оценки действия тестируемого элемента на рост целевых злокачественных клеток или клеток с нарушенной пролиферацией в тканевой культуре, рост опухоли у животных и клеточной культуре или любым другим способом, известным квалифицированным специалистам в данной области.
Употребляемый в тексте термин "ингибирование ангиогенеза" будет включать в себя частичное или полное ингибирование образования кровеносных сосудов в опухоли или снижение пропускной способности кровеносных сосудов, снабжающих кровью опухоли.
Употребляемый в тексте термин "индукция программированной гибели клеток или апоптоз" будет включать в себя частичную или полную гибель клеток в отношении тех клеток, которые обладают характерными для апоптоза морфологическими и биохимическими свойствами. Доза композиции согласно настоящему изобретению, которая вызывает апоптоз, может быть определена путем оценки действия тестируемого элемента на рост целевых злокачественных клеток или клеток с нарушенной пролиферацией в тканевой культуре, рост опухоли у животных и клеточной культуре или любым другим способом, известным квалифицированным специалистам в данной области.
Употребляемый в тексте термин "индукция подавления синтеза ДНК" будет включать в себя подавление роста благодаря обработке клеток, блокированных в фазах клеточного цикла GO/G1, S или G2/M. Доза композиции согласно настоящему изобретению, которая вызывает угнетение синтеза ДНК, может быть определена путем оценки действия тестируемого элемента на рост целевых злокачественных клеток или клеток с нарушенной пролиферацией в тканевой культуре, рост опухоли у животных и клеточной культуре или любым другим способом, известным квалифицированным специалистам в данной области.
Употребляемый в тексте термин "индукция клеточной дифференцировки" будет включать в себя угнетение роста клеток вследствие обработки клеток, претерпевающих клеточную дифференцировку согласно установленным морфологическим и биохимическим характеристикам дифференцировки, стадии, на которой пролиферации клеток не происходит. Доза композиции согласно настоящему изобретению, которая вызывает клеточную дифференцировку, может быть определена путем оценки действия тестируемого элемента на рост целевых злокачественных клеток или клеток с нарушенной пролиферацией в тканевой культуре, рост опухоли у животных и клеточной культуре или любым другим способом, известным квалифицированным специалистам в данной области.
Употребляемый в тексте термин "α-ТЕА" будет включать в себя аналог RRR-α-токоферола со связанной эфирной связью уксусной кислотой, который представляет собой негидролизуемый эфирный аналог RRR-α-токоферола, т.е. 2,5,7,8-тетраметил-2R-(4R,8R-12-триметилтридецил)хроман-6-илоксиуксусная кислота, которая может быть сокращенно написана как RRR-α-токоферилоксиуксусная кислота.
Изобретение представляет разработанный способ лечения заболеваний, связанных с пролиферацией клеток, посредством аэрозольной доставки липосомальной композиции или посредством доставки через желудочный зонд липосомальной композиции, содержащей природное или синтетическое противораковое лекарственное средство, основанное на витамине Е, и липид. Соединения согласно настоящему изобретению, основанные на витамине Е, проявляют антипролиферативное действие; характерными примерами таких антипролиферативных эффектов являются апоптоз, угнетение синтеза ДНК, подавление клеточного цикла или клеточной дифференцировки. Указанные соединения проявляют антиметастатический эффект и не проявляют токсичность по отношению к нормальным клеткам и тканям in vivo при введении клинически подходящим способом, таким как аэрозольная доставка или через желудочный зонд.
Возможно, противораковое лекарственное с