Композиции трамадола пролонгированного высвобождения с 24-часовым действием
Иллюстрации
Показать всеНастоящее изобретение относится к области лекарственных средств, в частности к твердой дозированной композиции для лечения боли, содержащей: ядро, включающее активный фармацевтический ингредиент и матрицу, и покрытие, включающее физическую смесь поливинилацетата, поливинилпирролидона и активного фармацевтического ингредиента, где активный фармацевтический ингредиент и матрица ядра связаны таким образом, что высвобождение фармацевтического ингредиента из матрицы ядра является контролируемым, при этом высвобождение из композиции активного ингредиента, находящегося в ядре, происходит медленнее, чем высвобождение активного фармацевтического ингредиента, находящегося в матрице оболочки; причем активный фармацевтический ингредиент ядра и оболочки является тем же самым и представляет собой трамадол или его стереоизомер или фармацевтически приемлемую соль. Изобретение также относится к таблетке, включающей указанную композицию. Композиция по изобретению при первоначальном введении одной дозы обеспечивает обезболивающий эффект не позднее чем через 2 часа, обезболивающий эффект которой продолжается в течение по меньшей мере 24 часов после введения. 2 н. и 12 з.п. ф-лы, 7 ил., 9 табл.
Реферат
Область изобретения
Данное изобретение относится к новой одноразового ежедневного приема фармацевтической композиции для контролируемого высвобождения трамадола или его соли.
Предшествующий уровень техники
Фармацевтические композиции трамадола
Гидрохлорид трамадола (HCl) был разработан Grunental GmbH, Германия. Он продавался в Германии с 1977 (например, Tramal™), в Соединенных Штатах как Ultram® с 1995. Эффективность и профиль безопасности трамадола HCl делает его очень подходящим для пролонгированного лечения хронической боли.
Трамадол HCl является синтетическим аналгезирующим средством центрального действия, эффективность которого была показана при разнообразных состояниях острой и хронической боли. Было показано, в частности, что трамадол HCl как в композициях немедленного, так и медленного высвобождения в сочетании с нестероидными противовоспалительными лекарственными средствами (НПВС) (Roth SH. "Efficacy and safety of tramadol HCl in breakthrough musculoskeletal pain attributed to osteoarthritis". J. Rheumatol 1998; 25:1358-1363. Wilder-Smith CH et al. "Treatment of severe pain from osteoarthritis with slow-release tramadol or dihydrocodeine in combination with NSAID's: a randomized study comparing analgesia, antinociception and gastrointestinal effects". Pain 2001; 91:23-31.), уменьшает боль, связанную с остеоартритом (ОА). После перорального введения трамадол HCl быстро и почти полностью абсорбируется и тщательно метаболизируется. Главными метаболическими путями являются N- и O-деметилирование и глюкуронидирование или сульфонирование в печени. Только один метаболит, моно-O-десметилтрамадол (M1), представляется фармакологически активным, обладающим приблизительно в 200 раз высшей аффинностью в отношении μ-опиоидного рецептора, чем рацемический трамадол (DeJong R. "Comment on the hypoalgesic effect of tramadol in relation to CYP2D6" (comment) Pain Dig 1997; 7:245; Kogel В. et al "Involvement of metabolites in the analgesic action of tramadol" Proc. 9th World Congress on Pain, Vienna, 1999). У здоровых людей трамадол деметилируется полиморфным энзимом цитохромом Р450 2D6 (CYP2D6) до M1-метаболита.
Механизм действия трамадола HCl не понят до конца. На животных моделях показано, что лекарственное средство (и его активный M1-метаболит) действует как опиоидный агонист, вероятно, путем селективной активности в отношении μ-рецептора. В дополнение к активности опиоидного агониста трамадол HCl ингибирует обратный захват некоторых моноаминов (норэпинефрин, серотонин), которые, оказывается, способствуют аналгезирующему эффекту лекарственного средства. Антиноцицептивный эффект трамадола HCl лишь частично антагонизируется налоксоном в некоторых тестах у животных и людей. Кроме того, вследствие опиоидной агонистической активности этого лекарственного средства предполагалось, что трамадол HCl может вызывать зависимость; однако потенциал его злоупотребления оказывается низким, и трамадол HCl не "подлежит контролю" согласно Федеральному Акту Соединенных Штатов по Контролю Веществ 1970 как включенное в список лекарственное средство.
Композиции трамадола HCl немедленного высвобождения хорошо известны в данной области. Такие композиции, однако, требуют частого дозирования, чтобы обеспечить эффективное облегчение боли. Недостаток соответствия режимам высокой частоты дозирования может быть результатом несоответствующих концентраций лекарственного препарата в плазме и, следовательно, менее стойкого обезболивания. Композиции ежедневного двухразового приема являются более полезными и желательными по сравнению с композициями с немедленным высвобождением, так как они обеспечивают более длительные периоды обезболивания после введения и требуют менее частого дозирования. Композиции ежедневного одноразового приема являются еще более желательными для повышенной эффективности, безопасности и удобства.
Решающим фактором, влияющим на скорость абсорбции, и, следовательно, безопасность и эффективность активного лекарственного ингредиента после перорального введения в организм в таблетированной или другой твердой лекарственной форме является скорость высвобождения активного лекарственного ингредиента из лекарственной формы после приема внутрь.
Таким образом, способность ингредиентов лекарственной формы контролировать скорость высвобождения, которая составляет основу для так называемого контролируемого высвобождения, продолжительного высвобождения, замедленного высвобождения или для лекарственных препаратов пролонгированного действия, которые разработаны для создания медленного, равномерного высвобождения и абсорбции активных лекарственных ингредиентов в течение периода, составляющего часы, дни, недели или месяцы. Преимущества таких композиций с контролируемым высвобождением включают в себя уменьшение требуемой частоты введения лекарственного средства по сравнению с общепринятыми лекарственными формами с немедленным высвобождением, часто приводящее к улучшению соблюдения больным режима и схемы лечения; поддержание стабильной концентрации лекарственного средства в организме, а следовательно, непрерывный терапевтический эффект в течение установленного времени; и уменьшение возникновения и выраженности нежелательных побочных эффектов активного средства, вызванных высокими концентрациями в плазме, которые встречаются после введения лекарственных форм с непрерывным высвобождением.
Были предложены и разработаны многие вещества в качестве матрицы для контролируемого высвобождения активных лекарственных ингредиентов. К таким веществам относятся, например, полимерные материалы, такие как поливинилхлорид, амиды полиэтилена, этилцеллюлоза, силикон и поли (гидроксиметилметакрилат). См., например. Патент США №3087860 Endicott et al.; Патент США №2987445 Lavesque et al.; Salomon et al. Pharm. Acta Helv., 55, 174-182 (1980); Korsmeyer, Diffusion Controlled Systems: Hydrogeis, Chap.2, pp 15-37 в Polymers for Controlled Drug Delivery, Ed Tarcha, CRC Press, Boca Raton, Fla. USA (1991); и Buri et al., Pharm. Acta Helv. 55, 189-197 (1980).
Для целей контролируемого высвобождения применяется также высокоамилозный крахмал, в частности последние достижения были сделаны с применением сшитого высокоамилозного крахмала. Например, в Патенте США №6284273 (Lenaerts et al.), выданном 4 сентября 2001, и №6419957 (Lenaerts et al.), выданном 16 июля 2002, описана твердая пероральная лекарственная форма с контролируемым высвобождением в виде таблеток, содержащих сухой порошок фармацевтического продукта и сухой порошок поперечно связанного высокоамилозного крахмала, где указанный поперечно связанный высокоамилозный крахмал представляет собой матрицу, содержащую смесь примерно из 10-60 мас.% амилопектина и примерно 40-90% амилозы. В Патенте США №6607748 (Lenaerts et al.), выданном 19 августа 2003, описан способ приготовления сшитого высокоамилозного крахмала, который известен под названием Contramid®.
Композиции с продолжительным высвобождением, известные в данной области
Были предложены композиции с продолжительным и контролируемым высвобождением, относящиеся к трамадолу HCl, и примеры таких композиций описаны в публикации Заявки на Патент США №2003/0143270, (Deboeck et al.), опубликованной 31 июля 2003; Патенте США №6254887 (Miller et al.), выданном 3 июля 2001; публикации Заявки на Патент США №2001/0036477 (Miller et al.), опубликованной 1 ноября 2001; Патенте США №6326027 (Miller et al.), выданном 4 декабря 2001; и Патенте США №5591452 (Miller et al.), выданном 7 января 1997; и Европейском Патенте №1190712 (Vanderbist), опубликованном 27 марта 2002.
Несмотря на то что на рынке существует несколько композиций трамадола HCl с контролируемым высвобождением, под которыми подразумеваются ежедневные одноразовые композиции, ни одна из них успешно не заменила ежедневные двухразовые композиции трамадола HCl.
Опубликованы статьи, в которых представленны сравнительные данные между предлагаемыми "ежедневными одноразовыми" композициями трамадола HCl и трамадола HCl с немедленным высвобождением: Alder et al., "A Comparison of Once-Daily Tramadol with Normal Release Tramadol in the Treatment of Pain in Osteoarthritis, "The Journal of Rheumatology (2002) 29(10):2195-2199; и Bodalia et al., "A Comparison of the Pharmacokinetics, Clinical Efficacy, and Tolerability of Once-Daily Tramadol Tablets with Normal Release Tramadol Capsules", Journal of Pain and Symptom Management (2003) 25(2):142-149.
Побочные эффекты от введения трамадола HCl
К наиболее частым описанным побочным эффектам трамадола, наблюдаемым при клинических испытаниях в Соединенных Штатах, относятся запор, тошнота, головокружение/вертиго, головная боль, сонливость и рвота. Такие явления представляют собой типичные побочные эффекты наркотических лекарственных средств. Эпилептические припадки и анафилактические реакции также были сообщены, хотя оцененная случаемость эпилептических припадков у пациентов, получающих трамадол HCl, составляет менее чем 1% (Kazmierczak, R., and Coley, K.: Doctor letters on prescribing: evaluation of the use of tramadol HCl." Formulary 32:977-978, 1997).
Adler et al., выше, сообщают о результатах клинического исследования по сравнению однократной суточной композицией трамадола с трамадолом с немедленным высвобождением при лечении боли при остеоартрите. Авторы сообщают о схожих профилях побочных явлений у индивидов в обеих группах лечения. Таблица 2 у Adler et al. указывает, что больший процент людей, которые были в группе однократного суточного лечения, выбыл из-за побочных эффектов по сравнению с теми, которые выбыли из второй группы лечения.
У Bodalia et al., выше сообщается о сравнительной толерантности при ежедневной однократной дозе в 150 мг, ежедневной однократной дозе в 200 мг и при трех дозах по 50 мг композиции трамадола с нормальным высвобождением. Данная статья, однако, не содержит какой-либо информации о том, как сделать композиции, которые подразумеваются как "однократные суточные", не раскрывает никаких фармакокинетических данных после однократной дозы
Цитирование или ссылка на любую ссылку в данном разделе не должно истолковываться как допущение, что такая ссылка доступна в качестве предшествующего уровня техники по отношению к настоящему изобретению.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Объект настоящего изобретения должен предоставить улучшенную композицию трамадола с пролонгированным высвобождением с 24-часовым эффективным обезболиванием.
В соответствии с одним объектом настоящего изобретения предоставляется однократная суточная пероральная фармацевтическая композиция для трамадола с контролируемым высвобождением или его соли, в котором композиция при первоначальном введении обеспечивает начало обезболивающего эффекта в течение 2 часов, обезболивающий эффект которого продолжается по меньшей мере в течение 24 часов после введения.
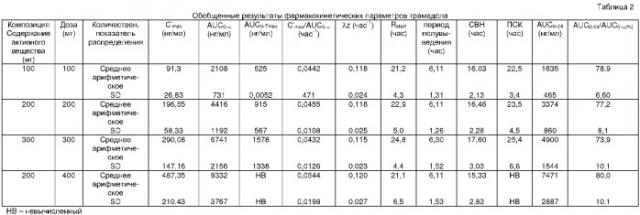
В соответствии с другим объектом настоящего изобретения предоставляется однократная суточная пероральная фармацевтическая композиция для трамадола с контролируемым высвобождением или его соли, в котором композиция при первоначальном введении одной дозы обеспечивает среднюю концентрацию в плазме по меньшей мере 100 нг/мл не позднее чем через 2 часа после введения и продолжает обеспечивать среднюю концентрацию в плазме по меньшей мере 100 нг/мл по меньшей мере в течение 22 часов после введения.
В одном из вариантов осуществления настоящего изобретения предоставляется однократная суточная пероральная фармацевтическая композиция для трамадола с контролируемым высвобождением или его соли, когда композиция при первоначальном введении одной дозы обеспечивает среднюю концентрацию в плазме по меньшей мере 100 нг/мл не позднее чем через 2 часа введения и продолжает обеспечивать среднюю концентрацию в плазме по меньшей мере 100 нг/мл по меньшей мере в течение 22 часов после введения, и где средняя максимальная концентрация в плазме (Сmax) меньше взятой 2,2 раза средней концентрации в плазме, полученной через 24 часа после введения (С24ч).
Обозначение "λz" соответствует вероятной константе заключительной скорости элиминации, определяемой наклоном линии регрессии в течение логарифмической фазы.
Обозначение "AUC0-max" соответствует средней площади под кривой зависимости концентрации от времени в плазме, от времени 0 до Tmax,и используется в качестве индикатора скорости абсорбции лекарственного средства, или образования метаболита. Она рассчитывается как среднее арифметическое площади под кривой зависимости концентрации от времени в плазме, от времени 0 до Tmax, рассчитанное для каждого индивида, участвующего в опытах по изучению биодоступности.
Обозначение "AUC0-∞" соответствует средней площади под кривой зависимости концентрации от времени в плазме, экстраполированной к бесконечности. Она рассчитывается как среднее арифметическое площади под кривой зависимости концентрации от времени в плазме от времени 0, экстраполированного к бесконечности, рассчитанное для каждого индивида, участвующего в опытах по изучению биодоступности.
Термин "обезболивающий эффект" определяется для целей настоящего изобретения как обеспечивающий среднюю концентрацию в плазме крови, составляющую по меньшей мере примерно 100 нг/мл трамадола.
Обозначение "С'max" означает максимум наблюдаемой концентрации в плазме, рассчитанный как среднее значение индивидуальных максимальных концентраций в плазме крови.
Выражение "контролируемое высвобождение" определяется для целей настоящего изобретения как способ доставки перорального лекарственного средства, где скорость высвобождения активного фармацевтического ингредиента из композиции зависит не только от концентрации активного фармацевтического ингредиента, остающегося в композиции, и/или растворимости активного фармацевтического ингредиента в среде, окружающей композицию, и где промежуток времени и/или локализация высвобождения активного ингредиента из фармацевтической композиции выбирается для достижения терапевтического эффекта или для целей удобства, не предлагаемых общепринятыми лекарственными формами.
Термин "период полувыведения" означает кажущийся период окончательного полувыведения.
Термин "ПСК" означает продолжительность поддержания среднего уровня, то есть время, в течение которого концентрация трамадола выше половины С'max. Данный показатель представляет собой индикатор формы кривой зависимости концентрации от времени в плазме.
Термин "немедленное высвобождение" определяется для целей настоящего изобретения как высвобождение активного ингредиента из фармацевтической композиции, когда скорость высвобождения активного фармацевтического ингредиента из фармацевтической композиции не тормозится матрицей контролируемого высвобождения и где ингредиенты фармацевтической композиции разработаны так, что при приеме внутрь максимальное воздействие указанного активного фармацевтического ингредиента на организм происходит за минимальный период.
Термин "первоначальное введение" определяется для целей настоящего изобретения как первая однократная доза композиции, содержащая активный ингредиент, вводимый пациенту или объекту, или первая доза, вводимая пациенту или объекту после соответствующего периода выведения.
Термин "СВН" означает среднее время нахождения в организме, которое соответствует средней величине времени нахождения молекулы трамадола в организме после перорального введения.
Термин "средняя максимальная концентрация в плазме" (Сmax) определяется для целей настоящего изобретения как максимальная средняя концентрация в плазме.
Термин "средняя концентрация в плазме" определяется для целей настоящего изобретения как среднее арифметическое концентрации в плазме крови.
Обозначение "tmax" соответствует промежутку времени, через которое достигается Сmax.
Обозначение "tmax" соответствует промежутку времени, через которое достигается максимальная концентрация в плазме крови у каждого из индивидов, участвующих в опытах по изучению биодоступности.
Термин "Rstart" означает время, при котором концентрация в плазме начинает снижаться по логарифмическому закону, т.е. время, при котором либо завершается абсорбция лекарственного средства, либо завершается образование его метаболита.
Слово "трамадол" так, как применяется здесь, относится к трамадолу, его стереоизомерам и его фармацевтически приемлемым солям.
Термин "стабильное состояние" определяется для целей настоящего изобретения как состояние, следующее за введением многократной дозы, когда скорость элиминации лекарственного препарата соответствует скорости ввода, и концентрации лекарственных препаратов в плазме в данный момент в пределах интервала дозирования являются приблизительно одними и теми же, от одного интервала дозирования до другого.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Разные признаки и преимущества настоящего изобретения станут ясны при более детальном описании, приведенном ниже с ссылкой на сопровождающие чертежи:
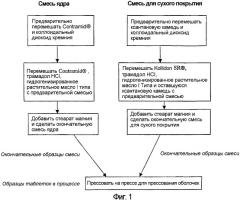
Фигура 1: Схематическое представление процесса производства таблеток.
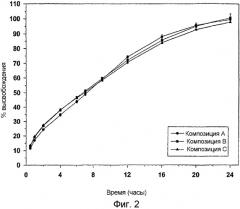
Фигура 2: Профили растворения композиций А, В и С: In vitro реализация композиций А, В и С: в условиях USP Типа 1; натрий-фосфатный буфер, 50 мМ, рН 6,8, 100 об/мин было тестировано 6 таблеток на единицу времени.
Фигура 3: Средние концентрации трамадола в плазме после введения однократной дозы (i) дозы 100 мг композиции с контролируемым высвобождением согласно изобретению (●), (ii) дозы 200 мг композиции с контролируемым высвобождением согласно изобретению (▪), и (iii) мг дозы композиции с контролируемым высвобождением 300 согласно изобретению (▴).
Фигура 4: Средние концентрации О-десметилтрамадола в плазме после введения однократной дозы, содержащей либо 100 мг (), либо 200 мг (О), либо 300 мг (Δ) активного вещества композиции трамадола (А, В и С соответственно).
Фигура 5: Средние концентрации трамадола в плазме после введения однократной дозы (i) 2×200 мг композиции с контролируемым высвобождением согласно изобретению (▴); и (ii) Topalgic® LP 200 мг BID q12h (Δ).
Фигура 6: Средние концентрации O-десметилтрамадола в плазме после введения однократной дозы (i) 2×200 мг композиции с контролируемым высвобождением согласно изобретению (▴); и (ii) Topalgic® LP 200 мг BID q12h (Δ).
Фигура 7: Средняя стабильная концентрация трамадола и O-десметилтрамадола в плазме после введения (i) 200 мг дозы композиции с контролируемым высвобождением согласно изобретению (●&○); и (ii) Topalgic® LP 100 мг BID q12h (▴&Δ).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ЯДРО
Ядро таблетки согласно изобретению включает в себя по меньшей мере один активный ингредиент и матрицу, данные ингредиенты связаны таким образом, что высвобождение фармацевтического ингредиента из матрицы является контролируемым. В особом варианте осуществления матрица ядра представляет собой поперечно сшитый высокоамилозный крахмал, известный под названием Contramid® и описанный совсем недавно в Патенте США №6607748 (Lenaerts et al.), выданном 19 августа 2003. Предпочтительная композиция в контексте данного изобретения представлена в описании Патента США №6607748.
Предпочтительно ядро образовано путем перемешивания ингредиентов (в форме гранул или порошка) и затем прессования смеси для образования ядра, поверх которого последовательно формируется оболочка. Вес ядра может составлять любой процент веса всей композиции между 10% и 80%. Предпочтительный процент зависит помимо всего прочего от общей дозировки фармацевтического средства. В специальном варианте осуществления, описанном далее, таблетка содержит 100 мг трамадола гидрохлорида и ядро, составляющее примерно 26% от общего веса таблетки. В другом варианте осуществления таблетка содержит 200 мг трамадола гидрохлорида и ядро составляет примерно до 33% от общего веса таблетки. В другом варианте осуществления таблетка содержит 300 мг трамадола гидрохлорида и ядро составляет 33% от общего веса таблетки.
Активное средство в ядре
В ядре композиции согласно изобретению присутствует активный фармацевтический ингредиент. Подходящий фармацевтический ингредиент согласно изобретению представляет собой любой такой ингредиент, который желательно должен быть доставлен в лекарственной форме с пролонгированным высвобождением. Подробный перечень подходящих фармацевтических средств можно найти в The Merck Index, 12th Ed. Предпочтительно фармацевтический ингредиент является, без ограничения, гидразидом изоникотоновой кислоты, салицилатом натрия, гидрохлоридом псевдоэфедрина, сульфатом псевдоэфедрина, ацетаминофеном или диклофенаком натрия, верапамилом, глипизидом, нифедипином, фелодипином, бетагистином, альбутеролом, акривастином, омепразолом, мизопростолом, трамадолом®, оксибутинином, тримебутином, ципрофлоксацином и их солями. В дополнение, фармацевтическое средство может быть противогрибковым средством, как, например, кетоконазол, или обезболивающим средством, как, например, ацетилсалициловая кислота, ацетаминофен, парацетамол, ибупрофен, кетопрофен, индометацин, дифлюнисал, напроксен, кеторолак, диклофенак, толметин, сулиндак, фенацетин, пироксикам, мефенамовая кислота, декстрометорфан, другие нестероидные противовоспалительные лекарственные средства, включая салицилаты, их фармацевтически приемлемые соли или их смеси. Пролекарства являются частью настоящего изобретения.
Растворимость лекарственного средства в водном растворе может иметь самые разнообразные значения. Водорастворимость лекарственного средства может составлять менее чем 10-3 г/л, более чем 10-3 г/л, более чем 10-2 г/л, более чем 10-1 г/л, более чем 1 г/л, более чем 10 г/л, более чем 100 г/л, более чем 500 г/л, более чем 1000 г/л или более чем 2000 г/л. Предпочтительно растворимость составляет более чем 100 г/л. Более предпочтительно, чтобы растворимость составляла более 500 г/л. Наиболее предпочтительно, когда растворимость составляет более 1000 г/л.
Лекарственное средство может удовлетворять разнообразные требования к дозировке. Например, требуемая дозировка лекарственного средства может составлять менее 1 мг/единицу дозировки, более чем 1 мг/единицу дозировки, более 10 мг/единицу дозировки, более 100 мг/единицу дозировки, более 200 мг/единицу дозировки, более 300 мг/единицу дозировки, более 400 мг/единицу дозировки, более 500 мг/единицу дозировки или более 1000 мг/единицу дозировки. Предпочтительно, если лекарственное средство составляет более 50 мг/единицу дозировки. Более предпочтительно, когда лекарственное средство составляет более 100 мг/единицу дозировки или, например, более 150 мг/единицу дозировки или 200 мг/единицу дозировки, или 250 мг/единицу дозировки, или 300 мг/единицу дозировки или более.
В особых вариантах осуществления ядро содержит трамадолгидрохлорид, причем ядро содержит примерно между 10% и 90% всего трамадола, присутствующего в таблетке, например примерно 45 мг 100 мг содержания активного вещества таблетки (45% всей таблетки) или примерно 90 из 200 мг содержания активного вещества таблетки (45% всей таблетки) или примерно 151 мг из 300 мг содержания активного вещества таблетки (50% всей таблетки).
Матрица ядра
Высвобождение из композиции активного фармацевтического ингредиента, находящегося в ядре, происходит медленнее, чем высвобождение активного фармацевтического ингредиента, находящегося в матрице оболочки. Предпочтительная матрица ядра представляет собой поперечно сшитый высокоамилозный крахмал, известный под названием Contramid® и описанный а патенте США №6607748. В специальных вариантах осуществления матрица составляет примерно между 10% и примерно 90% по весу ядра, то есть отношение матрицы ядра к активному ингредиенту ядра (мас./мас.) составляет примерно между 0,1 и примерно 10 или примерно между 0,2 и примерно 9, или примерно между 0,2 и примерно 8, или примерно между 0,3 и примерно 7, или примерно между 0,4 и примерно 6, или примерно между 0,5 и примерно 5, или примерно между 0,6 и примерно 4, или примерно между 1 и примерно 4, или примерно между 1 и примерно 3, и примерно 1,5 и примерно 2,5. В одном особом варианте осуществления ядро составляет примерно 90 мг, из которых 44 мг представлено Contramid® и 45 мг представлено трамадолгидрохлоридом. В данном случае Contramid®, таким образом, составляет примерно 49 весовых процента ядра.
Необязательные компоненты
Ядро композиции согласно изобретению может, по желанию, включать в себя фармацевтически приемлемый носитель или растворитель. Такие носители или растворители известны специалистам в данной области, и можно найти, например, в Remington's Pharmaceutical Sciences, 14th Ed. (1970). Примеры таких носителей или растворителей включают в себя лактозу, крахмал, дикальцийфосфат, сульфат кальция, каолин, маннит и сахарную пудру. Дополнительно, при необходимости, могут быть включены подходящие связующие вещества, смягчающие средства и расщепляющие средства. По желанию, могут быть включены также красители, а также подсластители или вкусовые добавки.
Ядро композиции согласно изобретению может, по желанию, включать в себя дополнительные ингредиенты, включая, без ограничения, диспергирующие средства, такие как микрокристаллическая целлюлоза, крахмал, поперечно сшитый крахмал, поперечно сшитый поливинилпирролидон и карбоксиметилцеллюлоза натрия; вкусовые средства; красящие средства; связующие средства; консерванты; поверхностно-активные средства и пр.
Ядро может, по желанию, также включать в себя одно или более связующих веществ, известных рядовому специалисту в данной области.
Подходящие формы микрокристаллической целлюлозы, например, МКЦ-Ф101; МКЦ-102; МКЦ-105 и пр.
Подходящие смягчающие вещества, такие, например, как те, которые известны специалистам, могут быть также включены. Например, стеарат магния, растительное масло, тальк, стеарилфумарат натрия, стеарат кальция, стеариновая кислота и так далее.
Подходящие скользящие вещества, известные в данной области, могут быть также включены. Примеры таких скользящих веществ включают в себя, без ограничения, тальк, коллоидный диоксид кремния и так далее.
Количественное соотношение
Активное средство присутствует в количествах, колеблющихся примерно от 1 примерно до 90 мас.% общего веса ядра, предпочтительно примерно от 10 примерно до 70 мас.% от общей композиции ядра, более предпочтительно - примерно от 20 примерно до 60 мас.% от общей композиции ядра и, вероятно, наиболее часто - примерно от 30 примерно до 50 мас.% общей композиции ядра.
Конечно, общее количество всех ингредиентов составляет 100 мас.%, и рядовые специалисты в данной области, могут изменять количества в пределах установленных диапазонов для достижения полезных композиций.
Покрытие (оболочка)
Покрытие лекарственной формы включает в себя физическую смесь поливинилацетата и поливинилпирролидона и активного фармацевтического ингредиента(ов) оболочки. Оболочка может также включать в себя поперечно сшитый высокоамилозный крахмал, например Contramid® и другие возможные ингредиенты. В предпочтительном варианте осуществления оболочка формируется путем сухого прессования. Вес оболочки может составлять любой процент веса общей композиции, примерно между 10% и 90%, но предпочтительно в более высокой части данного диапазона. Оболочка, таким образом, обычно составляет примерно между 20% и 90% (мас./мас.) таблетки согласно изобретению или примерно 25% и примерно 90% или примерно 30% и примерно 85%, или примерно 35% и примерно 85%, или примерно 40% и примерно 85%, или примерно 45% и примерно 85%, или примерно 25% и примерно 90%, или примерно 45% и примерно 90%, или примерно 50% и примерно 90%, или примерно 50% и примерно 85%, или примерно 55% и примерно 90%, или примерно 55% и примерно 85%, или примерно 55% и примерно 80%, или примерно 60% и примерно 90%, или примерно 60% и примерно 85%, или примерно 60% и примерно 80%, или примерно 60% и примерно 75%, или примерно 65% и примерно 90%, или примерно 65% и примерно 85%, или примерно 65% и примерно 80%, или примерно 65% и примерно 75%, или примерно 65% и примерно 70% или примерно 75%.
Оболочка часто включает в себя необязательное связующее средство.
Поливинилацетат и поливинилпирролидон покрытия (оболочки)
Процентный вес смеси поливинилацетат/поливинилпирролидона в оболочке может быть заключен в широком диапазоне значений. В зависимости от растворимости в воде активного ингредиента в оболочке, количество смеси поливинилацетат/поливинилпирролидона в оболочке может быть подобрано. В публикации Патента США №2001/0038852 описаны пути подбора. Например, для активных ингредиентов, которые в высшей степени растворимы в воде, смесь поливинилацетат/поливинилпирролидона может составлять примерно от 20% примерно до 80 мас.% оболочки, предпочтительно примерно от 30 примерно до 65 мас.% или примерно от 40 примерно до 55 мас.%. В особом варианте осуществления, описанном ниже, Kollidon™SR составляет примерно 45% по весу оболочки, которая составляет примерно 31% по весу трамадолгидрохлорида и примерно 23% ксантановой камеди. Для активных ингредиентов, от умеренно растворимых до слабо растворимых в воде, количество смеси поливинилацетат/поливинилпирролидона часто меньше, как описано в публикации Патента США №2001/0038852.
Отношение веса поливинилацетата к поливинилпирролидону в смеси поливинилацетат/поливинилпирролидон может составлять широкий диапазон значений. Предпочтительно такое соотношение составляет примерно между 6:4 и 9:1; более вероятно - примерно между 7:3 и 6:1, еще более предпочтительно - примерно 8:2.
Молекулярный вес поливинилацетатного ингредиента в смеси поливинилацетат/поливинилпирролидон может составлять широкий диапазон значений. Предпочтительно средний молекулярный вес поливинилацетата составляет примерно от 100 примерно до 1000000; или, примерно от 1000 примерно до 1000000; или примерно от 10000 примерно до 1000000; или примерно от 100000 примерно до 100000, или примерно 450000.
Молекулярный вес поливинилпирролидонового ингредиента в смеси поливинилацетат/поливинилпирролидон может составлять широкий диапазон значений. Средний молекулярный вес поливинилпирролидона может составлять примерно от 100 примерно до 10000000; или примерно 1000 примерно до 1000000; или примерно 5000 примерно до 500000; или примерно 10000 примерно до 100000; или примерно 50000.
Смесь поливинилацетата и поливинилпирролидона может быть приготовлена разнообразными способами, включая простое перемешивание порошков поливинилпирролидона и поливинилацетата. В предпочтительном варианте осуществления такая смесь представляет собой высушенный путем распыления порошок коллоидной дисперсии раствора поливинилацетата и поливинилпирролидона. По желанию, применяется лаурилсульфат натрия в качестве стабилизатора для предотвращения аггломерации во время процесса сушки распылением и/или применяется коллоидный кремний для улучшения свойств текучести смеси поливинилацетат/поливинилпирролидон. По желанию, поливинилацетат и поливинилпирролидон могут быть формованы произвольно или в блок-сополимере.
Необязательные компоненты
Подходящие связующие средства согласно изобретению включают в себя, без ограничения, растительные экстракты, смолы, синтетические или натуральные полисахариды, полипептиды, алгинаты, синтетические полимеры или их смесь.
Подходящие растительные экстракты, которые должны использоваться в качестве желатинизирующих средств, включают в себя, без ограничения, агар, ispaghula, подорожник, червец айвовый, огневку или их смесь.
Подходящие смолы, которые должны использоваться в качестве желатинизирующих средств, включают в себя, без ограничения, ксантановую камедь, гуаровую камедь, аравийскую камедь, ghatti камедь, камедь карайи, трагакантовую камедь или их смесь.
Подходящие синтетические или натуральные гидрофильные полисахариды, используемые в качестве желатинизирующих средств, включают в себя, без ограничения, гидроксиалкилцеллюлозу, простые эфиры целлюлозы, сложные эфиры целлюлозы, нитроцеллюлозы, декстрин, агар, каррагенан, пектин, фурцелларан, крахмал или производные крахмала, поперечносшитый высокоамилозный крахмал или их смесь.
Подходящие полипептиды, применяемые в качестве желатинизирующих средств, включают в себя, без ограничения, желатин, коллаген, полижелин или их смесь.
Подходящие альгинаты, применяемые в качестве желатинизирующих средств, включают в себя, без ограничения, альгиновую кислоту, пропиленгликольальгинат, альгинат натрия или их смесь.
Подходящие синтетические полимеры, применяемые в качестве желатинизирующих средств, включают в себя, без ограничения, карбоксивиниловый полимер, поливиниловый спирт, поливинилпирролидон, полиэтиленоксид, полиэтиленгликоли, сополимеры этиленоксида и пропиленоксида и их сополимеры или их смесь.
В предпочтительном варианте осуществления желатинизирующее средство представляет собой камедь, такую как ксантановая камедь, гуаровая камедь, аравийская камедь, ghatti камедь, камедь карайи, трагакантовая камедь или их смесь, РЕО 7000000 и HPMC K100 M.
В наиболее предпочтительном варианте осуществления, желатинизирующее средство представляет собой ксантановую камедь.
Активное средство в покрытии (оболочке)
Подходящий активный фармацевтический ингредиент согласно изобретению представляет собой любое активное средство, которое желательно предоставлено в лекарственной форме с пролонгированным высвобождением. Подробный перечень подходящих фармацевтических средств можно найти в The Merck Index, 12th Ed. Предпочтительно фармацевтический ингредиент представляет собой, без ограничения, гидразид изоникотиновой кислоты, салицилат натрия, гидрохлорид псевдоэфедрина, сульфат псевдоэфедрина, ацетоминофен или диклофенак натрия, верапамил, глипизид, нифедипин, фелодипин, бетагистин, альбутерол, акривастин, омепразол, мизопростол, трамадол®, оксибутинин, тримебутин, ципрофлоксацин и их соли. В дополнение, фармацевтическое средство может быть противогрибковым средством, как например, кетоконазол, или аналгезирующим средством, как например, ацетилсалициловая кислота, ацетаминофен, парацетамол, ибупрофен, кетопрофен, индометацин, дифлюнисал, напроксен, кеторолак, диклофенак, толметин, сулиндак, фенацетин, пироксикам, мефенамовая кислота, декстрометорфан, другие нестероидные противовоспалительные лекарственные средства, включая салицилаты, их фармацевтически приемлемые соли или их смеси.
Растворимость лекарственного средства в водном растворе может иметь значения в широком диапазоне. Водорастворимость фармацевтического средства может быть менее чем 10-3 г/л, более чем 10-3 г/л, более чем 10-2 г/л, более чем 10-1 г/л, более чем 1 г/л, более чем 10 г/л, более чем 100 г/л, более чем 500 г/л, более чем 1000 г/л или более чем 2000 г/л. Предпочтительно растворимость составляет более чем 100 г/л. Более предпочтительно, если растворимость составляет более чем 500 г/л или даже 1000 г/л.
Лекарственное средство может удовлетворять разным требованиям к дозировке. Например, требуемая дозировка лекарственного средства может быть менее чем 1 мг/единицу дозировки, более чем 1 мг/единицу дозировки, более чем 10 мг/единицу дозировки, более чем 100 мг/единицу дозировки, более чем 200 мг/единицу дозировки, более чем 300 мг/единицу дозировки, более чем 400 мг/единицу дозировки, более чем 500 мг/единицу дозировки или более чем 1000 мг/единицу дозировки. Предпочтительно лекарственное средство составляет более чем 50 мг/единицу дозировки. Более предпочтительно, если лекарственное средство составляет более чем 100 мг/единицу дозировки. Наиболее предпочтительно, лекарственное средство составляет более чем 200 мг/единицу дозировки.
Оболочка может составлять примерно между 5% и примерно 90 мас.% фармацевтически активного ингредиента, или примерно между 5% и примерно 80 мас.% api, или, примерно между 10% и примерно 70 мас.% api, или, примерно между 10% и примерно 60 мас.% api, или, примерно между 15% и примерно 50 мас.% api, или, примерно между 15% и примерно 45 мас.% api, или, примерно между 15% и примерно 40 мас.% api, или, примерно между 20% и примерно 35 мас.% api, или, примерно между 20% и примерно 30 мас.% api.
В особых вариантах осуществления, описанных ниже, вес трамадола в 100 мг таблетке трамадола составляет примерно 21 мас.% оболочки. Вес трамадола в 200 мг таблетке трамадола составляет примерно 31 мас.% оболочки. Вес трамадола в 300 мг таблетке трамадола составляет примерно 30 мас.% оболочки.
ПУТИ ВВЕДЕНИЯ
Таблетированная композиция согласно изобретению может быть введена, без ограничения, через ряд путей, таких, например, как пероральный, сублингвальный и ректальный. Предпочтительным путем введения композиций согласно изобретению является пероральный.
Композиции согласно изобретению, которые подходят для перорального введения, могут быть представлены в качестве дискретных единиц, таких как таблетки и