Способ повышения биодоступности лекарственных средств
Иллюстрации
Показать всеИзобретение относится к фармакологии и медицине и описывает способ повышения энтеральной биодоступности лекарственных средств, включающий смешивание последних с водорастворимым полимером, отличающийся тем, что лекарственное средство смешивают с 5,0-50,0% предварительно аэрированным и облученным потоком ускоренных электронов или импульсным УФ-лазерным излучением раствором полиэтиленоксида с молекулярной массой 0,4-20 кДа в присутствии 0,01-0,1 М фосфатного буфера, рН 6,0-8,0 и содержащим 0,05-0,3 М хлорида натрия. Предлагаемый способ прост и универсален и может быть применен для повышения энтеральной биодоступности лекарственных средств, вводимых преимущественно или исключительно парентерально из-за низкой резорбции через стенку кишечника. 3 з.п. ф-лы, 3 табл., 1 ил.
Реферат
Настоящее изобретение относится к фармакологии и медицине и может быть использовано для получения пероральных лекарственных форм и фармацевтических композиций, содержащих в качестве действующих веществ лекарственные средства, которые обладают низкой энтеральной биодоступностью и вследствие этого вводятся преимущественно парентерально.
В фармакологии существует три основных пути введения лекарственных препаратов, обладающих общерезорбтивным действием и проявляющих свое лечебное действие после поступления в системный кровоток: энтеральный (per os или введение препаратов через гастродуоденальный зонд), парентеральный (внутривенное, подкожное или внутримышечное введение препаратов) и наружный (нанесение лекарственного препарата на кожу или слизистые: интраназальное или ингаляционное введение). Путь введения лекарственного препарата зависит как от клинических показаний, так и от физико-химических свойств самого лекарственного препарата. В современной фармакологии существует очень мало примеров, когда лекарственный препарат может быть использован любым путем введения (глюкокортикоидные гормоны и местные анестетики). Как правило, из-за особенностей растворимости в водных и неводных средах, проницаемости через клеточные мембраны лекарственные препараты вводят одним или двумя путями. Существуют лекарственные препараты, которые вводят только одним путем: парентерально (циклоспорины) или энтерально (фторхинолоны). Для медицинского применения наиболее удобны и безопасны пероральные формы лекарственных препаратов, так как число осложнений при парентеральном введении препаратов (абсцессы, флегмоны), а также ингаляционном и интраназальном (аллергические риниты и бронхиальная астма) достаточно велико. Кроме того, только пероральное введение лекарственного препарата в виде капсул, таблеток или жидких лекарственных форм приемлемо для длительного лечения хронических заболеваний.
В современной клинической практике существует большая группа лекарственных препаратов, которые вводят только парентерально ввиду того, что они либо не всасываются из желудочно-кишечного тракта, либо разрушаются в нем. К таким препаратам относятся: пептидные гормоны (инсулин, АКТГ, кортексин, окситоцин, соматотропный гормон), антибиотики (аминогликозидного и цефалоспоринового ряда), гепарин и др. Все эти препараты применяют длительно, что создает определенные неудобства для пациентов, а также способствует возникновению инфекционно-воспалительных осложнений, характерных для инъекционного пути введения лекарственных препаратов. В современной научно-технической литературе имеются лишь единичные сведения о получении пероральных лекарственных форм таких препаратов.
Известные способы повышения биодоступности инъекционных лекарственных средств и получения на их основе пероральных лекарственных форм не являются универсальными, а, напротив, индивидуальны для каждого конкретного лекарственного вещества. Например, при получении пероральных форм инсулина основная цель модификации этого пептида заключается в снижении повреждающего действия на этот пептид соляной кислоты желудочного сока и пищеварительных протеолитических ферментов. Для получения пероральной формы гепарина этот способ неприемлем, так как гепарин устойчив к действию протеолитических ферментов и соляной кислоты, однако, его всасывание в кишечнике практически не происходит из-за физико-химических особенностей. Аналогичными свойствами обладают антибиотики из группы аминогликозидов и цефалоспоринов. Еще одним примером лекарственного средства, которое вводят только парентерально из-за низкой способности проникать через стенку кишечника, является ДНК. Ее низкая биодоступность при пероральном введении обусловлена высокой молекулярной массой - от 10 до нескольких тысяч кДа. В то же время уникальные лечебные эффекты при парентеральном введении ДНК делают ее весьма перспективным фармацевтическим препаратом. В медицинской практике препараты на основе ДНК, выделенные из молок осетровых рыб (препарат «Деринат»), используют в качестве активаторов клеточного и гуморального иммунитета для стимуляции гемопоэза и лейкопоэза. Недостатком препарата «Деринат» является то, что он применяется только наружно и парентерально. При пероральном применении «Деринат» неэффективен, так как из-за высокой молекулярной массы дезоксирибонуклеиновой кислоты его всасывание из желудочно-кишечного тракта недостаточно для проявления лечебного действия.
В современной научно-технической литературе нет данных о получении пероральных форм гепарина и его аналогов.
Известен способ получения препарата инсулина для перорального применения путем иммобилизации инсулина в объеме сшитого полимера, модифицированного ингибитором протеолитических ферментов (R.Z.Creenley, et.all Polymer Matrices for orol delivery, Polymer Preprits 1990, v.31, № 2, p.182-183). В качестве сшитого полимера используют акриловую или метакриловую кислоты, сшитые триэтиленгликольди(мет)акрилатом, а в качестве ингибитора протеолитических ферментов используют апротенин - панкреатический ингибитор трипсина.
Недостатком этого способа является невысокая устойчивость синтезированных полимерных гидрогелей к действию пищеварительных ферментов, следствием чего является низкая активность проникающего в кровь инсулина.
Наиболее близким к заявляемому способу - прототипом является способ повышения биодоступности инсулина путем иммобилизации последнего в объеме сшитого полимера, модифицированного ингибитором протеолитических ферментов, в качестве которого используют овомукоид в количестве 0,2-25 мг/г (набухшего в воде гидрогеля). Иммобилизацию проводят путем погружения сшитого модифицированного полимера в водный раствор инсулина с концентрацией 0,01-5 мг/мл на 1-2 часа до полного набухания полимера. Модифицированный полимер используют в количестве 0,01-1,0 г на 1 мл раствора инсулина (Патент РФ №2066551, кл. А61К 38/28, опубл. 20.09.96).
Недостатками известного способа являются технологическая сложность выделения овомукоида и получения сшитого полимера, им модифицированного, дороговизна и низкая терапевтическая эффективность получаемого препарата. Кроме этого, недостатками известного способа являются отсутствие универсальности и его неэффективность для повышения биодоступности других лекарственных средств, вводимых парентерально, в частности препаратов на основе ДНК и гепаринов.
Технической задачей предлагаемого изобретения является разработка простого и универсального способа повышения биодоступности лекарственных средств, вводимых преимущественно или исключительно парентерально из-за низкой резорбции через стенку кишечника.
Техническая задача достигается предлагаемым способом, заключающимся в следующем.
Лекарственное средство с низкой энтеральной биодоступностью, взятое в стандартных терапевтических дозах, определяемых для каждого лекарственного средства индивидуально, растворяют в 5,0-50,0% аэрированном растворе полиэтиленоксида с молекулярной массой от 400 до 20000 Да в присутствии 0,01-0,1 М фосфатного буфера с рН 6,0-8,0, содержащем 0,05-0,3 М хлорида натрия, предварительно активированного воздействием ионизирующего излучения (потоком ускоренных электронов или гамма-излучением) в дозах от 0,5 до 5,0 Мрад или импульсным УФ-лазерным излучением с длиной волны излучения 193-308 нм при энергии импульса 100-500 мДж, длительности импульса 15-25 нс и частоте повторения импульсов 50 Гц. В результате получают комплекс, который содержит фармакологически активный компонент и активированный облучением водорастворимый полимер, при этом фармакологически активное вещество модифицируется облученным полимером. Полученный комплекс обладает способностью проникать через стенку кишечника и, таким образом, фармакологически-активное вещество доставляется в системный кровоток и оказывает свое терапевтическое действие.
Повышение энтеральной биодоступности лекарственных средств достигается за счет свойства облученного полиэтиленоксида быстро проникать через любые биологические барьеры и его способности химически модифицировать лекарственные средства. Способность облученного полиэтиленоксида связываться с лекарственными средствами основана на процессе радиационно-химической активации полимеров. Высокоэнергетичное ионизирующее излучение, генерируемое линейными ускорителями электронов типа ИЛУ, ЭЛВ, или УФ-лазерное излучение воздействует на растворенные полимеры через цепь свободнорадикальных реакций. Окислительные свободные радикалы вызывают появление в структуре полимеров химически активных групп, способных связывать различные фармакологически активные соединения. Процессы, протекающие в облученных растворах полимеров, в основном связаны с радиационно-химическим или фотохимическим окислением и деструкцией -С-С- и -С-O- связей, при этом в полимере образуются химически активные группы: карбонильные и пероксидные. Они способны образовывать большое число лабильных (например, водородные связи) и относительно химически стабильных связей (например, азометиновые, пероксидные и ацетальные связи) с различными лекарственными веществами. При этом образуется временный комплекс лекарственного вещества и облученного водорастворимого полимера, который не является самостоятельным химическим соединением, все физико-химические характеристики лекарственного вещества остаются неизменными, однако за счет такого временного комплексообразования у фармакологически-активного вещества появляется высокая энтеральная биодоступность. Использование 0,01-0,1 М фосфатного буфера с рН 6,0-8,0 позволяет оптимизировать процесс окислительной радиационно-химической и фотохимической активации полиэтиленоксида. При концентрации буфера менее 0,01 М в процессе облучения за счет накопления продуктов радиолиза воды происходит смещение рН ниже 6,0 и это ведет к снижению выхода активированного полиэтиленоксида. Увеличение концентрации буфера более 0,1 М снижает растворимость фармакологически активных соединений в облученном растворе полиэтиленоксида. Выбор фосфатного буфера продиктован тем, что фосфат-ионы, в отличие от других неорганических анионов, в используемом диапазоне доз ионизирующего излучения и параметров УФ-лазерного излучения, химически неактивны и не подвергаются радиолизу и фотолизу. Выбор рН буферного раствора обусловлен тем, что при рН ниже 6,0 и выше 8,0 выходы радиационно-активированного полиэтиленоксида резко снижаются. Введение в облучаемый раствор полиэтиленоксида хлорида натрия в заявляемом диапазоне до 0,05-0,3 М позволяет увеличить количество окислительных радикалов, образующихся при радиолизе воды, которые в свою очередь повышают выход активированного полиэтиленоксида. Концентрация хлорида натрия менее 0,05 М существенно не влияет на увеличение выхода активированного полиэтиленоксида, а концентрации свыше 0,3 М создают избыточную солевую нагрузку на почки и кишечник при использовании лекарственного средства. Для увеличения выхода радиационно-активированного полиэтиленоксида его раствор перед облучением подвергают дополнительной аэрации путем барботажа воздухом или кислородом в течение 30 минут при 4-8°С.
Определяющим существенным отличием предлагаемого способа от прототипа является то, что в качестве транспортного агента, доставляющего фармакологически активное вещество через стенку кишечника, используют предварительно активированный ионизирующим излучением полимер - полиэтиленоксид с молекулярной массой от 400 до 20000 Да в виде 5,0-50,0% водного раствора, с которым оно образует лабильный комплекс, высвобождающий действующее фармакологически активное вещество после прохождения стенки кишечника в системный кровоток.
Заявленный способ подтверждается следующими примерами конкретного выполнения.
Пример 1
10% водный раствор полиэтиленоксида, предварительно аэрированный барботажем воздуха, с молекулярной массой 400 Да в 0,01 М фосфатном буфере с рН 8,0, содержащий 0,3 М хлорида натрия, облучают потоком ускоренных электронов в дозе 0,5 Мрад. В облученный раствор вносят ДНК из молок лососевых рыб до конечной концентрации 25 мг в 1 мл (соотношение полиэтиленоксид:ДНК равно 4:1). Смесь перемешивают 15 минут и получают препарат ДНК в виде слегка опалесцирующего вязкого раствора. Выход готового продукта составляет 99%.
Пример 2
50% водный раствор полиэтиленоксида, предварительно аэрированный барботажем кислорода, с молекулярной массой 4000 Да в 0,1 М фосфатном буфере с рН 7,0, содержащий 0,05 М хлорида натрия, облучают потоком ускоренных электронов в дозе 5 Мрад. В облученный раствор вносят ДНК из молок лососевых рыб до конечной концентрации 50 мг в 1 мл (соотношение полиэтиленоксид:ДНК равно 10:1). Смесь перемешивают 15 минут и получают препарат ДНК в виде слегка опалесцирующего вязкого раствора. Выход готового продукта составляет 98%.
Пример 3
25% водный раствор полиэтиленоксида, предварительно аэрированный барботажем воздуха, с молекулярной массой 1500 Да в 0,05 М фосфатном буфере с рН 6,0, содержащий 0,1 М хлорида натрия, облучают потоком ускоренных электронов в дозе 2,5 Мрад. В облученный раствор вносят инсулин до конечной концентрации 5 мг в 1 мл (соотношение полиэтиленоксид:инсулин равно 50:1). Смесь перемешивают 15 минут и получают препарат инсулина в виде слегка опалесцирующего раствора. Выход готового продукта составляет 99%.
Пример 4
5% водный раствор полиэтиленоксида, предварительно аэрированный барботажем воздуха, с молекулярной массой 20000 Да в 0,1 М фосфатном буфере с рН 7,0, содержащий 0,2 М хлорида натрия, облучают потоком ускоренных электронов в дозе 5 Мрад. В облученный раствор вносят инсулин до конечной концентрации 50 мг в 1 мл (соотношение полиэтиленоксид:инсулин равно 1:1). Смесь перемешивают 15 минут и получают препарат инсулина в виде слегка опалесцирующего раствора. Выход готового продукта составляет 99%.
Пример 5
20% водный раствор полиэтиленоксида, предварительно аэрированный барботажем воздуха, с молекулярной массой 400 Да в 0,05 М фосфатном буфере с рН 8,0, содержащий 0,2 М хлорида натрия, облучают потоком ускоренных электронов в дозе 1,5 Мрад. В облученный раствор вносят гепарин до конечной концентрации 19,25 мг (2500 ЕД) в 1 мл (соотношение полиэтиленоксид:гепарин равно 10:1). Смесь перемешивают 15 минут и получают препарат гепарина в виде прозрачного раствора. Выход готового продукта составляет 97%.
Пример 6
10% водный раствор полиэтиленоксида, предварительно аэрированный барботажем кислорода, с молекулярной массой 4000 Да в 0,01 М фосфатном буфере с рН 7,0, содержащий 0,1 М хлорида натрия, облучают потоком ускоренных электронов в дозе 3,5 Мрад. В облученный раствор вносят гепарин до конечной концентрации 38,50 мг (5000 ЕД) в 1 мл (соотношение полиэтиленоксид:гепарин равно 2,5:1). Смесь перемешивают 15 минут и получают препарат гепарина в виде прозрачного раствора. Выход готового продукта составляет 98%.
Пример 7
5% водный раствор полиэтиленоксида, предварительно аэрированный барботажем кислорода, с молекулярной массой 20000 Да в 0,01 М фосфатном буфере с рН 8,0, содержащий 0,01 М хлорида натрия, облучают потоком ускоренных электронов в дозе 5 Мрад. В облученный раствор вносят протеазу Bacillus subtilis до конечной концентрации 5 мг (5000 ЕД) в 1 мл (соотношение полиэтиленоксид:протеаза равно 10:1). Смесь перемешивают 15 минут и получают препарат модифицированной протеазы в виде прозрачного раствора. Выход готового продукта составляет 98%.
Пример 8
10% водный раствор полиэтиленоксида, предварительно аэрированный барботажем кислорода, с молекулярной массой 1500 Да в 0,01 М фосфатном буфере с рН 7,4, содержащий 0,1 М хлорида натрия, облучают потоком ускоренных электронов в дозе 1 Мрад. В облученный раствор вносят протеазу Bacillus subtilis до конечной концентрации 5 мг в 1 мл (соотношение полиэтиленоксид:протеаза равно 20:1). Смесь перемешивают 15 минут и получают препарат модифицированной протеазы в виде прозрачного раствора. Выход готового продукта составляет 98%.
Пример 9
10% водный раствор полиэтиленоксида, предварительно аэрированный барботажем кислорода, с молекулярной массой 1500 Да в 0,01 М фосфатном буфере с рН 7,4, содержащий 0,1 М хлорида натрия, облучают УФ-лазерным излучением, длина волны излучения 193 нм, энергия импульса 500 мДж при длительности 15 нс и частоте 50 Гц. В облученный раствор вносят протеазу Bacillus subtilis до конечной концентрации 5 мг в 1 мл (соотношение полиэтиленоксид:протеаза равно 20:1). Смесь перемешивают 15 минут и получают препарат модифицированной протеазы в виде прозрачного раствора. Выход готового продукта составляет 99%.
Пример 10
5% водный раствор полиэтиленоксида, предварительно аэрированный барботажем кислорода, с молекулярной массой 4000 Да в 0,01 М фосфатном буфере с рН 7,4, содержащий 0,1 М хлорида натрия и протеазу Bacillus subtilis в концентрации 5 мг в 1 мл (соотношение полиэтиленоксид:протеаза равно 10:1), облучают УФ-лазерным излучением, длина волны излучения 308 нм, энергия импульса 100 мДж при длительности 25 нс и частоте 50 Гц. В результате получают препарат модифицированной протеазы в виде прозрачного раствора. Выход готового продукта составляет 99%.
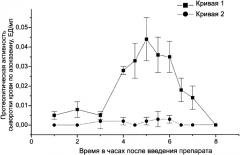
На чертеже представлены данные о повышении энтеральной биодоступности протеаз Bacillus subtilis, модифицированных заявляемым способом. Энтеральную биодоступность исследовали по динамике изменения протеолитической активности (по гидролизу азоказеина) сыворотки крови у крыс линии Wistar в течение 8 часов после однократного внутрижелудочного введения в эквивалентных дозах немодифицированной протеазы и протеазы, модифицированной заявляемым способом. Как видно из представленных на чертеже результатов, немодифицированная протеаза при внутрижелудочном введении практически не обладает энтеральной биодоступностью и соотвественно в течение всего времени измерения не приводит к статистически значимому повышению протеолитической активности сыворотки крови. Модифицированные протеазы Bacillus subtilis, напротив, при внутрижелудочном введении обладают высокой энтеральной биодоступностью, что находит свое отражение в существенном увеличении протеолитической активности сыворотки крови, а именно более чем в 10 раз при сравнении максимальных величин активности протеаз в сыворотке крови у крыс.
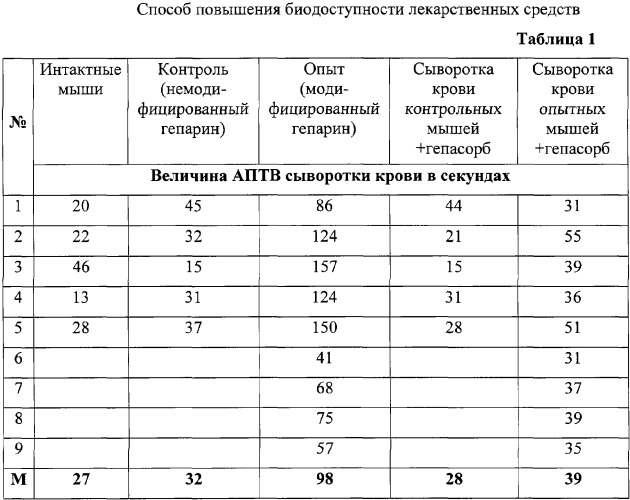
В таблице 1 представлены данные об энтеральной биодоступности гепарина и гепарина, модифицированного заявляемым способом, при однократном внутрижелудочном введении мышам. Энтеральную биодоступность исследовали по изменению АПТВ (активированное парциальное тромбопластиновое время) сыворотки крови экспериментальных животных через 3 часа после внутрижелудочного введения в эквивалентных дозах (1250 ЕД в 0,5 мл изотонического раствора хлорида натрия) немодифицированного и модифицированного гепарина. Как видно из представленных в таблице 1 результатов, немодифицированный гепарин при внутрижелудочном (в/ж) введении практически не обладает энтеральной биодоступностью и соотвественно величина АПТВ сыворотки крови через 3 часа после его в/ж введения практически не отличается от АПТВ сыворотки крови мышей контрольной группы, которым был в/ж введен изотонический раствор хлорида натрия в эквивалентном объеме. При добавлении к сыворотке крови мышей контрольной группы селективного сорбента гепарина - гепасорб величина АПТВ также остается в пределах исходных величин, что свидетельствует об отсутствии в сыворотке гепарина в дозах, превышающих его физиологический уровень, то есть в сыворотке крови отсутствует гепарин, резорбированный из желудочно-кишечного тракта. Модифицированный гепарин, напротив, при в/ж введении обладает высокой энтеральной биодоступностью, что находит свое отражение в существенном увеличении (более чем в 3 раза) АПТВ сыворотки крови в опытной группе мышей. При добавлении к сыворотке крови мышей опытной группы гепасорба величина АПТВ снижается, что свидетельствует о том, что в сыворотке крови присутствует гепарин в дозах, значительно превосходящих его физиологический уровень, то есть в крови присутствует гепарин, резорбированный из желудочно-кишечного тракта.
В таблице 2 представлены данные по исследованию энтеральной биодоступности человеческого инсулина, модифицированного заявляемым способом, и немодифицированного инсулина. Энтеральную биодоступность оценивали по гипогликемическому действию инсулина на модели аллоксанового диабета у крыс. В опытной группе экспериментальным животным в/ж однократно введено по 1 мл модифицированного инсулина с активностью 50 МЕ/мл (соотношение полиэтиленоксид: инсулин равно 70:1). В контрольной группе животным введено по 1 мл немодифицированного человеческого инсулина с активностью 50 МЕ/мл.
Как видно из таблицы 2, модифицированный инсулин обладает выраженной гипогликемической активностью при в/ж введении крысам с аллоксановой моделью диабета, что свидетельствует о его высокой энтеральной биодоступности в сравнении с немодифицированным инсулином.
В таблице 3 приведены данные по сравнительному исследованию клинической эффективности в лечении хронической венозной недостаточности нижних конечностей немодифицированной ДНК в сочетании со стандартными методами лечения (контрольная группа) и монотерапией препаратом, содержащим ДНК, модифицированную заявляемым способом (опытная группа). Исследуемые препараты ДНК применялись в обеих группах per os. Клиническую эффективность проводимой терапии оценивали по стандартным параметрам электрореовазографии. Как видно из представленных результатов, электрофизиологические параметры венозной системы нижних конечностей в опытной группе свидетельствуют о значительно более выраженном лечебном эффекте при приеме ДНК, модифицированной заявляемым способом, что свидетельствует о ее высокой энтеральной биодоступности.
Заявляемый способ обладает универсальностью и может быть использован для повышения энтеральной биодоступности широко круга лекарственных средств, в частности инсулина, протеаз, гепарина и нуклеиновых кислот (ДНК и РНК).
Способ повышения биодоступности лекарственных средств
| Таблица 3 | ||||
| Исследованные параметры | Контрольная группа | Основная группа | ||
| До лечения | После лечения | До лечения | После лечения | |
| Скорость лимфатического оттока, Ом/с | 0,17±0,02 | 0,2±0,02 | 0,18±0,02 | 0,25±0,02 |
| Объем лимфатического оттока, Ом | 0,26±0,02 | 0,28±0,03 | 0,25±0,02 | 0,32±0,03 |
| Сопротивление лимфатическому оттоку, с/Ом | 2,97±0,17 | 2,69±0,15 | 3,12±0,21 | 2,54±0,15 |
| Скорость венозного оттока, Ом/с | 0,25±0,02 | 0,28±0,02 | 0,22±0,02 | 0,31±0,02 |
| Объем венозного оттока, Ом | 0,31±0,03 | 0,37±0,03 | 0,33±0,03 | 0,42±0,42 |
| Сопротивление венозному оттоку, с/Ом | 3,35±0,24 | 2,96±0,18 | 3,19±0,22 | 2,73±0,16 |
1. Способ повышения энтеральной биодоступности лекарственных средств, включающий смешивание последних с водорастворимым полимером, отличающийся тем, что лекарственное средство смешивают с 5,0-50,0% предварительно аэрированным и облученным потоком ускоренных электронов или импульсным УФ-лазерным излучением раствором полиэтиленоксида с молекулярной массой 0,4-20 кДа в присутствии 0,01-0,1 М фосфатного буфера, рН 6,0-8,0 и содержащим 0,05-0,3 М хлорида натрия.
2. Способ по п.1, отличающийся тем, что раствор полиэтиленоксида аэрируют путем барботажа воздухом или кислородом в течение 30 мин при 4-8°С.
3. Способ по п.1, отличающийся тем, что раствор полиэтиленоксида облучают потоком ускоренных электронов или гамма-излучением в дозах 0,5-5,0 Мрад.
4. Способ по п.1, отличающийся тем, что раствор полиэтиленоксида облучают импульсным УФ-лазерным излучением с длиной волны 193-308 нм при энергии импульса 100-500 мДж, длительности импульса 15-25 нс и частоте повторения импульсов 50 Гц.