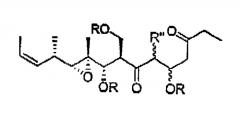
Общий синтез мириапоронов
Иллюстрации
Показать всеИзобретение относится к соединению формулы I, где R выбран из Н, SiR'3, SOR', SO2R', C(=O)R' или необязательно замещенного C1-С6алкила; R' выбран из C1-С6алкильной группы; R'' выбран из CH2OR, C1-С6алкила, C1-С6галогеналкила, С2-С6алкенила или C1-С6алкилидена; заместителями являются алкоксигруппы. Изобретение также относится к соединению формулы (I-31), (I-34), (I-43), (I-46), где R1, R2, R4 и R6 выбраны из РМВ, бензила, 2,6-диметилбензила, о-нитробензила, 2,6-дихлорбензила, 3,4-дихлорбензила, TBS, TES, TBDPS, TIPS и TMS; R5 выбран из OR', N(R')2, N(R')(C1-C4алкокси); и R' выбран из C1-С6алкила и С7-С10аралкила, L является стереоспецифической уходящей группой. Предложен способ синтеза соединения формулы 5, включающий удаление защитных групп с гидроксильных групп предшественника. Предложены способ получения соединения формулы 14 и способ получения соединения формулы 26, которые включают наращивание цепи предшественника путем взаимодействия с соединением СН3С(O)R5, где R5 представляет собой группу, выбранную из OR', N(R')2, N(R')(С1-С4алкокси); и R' представляет собой C1-С6алкил и С7-С10аралкил. Предложены способ получения соединения формулы 19 и способ получения соединения формулы 30, которые включают наращивание цепи предшественника путем взаимодействия с этилмагнийбромидом. Предложена фармацевтическая композиция с цитотоксической активностью на основе соединения формулы I. Предложено применение соединения формулы I для получения лекарственного препарата для лечения опухоли. Технический результат - соединение формулы I с цитотоксической активностью, способ их получения. 12 н. и 35 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к новым аналогам мириапоронов и к их использованию для лечения рака. Настоящее изобретение относится также к общему синтезу мириапоронов и аналогов.
Уровень техники
Мириапороны представляют собой новый класс производных поликетидов морских веществ, выделенных из бриозоанов Myriapora truncata.
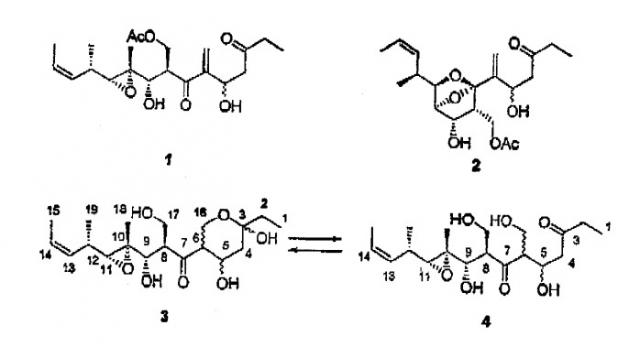
Описано, что мириапороны обладают противоопухолевой активностью. Полная структура данных родственных соединений была приведена K. L. Rinehart et al., J. Nat. Prod. 1995, 58, 344 и в патенте США № 5514708. Описанные там мириапороны 3 и 4 находятся в форме равновесной смеси между свободным гидроксикетоном и полукеталем, как изображено выше.
Было предпринято несколько безуспешных попыток синтеза мириапоронов, см., например, Taylor, R. E.; Ciavarri, J. C.; Hearn, B. R. "A Divergent Approach the Myriaporones and Tedanolide: Enantioselective Preparation of the Common Intermediate" Tetrahedron Lett. 1998, 39, 9361; Taylor et al., Org. Lett. 2002, 4, 2853, доступные на Web с 02 августа 2002 г.
Ввиду их интересных биологических свойств существует потребность в предоставлении эффективного стереоконтролируемого общего синтеза мириапоронов и родственных соединений.
Сущность изобретения
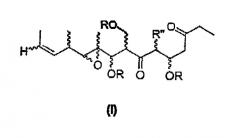
В первом аспекте настоящее изобретение направлено на соединения общей формулы I, или их фармацевтически приемлемые соли, производные, пролекарства или стереоизомеры
в которых каждый из заместителей, обозначенных R, независимо выбирают из группы, включающей H, SiR'3, SOR', SO2R', C(=O)R', C(=O)OR', C(=O)NR', замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, арил, гетероарил, или аралкил;
группу R' выбирают из замещенной или незамещенной алкильной, замещенной или незамещенной алкенильной, замещенной или незамещенной алкинильной, аминоалкильной, арильной, аралкильной и гетероциклической групп, а
группу R'' выбирают из группы, включающей H, OH, OR', OCOR', SH, SR', SOR', SO2R', NO2, NH2, NHR', N(R')2, NHCOR', N(COR')2, NHSO2R', CN, галогена, C(=O)H, C(=O)R', CO2H, CO2R',CH2OR,замещенный или незамещенный алкил, замещенный или незамещенный галогеналкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкилиден, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный аралкил, или замещенный или незамещенный гетероароматический радикал;
при условии, что соединение не является соединением 1, 3 или 4 патента США № 5514708.
Соединение 1 патента США № 5514708 соответствует приведенной выше формуле 1 в описании предшествующего уровня техники.
Согласно исследованиям авторов изобретения, природные соединения 3 и 4 патента США № 5514708 соответствуют соединениям 3а и 4а, описанным в приведенных ниже примерах.
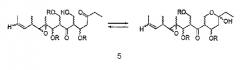
В том случае, когда R'' представляет собой СН2ОН, соединения формулы I могут существовать в виде смеси изомера кетона и изомера полукеталя (5),
в которых заместители, обозначенные R, являются определенными выше.
В частности, авторы изобретения предпочитают, чтобы, по меньшей мере, один из заместителей R не являлся водородом. Авторами изобретения найдено, что подобные соединения проявляют повышенную цитотоксичность.
Мириапороны получают из природных источников. Следующей целью настоящего изобретения является предоставление синтетического подхода к получению мириапоронов и их производных. Таким образом, настоящее изобретение направлено на синтез соединений формулы I, определенных выше, включая те из них, в которых все группы R являются Н, и на промежуточные соединения, используемые в процессе синтеза.
Согласно настоящему изобретению предлагаемый способ включает в себя снятие защитной группы в соединении формулы 5а, в котором, по меньшей мере, одна группа R представляет собой защитную группу, с получением соответствующего соединения формулы 5b, в котором, по меньшей мере, одна указанная группа R представляет собой водород. Данный синтетический подход можно использовать для новых и известных мириапоронов.
Следующий вариант осуществления настоящего изобретения представляет собой фармацевтическую композицию, включающую в себя соединение формулы I или его фармацевтически приемлемую соль, производное, пролекарство, или стереоизомер, или промежуточное соединение для его синтеза, и фармацевтически приемлемый носитель.
Следующий вариант осуществления настоящего изобретения представляет собой использование соединений формулы I, или их фармацевтически приемлемых солей, производных, пролекарств, или стереоизомеров в качестве противоопухолевых агентов.
Подробное описание изобретения
Настоящее изобретение относится к соединениям формулы I, определенным выше.
В данных соединениях заместители могут быть выбраны согласно следующему принципу.
Алкильные группы предпочтительно содержат от 1 до 12 атомов углерода. Один из более предпочтительных классов алкильных групп содержит от 1 до 8 атомов углерода, еще более предпочтительно от 1 до 6 атомов углерода и наиболее предпочтительно 1, 2, 3, или 4 атома углерода. В соединениях настоящего изобретения метил, этил и пропил, включая изопропил, являются особенно предпочтительными алкильными группами. Как использовано здесь, термин алкил, если нет иных изменений, относится как к циклическим, так и к ациклическим группам, хотя циклические группы будут содержать, по меньшей мере, три углеродных члена цикла.
Предпочтительные алкенильные и алкинильные группы в соединениях настоящего изобретения содержат одну или более ненасыщенных связей и от 2 до 12 атомов углерода, более предпочтительно от 2 до 8 атомов углерода, еще более предпочтительно от 2 до 6 атомов углерода и даже более предпочтительно 2, 3, или 4 атома углерода. Используемые здесь термины алкенил и алкинил относятся как к циклическим, так и к ациклическим группам, хотя линейные или разветвленные ациклические группы, как правило, более предпочтительны.
Алкилиденовые группы могут быть разветвленными или неразветвленными и предпочтительно содержат от 1 до 12 атомов углерода. Один из более предпочтительных классов алкилиденовых групп содержит от 1 до 8 атомов углерода, еще более предпочтительно от 1 до 6 атомов углерода и наиболее предпочтительно 1, 2, 3, или 4 атома углерода. В соединениях настоящего изобретения метилиденовая, этилиденовая и пропилиденовая, включая изопропилиденовую, являются особенно предпочтительными алкилиденовыми группами.
Предпочтительные алкилсульфинильные группы в соединениях настоящего изобретения включают в себя группы, содержащие одну или более сульфоксидных (SO) групп и от 1 до 12 атомов углерода, более предпочтительно от 1 до 8 атомов углерода и еще более предпочтительно от 1 до 6 атомов углерода. В особенности предпочтительны алкилсульфинильные группы, содержащие 1, 2, 3, или 4 атома углерода.
Предпочтительные алкилсульфонильные группы в соединениях настоящего изобретения включают в себя группы, содержащие одну или более сульфонильных (SO2) групп и от 1 до 12 атомов углерода, более предпочтительно от 1 до 8 атомов углерода и еще более предпочтительно от 1 до 6 атомов углерода. В особенности предпочтительны алкилсульфонильные группы, содержащие 1, 2, 3, или 4 атома углерода.
Предпочтительные аминоалкильные группы включают в себя группы, содержащие одну или более первичных, вторичных и/или третичных аминогрупп и от 1 до 12 атомов углерода, более предпочтительно от 1 до 8 атомов углерода, еще более предпочтительно от 1 до 6 атомов углерода и еще более предпочтительно 1, 2, 3, или 4 атома углерода. Обычно вторичные и третичные аминогруппы более предпочтительны, чем первичные аминогруппы.
Подходящие гетероциклические группы включают в себя гетероароматические и гетероалициклические группы. Подходящие гетероароматические группы в соединениях настоящего изобретения содержат один, два или три гетероатома, выбранных из N, O или S атомов, и включают в себя, например, кумаринил, включая 8-кумаринил, хинолинил, включая 8-хинолинил, пиридил, пиразинил, пиримидил, фурил, пирролил, тиенил, тиазолил, оксазолил, имидазолил, индолил, бензофуранил и бензотиазол. Подходящие гетероалициклические группы в соединениях настоящего изобретения содержат один, два или три гетероатома, выбранных из N, O или S атомов, и включают в себя, например, тетрагидрофуранильную, тетрагидропиранильную, пиперидинильную, морфолино- и пирролидинильную группы.
Подходящие арильные группы в соединениях настоящего изобретения включают в себя моно- и полициклические соединения, включая полициклические соединения, содержащие отдельные и/или конденсированные арильные группы. Обычные арильные группы содержат от 1 до 3 отдельных или конденсированных колец и от 6 до около 18 атомов углерода цикла. Особенно предпочтительные арильные группы включают в себя замещенный или незамещенный фенил, нафтил, дифенил, фенантрил и антрацил.
Приведенные здесь ссылки на замещенные группы в соединениях настоящего изобретения относятся к конкретной группе, обычно алкилу или алкенилу, которые могут быть замещены в одном или более возможных положениях одной или более подходящими группами, например галогеном, таким как фтор, хлор, бром или йод, циано, гидроксилом, нитро, азидо, карбоксамидо, алкильными группами, включая группы, содержащие от 1 до 12 атомов углерода, предпочтительно от 1 до 6 атомов углерода и более предпочтительно 1-3 атома углерода, алкенильными и алкинильными группами, включая группы, содержащие одну или более ненасыщенных связей и от 2 до около 12 атомов углерода, или от 2 до около 6 атомов углерода, алкоксигруппами, включая группы, содержащие одну или более связей с кислородом и от 1 до около 12 атомов углерода, предпочтительно от 1 до около 6 атомов углерода, арилокси, таким, как фенокси, алкилтиогруппами, включая группы, содержащие одну или более тиоэфирных связей и от 1 до около 12 атомов углерода, предпочтительно от 1 до около 6 атомов углерода, алкилсульфинильными группами, включая группы, содержащие одну или более сульфинильных связей и от 1 до около 12 атомов углерода, предпочтительно от 1 до около 6 атомов углерода, алкилсульфонильными группами, включая группы, содержащие одну или более сульфонильных связей и от 1 до около 12 атомов углерода, предпочтительно от 1 до около 6 атомов углерода, аминоалкильными группами, такими, как группы, содержащие один или более N атомов и от 1 до около 12 атомов углерода, предпочтительно от 1 до около 6 атомов углерода, арилом, содержащим 6 и более атомов углерода, в частности фенилом, аралкилом, таким, как бензил, гетероциклическими группами, включая гетероалициклические и гетероароматические группы, в особенности содержащие от 5 до 10 атомов цикла, из которых от 1 до 4 являются гетероатомами, более предпочтительно гетероциклическими группами, содержащими 5 или 6 атомов цикла и 1 или 2 гетероатома, или содержащими 10 атомов цикла и от 1 до 3 гетероатомов.
Предпочтительные группы R включают алкил, алкенил и алкинил, которые могут быть замещены в одном или более возможных положениях одной или более подходящими группами, например галогеном, таким, как фтор, хлор, бром и йод, в особенности, ω-хлор или перфтор, аминоалкильными группами, такими, как группы, содержащие один или более атомов N и от 1 до 12 атомов углерода, предпочтительно от 1 до 6 атомов углерода, арилом, содержащим 6 или более атомов углерода, в частности фенилом, аралкилом, таким, как бензил, гетероциклическими группами, включая гетероалициклические и гетероароматические группы, в особенности содержащие от 5 до 10 атомов цикла, из которых от 1 до 4 являются гетероатомами, более предпочтительно гетероциклическими группами, содержащими 5 или 6 атомов цикла и 1 или 2 гетероатома или содержащими 10 атомов цикла и от 1 до 3 гетероатомов, при этом гетероциклические группы необязательно замещены одним или более заместителями, в особенности амино, таким, как диметиламино или кето.
Термин «фармацевтически приемлемые соли, производные, пролекарства» относится к любой фармацевтически приемлемой соли, сложному эфиру, сольвату, гидрату или любому другому соединению, которое при введении реципиенту способно дать (непосредственно или косвенно) описанное здесь соединение. Однако понятно, что в рамки данного изобретения входят также не фармацевтически приемлемые соли, поскольку их можно использовать для получения фармацевтически приемлемых солей. Получение солей, пролекарств и производных можно осуществить способами, известными в данной области техники.
Например, фармацевтически приемлемые соли предоставленных здесь соединений получают из исходных соединений, содержащих основную или кислотную группу, обычными химическими способами. Как правило, подобные соли получают, например, вводя во взаимодействие данные соединения в форме свободной кислоты или свободного основания со стехиометрическим количеством соответствующего основания или кислоты в воде или органическом растворителе, или в их смеси. Обычно предпочитают неводные среды, например эфир, этилацетат, этанол, изопропанол или ацетонитрил. Примеры солей присоединения кислоты включают в себя соли присоединения минеральных кислот, например такие, как гидрохлорид, гидробромид, гидройодид, сульфат, нитрат, фосфат, и соли присоединения органических кислот, такие, например, как ацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, манделат, метансульфонат и п-толуолсульфонат. Примеры солей присоединений оснований включают в себя неорганические соли, например такие, как соли натрия, калия, кальция и аммония, и соли органических оснований, например таких, как этилендиамин, этаноламин, N,N-диалкиленэтаноламин, триэтаноламин и соли основных аминокислот.
Соединения данного изобретения могут находиться в кристаллическом состоянии либо в виде свободных соединений, либо в виде сольватов (например, гидратов) и подразумевается, что в рамки настоящего изобретения входят обе формы. Методы сольватирования общеизвестны в данной области техники.
Любое соединение, являющееся пролекарством соединения формулы I, соответствует рамкам и духу настоящего изобретения. Термин «пролекарство» использован в его самом широком смысле и включает в себя такие производные, которые превращаются in vivo в соединения данного изобретения. Подобные производные легко может представить себе специалист в данной области техники и они включают, например, соединения, в которых свободная гидроксигруппа переведена в сложноэфирное производное.
Соединения настоящего изобретения, представленные описанной выше формулой I, могут включать энантиомеры в зависимости от их асимметрии или диастереоизомеры. Отдельные изомеры и смеси изомеров входят в рамки настоящего изобретения.
В одном из аспектов настоящее изобретение распространяется на соединения формулы I, отличающиеся от известных мириапоронов в том, что касается одного или более положений стереохимии. Таким образом, в данном аспекте соединения представляют собой изомеры и изомерные производные.
Предпочтительной стереохимией соединений формулы I является
В случае, когда R'' является СН2ОН, предпочтительной стереохимией соединений формулы (5) является
Особенно предпочтительными являются соединения со следующей стереохимией:
и
Авторами изобретения найдено, что данные конкретные группы соединений проявляют улучшенные биологические свойства.
В следующем предпочтительном варианте осуществления R'' представляет собой замещенный или незамещенный алкилиден.
В одном из предпочтительных вариантов осуществления соединений формулы (5), по меньшей мере, один из заместителей R является С(=О)R'. Особенно предпочтительным является соединение формулы (47):
В следующем варианте осуществления соединений формулы I или формулы (5), по меньшей мере, один из заместителей R не является водородом. Подходящим образом каждая группа, не являющаяся водородом, представляет собой защитную группу, которая может быть одинаковой или различной.
Предпочтительны соединения следующей формулы:
в которой R1, R2, R6 и R7 являются защитными группами для гидрокси.
В особенности предпочтительными являются соединения формулы (19):
в которой R1, R2, R6 и R7 являются защитными группами для гидрокси;
и формулы (30):
в которой R1, R2, R6 и R7 являются защитными группами для гидрокси.
Подходящим образом R1, R2, R6 и R7 являются одинаковыми защитными группами. Их можно выбрать из числа TBS (tBuMe2Si-), TBDPS (tBuPh2Si-), TES (Et3Si-), MOM (CH3OCH2-), MEM (CH3OCH2CH2OCH2-), SEM ((CH3)3SiCH2CH2OCH2-) и Ac- (CH3CO-). Особенно предпочтительными являются TBS (tBuMe2Si-) или TBDPS (tBuPh2Si-).
Предпочтительными являются также соединения следующей формулы:
в которой R1 является защитной группой для гидрокси.
В особенности предпочтительны соединения формул (20) и (31):
В приведенных выше соединениях R1 подходящим образом является TBS (tBuMe2Si-).
В настоящем изобретении также предоставлен способ синтеза мириапоронового соединения формулы (5):
которое может существовать в виде смеси изомера кетона и изомера полукеталя или в виде одной из этих двух изомерных форм;
в котором каждую из замещающих групп, обозначенных R, независимо выбирают из группы, включающей H, SiR'3, SOR', SO2R', C(=O)R', C(=O)OR', C(=O)NR', замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, арил, гетероарил, или аралкил, и в котором, по меньшей мере, одна группа R является водородом;
и в котором группу R' выбирают из замещенной или незамещенной алкильной, замещенной или незамещенной алкенильной, замещенной или незамещенной алкинильной, аминоалкильной, арильной, аралкильной и гетероциклической групп;
который включает снятие защитной группы в промежуточном соединении формулы:
в котором каждую из замещающих групп, обозначенных R, независимо выбирают из группы, включающей H, SiR'3, SOR', SO2R', C(=O)R', C(=O)OR', C(=O)NR', замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, арил, гетероарил или аралкил, и в котором одна или каждая группа R, которая должна стать водородом в соединении 5, в промежуточном соединении является защитной группой;
и в котором группа R' аналогична определенной.
Подходящим образом в промежуточном соединении более одной группы R являются защитными.
Способ изобретения может включать в себя снятие, по меньшей мере, одной защитной группы в соединении формулы (19):
в котором R1, R2, R6 и R7 являются защитными группами для гидрокси.
Родственный способ данного изобретения может включать в себя снятие, по меньшей мере, одной защитной группы в соединении формулы (30):
в котором R1, R2, R6 и R7 являются защитными группами для гидрокси.
Подходящим образом R1, R2, R6 и R7 являются одинаковыми защитными группами и их удаляют.
Другой способ изобретения включает в себя снятие защитной группы в соединении формулы (20):
в котором R1 является защитной группой для гидрокси.
Родственный способ данного изобретения включает в себя снятие защитной группы в соединении формулы (31):
в котором R1 является защитной группой для гидрокси.
Кроме того, в изобретении предоставлен способ синтеза мириапоронового соединения формулы I:
в котором заместители R и R'' аналогичны описанным выше для формулы I;
который включает в себя получение производного соединения формулы (5):
которое может существовать в виде смеси изомера кетона и изомера полукеталя или в виде одной из этих двух изомерных форм;
и в котором заместители аналогичны описанным в п. 25.
Кроме того, в изобретении предоставлены соединения следующей формулы:
в котором R1, R2 и R4 являются защитными группами для гидрокси, а L представляет собой стереоспецифическую уходящую группу, наводящую хиральность.
Предпочтительными являются соединения формул (10) и (22):
Кроме того, в изобретении предоставлены соединения следующей формулы:
в которых R1, R2, R4 и R6 являются защитными группами для гидрокси;
R5 выбирают из группы, включающей H, SOR', SO2R', C(=O)R', C(=O)OR', C(=O)NR', замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, арил, гетероарил или аралкил;
а R' имеет значение, аналогичное определенному в п. 1.
Предпочтительными являются соединения формул (14) и (26):
В изобретении также предоставлен способ получения соединения формулы (14), включающий в себя наращивание цепи в соединении формулы (13), способ получения соединения формулы (26), включающий в себя наращивание цепи в соединении формулы (25), способ получения соединения формулы (19), включающий в себя наращивание цепи в соединении формулы (18) и способ получения соединения формулы (30), включающий в себя наращивание цепи в соединении формулы (29).
Кроме того, в изобретении представлены соединения следующей формулы:
в которых R1, R2 и R4 являются защитными группами для гидрокси.
Предпочтительными являются соединения формул (11) и (23):
Кроме того, в изобретении представлены соединения следующей формулы:
в которых R1, R2 и R4 являются защитными группами для гидрокси.
Предпочтительными являются соединения формулы (8):
Соединения настоящего изобретения можно синтезировать из промежуточного соединения 6, описанного W. R. Roush et al., Org. Lett. 1999, 1, 95, или из его стереоизомеров.
Способ получения соединений формулы I приведен на схеме 1.
Схема 1
Для обсуждения данной схемы атомам углерода в каждой взятой в отдельности молекуле приписан номер, соответствующий их конечному положению в конечном продукте формулы I с использованием системы нумерации, приведенной ранее для известного соединения 3/4. Схема 1 включает
- защиту соединения 6 с получением защищенного соединения 7. Данную защиту осуществляют при помощи соответствующего реагента для выбранной защитной группы (такого, как TBSCl, TESOTf, MOMBr или tBu2Si(OTf)2) в условиях, соответствующих известным методикам органического синтеза (например, имидазол, DIPEA, или 2,6-лутидин в ДМФА или CH2Cl2), рассматриваются также альтернативные защитные группы,
- превращение терминальной винильной группы при 6 и 7 атомах углерода в альдегид в соединении (8). Это превращение осуществляют озонолизом данной винильной группы (например, при действии О3 в CH2Cl2 при -78°С) или за счет образования соответствующего дигидроксипроизводного (например, при действии NMO, OsO4 в смеси ТГФ:Н2О) и расщепления данного диола (например, NaIO4 в смеси ТГФ:Н2О) в соответствующий альдегид,
- взаимодействие с оксазолидиноном 9 с получением соединения 10. Оксазолидинон 9 переводят в соответствующий енолят (например, при действии Bu2BOTf и Et3N в CH2Cl2 при -78°С) и прибавляют к 8 при низкой температуре (-30°С), получая 10. В рамках защиты данного изобретения рассматриваются также другие стереоспецифические уходящие группы, наводящие требуемую хиральность,
- восстановление соединения 10 с получением 17-гидроксиметильной боковой цепи в соединении 11. Данное восстановление проводят при действии соответствующего реагента (такого, как LiBH4) в условиях (например, в смеси ТГФ:Н2О, или в CH2Cl2) по известным методикам органического синтеза, хотя в рамках защиты данного изобретения рассматриваются также другие восстанавливающие агенты,
- последующую защиту 17-гидроксигруппы с получением соединения 12. Данную защиту осуществляют при помощи соответствующего реагента для выбранной защитной группы (такого, как TBSCl, TESCl, MEMCl или SMCl) в условиях, соответствующих известными методиками органического синтеза (например, имидазол, DIPEA, DMAP, или Et3N в ДМФА, или CH2Cl2), при этом в изобретении рассматриваются также другие защитные группы,
- превращение терминальной винильной группы при 4 и 5 атомах углерода в альдегид в соединении 13. Данное превращение осуществляют озонолизом данной винильной группы (например, при действии О3 в CH2Cl2 при -78°С), или за счет образования соответствующего дигидроксипроизводного (например, при действии NMO, OsO4 в смеси ТГФ:Н2О) и расщепления данного диола (например, NaIO4 в смеси ТГФ:Н2О или Pb(OAc)4 в толуоле) в соответствующий альдегид,
- наращивание цепи при 5 атоме углерода с получением соединения 14. В иллюстративном примере выбранный реагент (СН3С(О)N(CH3)OCH3) переводят в соответствующий енолят ([(СН3)3Si]2NLi в ТГФ при -78°С) и прибавляют к 13 при низкой температуре (-78°С), получая 14, при этом для достижения той же цели также можно использовать альтернативные методики наращивания цепи, известные специалисту в данной области техники,
- последующую защиту 5-гидроксигруппы с получением соединения 15. Данную защиту осуществляют при помощи соответствующего реагента для выбранной защитной группы (такого, как TBSOTf) в условиях (2,6-лутидин в CH2Cl2), соответствующих известным методикам. Можно также использовать альтернативные защитные группы,
- окисление гидроксигруппы при 7 атоме углерода для получения соединения 16. Данное окисление проводят при помощи соответствующего реагента (такого, как перйодинан Десс-Мартина) в условиях, соответствующих известным методикам органического синтеза (например, в CH2Cl2),
- снятие защиты с 13-защищенной гидроксигруппы с получением соединения 17 со снятой терминальной защитой. Данное снятие защиты проводят при помощи соответствующего реагента (например, DDQ) для выбранной защитной группы (например, РМВ) в условиях, соответствующих известным методикам (например, в смеси CH2Cl2:H2O),
- формирование терминальной олефиновой группы путем наращивания цепи за счет 14 и 15 атомов углерода с получением соединения 18. Данное превращение осуществляют в две стадии: а) окисление первичной гидроксигруппы в соответствующий альдегид при действии выбранного реагента (например, перйодинана Десс-Мартина) и b) образование цис-двойной связи по реакции Виттига или Хорнера-Водсворта-Эммонса в стандартных условиях, при этом для достижения той же цели также можно использовать альтернативные методы наращивания цепи, известные специалисту в данной области техникик,
- образование, в том случае, если таковой еще отсутствует, 7-кето-заместителя в соединении 19. Данное окисление проводят при помощи соответствующего реагента (такого, как перйодинан Десс-Мартина) в условиях, соответствующих известным методикам органического синтеза (например, в CH2Cl2),
- наращивание цепи за счет атомов углерода 1 и 2, если оно еще отсутствует в соединении 19. Данное расширение проводят при помощи соответствующего реагента (такого, как BrMgEt) в условиях, соответствующих известным методикам органического синтеза (например, в ТГФ),
- частичное или полное снятие защиты, приводящее к соединению 20 или 4/3. Данное снятие защиты проводят при помощи соответствующего реагента (такого, как TBAF или AcOH) для выбранной защитной группы (например, TBS) в условиях, соответствующих известным методикам (например, в CH2Cl2),
- и необязательная дериватизация с получением производного, представленного как соединение (I), в котором, по меньшей мере, один R не является водородом, например, реакцией с Ас2О, любым алкилкарбонилхлоридом, или ангидридом в присутствии соответствующего основания (например, Et3N) в любом подходящем растворителе, например таком, как CH2Cl2.
Кроме того, из промежуточного соединения 8 получают различные изомерные синтетические мириапороны при использовании другой стереоспецифической уходящей группы, например при использовании (S)-оксазолидинона вместо (R)-оксазолидинона. Способ получения данных соединений представлен на схеме 2.
Схема 2
В схему реакции 2 входят те же реакции, что и реакции из схемы 1, с другой стереохимией оксазолидинона 9.
Цель данного изобретения состоит в предоставлении первого общего синтеза мириапоронов 3 и 4 и получении из этих соединений или предшествующих промежуточных соединений других соединений формулы I. Данный синтез предпочтительно позволил бы получать наибольшие возможные количества мириапоронов 3 и 4 при помощи простых подходов и способов. Данный синтез также дал бы возможность получать наибольшее возможное число определенных производных мириапоронов 3 и 4. Кроме того, данный синтез предпочтительно происходил бы стереоселективно, так что можно было бы получать четыре диастереоизомера мириапоронов 3 и 4 в индивидуальном состоянии. Следующая цель изобретения заключается в предоставлении некоторых промежуточных соединений общего синтеза, что сделает синтез гибким, насколько это возможно и, таким образом, позволит получать широкий ряд производных.
В предыдущих схемах реакций защитные группы для гидроксигрупп R1, R2, R4, R6 и R7 могут представлять собой любой пример защитной группы для гидроксигруппы, приведенный в "Protective Groups in Organic Synthesis", T.W. Green, P.G. Wuts, Ed. Wiley-Interscience, 3rd Edition. Примеры защитных групп для гидроксигрупп приведены в следующем перечне:
| Простые эфиры | Защита ОН-группы(Аббревиатура) |
| Метиловый | |
| Метоксиметиловый | MOM |
| Бензилоксиметиловый | BOM |
| Метоксиэтоксиметиловый | MEM |
| 2-(Триметилсилил)этоксиметиловый | SEM |
| Метилтиометиловый | MTM |
| Фенилтиометиловый | PTM |
| Азидометиловый | |
| Цианометиловый | |
| 2,2-Дихлор-1,1-дифторэтиловый | |
| 2-Хлорэтиловый | |
| 2-Бромэтиловый | |
| Тетрагидропиранильный | THP |
| 1-Этоксиэтиловый | EE |
| Фенациловый | |
| 4-Бромфенациловый | |
| Циклопропилметиловый | |
| Аллиловый | |
| Пропаргиловый | |
| Изопропиловый | |
| Циклогексиловый | |
| Третбутиловый | |
| Бензиловый | |
| 2,6-Диметилбензиловый | |
| 4-Метоксибензиловый | MPM или PMB |
| О-Нитробензиловый | |
| 2,6-Дихлорбензиловый | |
| 3,4-Дихлорбензиловый | |
| 4-(Диметиламино)карбонилбензиловый | |
| 4-Метилсульфинилбензиловый | Msib |
| 9-Антрилметиловый | |
| 4-Пиколиловый | |
| Гептафтор-п-толиловый | |
| Тетрафтор-4-пиридиловый | |
| Триметилсилиловый | TMS |
| Третбутилдиметилсилиловый | TBDMS |
| Третбутилдифенилсилиловый | TBDPS |
| Триизопропилсилиловый | TIPS |
| Сложные эфиры | |
| Арилформиат | |
| Арилацетат | |
| Ариллевулинат | |
| Арилпивалоат | ArOPv |
| Арилбензоат | |
| Арил-9-фторкарбоксилат | |
| Арилметилкарбонат | |
| 1-Адамантилкарбонат | |
| Третбутилкарбонат | BOC-OAr |
| 4-Метилсульфинилбензилкарбонат | Msz-Oar |
| 2,4-Диметилпент-3-илкарбонат | Doc-Oar |
| Арил-2,2,2-трихлорэтилкарбонат | |
| Арилвинилкарбонат | |
| Арилбензилкарбонат | |
| Арилкарбамат | |
| Диметилфосфинил | Dmp-OAr |
| Диметилфосфинотиоил | Mpt-OAr |
| Дифенилфосфинотиоил | Dpt-Oar |
| Арилметансульфонат | |
| Арилтолуолсульфонат | |
| Арил-2-формилбензолсульфонат |
Предпочтительными R2, R4, R6 и R7 являются TBS (tBuMe2Si-), TBDPS (tBuPh2Si-), TES (Et3Si-), MOM (CH3OCH2-), MEM (CH3OCH2CH2OCH2-), SEM ((CH3)3SiCH2CH2OCH2-) и Ас-, а более предпочтительными являются TBS и TBDPS. Кроме того, предпочтительно, чтобы R2, R4, R6 и R7 являлись одинаковыми защитными группами. Предпочтительным R1 является PMB (п-МеО-Ph-CH2-). Реакции защиты и снятия защиты, представленные на предшествующих схемах реакций, проводят согласно состоянию данной области техники.
Представленную на схемах группу R3 выбирают из группы, включающей H, OH, =O, OR', OSiR', OSOR', OSO2R', OCOR', OCOOR', CONR', NHR' и NR'R'. R' имеет значение, аналогичное определенному в формуле I. Предпочтительный R3 является гидрокси или =О.
Группу, представленную на схемах как R5, выбирают из группы, включающей H, SOR', SO2R', C(=O)R', C(=O)OR', C(=O)NR', замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, арил, гетероарил, или аралкил. И R' имеет значение, аналогичное определенному в формуле I. Предпочтительный R5 является С1-С6, а более предпочтительный - этилом.
Тождественность соединений 9 и 21 можно изменить, получая соединения 11 и 23 из соединения 8 другими способами, в соответствии с состоянием данной области техники.
Относительную стереохимию при атомах С-8-С-12 соединений 3 и 4 считают аналогичной той, которая описана в патенте № 5514708, 1996, исходя из сопоставления приведенных там констант спин-спинового взаимодействия. Кроме того, стереохимия описанного выше исходного соединения 6 была уже указана W.R. Roush et al., Org. Lett. 1999, 1, 95.
Для подтверждения данной информации стереохимия указанных атомов углерода была установлена на основании экспериментов NOESY и COSY на продукте 33 раскрытия внутримолекулярного эпоксида, полученного в две стадии из 11а (схема 3).
Схема 3
Абсолютная конфигурация атомов от С-8 до С-12 была легко установлена при помощи NOE экспериментов. Вывод об относительной син-конфигурации при С-11-С-12 был сделан на основании константы спин-спинового взаимодействия (J=1,5 Гц). Сигнал NOE между Н-11 и Н-14 указывает на то, что оба атома должны находиться в аксиальных положениях.
Вывод об относительной антиконфигурации при С-6-С-7 был сделан на основании небольшой величины константы спин-спинового взаимодействия ацетонида 34, полученного из соеди