Полипептиды, обработанные has, особенно эритропоэтин, обработанный has
Иллюстрации
Показать всеИзобретение относится к биоорганической химии и касается нового конъюгата эритропоэтина, способа его получения и фармацевтической композиции на его основе. Предложен конъюгат гидроксиэтилкрахмала и эритропоэтина, содержащий одну или несколько молекул гидроксиэтилкрахмала. Каждая молекула гидроксиэтилкрахмала конъюгирована с эритропоэтином, через углеводный фрагмент. Указанный гидроксиэтилкрахмал имеет молекулярную массу от 1 до 300 кДа и проявляет соотношение С2:С6-замещения в диапазоне 2-20 по гидроксиэтильным группам. Предложен способ получения конъюгата гидроксиэтилкрахмала и эритропоэтина, в соответствии с которым необязательно частично или полностью ферментативно и/или химически удаляют концевую сиаловую кислоту и необязательно частично или полностью окисляют концевое сахаридное звено эритропоэтина с получением эритропоэтина, способного к реакции с модифицированным гидроксиэтилкрахмалом. В гидроксиэтилкрахмал вводят свободную гидразидную, гидроксиламиновую, тиольную или семикарбазидную функциональную группу с получением модифицированного гидроксиэтилкрахмала, который конъюгируют с эритропоэтином, способным к реакции с модифицированным гидроксиэтилкрахмалом, и получают конъюгат гидроксиэтилкрахмала и эритропоэтина, содержащий одну или несколько молекул гидроксиэтилкрахмала. Фармацевтическая композиция содержит конъюгат гидроксиэтилкрахмала и эритропоэтина, который обладает активностью эритропоэтина, и фармацевтически приемлемый разбавитель, адъювант и/или носитель. Технический результат - конъюгат гидроксиэтилкрахмала и эритропоэтина, обладающий активностью эритропоэтина. 3 н. и 16 з.п. ф-лы, 4 табл., 25 ил.
Реферат
Настоящее изобретение относится к полипептидам, в особенности к эритропоэтину, конъюгированному с гидроксиалкилкрахмалом (HAS), и в особенности с гидроксиэтилкрахмалом.
Применение полипептидов, особенно ферментов или цитокинов, для введения их в систему кровообращения с целью достижения конкретного физиологического эффекта представляет собой хорошо известный инструмент в современной медицине.
Эритропоэтин (EPO) представляет собой гликопротеиновый гормон, необходимый для созревания эритроидных клеток-предшественников в эритроциты. У взрослых людей он образуется в почках. EPO необходим для регулирования уровня эритроцитов в кровотоке. Условия, определяемые низким уровнем кислорода в тканях, провоцируют усиление биосинтеза EPO, что, в свою очередь, стимулирует эритропоэз. Снижение функциональной активности почек, которая отмечается при хронической почечной недостаточности, в типичном случае может, например, приводить к снижению биосинтеза EPO и к сопутствующему снижению уровня эритроцитов.
Эритропоэтин представляет собой кислый гликопротеидный гормон массой примерно 34000 Да. Человеческий эритропоэтин представляет собой полипептид из 166 аминокислот, который в природе обычно представлен в форме мономера (Lin et al, PNAS 82, 7580-7584, EP 148605 B2, EP 411678 B). Идентификация, клонирование и экспрессия генов, кодирующих эритропоэтин, описана, например, в патенте США 4703008. Выделение и очистка рекомбинантного эритропоэтина из культуральной среды, используемой для выращивания клеток млекопитающих, содержащих плазмиды для получения рекомбинантного эритропоэтина, описаны, например, в патенте США 4667016.
В основном в данной области техники известно, что биологическая активность EPO in vivo в основном зависит от уровня содержащихся сиаловых кислот, которые присоединяются к EPO (см., например, EP 428267 B1). Теоретически 14 молекул сиаловой кислоты могут присоединиться к одной молекуле EPO на терминальных участках боковых цепей углеводов, присоединенных к N- и О-сайтам гликозилирования. Для получения высокосиалилированных препаратов EPO требуются чрезвычайно сложные стадии очистки.
В литературе имеется детальная информация по различным аспектам эритропоэтина (см., например, Krantz, Erythropoietin, 1991, Blood, 77(3):419-34 (обзор) and Cerami, Beyond erythropoiesis: novel application for recombinant human erythropoietin, 2001, Semin Hematol., (3 Suppl 7):33-9 (обзор).
Ряд имеющихся проблемы, связанных с применением полипептидов и ферментов, заключается в том, что указанные белки зачастую проявляют неудовлетворительную стабильность. В особенности известно, что эритропоэтин обладает относительно коротким периодом полувыведения из плазмы (Spivak and Hogans, 1989, Blood 73, 90; McMahon et al., 1990, Blood 76, 1718). Данный аспект указывает на то, что терапевтические уровни в плазме быстро снижаются и должны проводиться повторные внутривенные введения. Кроме того, в некоторых случаях наблюдается иммунный ответ против вводимых пептидов.
В основном считается, что стабильность полипептидов может быть улучшена и иммунный ответ против указанных полипептидов снижен, если полипептид связать с полимерными молекулами. В WO 94/28024 показано, что физиологически активный полипептид, модифицированный полиэтиленгликолем (PEG), демонстрирует сниженную иммуногенность и антигенность и циркулирует в кровотоке значительно дольше, чем неконъюгированные белки, то есть имеет более длительный клиренс.
Однако конъюгатам PEG-лекарственное средство свойственны некоторые недостатки, определяемые тем, что они не имеют природной структуры, которая может распознаваться элементами путей деградации in vivo. В этой связи кроме PEG-конъюгатов были разработаны другие конъюгаты и белковые полимерные образования. В литературе описано множество методов сшивания различных белков и макромолекул, таких как метод с использованием полимеразы (см., например, Wong, Chemistry of protein conjugation and cross-linking, 1993, CRCS, Inc.).
Гидроксиэтилкрахмал (HES) представляет собой производное природного амилопектина, которое подвергается деградации в организме под действием α-амилазы. Получение HES-пептидных конъюгатов описано в данной области техники (см., например, HES-hemoglobin-conjugates в DE 2616086 или DE 2646854).
В DE 2646854 раскрываются способы конъюгирования гемоглобина с HES. В рамках данных методик HES подвергают реакции с перйодатом натрия, приводящей к образованию диальдегидов, которые связывают с гемоглобином. В отличие от указанной методики, в документе DE 2616086 раскрывается конъюгирование гемоглобина с HES по процедуре, в которой вначале сшивающий агент (например, бромциан) связывают с HES и затем гемоглобин связывают с промежуточным продуктом.
HES представляет собой замещенное производное углеводного полимера амилопептида, который присутствует в кукурузном крахмале в концентрации до 95 мас.%. HES демонстрирует полезные биологические свойства и используется в качестве кровезаменителя и при лечении по методу гемодилюции в клинических условиях (Sommermeyer et al., 1987, Krankenhauspharmazie, 8(8), 271-278, и Weidler et al., 1991, Arzneim.-Forschung/Drug Res., 41, 494-498).
Амилопептид состоит из двух фрагментов глюкозы, причем в главной цепи имеются α-1,4-гликозидные связи, а в сайтах ветвления найдены α-1,6-гликозидные связи. Физико-химические свойства данной молекулы в основном определяются типом гликозидных связей. Из-за точечных разрывов α-1,4-гликозидных связей образуются спиральные структуры с шестью глюкозными мономерами на виток структуры.
Физико-химические, а также биохимические свойства полимера могут быть модифицированы путем замещения. Введение гидроксиэтильной группы может быть осуществлено путем щелочного гидроксиэтилирования. При соответствующей адаптации реакционных условий можно использовать различную реакционную способность в отношении гидроксиэтилирования соответствующей гидроксильной группы в незамещенном глюкозном мономере. В этой связи любой специалист со средним уровнем знаний в данной области может в некотором ограниченном диапазоне оказывать воздействие на характер замещения.
Соответственно HES в основном характеризуется определенным распределением по молекулярной массе и степени замещения. Имеются две возможности характеристики степени замещения:
1. Степень замещения может быть описана относительно части замещенных глюкозных мономеров в сравнении с соответствующим показателем для всех глюкозных фрагментов (DS).
2. Степень замещения может быть охарактеризована как "молярное замещение" (MS), когда описывают количество гидроксиэтильных групп, приходящихся на фрагмент глюкозы.
Растворы HES присутствуют в виде полидисперсных композиций, где каждая молекула отличается от другой степенью полимеризации, числом и характером сайтов ветвления, а также характером замещения. В этой связи HES представлен смесью соединений с разной молекулярной массой. Следовательно, конкретный раствор HES может быть определен по средней молекулярной массе с помощью статистических методов. В данном контексте Mn вычисляют как среднее арифметическое значение, зависящее от числа молекул. Альтернативно MW,как среднее значение молекулярной массы, отражает единицу, которая зависит от массы HES.
Известные в настоящее время конъюгаты HES-лекарственное средство имеют недостаток, связанный с тем, что HES не конъюгирует сайт-специфичным образом относительно лекарственного средства. В этой связи конъюгирование приводит к получению очень гетерогенного продукта, включающего много компонентов, которые могут быть неактивными из-за деструкции трехмерной структуры на стадии конъюгирования.
Резюмируя, следует отметить, что все еще имеется потребность в более усовершенствованных полипептидах с улучшенной стабильностью и/или биологической активностью. Указанное особенно относится в эритропоэтину, в случае которого изоформы с высокой степенью присоединенных сиаловых кислот и в этой связи с более высокой активностью должны быть отделены при очистке от изоформ с низким уровнем содержания сиаловых кислот (см. EP 428267 B1). В этой связи было бы очень выгодно, если бы были доступны способы производства, которые обеспечивали бы получение высокоактивных полипептидов без потребности в тщательной очистке. К сожалению, получение пептидов в бактериях или в клетках насекомых часто затруднено, поскольку полипептиды зачастую не продуцируются в таких случаях в соответствующей складчатой, нативной конфигурации и не имеют соответствующего гликозилирования.
Следовательно, объектом настоящего изобретения является получение полипептидных производных, в особенности производных эритропоэтина, обладающих высокой биологической активностью in vivo, которые могут быть легко получены и со сниженной стоимостью. Кроме того, другим объектом настоящего изобретения является разработка способа получения полипептидных производных, который было бы легко осуществлять и который приводил бы к получению продуктов с высокой биологической активностью. Еще одним объектом настоящего изобретения является получение фармацевтической композиции, включающей полипептидные производные с высокой биологической активностью.
В соответствии с одним аспектом настоящего изобретения указанная проблема решается с помощью конъюгата гидроксиалкилкрахмал (HAS) - эриторопоэтин (EPO) (HAS-EPO), содержащего одну или несколько молекул HAS, где каждая HAS конъюгирована с EPO через
а) углеводный фрагмент или
b) тиоэфир.
Конъюгат HAS-EPO по настоящему изобретению обладает преимуществом, связанным с тем, что он демонстрирует повышенную биологическую активность в сравнении с эритропоэтином до конъюгирования. Кроме того, он демонстрирует более высокую биологическую активность, чем стандартный препарат EPO BRP. Указанное свойство связано главным образом с тем, что HAS-EPO в меньшей степени или вовсе не распознается системами удаления в печени и почках, и в этой связи указанный конъюгат циркулирует в системе кровообращения в течение длительного периода времени. Кроме того, поскольку HAS подвергается сайт-специфичному воздействию, минимизируется риск нарушения биологической активности EPO in vivo путем конъюгирования HAS с EPO.
Конъюгат HAS-EPO по настоящему изобретению включает в основном два компонента, а именно: эритропоэтин (EPO)-полипептид и гидроксиалкилкрахмал (HAS), присоединенный к нему.
EPO может быть человеческого происхождения (см., например, Inoue, Wada, Takeuchi, 1994, An improved method for the purification of human erythropoietin with high in vivo activity from the urine of anemic patients, Biol Pherm Bull. 17(2), 180-4; Miyake, Kung, Goldwasser, 1977, Purification of human erythropoietin., J Biol Chem., 252(15), 5558-64) или может происходить из другого млекопитающего в качестве источника и может быть получен путем выделения и очистки из природных источников, таких как почка человека, эмбриональная печень человека, предпочтительно почки обезьяны. Кроме того, выражение "эритропоэтин" или "EPO" относится к варианту EPO, где одна или несколько аминокислот (например, от 1 до 25, предпочтительно от 1 до 10, более предпочтительно от 1 до 5, наиболее предпочтительно от 1 до 2) заменены на другую аминокислоту и который проявляет эритропоэтическую активность (см., например, EP 640619 B1). Определение эритропоэтической активности описано в литературе (например, измерение активности in vitro приведено в Fibi et al., 1991, Blood, 77, 1203 ff; Kitamura et al., 1989, J.Cell Phys., 140, 323-334; описание метода измерения активности EPO in vivo см. в Ph.Eur. 2001, 911-917; Ph. Eur. 2000, 1316 Erythropoietini solutio concentrata, 780-785; European Pharmacopoeia (1996/2000); European Pharmacopoeia 1996, Erythropoietin concentrated solution, Pharmaeuropa., 8, 371-377; Fibi, Hermentin, Pauly, Lauffer, Zettimeissl., 1995, N- and O-glycosylation muteins of recombinant human erythropoietin secreted from BHK-21 cells, Blood, 85(5), 1229-36) (EPO и модифицированные формы EPO инъецируют самкам мышей NMRI (что эквивалентно по белку 50 нг/мышь) в дни 1, 2 и 3, на 4 день отбирают образцы крови и определяют число ретикулоцитов). Другие публикации, в которых описаны тесты измерения активности, включают: Barbone, Aparicio, Anderson, Natarajan, Ritchie, 1994, Reticulocytes measurement as a bioassay for erythropoietin, J. Pharm. Biomed, Anal., 12(4), 515-22; Bowen, Culligan, Beguin, Kendal, Villis, 1994, Estimation of effective and total erythropoiesis in myelodysplasia using serum transferrin receptors and erythropoietin concentrations, with automated reticulocyte parameters, Leukemi, 8(1), 151-5; Delorme, Lorenzini, Giffin, Martin, Jacobsen, Boone, Elliot, 1992, Role of glycosylation on the secretion and biological activity of erythropoietin, Biochemisrty, 31(41), 9871-6; Higuchi, Oh-eda, Kuboniwa, Tomonoh, Shimonaka, Ochi, 1992; Role of sugar chains in the expression of the biological activity of human erythropoietin, J. Biol. Chem., 267(11), 7703-9; Yamaguchi, Akai, Kawanishi, Ueda, Masuda, Sasaki, 1991, Effects of site-directed removal of N-glycosylation sites in human erythropoietin on its production and biological properties, J. Biol. Chem., 266(30), 20434-9; Takeuchi, Inoue, Strickland, Kubota, Wada, Shimizu, Hoshi, Kozutsumi, Takasaki, Kobata, 1989, Relationship between sugar chains structure and biological activity of recombinant human erythropoietin produced in Chinese hamster ovary cells, Prod, Natl. Acad. Sci. USA, 85(20), 7819-22; Kurtz, Eckardt, 1989, Assay methods for erythropoietin, Nephron., 51(1), 11-4 (German); Zucali, Sulkowski, 1989, Purification of human urinary erythropoietin on controlled-pore glass and silicic acid, Exp. Hematol., 13(3), 833-7; Krystal, 1983, Physical and biological characterization of erythroblast enhancing factor (EEF), a late acting erythropoietin stimulator in serum distinct from erythropoietin, Exp. Hematol., 11(1), 18-31.
Предпочтительно EPO получают рекомбинантными способами. Указанный вариант включает продукцию в эукариотических или прокариотических клетках, предпочтительно в клетках млекопитающих, насекомых, дрожжей, бактериальных клетках или в клетках любого другого типа, которые удобны для получения EPO рекомбинантными методами. Кроме того, EPO может экспрессироваться в трансгенных животных, например в жидкостях организма (таких как молоко, кровь и т.п.), в яйцах трансгенных птиц, в особенности у сельскохозяйственных птиц, предпочтительно у кур, или в трансгенных растениях.
Получение полипептидов по рекомбинантной технологии известно специалистам в данной области техники. В целом такая продукция включает трансфекцию клетки-хозяина соответствующим экспрессирующим вектором, культивирование клеток-хозяев в условиях, позволяющих осуществлять продукцию полипептида и выделение и очистку полипептида из клеток-хозяев. Подробная информация содержится в ряде публикаций (см., например, Kristal, Pankratz, Farber, Smart, 1986, Purification of human erythropoietin to homogeneity by a rapid five-step procedure, Blood, 67(1), 71-9; Quelle, Caslake, Burkert, Wojchowski, 1989, High-level expression and purification of a recombinant human erythropoietin produced using a baculovirus vector, Blood, 74(2), 652-7; EO 640619 B1 and EP 668351 B1).
В предпочтительном варианте осуществления настоящего изобретения EPO имеет аминокислотную последовательность человеческого EPO (см., EP 148605 B2).
EPO может включать одну или несколько углеводных боковых цепей (предпочтительно 1-4, предпочтительно 4), присоединяемых к EPO через N- и/или O-связанное гликозилирование, т.е. EPO гликозилируется. Обычно в случае продукции EPO в эукариотических клетках полипептид подвергается посттрансляционному гликозилированию. Следовательно, углеводные боковые цепи могут присоединяться к EPO в процессе синтеза в клетках млекопитающего, особенно человека, клетках насекомых или дрожжей. Структура и свойства гликозилированного EPO широко исследовались в данной области (см. EP 428267 B1; EP 640619 B1, Rush, Derby, Smith, Merry, Rogers, Rohde, Katta, 1995, Microgeterogeneity of erythropoietin carbohydrate structure, Anal Chem., 67(8), 1442-52; Takeuchi, Kobata, 1991, Structure and functional roles of the sugar chains of human erythropoietin, Glycobiology, 1(4), 337-46 (обзор)).
HAS может быть непосредственно конъюгирован с EPO или, альтернативно, он может быть конъюгирован через молекулу линкера. Природа линкерной молекулы зависит от способа, посредством которого HAS присоединяется к EPO. Возможные функциональные группы линкеров показаны в таблице 1 и в приведенном ниже описании. Некоторые линкеры коммерчески доступны (например, от Pierce, доступной от компании Perbio Science Deutschland GmbH, Bonn, Germany). Некоторые подходящие линкеры описаны в таблице 2. Природа линкера и его назначение подробно описаны ниже в разделе, относящемся к способу получения HES-EPO.
В соответствии с предпочтительным вариантом осуществления настоящего изобретения в аспекте конъюгата HAS-EPO указанный HAS подвергают конъюгированию с EPO через углеводный фрагмент.
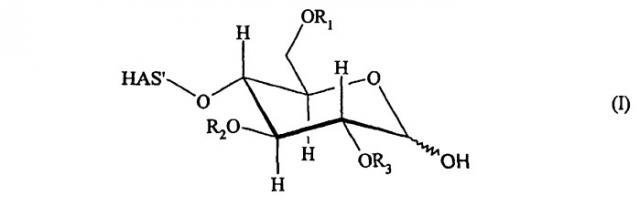
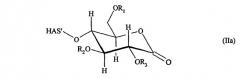
В контексте настоящего описания термин "углеводный фрагмент" относится к гидроксиальдегидам или гидроксикетонам, а также к их химическим модификациям (см. Rompp Chemielexicon, Thieme Stuttgart, Germany, 9th edition 1990, Volume 9, pages 2281-2285, и цитированная в работе литература). Кроме того, указанный термин также относится к производным природных углеводных фрагментов типа глюкозы, галактозы, маннозы, сиаловой кислоты и т.п. Указанный термин также включает химически окисленные природные углеводные фрагменты, которые имеют открытую циклическую структуру.
Углеводный фрагмент может быть присоединен непосредственно к полипептидному скелету EPO. Предпочтительно углеводный фрагмент представляет собой часть углеводной боковой цепи. В данном случае другие углеводные фрагменты могут присутствовать между углеводным фрагментом, к которому присоединяется HAS, и полипептидным скелетом EPO. Более предпочтительно углеводный фрагмент представляет собой терминальный фрагмент углеводной боковой цепи.
В предпочтительном варианте изобретения HAS подвергают конъюгированию с галактозным остатком углеводных боковых цепей, предпочтительно с терминальным галактозным остатком углеводной боковой цепи. Указанный галактозный остаток может быть открыт для конъюгирования за счет удаления терминальных сиаловых кислот с последующим окислением (см. приведенное ниже описание).
В другом более предпочтительном варианте HAS подвергают конъюгированию с остатком сиаловой кислоты в углеводных боковых цепях, предпочтительно с терминальным остатком сиаловой кислоты в углеводной боковой цепи.
Кроме того, HAS может быть подвергнут конъюгированию с EPO через тиоэфир. Как будет описано подробно ниже, атом S может происходить из SH-группы, присоединенной к EPO как в природном, так и в неприродном варианте.
В предпочтительном варианте осуществления изобретения атом S может содержаться в SH-группе, которую вводят в окисленный углеводный фрагмент HES, предпочтительно окисленный углеводный фрагмент, который представляет собой часть углеводной боковой цепи EPO (см. приведенное ниже описание).
Предпочтительно атом S в тиоэфире получают из природного цистеина или из добавленного цистеина. Более предпочтительно EPO имеет аминокислотную последовательность человеческого EPO, а природные цистеины представляют собой цистеин 29 и/или 33. В более предпочтительном варианте HAS подвергают конъюгированию с цистеином 29, а цистеин 33 замещают другой аминокислотой. Альтернативно HAS может быть конъюгирован с цистеином 33, а цистеин 29 заменяют другой аминокислотой.
В контексте настоящего описания термин "добавленные цистеины" следует понимать таким образом, что полипептиды, предпочтительно EPO, включают цистеиновый остаток, который не присутствует в полипептиде дикого типа.
В контексте данного аспекта изобретения цистеин может представлять собой дополнительную аминокислоту, добавляемую на N- или С-конце EPO.
Кроме того, добавленный цистеин может быть внесен путем замены природной аминокислоты цистеином. Подходящие способы известны в технике (см. выше). Предпочтительно в контексте данного аспекта изобретения EPO представляет собой человеческий EPO и замененный аминокислотный остаток представляет собой серин 126.
Второй компонент HAS-EPO представляет собой гидроксиалкилкрахмал (HAS).
В контексте настоящего описания термин "гидроксиалкилкрахмал" используют для указания производных крахмала, которые содержат замещение гидроксиалкильными группами. В данном контексте алкильная группа может быть замещена. Предпочтительно гидроксиалкил содержит 2-10 атомов углерода, более предпочтительно 2-4 атома углерода. Термин "гидроксиалкилкрахмал" в этой связи предпочтительно включает гидроксиэтилкрахмал, гидроксипропилкрахмал и гидроксибутилкрахмал, где предпочтительными являются гидроксиэтилкрахмал и гидроксипропилкрахмал.
Гидроксиалкильная группа(ы) HAS содержит по меньшей мере одну OH-группу.
Выражение "гидроксиалкилкрахмал" также включает производные, в которых алкильная группа представляет собой моно- или полизамещенную группу. В данном контексте предпочтительно, чтобы алкильная группа была замещена галогеном, в особенности фтором, или арильной группой, при условии, что HAS остается водорастворимым. Кроме того, терминальная гидроксигруппа гидроксиалкила может быть этерифицирована с образованием простого или сложного эфира. Дополнительно следует отметить, что алкильная группа в гидроксиалкилкрахмале может быть линейной или разветвленной.
Кроме того, вместо алкила могут также использоваться линейные или разветвленные замещенные или незамещенные алкеновые группы.
Гидроксиэтилкрахмал (HES) наиболее предпочтителен для всех вариантов осуществления настоящего изобретения.
В контексте настоящего описания гидроксиэтилкрахмал может иметь значение средней молекулярной массы (средняя масса) от 1 до 300 кДа, где средняя молекулярная масса, равная 5-100 кДа, является более предпочтительной. Гидроксиэтилкрахмал может также демонстрировать степень молярного замещения от 0,1 до 0,8 и соотношение между С2:С6-замещением в диапазоне 2-20 относительно гидроксиэтильных групп.
HAS-EPO может включать 1-12, предпочтительно 1-9, 1-6 или 1-3, наиболее предпочтительно 1-4 молекул HAS на одну молекулу EPO. Количество HAS-молекул на одну молекулу EPO может быть определено путем количественного анализа углеводного состава с использованием GC-MS после гидролиза продукта и дериватизации полученных моносахаридов (см. Chaplin and Kennedy (eds.), 1986, Carbohydrate Analysis: a practical approach, IRL Press Practical approach series (ISBN 0-947946-44-3), в особенности Chapter 1, Monosaccharides, page 1-36; Capter 2, Oligosaccharides, page 37-53, Chapter 3, Neutral Polysaccharides, page 55-96).
HAS-EPO конъюгат по настоящему изобретению может демонстрировать по существу ту же биологическую активность in vitro, что и рекомбинантный нативный EPO, поскольку его биологическая активность in vitro основана на измерении лишь аффинности по связыванию с рецептором EPO. Способы определения биологической активности in vitro известны в данной области техники (см. приведенное выше описание).
Кроме того, HAS-EPO демонстрирует бульшую активность in vivo, чем EPO, используемый в качестве исходного материала для конъюгирования (неконъюгированный EPO). Способы определения биологической активности in vivo известны в технике (см. приведенное выше описание). Кроме того, в примерах 9 и 10 даны тесты для определения активности EPO in vivo и in vitro.
Конъюгат HAS-EPO может демонстрировать активность in vivo, составляющую от 110 до 500%, предпочтительно от 300 до 400%, или от 110% до 300%, предпочтительно от 110% до 200%, более предпочтительно от 110% до 180% или от 110% до 150%, наиболее предпочтительно от 110% до 140%, если активность in vivo неконъюгированного EPO принять за 100%.
В сравнении с высокосиалилированной формой EPO в виде препарата Амген (Amgen) (см. EP 428267 B1), HAS-EPO демонстрирует активность in vivo, равную предпочтительно по меньшей мере 50%, более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 85% или по меньшей мере 95%, по меньшей мере 150%, по меньшей мере 200% или по меньшей мере 300% от активности высокосиалилированного EPO, если активность in vivo высокосиалилированного EPO принять за 100%. Наиболее предпочтительно указанная форма демонстрирует активность по меньшей мере на уровне 95% от активности in vivo высокосиалилированного EPO.
Высокая биологическая активность in vivo конъюгата HAS-EPO по настоящему изобретению в основном связана с тем фактом, что конъюгат HAS-EPO остается дольше в кровотоке, чем неконъюгированный EPO, поскольку он хуже распознается системами удаления печени и поскольку снижен почечный клиренс из-за более высокой молекулярной массы. Способы определения in vivo периода полувыведения EPO из кровотока известны в данной области техники (Sytkowski, Lunn, Davis, Feldman, Siekman, 1998, Human erythropoietin dimers with markedly enhanced in vivo activity, Proc. Natl. Acad. Sci. USA, 95(3), 1184-8).
В этой связи большим преимуществом настоящего изобретения является тот факт, что HAS-EPO представляет собой форму, которая может вводиться реже, чем препараты EPO, коммерчески доступные в настоящее время. В то время как стандартные препараты EPO должны вводиться по меньшей мере 3 дня, конъюгат HAS-EPO по настоящему изобретению предпочтительно вводится два раза в неделю или предпочтительно один раз в неделю.
Все раскрытые ниже варианты осуществления изобретения, относящиеся к способу производства HAS-EPO по настоящему изобретению, которые относятся к свойствам EPO или HAS, применимы также и к конъюгату HAS-EPO по настоящему изобретению.
Гидроксиалкилкрахмал представляет собой эфирное производное крахмала. В контексте настоящего изобретения, кроме указанных производных в виде простого эфира, могут также использоваться другие производные крахмала. Например, могут использоваться производные, которые включают этерифицированные гидроксигруппы. Такие производные могут представлять собой производные незамещенных моно- или дикарбоновых кислот, включающих 2-12 атомов углерода, или их замещенные производные. Особенно подходят для использования производные незамещенных монокарбоновых кислот, включающие 2-6 атомов углерода, в особенности уксусной кислоты. В контексте настоящего изобретения предпочтительны ацетилкрахмал, бутилкрахлмал или пропилкрахмал.
Кроме того, предпочтительны производные незамещенных дикарбоновых кислот, включающих 2-6 атомов углерода.
В случае производных дикарбоновых кислот полезно, если вторая карбоксигруппа в дикарбоновой кислоте также этерифицирована. Кроме того, в контексте настоящего изобретения также пригодны производные сложных моноалкиловых эфиров дикарбоновых кислот.
В случае замещенных моно- или дикарбоновых кислот могут быть предпочтительны те же замещающие группы, что и указанные выше для случая замещенных алкильных остатков.
Методики этерификации известны в данной области техники (см., например, Klemm D. et al., Comprehensive Cellulose Chemistry Vol. 2, 1998, Whiley-VCH, Wienheim, New York, especially chapter 4.4, Esterification of Celulose (ISBN 3-527-29489-9).
В другом аспекте настоящее изобретение относится к способу получения конъюгата гидроксиалкилкрахмала (HAS)-эритропоэтина (EPO) (HAS-EPO), включающему стадии:
а) получения EPO, способного реагировать с модифицированным HAS,
b) получение модифицированного HAS, способного взаимодействовать с EPO со стадии а), и
c) проведения реакции EPO со стадии а) с HAS со стадии b), посредством чего образуется HAS-EPO, включающий одну или несколько молекул HAS, где каждый из HAS конъюгирует с EPO через
i) углеводный фрагмент или
ii) тиоэфир.
Способ по настоящему изобретению имеет то преимущество, что образуется конъюгат HAS-EPO, который демонстрирует высокую биологическую активность. Кроме того, способ по настоящему изобретению имеет то достоинство, что может быть получено эффективное производное EPO со сниженной стоимостью, поскольку данный способ не включает дорогостоящие и длительные по времени стадии очистки, приводящие к низкому конечному выходу, то есть в данном способе нет необходимости очищать продукт от недостаточно сиалилированных EPO, которые, как известно, характеризуются низкой биологической активностью in vivo или вовсе ее отсутствием. В особенности пример 20 показывает, что получаемый в результате нескольких стадий модификации HES-EPO обладает трехкратной активностью в сравнении со стандартным препаратом BRP-EPO.
Соответственно на первой стадии способа по настоящему изобретению получают EPO, который способен взаимодействовать с модифицированным HAS.
В контексте настоящего описания термин "получение" следует интерпретировать таким образом, что после соответствующей стадии становится доступной молекула (стадии а) EPO на стадии b) HAS) с желательными свойствами.
В случае стадии а) данный термин включает выделение и очистку EPO из природных источников, а также получение в клетках-хозяевах или организмах рекомбинантными методами и, при необходимости, модификацию получаемого при этом EPO.
В том, что касается EPO, выполняющего функцию исходного материала по настоящему изобретению, к нему относятся те же требования, что и в отношении эритропоэтина, представляющего собой часть конъюгата HAS-EPO по настоящему изобретению. В данном контексте предпочтительные варианты, раскрываемые выше, применимы также к способу по настоящему изобретению.
Следовательно, в предпочтительном варианте указанный EPO имеет аминокислотную последовательность человеческого EPO.
Предпочтительно EPO получают рекомбинантным способом. Указанный способ включает получение в эукариотических или прокариотических клетках, предпочтительно в клетках млекопитающего, насекомых, дрожжей, бактерий или в клетках любого другого типа, которые удобны для получения EPO рекомбинантными методами. Кроме того, EPO может быть экспрессирован в трансгенных животных (например, в жидкостях организма типа молока, крови и т.п.), в яйцах трансгенных птиц, особенно сельскохозяйственных птиц, предпочтительно кур, или в трансгенных растениях.
Получение полипептида рекомбинантными меиодами известно в данной области техники. В целом указанный способ получения включает трансфекцию клеток-хозяев соответствующим экспрессирующим вектором, культивирование клеток-хозяев, позволяющие осуществлять продукцию полипептида, а также выделение и очистку полипептида из клеток-хозяев (Kristal, Pankratz, Farber, Smart, 1986, Purification of human erythropoietin to homogeneity by a rapid five-step procedure, Blood, 67(1), 71-9; Quelle, Caslake, Burkert, Wojchowski, 1989, High-level expression and purification of a recombinant human erythropoietin produced using a baculovirus vector, Blood, 74(2), 652-7; EP 640619 B1 и EP 668351 B1).
EPO может включать одну или несколько углеводных боковых цепей, присоединенных к EPO путем N- или O-связанного гликозилирования, т.е. EPO в данном случае подвергается гликозилированию. Обычно, когда EPO продуцируется в эукариотических клетках, полипептид подвергается посттрансляционному гликозилированию. Следовательно, углеводные боковые цепи могут быть присоединены к EPO в процессе образования в клетках млекопитающего, особенно человека, в клетках насекомых или дрожжей, которые могут представлять собой клетки трансгенного животного (см. выше), либо могут быть экстрагированы из животного или все еще находиться в организме животного.
Указанные углеводные боковые цепи могут быть химически или энзиматически модифицированы после экспрессии в соответствующих клетках, например, путем удаления или добавления одного или нескольких углеводных фрагментов (см., например, Dittmar, Conradt, Hauser, Hofer, Lindenmaier, 1989, Advanced in Protein design; Bloecker, Collins, Schmidt, and, Schomburg eds., GBF-Monographs, 12, 231-246, VCH Publishers, Wienheim, New York, Cambridge).
Другой аспект способа по настоящему изобретению относится к получению HAS-EPO, включающему одну или несколько молекул HAS, где указанный HAS конъюгируют с EPO через углеводный фрагмент (i) или через тиоэфир (ii). Следовательно, EPO, образуемый на стадии а), должен иметь свойства, позволяющие осуществлять конъюгирование через углеводный фрагмент и/или тиоэфир. В этой связи EPO после стадии а) может предпочтительно содержать
(1) по меньшей мере одну реакционноспособную группу, присоединенную непосредственно или через линкерную молекулу к сульфидным группам или углеводным фрагментам, которые способны взаимодействовать с HES или с модифицированным HES,
(2) по меньшей мере один углеводный фрагмент, с которым может быть конъюгирован модифицированный HAS, и/или
(3) одну свободную SH-группу.
В том, что касается указанного выше пункта (1), EPO на стадии а) предпочтительно получают путем конъюгирования соответствующей линкерной молекулы с SH-группой(ами) или углеводными фрагментами EPO. Пример такого модифицированного EPO приведен в примере 4, 2.1. Важно отметить, что добавление линкерной молекулы не повреждает EPO. Однако это известно специалистам в данной области техники.
В том, что касается указанного выше пункта 2, в предпочтительном варианте осуществления изобретения модифицированный HAS подвергают конъюгированию с EPO через углеводный фрагмент.
Углеводный фрагмент может быть соединен непосредственно с полипептидным скелетом EPO. Предпочтительно углеводный фрагмент представляет собой часть углеводной боковой цепи. В данном случае другие углеводный фрагменты могут присутствовать между углеводным фрагментом, к которому присоединяется HAS, и полипептидным скелетом EPO. Более предпочтительно углеводный фрагмент представляет собой терминальный фрагмент углеводной боковой цепи.
Следовательно, в предпочтительном варианте осуществления настоящего изобретения модифицированный HAS присоединяют (через линкер или нет, см. ниже) к углеводородным цепям, присоединенным к N- и/или О-сайтам гликозилирования EPO.
Однако в область настоящего изобретения включается также тот аспект, что EPO содержит другой(ие) углеводный(ые) фрагмент(ы), с которым(ими) подвергают конъюгированию модифицированный HAS. Методики присоединения углеводных фрагментов к полипептидам либо ферментного характера, либо путем генно-инженерной процедуры с последующей экспрессией в соответствующих клетках, известны специалистам в данной области (Berger, Greber, Mosbach, 1986, Galactosyltransferase-dependent sialylation of complex and endo-N-acetylglucosaminidase H-treated core N-glycans in vitro, FEBS Lett., 203(1), 64-8; Dittmar, Conradt, Hauser, Hofer, Lindenmaier, 1989, Advanced in Protein design; Bloecker, Collins, Schmidt, and, Schomburg eds., GBF-Monographs, 12, 231-246, VCH Publishers, Wienheim, New York, Cambridge).
В предпочтительном варианте осуществления способа по настоящему изобретению окисляют углеводный фрагмент с тем, чтобы он обладал способностью взаимодействовать с модифицированным HAS. Указанное окисление может быть проведено химическим или ферментативным способом.
Способы химического окисления углеводных фрагментов полипептидов известны в данной области техники и включают обработку перйодатом (Chamow et al., 1992, J. Biol. Chem., 267, 15916-15922).
При проведении химического окисления становится принципиально возможным окислить любой углеводный фрагмент, независимо от того, локализован он в концевом положении или нет. Однако при выборе мягких условий обработки (1 мМ перйодата, 0°С, тогда как жесткие условия включают: 10 мМ перйодата, 1 час при комнатной температуре) достигается возможность окислить предпочтительно терминальный углеводный фрагмент, например сиаловую кислоту или галактозу в боковой цепи углевода.
Альтернативно углеводный фрагмент может быть окислен ферментативным способом. Ферменты, применяемые для окисления отдельных углеводных фрагментов, известны в технике и включают, например, в случае галактозы, фермент галактозооксидазу.
В случае проведения окисления терминальных фрагментов галактозы возникает необходимость постепенно удалять терминальные сиаловые кислоты (частично или полностью), если EPO продуцируется в клетках, способных осуществлять реакцию присоединения сиаловых кислот к углеводным цепям, например, в клетках млекопитающих или в клетках, которые были генетически модифицированы, с целью придать им способность присоединять сиаловые кислоты к углеводным цепям. Химические или ферментативные способы удаления сиаловых кислот известны в данной области техники (Chaplin and Kennedy (eds.), 1986, Carbohydrate Analysis: a practical approach, в особенности Chapter 5 Montreuill, Glycoproteins, pages 175-177; IRL Press Practical approach series (ISBN 0-947946-44-3)).
Однако в область настоящего изобретения включается также вариант, при котором углеводный фрагмент, к которому должен быть присоединен модифицированный HAS, присоединяется к EPO в ходе стадии (а). В таком случае желательно присоединять галактозу, что может быть достигнуто с использованием галактозилтрансферазы. Такие способы известны в данной области техники (Berger, Greber, Mosbach, 1986, Galactosyltransferase-dependent sialylation of complex and endo-N-acetylglucosaminidase H-treated core N-glycans in vitro, FEBS Lett., 203(1), 64-8).
В наиболее предпочтительном варианте осуществления настоящего изобретения EPO на стадии (а) модифицируют путем окисления по меньшей мере одной терминальной сахаридной единицы, предпочтительно галактозы, в одной или большем числе боковых углеводных цепей EPO, предпочтительно после частичного или полного (ферментативного и/или химического) удаления терминальной сиаловой кислоты, при необходимости (см. приведенное выше описание).
Соответственно и предпочтительно модифицированный HAS подвергают конъюгированию с окисленной терминальной сахаридной единицей углеводной цепи, предпочтительно с галактозой.
Кроме того, модифицированный HAS может быть предпочтительно конъюгирован с терминальной сиаловой кислотой, которую предпочтительно окисляют на стадии (а) по способу настоящего изобретения.
В другим предпочтительном варианте осуществления настоящего изобретения (см. пункт (3) выше) EPO включает по меньшей мере одну SH-группу.
В соответствии с предпочтительным вариантом указанная SH-группа может быть присоединена к предпочтительно окисленному углеводному фрагменту, например, путем использования производного гидроксиламина, например, гидрохлорида 2-(аминоокси)этилмеркаптана (Bauer L. et al., 1965, J. Org. Chem., 30, 949) или с использованием гидразидного производного, например гидразида тиогликолевой кислоты (Whitesides et al., 1977, J. Org. Chem., 42, 332). Способ