Полипептид, обладающий противовирусной, антипролиферативной и/или иммуномодулирующей активностью, выделенный полинуклеотид, кодирующий полипептид и их применение
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Предложен новый полинуклеотид, полученный из нуклеотидной последовательности гена IFNα-17, содержащий единичный нуклеотидный полиморфизм SNP g771c. Также предложен новый полипептид, происходящий от природного белка IFNα-17 дикого типа, содержащий SNP G45R. Изобретение может быть использовано для получения эффективного терапевтического средства, обладающего противовирусной, антипролиферативной и/или иммуномодулирующей активностью. 7 н. и 6 з.п. ф-лы, 5 табл., 5 ил.
Реферат
Связанные заявки
Настоящее изобретение имеет приоритет по французской заявке 0105516, поданной 24 апреля 2001 и озаглавленной "Новые полинуклеотиды и полипептиды гена IFNα-17".
Предшествующий уровень техники
Область, к которой относится изобретение
Настоящее изобретение относится к новым полинуклеотидам, происходящим от нуклеотидной последовательности гена IFNα-17, содержащей новые SNP, и к новым полипептидам, происходящим от природного белка дикого типа IFNα-17, содержащего мутации, вызванные указанными SNP, а также к их терапевтическому применению.
Предшествующий уровень техники
Ген интерферона альфа 17, называемого далее IFNα-17, описан в следующих публикациях:
- Olopade et al.: "Mapping of the shortest region of overlap of deletions of the short arm of chromosome 9 associated with human neoplasia"; Genomics; 14: 437-443; 1992.
- Lawn R.M. et al.: "DNA sequence of two closely linked human leukocyte interferon genes"; Science 212 (4499), 1159-1162 (1981).
Нуклеотидная последовательность этого гена имеется в базе данных Genbank под регистрационным номером V00532.
IFNα известны своим антипролиферативным действием на клетки и своим участием в противовирусных и противопаразитарных ответах.
Также известно, что IFNα ингибируют экспрессию некоторых других цитокинов на уровне гемопоэтических стволовых клеток, а также ингибируют клеточную пролиферацию некоторых опухолей.
Кроме того, известно, что IFNα подавляют экспрессию рецепторов EGF в карциномах почек, ингибируют экспрессию некоторых митохондриальных генов, ингибируют пролиферацию фибробластов, моноцитов и В-лимфоцитов, особенно in vitro, и блокируют синтез антител В-лимфоцитами.
Также известно, что IFNα индуцируют экспрессию опухолеспецифических антигенов на поверхности опухолевых клеток, а также индуцируют гены, находящиеся под контролем промоторных областей типа ISRE (элемент ответа, стимулируемого интерфероном), путем воздействия на специфический фактор транскрипции указанного ISRE.
Известно, что IFNα вызывают различные расстройства и/или болезни у человека, такие как различные виды рака, например карциномы, меланомы, лимфомы, лейкозы и рак печени, шеи, головы и почек; сердечно-сосудистые заболевания; болезни обмена веществ, не связанные с иммунной системой, например, такие как ожирение; инфекционные заболевания, такие как гепатит В и С и СПИД; пневмонии, язвенный колит; заболевания центральной нервной системы, например болезнь Альцгеймера, шизофрения и депрессия; отторжение трансплантата ткани или органов; заживление ран; анемия у пациентов, подвергнутых диализу; аллергии; астма; рассеянный склероз; остеопороз; псориаз; ревматоидный артрит; болезнь Крона, аутоиммунные заболевания и расстройства; расстройства желудочно-кишечного тракта или даже расстройства, связанные с лечением химиотерапией.
IFNα используются, в частности, для лечения некоторых видов лейкоза, метастазирующих карцином почек, а также опухолей, вызываемых иммунодефицитом, таких как саркома Капоши в случае СПИДа. IFNα является также эффективным против других типов опухолей и против некоторых вирусных инфекций. IFNα также одобрен FDA (Управлением по контролю за качеством пищевых продуктов, медикаментов и косметических средств) как средство для лечения остроконечных бородавок или венерических болезней.
Однако IFNα, а в частности IFNα-17, при их использовании в фармацевтических композициях, дают множество побочных эффектов, таких как реакции острой гиперчувствительности (крапивница, бронхоспазм, анафилактический шок и т.п.), сердечные аритмии, пониженное кровяное давление, эпилептические припадки, нарушение функции щитовидной железы, синдромы, подобные гриппу (повышенная температура, потливость, миалгии) и т.п.
Кроме того, у пациентов, проходящих лечение интерфероном IFNα, могут вырабатываться антитела, нейтрализующие эти молекулы, в результате чего его эффективность снижается.
Авторами настоящего изобретения были обнаружены новые полипептидные и новые полинуклеотидные аналоги гена IFNα-17, имеющего функции, отличающиеся от природного белка IFNα-17 дикого типа.
Эти новые полипептиды и полинуклеотиды могут быть, в частности, использованы для лечения или профилактики вышеупомянутых расстройств или заболеваний, и при этом они не обладают всеми или частью из тех побочных эффектов, которые обычно связаны с их применением.
Краткое описание изобретения
Первым объектом настоящего изобретения являются новые полинуклеотиды, которые отличаются от нуклеотидной последовательности исходного гена IFNα-17 дикого типа тем, что они содержат один или несколько SNP (полиморфизм по одному нуклеотиду).
Нуклеотидная последовательность SEQ ID NO:1 исходного человеческого гена IFNα-17 дикого типа состоит из 1873 нуклеотидов и содержит кодирующую последовательность из 570 нуклеотидов, начиная с нуклеотида 639 (старт-кодон) и до нуклеотида 1208 (стоп-кодон).
Заявителем были идентифицированы 2 SNP в нуклеотидной последовательности исходного гена IFNα-17 дикого типа.
Такими SNP являются: g771с, 808Ins(a).
Следует отметить, что в описании настоящего изобретения нумерация, соответствующая положению SNP, определенного выше, относится к нумерации нуклеотидной последовательности SEQ ID NO:1.
Буквы а, t, c и g соответствуют азотистым основаниям аденину, тимину, цитозину и гуанину соответственно.
Первая буква соответствует нуклеотиду дикого типа, а последняя буква соответствует мутированному нуклеотиду.
Так, например, SNP g771с соответствует мутации с заменой гуанина (g) в положении 771 нуклеотидной последовательности SEQ ID NO:1 исходного гена IFNα-17 дикого типа на цитозин (с).
SNP 808Ins(a) соответствует инсерции аденина (а) в положении 808 нуклеотидной последовательности SEQ ID NO:1 исходного гена IFNα-17 дикого типа.
Эти SNP были идентифицированы заявителем в соответствии со способом определения, описанным заявителем в патентной заявке FR 00 22894, озаглавленной "Process for the determination of one or several functional polymorphism(s) in the nucleotide sequence of a preselected functional candidate gene and its applications" и поданной 6 декабря 2000, описание которой вводится в настоящее описание посредством ссылки.
Способ, описанный в этой патентной заявке, позволяет идентифицировать один (или несколько) уже имеющихся SNP, по крайней мере, у одного индивидуума, произвольно выбранного из данной популяции.
В соответствии с объемом настоящего изобретения фрагмент нуклеотидной последовательности гена IFNα-17, включающий, например, кодирующую последовательность, выделяли у различных индивидуумов, произвольно выбранных из данной популяции.
Затем, после анализа, проведенного с помощью ДВЭЖХ ("денатурирующей высокоэффективной жидкостной хроматографии"), осуществляли секвенирование этих фрагментов на некоторых из этих образцов, имеющих гетеродуплексный профиль (т.е. профиль, отличающийся от профиля последовательности исходного гена IFNα-17 дикого типа).
Затем фрагмент, секвенированный этим способом, сравнивали с нуклеотидной последовательностью фрагмента исходного гена IFNα-17 дикого типа и SNP, идентифицированными в соответствии с настоящим изобретением.
Таким образом, указанные SNP являются природными, и каждый из них присутствует у некоторых индивидуумов населения всего мира.
Исходный ген IFNα-17 дикого типа кодирует незрелый белок из 189 аминокислот, соответствующий аминокислотной последовательности SEQ ID NO:2, которая может быть превращена в зрелый белок из 166 аминокислот путем отщепления сигнального пептида, включающего первые 23 аминокислоты.
Кодирующий SNP настоящего изобретения, а именно g771с и 808Ins(a), приводит к модификациям на уровне аминокислотной последовательности белка, кодируемого нуклеотидной последовательностью гена IFNα-17. Такими модификациями являются:
- SNP g771с вызывает мутацию аминокислоты глицина (G) в положении 45 в незрелом белке гена IFNα-17, соответствующем аминокислотной последовательности SEQ ID NO:2, с заменой на аргинин (R) и в положении 22 зрелого белка. В описании настоящего изобретения мутации, кодируемые SNP, обозначаются G22R и G45R, независимо от того, присутствуют ли они в зрелом белке или в незрелом белке;
- SNP 808Ins(a) вызывает мутацию аминокислоты гистидина (Н) в положении 57 в незрелом белке гена IFNα-17, соответствующем аминокислотной последовательности SEQ ID NO:2, с заменой на глутамин (Q) и в положении 34 зрелого белка. Кроме того, инсерция аденина в положение 808 нуклеотидной последовательности приводит к сдвигу рамки считывания при трансляции белка, в результате чего стоп-кодон присутствует в положении 58 аминокислотной последовательности. Таким образом, SNP 808Ins(a) приводит к остановке трансляции сразу после глутамина 57. Как следствие, полученный незрелый белок укорачивается и состоит только из 57 аминокислот. Такой полиморфизм также называется "Н57Q-рамка 57". В описании настоящего изобретения такой полиморфизм, то есть мутацию, кодируемую указанным SNP, обозначают "Н34Q-рамка 34" и "Н57Q-рамка 57", независимо от того, присутствует ли она в зрелом белке или в незрелом белке.
Аминокислотная последовательность SEQ ID NO:3 соответствует мутированному незрелому белку ("Н57Q-рамка 57"), кодируемому нуклеотидной последовательностью SEQ ID NO:1, содержащей SNP 808Ins(a).
Каждый из SNP настоящего изобретения приводит к модификациям пространственной конформации полипептидов настоящего изобретения по сравнению с полипептидом, кодируемым нуклеотидной последовательностью исходного гена IFNα-17 дикого типа.
Эти модификации могут наблюдаться при компьютерном молекулярном моделировании, осуществляемом методами, хорошо известными специалистам, с использованием, например, программ по моделированию de novo (например, SEQFOLD/MSI), гомологии (например, MODELER/MSI), минимизации силового поля (например, DISCOVER, DELPHI/MSI) и/или молекулярной динамики (например, CFF/MSI).
Один из примеров таких моделей приводится ниже в описании экспериментальной части.
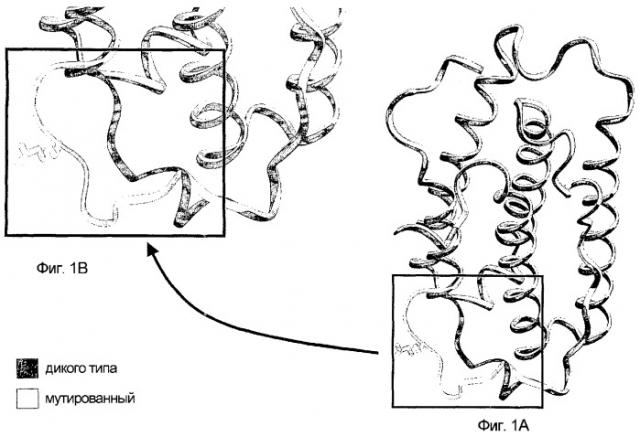
Компьютерное молекулярное моделирование показало, что мутация G22R в мутированном зрелом белке вызывает модификацию и замену в петле АВ возле положения 22, что приводит к элиминации водородных связей.
На фигурах 1А и 1В показано, что петля АВ не является уложенной и выступающей петлей.
На исходном IFNα-17 дикого типа остаток G22 находится очень близко к остатку R144. Известно, что этот остаток R144 участвует в связывании интерферона α-2 (IFNα-2) с его рецептором. Структуры IFNα-2 и IFNα-17 имеют большое сходство, и, по всей вероятности, остаток R144 в IFNα-17 участвует в связывании с его рецептором.
Таким образом, G22R-мутированный белок имеет трехмерную конформацию, отличающуюся от конформации природного белка IFNα-17 дикого типа.
Компьютерное молекулярное моделирование также позволяет предсказать, что присутствие аминокислоты аргинина в положении 22 приводит к значительному изменению структуры и функции природного белка дикого типа IFNα-17, а именно на уровне связывания IFNα-17 с его рецептором.
Генотипирование полинуклеотидов настоящего изобретения может быть осуществлено так, чтобы можно было определить частоту встречаемости аллелей этих полинуклеотидов в данной популяции.
Определение функциональных свойств полипептидов настоящего изобретения может быть аналогичным образом осуществлено с помощью теста на их биологическую активность.
Для этого можно измерить, например, трансдукцию сигнала, созревание дендритных клеток, высвобождение цитокинов Т-лимфоцитами, высвобождение цитокинов моноцитами, in vitro или in vivo антивирусную активность полипептидов настоящего изобретения, клеточную антипролиферативную активность полипептидов настоящего изобретения по отношению к клеточной линии Дауди Беркитта, клеточную антипролиферативную активность полипептидов настоящего изобретения по отношению к клеточной линии TF-1 и провести сравнение с IFNα-17 дикого типа или с IFNα-2 дикого типа, выбранного в качестве репрезентативного коммерческого продукта Intron А.
Настоящее изобретение также относится к применению полинуклеотидов и полипептидов настоящего изобретения, а также терапевтических молекул, полученных и/или идентифицированных на основании из этих полинуклеотидов и полипептидов, а в частности для профилактики и лечения некоторых расстройств и/или заболеваний человека.
Краткое описание графического материала
На фигуре 1А представлена модель кодируемого белка настоящего изобретения, включающего SNP G45R, и белка IFNα-17 дикого типа. На фигуре 1В, в более крупном масштабе, представлена модель нижней части каждого из белков, представленных на фигуре 1А.
На фигурах 1А и 1В черные "ленты" представляют структуру белка IFNα-17 дикого типа, а белые "ленты" представляют структуры G22R-мутированного белка IFNα-17.
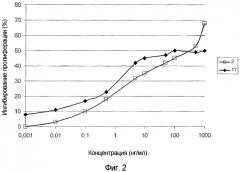
На фигуре 2 представлены результаты теста для оценки антипролиферативного действия G45R-мутированного IFNα-17 на клеточную линию TF-1. На этой фигуре по оси абсцисс отложена концентрация IFNα (нг/мл), а по оси ординат отложена степень ингибирования пролиферации клеток (%). Антипролиферативное действие G45R-мутированного IFNα-17 (черные ромбы) сравнивали с антипролиферативным действием IFNα-2 дикого типа (белые квадраты).
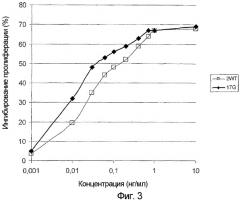
На фигуре 3 представлены результаты теста для оценки антипролиферативного действия G45R-мутированного IFNα-17 на клеточную линию Дауди Беркитта. На этой фигуре по оси абсцисс отложена концентрация IFNα (нг/мл), а по оси ординат отложена степень ингибирования пролиферации клеток (%). Антипролиферативное действие G45R-мутированного IFNα-17 (черные ромбы) сравнивали с антипролиферативным действием IFNα-2 дикого типа (белые квадраты).
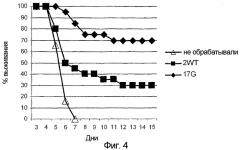
На фигуре 4 представлены оценки выживаемости мышей, предварительно инфицированных вирусом VSV и обработанных G45R-мутированным белком IFNα-17, по сравнению с мышами, обработанными IFNα-2 дикого типа, или по сравнению с необработанными мышами. На этой фигуре по оси абсцисс отложено время выживания (дни), а по оси ординат отложен относительный уровень выживания VSV-инфицированных мышей. Черные ромбы относятся к данным, полученным для VSV-инфицированных мышей, обработанных G45R-мутированным IFNα-17, черные квадраты относятся к данным, полученным для VSV-инфицированных мышей, обработанных IFNα-2 дикого типа, а незаштрихованные треугольники относятся к данным, полученным для необработанных VSV-инфицированных мышей.
Подробное описание изобретения
Определения
Выражение "нуклеотидная последовательность исходного гена дикого типа" следует понимать как "нуклеотидная последовательность SEQ ID NO:1 человеческого гена IFNα-17".
Эта последовательность имеется в Genbank под регистрационным номером V00532 и описана в работах:
Olopade et al.: "Mapping of the shortest region of overlap of deletions of the short arm of chromosome 9 associated with human neoplasia"; Genomics; 14: 437-443; 1992.
Lawn R. M. et al.: "DNA sequence of two closely linked human leukocyte interferon genes"; Science 212 (4499), 1159-1162 (1981).
Термины "природный белок IFNα-17 дикого типа" или белок IFNα-17 дикого типа" означают зрелый белок, кодируемый нуклеотидной последовательностью исходного гена IFNα-17 дикого типа. Природный незрелый белок IFNα-17 дикого типа соответствует пептидной последовательности, представленной в SEQ ID NO:2.
Термин "полинуклеотид" означает полирибонуклеотид или полидезоксирибонуклеотид, который может представлять собой модифицированную или немодифицированную ДНК или РНК.
Термин "полинуклеотид" означает, например, одноцепочечную или двухцепочечную ДНК; ДНК, состоящую из смеси одной или нескольких одноцепочечных областей или одной или нескольких двухцепочечных областей; одноцепочечную или двухцепочечную РНК и РНК, состоящую из смеси одной или нескольких одноцепочечных областей и одной или нескольких двухцепочечных областей. Термин "полинуклеотид" может также означать РНК и/или ДНК, включающую одну или несколько трехцепочечных областей. Термин "полинуклеотид" может также означать ДНК и РНК, содержащие одно или несколько оснований, модифицированных так, чтобы они имели скелет, модифицированный в целях его стабилизации или в других целях. Термин "модифицированное основание" означает, например, необычные основания, такие как инозин.
Термин "полипептид" означает пептид, олигопептид, олигомер или белок, содержащий, по крайней мере, две аминокислоты, присоединенные друг к другу нормальной или модифицированной пептидной связью, такой как, например, в случаях изостерических пептидов.
Полипептид может состоять из аминокислот, не входящих в 20 аминокислот, определенных генетическим кодом. Полипептид может также состоять из аминокислот, модифицированных в ходе природных процессов, таких как процессы посттрансляционного созревания, или в ходе химических процессов, хорошо известных специалистам. Такие модификации подробно описаны в литературе. Эти модификации могут наблюдаться в любой части полипептида: в пептидном скелете, в аминокислотной цепи или даже у карбокси- или амино-концов.
Полипептид может быть сделан разветвленным после обработки убихитином, или он может быть циклическим с ветвлением или без ветвления. Такой тип модификации может быть результатом природного или искусственного посттрансляционного процессов, хорошо известных специалистам.
Так, например, в понятие "полипептидные модификации" входят ацетилирование, ацилирование, ADP-рибозилирование, амидирование, ковалентное связывание с флавином, ковалентное связывание с гемом, ковалентное связывание с нуклеотидом или с нуклеотидным производным, ковалентное связывание с липидом или с липидным производным, ковалентное связывание с фосфатидилинозитом, ковалентное или нековалентное перекрестное связывание, циклизация, образование дисульфидных связей, деметилирование, образование цистеина, образование пироглутамата, формилирование, гамма-карбоксилирование, гликозилирование, включая введение ПЭГ, образование GPI-якоря, гидроксилирование, иодирование, метилирование, миристоилирование, окисление, протеолитические процессы, фосфорилирование, пренилирование, рацемизация, сенелоилирование, сульфатирование, присоединение аминокислот, таких как аригинин, или присоединение убихитина. Такие модификации подробно описаны в литературе: PROTEINS-STRUCTURE AND MOLECULAR PROPERTIES, 2nd Ed., T. E. Creighton, New York, 1993, POST-TRANSLATIONAL COVALENT MODIFICATION OF PROTEINS, В. С. Johnson, Ed., Academic Press, New York, 1983, Seifter et al. "Analysis for protein modifications and nonprotein cofactors", Meth. Enzymol. (1990) 182: 626-646, and Rattan et al. "Protein Synthesis: Post-translational Modifications and Aging", Ann NY Acad Sci (1992) 663: 48-62.
Термины "выделенный полинуклеотид" или "выделенный полипептид" означают соответственно полинуклеотид или полипептид, такой как полинуклеотид или полипептид, определенный ранее и выделенный из организма человека или продуцированный каким-либо другим техническим способом.
Термин "идентичность" означает степень идентичности нуклеотидной или полипептидной последовательностей.
Термин "идентичность" хорошо известен специалистам и хорошо описан в литературе. COMPUTATIONAL MOLECULAR BIOLOGY, Lesk, A.M., Ed., Oxford University Press, New York, 1998; BIOCOMPUTING INFORMATICS AND GENOME PROJECT, Smith, D.W., Ed., Academic Press, New York, 1993; COMPUTER ANALYSIS OF SEQUENCE DATA, PART I, Griffin, A.M. and Griffin H.G., Ed, Humana Press, New Jersey, 1994; and SEQUENCE ANALYSIS IN MOLECULAR BIOLOGY, von Heinje, G., Academic Press, 1987.
Методы, широко используемые для определения идентичности и сходства между двумя последовательностями, также хорошо описаны в литературе. См. GUIDE TO HUGE COMPUTER, Martin J. Bishop, Ed, Academic Press, San Diego, 1994 и Carillo H. & Lipton D., Siam J. Applied Math (1988) 48:1073.
Полинуклеотид, который, например, на 95% идентичен нуклеотидной последовательности SEQ ID NO:1, представляет собой полинуклеотид, содержащий максимум 5 точечных мутаций на 100 нуклеотидов, по сравнению с указанной последовательностью.
Такими точечными мутациями могут быть одна (или несколько) замен, добавлений и/или делеций в одном (или нескольких) нуклеотиде.
Аналогичным образом, полипептид, который, например, на 95% идентичен аминокислотной последовательности SEQ ID NO:2, представляет собой полипептид, содержащий максимум 5 точечных мутаций на 100 аминокислот, по сравнению с указанной последовательностью.
Такими точечными мутациями могут быть одна (или несколько) замен, добавлений и/или делеций в одной (или нескольких) аминокислоте.
Полинуклеотиды и полипептиды настоящего изобретения, которые не являются полностью идентичными соответственно:
- нуклеотидной последовательности SEQ ID NO:1, содержащей, по крайней мере, одну из следующих SNP: g771с и 808Ins(a),
- аминокислотной последовательности SEQ ID NO:2, содержащей SNP G45R,
- аминокислотной последовательности SEQ ID NO:3, содержащей SNP G45R,
рассматриваются как варианты этих последовательностей.
Обычно полинуклеотид настоящего изобретения обладает биологической активностью, аналогичной или почти аналогичной активности нуклеотидной последовательности SEQ ID NO:1, содержащей, по крайней мере, одну из SNP: g771с и 808Ins(a).
Аналогичным образом, полипептид настоящего изобретения обычно обладает биологической активностью, аналогичной или почти аналогичной активности:
- аминокислотной последовательности SEQ ID NO:2, содержащей SNP G45R, и/или
- аминокислотной последовательности SEQ ID NO:3, возможно, содержащей SNP G45R.
Вариант настоящего изобретения может быть получен, например, путем сайт-направленного мутагенеза или прямого синтеза.
Термин "SNP" означает любое природное изменение в основании нуклеотидной последовательности. При этом SNP на нуклеотидной последовательности может быть кодирующим, молчащим и некодирующим.
"Кодирующий SNP" представляет собой полиморфизм, содержащийся в кодирующей последовательности нуклеотидной последовательности, который влечет за собой аминокислотную модификацию в последовательности аминокислот, кодируемых указанной нуклеотидной последовательностью. В этом случае, в более широком смысле, термин "SNP" также означает мутацию в аминокислотной последовательности.
"Молчащий SNP" представляет собой полиморфизм, содержащийся в кодирующей последовательности нуклеотидной последовательности, который не влечет за собой аминокислотную модификацию в последовательности аминокислот, кодируемых указанной нуклеотидной последовательностью.
"Некодирующий" SNP представляет собой полиморфизм, содержащийся в некодирующей последовательности нуклеотидной последовательности. Этот полиморфизм может, в частности, присутствовать в интроне, в области сплайсинга, в промоторе транскрипции или в энхансерной последовательности.
Термин "функциональный SNP" означает SNP, определенный выше, который присутствует в нуклеотидной последовательности или в аминокислотной последовательности, обладающей функциональностью.
Термин "функциональность" означает биологическую активность полипептида или полинуклеотида.
Функциональность полипептида или полинуклеотида настоящего изобретения может заключаться в сохранении, усилении, снижении или подавлении биологической активности полипептида, кодируемого нуклеотидной последовательностью исходного гена дикого типа или последовательностью указанного полинуклеотида.
Функциональность полипептида или полинуклеотида настоящего изобретения может также заключаться в изменении природы биологической активности полипептида, кодируемого нуклеотидной последовательностью исходного гена дикого типа или последовательностью указанного полинуклеотида.
Биологическая активность может быть, в частности, ассоциирована с аффинностью или с отсутствием аффинности полипептида настоящего изобретения по отношению к рецептору.
Полинуклеотид
Первым объектом настоящего изобретения является выделенный полинуклеотид, включающий:
а) нуклеотидную последовательность, которая, по крайней мере, на 90% идентична, предпочтительно, по крайней мере, на 95% идентична, а более предпочтительно, по крайней мере, на 99% идентична последовательности SEQ ID NO:1 или ее кодирующей последовательности (от нуклеотида 639 до нуклеотида 1208), причем указанная нуклеотидная последовательность включает, по крайней мере, один из следующих кодирующих SNP: g771с и 808Ins(a), или
b) нуклеотидную последовательность, комплементарную нуклеотидной последовательности (а).
В соответствии с настоящим изобретением нуклеотидная последовательность (а) может содержать SNP g771с или 808Ins(a), либо SNP g771с и 808Ins(a).
Следует отметить, что в контексте настоящего изобретения данная нумерация совпадает с положениями SNP в нуклеотидной последовательности SEQ ID NO:1.
Настоящее изобретение также относится к выделенному полинуклеотиду, содержащему:
а) нуклеотидную последовательность SEQ ID NO:1 или ее кодирующую последовательность, причем каждая из этих последовательностей содержит, по крайней мере, один из следующих кодирующих SNP: g771с и 808Ins(a) или
b) нуклеотидную последовательность, комплементарную нуклеотидной последовательности (а).
Полинуклеотид настоящего изобретения, предпочтительно, состоит из последовательности SEQ ID NO:1 или ее кодирующей последовательности, причем каждая из этих последовательностей включает, по крайней мере, один из следующих кодирующих SNP: g771с и 808Ins(a).
В соответствии с настоящим изобретением полинуклеотид, определенный выше, включает один кодирующий SNP, выбранный из группы, состоящей из g771с и 808Ins(a).
Настоящее изобретение также относится к выделенному полинуклеотиду, состоящему из части:
а) нуклеотидной последовательности SEQ ID NO:1 или ее кодирующей последовательности, где каждая из этих последовательностей включает, по крайней мере, один из следующих SNP: g771с и 808Ins(a), или
b) нуклеотидной последовательности, комплементарной нуклеотидной последовательности (а),
при этом указанный выделенный полинуклеотид состоит, по крайней мере, из 10 нуклеотидов.
Предпочтительно выделенный полинуклеотид, определенный выше, состоит из 10-40 нуклеотидов.
Настоящее изобретение также относится к выделенному полинуклеотиду, кодирующему полипептид, включающий:
а) аминокислотную последовательность SEQ ID NO:2 или
b) аминокислотную последовательность, содержащую аминокислоты, расположенные между положениями 24 и 189 аминокислотной последовательности SEQ ID NO:2,
где каждая из аминокислотных последовательностей (а) и (b) содержит следующий кодирующий SNP: G45R.
Следует отметить, что в контексте настоящего изобретения данная нумерация совпадает с положением SNP G45R в аминокислотной последовательности SEQ ID NO:2.
Еще одним объектом настоящего изобретения является выделенный полинуклеотид, кодирующий полипептид, включающий:
а) аминокислотную последовательность SEQ ID NO:3 или
b) аминокислотную последовательность, содержащую аминокислоты, расположенные между положениями 24 и 57 аминокислотной последовательности SEQ ID NO:3.
Каждая из аминокислотных последовательностей а) и b) определенного выше полипептида может также содержать SNP G45R.
В соответствии с предпочтительным объектом настоящего изобретения определенный выше полипептид содержит один кодирующий SNP, такой как SNP, определенный выше.
Более предпочтительно выделенный полинуклеотид настоящего изобретения кодирует полипептид, содержащий всю аминокислотную последовательность SEQ ID NO:2 или ее часть и имеющий кодирующий SNP G45R.
Более предпочтительно выделенный полинуклеотид настоящего изобретения кодирует полипептид, содержащий всю аминокислотную последовательность SEQ ID NO:3 или ее часть и, возможно, также имеющий кодирующий SNP G45R.
Полинуклеотид настоящего изобретения предпочтительно состоит из ДНК- или РНК-молекулы.
Полинуклеотид настоящего изобретения может быть получен стандартными методами синтеза ДНК или РНК.
Полинуклеотид настоящего изобретения, содержащий SNP g771с, может быть также получен с помощью сайт-направленного мутагенеза из этой нуклеотидной последовательности гена IFNα-17 путем модификации нуклеотидной последовательности дикого типа посредством замены гуанина (g) на цитозин (с) в положении 771 нуклеотидной последовательности SEQ ID NO:1.
Полинуклеотид настоящего изобретения, содержащий SNP 808Ins(a), может быть также получен с помощью сайт-направленного мутагенеза из нуклеотидной последовательности гена IFNα-17 путем добавления аденина (а) в положение 808 нуклеотидной последовательности SEQ ID NO:1.
Сайт-направленный мутагенез, который может быть осуществлен таким способом, хорошо известен специалистам. В этой связи может быть упомянута публикация T.A. Kunkel, 1985, "Proc.Natl. Acad. Sci., USA", 82:488.
Выделенный полинуклеотид может также включать, например, нуклеотидные последовательности, кодирующие аминокислотные последовательности пре-, про- или пре-про-белка или маркерные аминокислотные последовательности, такие как гекса-гистидиновый пептид.
Полинуклеотид настоящего изобретения может быть также ассоциирован с нуклеотидными последовательностями, кодирующими другие белки или фрагменты белка, в целях получения гибридных белков или других продуктов для очистки.
Полинуклеотид настоящего изобретения может также включать нуклеотидные последовательности, такие как 5'- и/или 3'-некодирующие последовательности, например такие как транскрибируемые или нетранскрибируемые последовательности, транслируемые или нетранслируемые последовательности, последовательности сигнала сплайсинга, последовательности полиаденилирования, последовательности, связывающиеся с рибосомой, или даже последовательности, которые стабилизируют мРНК.
Нуклеотидная последовательность, комплементарная нуклеотидной или полинуклеотидной последовательности, означает, что она может гибридизоваться с этой нуклеотидной последовательностью в жестких условиях.
Термины "жесткие условия гибридизации" означают, в основном, но необязательно, химические условия, позволяющие осуществляться гибридизации, в случае, если указанные нуклеотидные последовательности имеют идентичность, по крайней мере, 80%, предпочтительно превышающую или равную 90%, еще более предпочтительно превышающую или равную 95%, а наиболее предпочтительно превышающую или равную 97%.
Жесткие условия могут быть получены методами, хорошо известными специалистам, например, путем инкубирования полинуклеотидов при 42°С в растворе, содержащем 50% формамида, 5 х SSC (150 мМ NaCl, 15 мМ тринатрийцитрата), 50 мМ фосфата натрия (рН=7,6), 5 х раствор Денхардта, 10% сульфата декстрана и 20 мкг денатурированной ДНК спермы лосося, с последующей промывкой фильтров в 0,1 х SSC при 65°С.
В соответствии с объемом настоящего изобретения в случае, если жесткие условия позволяют осуществляться гибридизации нуклеотидных последовательностей, имеющих идентичность, равную 100%, то считается, что эта нуклеотидная последовательность является строго комплементарной нуклеотидной последовательности, описанной в (а).
Следует отметить, что в контексте настоящего изобретения нуклеотидная последовательность, комплементарная какой-либо нуклеотидной последовательности, содержит, по крайней мере, один антисмысловой SNP настоящего изобретения.
Так, например, если данная нуклеотидная последовательность содержит SNP g771с, то ее комплементарная нуклеотидная последовательность содержит нуклеотид g в эквивалентном положении 771.
Идентификация, гибридизация и/или амплификация полинуклеотида, содержащего SNP
Настоящее изобретение также относится к использованию всего или части:
а) полинуклеотида, который на 80-100% (предпочтительно, по крайней мере, на 90%, более предпочтительно на 95%, а особенно предпочтительно на 100%) идентичен нуклеотидной последовательности SEQ ID NO:1, и/или
b) полинуклеотида настоящего изобретения, содержащего, по крайней мере, один SNP,
в целях идентификации, гибридизации и/или амплификации всего или части полинуклеотида, который на 80-100% (предпочтительно, по крайней мере, на 90%, более предпочтительно на 95%, а особенно предпочтительно на 100%) идентичен нуклеотидной последовательности SEQ ID NO:1, или, если необходимо, ее кодирующей последовательности (от нуклеотида 639 до нуклеотида 1208), где каждая из этих последовательностей включает, по крайней мере, один из следующих SNP: g771с, 808Ins(a).
Генотипирование и частоты встречаемости SNP
Настоящее изобретение также относится к использованию всего или части:
а) полинуклеотида, который на 80-100% (предпочтительно, по крайней мере, на 90%, более предпочтительно на 95%, а особенно предпочтительно на 100%) идентичен нуклеотидной последовательности SEQ ID NO:1, и/или
b) полинуклеотида настоящего изобретения, содержащего, по крайней мере, один SNP,
для генотипирования всего или части полинуклеотида, являющегося на 80-100% (предпочтительно, по крайней мере, на 90%, более предпочтительно на 95%, а особенно предпочтительно на 100%) идентичным нуклеотидной последовательности SEQ ID NO:1, или, если необходимо, ее кодирующей последовательности (от нуклеотида 639 до нуклеотида 1208), где каждая из этих последовательностей включает, по крайней мере, один из следующих SNP: g771с, 808Ins(a).
В соответствии с настоящим изобретением генотипирование может быть осуществлено у индивидуума или у популяции индивидуумов.
В контексте настоящего изобретения понятие "генотипирование" означает процесс генотипирования у одного индивидуума или у популяции индивидуумов. Генотип состоит из аллелей, присутствующих в одном или в более специфических локусах.
Термин "популяция индивидуумов" означает группу индивидуумов, выбранных произвольным или непроизвольным образом. Такими индивидуумами могут быть человек, животное, микроорганизмы или растения.
Обычно группа индивидуумов включает, по крайней мере, 10 индивидуумов, а предпочтительно от 100 до 300 индивидуумов. Эти индивидуумы могут быть выбраны по их этническим принадлежности или по их фенотипу, а в частности могут быть выбраны такие индивидуумы, которые страдают такими расстройствами и/или заболеваниями, как карциномы, меланомы, лимфомы, лейкозы и рак печени, шеи, головы и почек; сердечно-сосудистые заболевания; болезни обмена веществ, которые не связаны с иммунной системой, например ожирение; инфекционные заболевания, такие как гепатит В и С и СПИД; пневмонии, язвенный колит; заболевания центральной нервной системы, например болезнь Альцгеймера, шизофрения и депрессия; отторжение трансплантата ткани или органов; заживление ран; анемия у пациентов, подвергнутых диализу; аллергии; астма; рассеянный склероз; остеопороз; псориаз; ревматоидный артрит; болезнь Крона, аутоиммунные заболевания и расстройства; расстройства желудочно-кишечного тракта или даже расстройства, связанные с лечением химиотерапией.
Предпочтительно, чтобы у данной группы индивидуумов был генотипирован функциональный SNP настоящего изобретения.
Для генотипирования SNP существует множество технологий (см., например, Kwok Pharmacogenomics, 2000, vol.1, pp.95-100. "High-throughput genotyping assay approaches"). Эти технологии основаны на одном из четырех следующих принципов: гибридизации аллель-специфических олигонуклеотидов; удлинении олигонуклеотидов дидезоксинуклеотидами, необязательно в присутствии дезоксинуклеотидов; лигировании аллель-специфических олигонуклеотидов или расщепления аллель-специфических олигонуклеотидов. Каждая из этих технологий может быть ассоциирована с системой детекции, такой как измерение прямой или поляризованной флуоресценции или масс-спектрометрия.
Генотипирование может быть, в частности, осуществлено с помощью минисеквенирования с использованием "горячих" ddNTP (2 различных ddNTP, меченных различными флуорофорами) и "холодных" ddNTP (2 различных немеченных ddNTP) в комбинации с использованием поляризационно-флуоресцентного сканера. Протокол минисеквенирования со считыванием поляризованной флуоресценции (FP-TDI Technology or Fluorescence Polarization Template-direct Dye-Terminator Incorporation) хорошо известен специалистам.
Это может быть осуществлено на продукте, полученном после амплификации с помощью полимеразной цепной реакции (ПЦР) ДНК от каждого индивидуума. Этот ПЦР-продукт выбирают так, чтобы он включал генную область полинуклеотида, содержащую исследуемый SNP. После последней стадии в ПЦР-термоячейке планшет помещают на поляризационно-флуоресцентный сканер для считывания меченых оснований с использованием фильтров флуорофор-специфического возбуждения и излучения. Величины интенсивности меченных оснований представлены на графике.
Для ПЦР-амплификации, в случае одного SNP настоящего изобретения, смысловые и антисмысловые праймеры соответственно могут быть легко выбраны любым специалистом в соответствии с положением SNP настоящего изобретения.
Так, например, в качестве праймеров для ПЦР-амиплификации могут служить следующие смысловые и антисмысловые