Комбинированная терапия для лечения иммуновоспалительных заболеваний
Иллюстрации
Показать всеНастоящее изобретение относится к химико-фармацевтической промышленности и касается композиции для лечения пациента, имеющего диагноз или риск развития иммуновоспалительного заболевания. Композиции по настоящему изобретению используются как средство лечения или профилактики иммуновоспалительного заболевания и включают нестероидный иммунофилинзависимый иммунодепрессант (NsIDI) и усилитель NsIDI (NsIDIE), выбранный из селективного ингибитора обратного захвата серотонина (SSRI), трициклического антидепрессанта (ТСА), феноксифенола, антигистаминного агента, фенотиазина или агониста мю-опиоидных рецепторов. Использование данного изобретения позволяет повысить эффективность подавления секреции провоспалительных цитокинов, тем самым повысить эффективность лечения иммуновоспалительного заболевания. 5 н. и 34 з.п. ф-лы, 26 табл.
Реферат
Уровень техники
Изобретение относится к лечению иммуновоспалительных заболеваний.
Иммуновоспалительные заболевания характеризуются неправильной активацией иммунной защиты организма. Вместо борьбы с внедрившимися в организм инфекционными агентами иммунный ответ направляется на собственные ткани организма или трансплантированные ткани и повреждает их. При различных заболеваниях иммунная система нацеливается на различные ткани. Например, при рассеянном склерозе иммунный ответ направлен против нейрональной ткани, в то время как при болезни Крона мишенью является желудочно-кишечный тракт. Иммуновоспалительные заболевания поражают миллионы людей и включают такие состояния, как астма, аллергические внутриглазные воспалительные заболевания, артрит, атопический дерматит, атопическая экзема, диабет, гемолитическая анемия, воспалительные дерматозы, воспалительное заболевание кишечника или желудочно-кишечные заболевания (например, болезнь Крона и язвенный колит), рассеянный склероз, астенический бульбарный паралич, зуд/воспаление, псориаз, ревматоидный артрит, цирроз и системная красная волчанка.
Современные схемы лечения иммуновоспалительных заболеваний обычно опираются на иммунодепрессанты. Эффективность указанных агентов может варьировать, а их использование часто сопровождается неблагоприятными побочными эффектами. Таким образом, существует потребность в улучшенных терапевтических агентах и способах лечения иммуновоспалительных заболеваний.
Сущность изобретения
Заявители установили, что комбинация нестероидного иммунофилинзависимого иммунодепрессанта (NsIDI) (например, циклоспорина А) и усилителя нестероидного иммунофилинзависимого иммунодепрессанта (NsIDIE) (например, селективного ингибитора обратного захвата серотонина (SSRI), трициклического антидепрессанта, феноксифенола, антигистаминного агента, фенотиазина или агониста мю-опиоидных рецепторов) является более эффективной для подавления секреции провоспалительных цитокинов, чем каждый из указанных агентов по отдельности. Таким образом, комбинации NsIDI и NsIDIE, а также их структурных или функциональных аналогов можно использовать в противовоспалительной комбинации по настоящему изобретению.
Соединения, пригодные для настоящего изобретения, включают соединения, описанные в настоящем документе, в любых своих фармацевтически приемлемых формах, включая их изомеры, такие как диастереомеры и энантиомеры, соли, эфиры, сольваты и полиморфы, а также рацемические смеси и чистые изомеры соединений, описанных в настоящем документе.
В одном аспекте изобретение относится к композиции, содержащей нестероидный иммунофилинзависимый иммунодепрессант (NsIDI) и усилитель нестероидного иммунофилинзависимого иммунодепрессанта (NsIDIE) в количествах, которые совместно являются достаточными in vivo для уменьшения секреции или выработки провоспалительных цитокинов или для лечения иммуновоспалительного заболевания.
Необязательно, композиция дополнительно содержит нестероидное противовоспалительное лекарственное средство (NSAID), ингибитор СОХ-2, биопрепарат, модифицирующие заболевание противоревматические лекарственные средства (DMARD), ксантин, антихолинергическое соединение, агонист бета-рецептора, бронходилятатор, нестероидный ингибитор кальциневрина, аналог витамина D, псорален, ретиноид или 5-аминосалициловую кислоту. В некоторых вариантах осуществления настоящего изобретения композицию изготавливают для местного или системного введения.
Настоящее изобретение относится также к способу уменьшения секреции или выработки провоспалительных цитокинов у пациента; указанный способ включает введение пациенту композиции, содержащей нестероидный иммунофилинзависимый иммунодепрессант (NsIDI) и усилитель нестероидного иммунофилинзависимого иммунодепрессанта (NsIDIE), одновременно или в течение 14 дней для каждого, в количествах, достаточных in vivo для уменьшения секреции или выработки провоспалительных цитокинов у пациента.
Настоящее изобретение также относится к способу уменьшения секреции или выработки провоспалительных цитокинов у пациента. Способ включает введение пациенту NsIDI и NsIDIE одновременно или в течение 14 дней для каждого в количествах, достаточных in vivo для уменьшения секреции или выработки провоспалительных цитокинов у пациента.
Помимо этого, изобретение относится к способу лечения пациента с диагнозом или в группе риска развития иммуновоспалительного заболевания. Способ включает введение пациенту NsIDI и NsIDIE одновременно или в течение 14 дней для каждого в количествах, достаточных для лечения пациента.
Изобретение относится также к способу уменьшения секреции или выработки провоспалительных цитокинов в клетке (например, в клетке млекопитающего in vivo). Способ включает контактирование клетки с NsIDI и NsIDIE одновременно или в течение 14 дней для каждого в количествах, достаточных для уменьшения секреции или выработки провоспалительных цитокинов в клетке.
Изобретение относится также к набору, содержащему композицию, содержащую NsIDI и NsIDIE, и инструкции по введению композиции пациенту с диагнозом или с риском развития иммуновоспалительного заболевания.
Изобретение относится также к набору, содержащему NsIDI и NsIDIE, и инструкции по введению NsIDI и NsIDIE пациенту с диагнозом или с риском развития иммуновоспалительного заболевания.
Изобретение относится также к набору, содержащему NsIDI, и инструкции по введению NsIDI и NsIDIE пациенту с диагнозом или с риском развития иммуновоспалительного заболевания.
Изобретение относится также к набору, содержащему NsIDIE, и инструкции по введению NsIDIE и NsIDI пациенту с диагнозом или с риском развития иммуновоспалительного заболевания.
Изобретение относится также к способу идентификации комбинаций соединений, пригодных для подавления секреции провоспалительных цитокинов у пациента, который нуждается в указанном лечении. Способ включает контактирование клетки in vitro с NsIDI и соединением-кандидатом и (b) определение наличия или отсутствия уменьшения соединением-кандидатом уровней цитокинов в клетках крови со стимулированной секрецией цитокинов по сравнению с клетками, контактировавшими с NsIDI, но не контактировавшими с соединением-кандидатом, или с клетками, контактировавшими с соединением-кандидатом, но не с NsIDI; при этом снижением уровней цитокинов идентифицируют комбинацию как комбинацию, которая является пригодной для лечения пациента, который нуждается в указанном лечении.
В предпочтительных вариантах осуществления любого из предыдущих аспектов NsIDI представляет собой, например, ингибитор кальциневрина, такой как циклоспорин, такролимус, аскомицин, пимекролимус или ISAtx247, или FK506-связывающий белок, такой как рапамицин или эверолимус.
В предпочтительных вариантах осуществления любого из предыдущих аспектов усилитель NsIDI (NsIDIE) представляет собой, например, селективный ингибитор обратного захвата серотонина (SSRI), трициклический антидепрессант (ТСА), феноксифенол, антигистаминный агент, фенотиазин или агонист мю-опиоидных рецепторов.
Под «нестероидным иммунофилинзависимым иммунодепрессантом» или «NsIDI» подразумевается любой нестероидный агент, который уменьшает выработку или секрецию провоспалительных цитокинов, связывает иммунофилин или вызывает понижающую регуляцию провоспалительной реакции. NsIDI включают ингибиторы кальциневрина, такие как циклоспорин, такролимус, аскомицин, пимекролимус, а также другие агенты (пептиды, пептидные фрагменты, химически модифицированные пептиды или пептидные миметики), которые ингибируют фосфатазную активность кальциневрина. NsIDI также включают рапамицин (сиролимус) и эверолимус, которые связываются с FK506-связывающим белком, FKBP-12 и блокируют индуцированную антигеном пролиферацию белых кровяных клеток и секрецию цитокинов.
Под «усилителем нестероидного иммунофилинзависимого иммунодепрессанта» или «NsIDIE» подразумевается любое соединение, которое повышает эффективность нестероидного иммунофилинзависимого иммунодепрессанта. NsIDIE включают селективные ингибиторы обратного захвата серотонина, трициклические антидепрессанты, феноксифенолы (например, триклозан), антигистаминные агенты, фенотиазины и агонисты мю-опиоидных рецепторов.
Под «антигистаминным агентом» подразумевается соединение, которое блокирует действие гистамина. Классы антигистаминных агентов включают, без ограничения, этаноламины, этилендиамин, фенотиазин, алкиламины, пиперазины и пиперидины.
Под «селективным ингибитором обратного захвата серотонина» или «SSRI» подразумевается любой член класса соединений, которые (i) ингибируют захват серотонина нейронами центральной нервной системы, (ii) имеют коэффициент ингибирования (Ki) 10 нМ или менее и (iii) селективность в отношении серотонина по сравнению с норэпинефрином, т.е. соотношение Ki(норэпинефрин) и Ki(серотонин) составляет более 100. Обычно SSRI вводят в дозах более 100 мг в день, когда их используют в качестве антидепрессантов. Примеры SSRI для применения по настоящему изобретению описаны в настоящем документе.
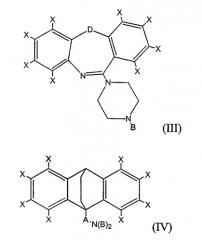
Под «трициклическим антидепрессантом» или «ТСА» подразумевается соединение, имеющее одну из следующих формул (I), (II), (III) или (IV):
где каждый Х независимо представляет собой H, Cl, F, Br, I, CH3, CF3, OH, OCH3, CH2CH3 или OCH2CH3; Y представляет собой CH2, O, NH, S(O)0-2, (CH2)3, (CH)2, CH2O, CH2NH, CHN или CH2S; Z представляет собой С или S; А представляет собой разветвленную или неразветвленную, насыщенную или мононенасыщенную углеводородную цепь, имеющую от 3 до 6 атомов углерода включительно; каждый В представляет собой, независимо, H, Cl, F, Br, I, CX3, CH2CH3, OCX3 или OCX2CX3; а D представляет собой CH2, O, NH, S(O)0-2.
В предпочтительных вариантах осуществления настоящего изобретения каждый Х независимо представляет собой H, Cl или F; Y представляет собой (CH2)2; Z представляет собой С; А представляет собой (CH2)3; и каждый В представляет собой, независимо, H, Cl или F.
Примерами трициклических антидепрессантов являются мапротилин, амоксапин, 8-гидроксиамоксапин, 7-гидроксиамоксапин, локсапин, локсапина сукцинат, локсапина гидрохлорид, 8-гидроксилоксапин, амитриптилин, кломипрамин, доксепин, имипрамин, тримипрамин, дезипрамин, нортриптилин и протриптилин.
Под «кортикостероидом» подразумевается любое натуральное или синтетическое соединение, характеризующееся гидрированной циклопентанопергидрофенантреновой кольцевой системой и обладающее иммунодепрессантной и/или противовоспалительной активностью. Натуральные кортикостероиды обычно вырабатываются корой надпочечников. Синтетические кортикостероиды могут быть галогенированными. Примеры кортикостероидов приводятся в настоящем документе.
Под «низкомолекулярным иммуномодулятором» подразумевается нестероидное, не являющееся NsIDI соединение, которое уменьшает выработку или секрецию провоспалительных цитокинов, вызывает понижающую регуляцию провоспалительной реакции или как-либо иначе модулирует иммунную систему независимо от иммунофилина. Примерами низкомолекулярных иммуномодуляторов являются ингибиторы р38 МАР киназы, такие как VX 702 (Vertex Pharmaceuticals), SCIO 469 (Scios), дорамапимод (Boehringer Ingelheim), RO 30201195 (Roche) и SCIO 323 (Scios), ингибиторы ТАСЕ, такие как DPC 333 (Bristol Myers Squibb), ингибиторы ICE, такие как праналказан (Vertex Pharmaceuticals) и ингибиторы IMPDH, такие как микофенолят (Roche) и меримеподиб (Vertex Pharmaceuticals).
Под «низкой дозой» подразумевается доза, которая по меньшей мере на 5% меньше (например, по меньшей мере на 10%, 20%, 50%, 80%, 90% или даже 95%) самой низкой стандартной рекомендованной дозы конкретного соединения, изготовленного для данного пути введения, для лечения любого заболевания или состояния человека. Например, низкая доза кортикостероида, изготовленного для введения путем ингаляции, будет отличаться от низкой дозы кортикостероида, изготовленного для перорального введения.
Под «высокой дозой» подразумевается доза, которая по меньшей мере на 5% больше (например, по меньшей мере на 10%, 20%, 50%, 100%, 200% или даже 300%) самой высокой стандартной рекомендованной дозы конкретного соединения, изготовленного для данного пути введения, для лечения любого заболевания или состояния человека.
Под «умеренной дозой» подразумевается доза между низкой дозой и высокой дозой.
Под «лечением» подразумевается введение или назначение фармацевтической композиции для лечения или профилактики иммуновоспалительного заболевания.
Под «пациентом» подразумевается любое животное (например, человек). Другие животные, которых можно лечить с использованием способов, композиций и наборов по настоящему изобретению, включают лошадей, собак, кошек, свиней, коз, кроликов, хомячков, обезьян, морских свинок, крыс, мышей, ящериц, змей, овец, крупный рогатый скот, рыбу и птиц. В одном варианте осуществления настоящего изобретения пациент, подвергаемый лечению с использованием SSRI или ТСА, описанному в настоящем документе, не имеет клинической депрессии, тревожности или панического расстройства, обсессивно-компульсивного расстройства, алкоголизма, расстройства питания, расстройства, сопровождающегося дефицитом внимания, пограничного расстройства личности, расстройства сна, головной боли, предменструального синдрома, нарушений сердечного ритма, шизофрении, синдрома Туретта или фобий.
Под «достаточным количеством» подразумевается количество соединения в способах, композициях и наборах по настоящему изобретению, которое требуется для лечения или профилактики иммуновоспалительного заболевания клинически подходящим способом. Достаточное количество активного соединения, используемое в практике настоящего изобретения для терапевтического лечения состояний, вызванных или вносящих свой вклад в иммуновоспалительное заболевание, варьирует в зависимости от способа введения, возраста, массы тела и общего состояния здоровья пациента. В конечном итоге вопрос о подходящем количестве и схеме дозирования решает лечащий врач.
Под «более эффективным» подразумевается, что способ, композиция или набор демонстрируют более высокую эффективность, являются менее токсичными, более безопасными, более удобными, легче переносятся или менее дорогостоящи или обеспечивают более хорошие результаты лечения, чем другой способ, композиция или набор, с которым производится сравнение. Эффективность может оценить специалист с использованием любого стандартного способа, который подходит в конкретных условиях.
Термин «иммуновоспалительное заболевание» охватывает ряд состояний, включая аутоиммунные заболевания, пролиферативные заболевания кожи и воспалительные дерматозы. Иммуновоспалительные заболевания приводят к разрушению здоровой ткани воспалительным процессом, дисрегуляции иммунной системы и нежелательной пролиферации клеток. Примерами иммуновоспалительных заболеваний являются обыкновенные угри, острый респираторный дистресс-синдром, болезнь Аддисона, аллергический ринит, аллергические внутриглазные воспалительные заболевания, ANCA-связанный васкулит малых сосудов, анкилозирующий спондилит, артрит, астма, атеросклероз, атопический дерматит, аутоиммунный гепатит, аутоиммунная гемолитическая анемия, аутоиммунный гепатит, болезнь Бехчета, паралич Белла, буллезный пемфигоид, церебральная ишемия, хроническое обструктивное заболевание легких, цирроз, синдром Когана, контактный дерматит, ХОЗЛ, болезнь Крона, синдром Кушинга, дерматомиозит, сахарный диабет, дискоидная красная волчанка, эозинофильный фасциит, узловатая эритема, эксфолиативный дерматит, фибромиалгия, очаговый гломерулосклероз, очаговый сегментарный гломерулосклероз, гигантоклеточный артериит, подагра, подагрический артрит, реакция «трансплантат против хозяина», экзема рук, пурпура Геноха-Шенлейна, герпес беременных, гирсутизм, идиопатический цератосклерит, идиопатический пневмофиброз, идиопатическая тромбоцитопеническая пурпура, иммунная тромбоцитопеническая пурпура, воспалительное заболевание кишечника или желудочно-кишечные расстройства, воспалительные дерматозы, плоский лишай, волчаночный нефрит, лимфоматозный трахеобронхит, отек желтого пятна, рассеянный склероз, астенический бульбарный паралич, миозит, неспецифическое фиброзирующее заболевание легких, остеоартрит, панкреатит, пемфигоид беременных, вульгарная пузырчатка, периодонтит, нодозный полиартериит, ревматическая полимиалгия, pruritis scroti, зуд/воспаление, псориаз, псориатический артрит, гистоплазмоз легких, ревматоидный артрит, рецидивирующая полихондрия, розацеа, вызванная саркоидозом, розацеа, вызванная склеродермой, розацеа, вызванная синдромом Свита, розацеа, вызванная системной красной волчанкой, розацеа, вызванная крапивницей, розацеа, вызванная болью, связанной с герпесом зостер, саркоидоз, склеродерма, сегментарный гломерулосклероз, синдром септического шока, тендинит или бурсит плечевого сустава, синдром Шегрена, болезнь Стилла, гибель клеток головного мозга, вызванная инсультом, болезнь Свита, системная красная волчанка, системный склероз, артериит Такаясу, височный артериит, токсический некролиз эпидермиса, отторжение трансплантата и синдромы, связанные с отторжением трансплантата, туберкулез, диабет 1 типа, язвенный колит, увеит, васкулит и грануломатоз Вегенера.
«Некожные воспалительные заболевания» включают, например, ревматоидный артрит, воспалительное заболевание кишечника, астму и хроническое обструктивное заболевание легких.
«Кожные воспалительные заболевания» или «воспалительные дерматозы» включают, например, псориаз, острый фебрильный нейтрофильный дерматоз, экзему (например, астеатотическую экзему, дисгидротическую экзему, везикулярную пальмоплантарную экзему), круговой плазмацеллюлярный баланит, баланопостит, болезнь Бехчета, кольцевидную эритему, пепельный дерматоз, экссудативную многоформную эритему, кольцевидную гранулему, блестящий лишай, плоский лишай, склерозирующий и атрофический лишай, лихеноидный зудящий дерматит, шиповидный лишай, монетовидный дерматит, гангренозную пиодерму, саркоидоз, субкорнеальный пустулезный дерматоз, крапивницу и преходящий акантолитический дерматоз.
Под «пролиферативным заболеванием кожи» подразумевается доброкачественное или злокачественное заболевание, которое характеризуется ускоренным делением клеток в эпидермисе или дерме. Примерами пролиферативных заболеваний кожи являются псориаз, атопический дерматит, неспецифический дерматит, первичный контактный дерматит, аллергический контактный дерматит, базальные и плоскоклеточные карциномы кожи, ламеллярный ихтиоз, эпидермолитический гиперкератоз, предраковый кератоз, угри и себоррейный дерматит.
Специалисту понятно, что конкретное заболевание, расстройство или состояние можно охарактеризовать как пролиферативное заболевание кожи и воспалительный дерматоз. Примером указанного заболевания является псориаз.
Под «замедленным высвобождением» или «контролируемым высвобождением» подразумевается, что терапевтически активный компонент высвобождается из композиции с контролируемой скоростью таким образом, чтобы терапевтически благоприятные уровни компонента в крови (но ниже токсических уровней) поддерживались в течение увеличенного периода времени, например приблизительно от 12 до 24 часов, что делает возможным получение лекарственных форм, которые вводятся каждые 12 или 24 часа.
В общих описаниях соединений по настоящему изобретению количество атомов конкретного типа в заместительной группе обычно приводится в виде пределов, например алкильная группа, содержащая от 1 до 7 атомов углерода, или С1-7 алкил. Ссылки на указанные пределы предназначены для включения конкретных ссылок на группы, имеющие каждое из целых чисел атомов в указанных пределах. Например, алкильная группа от 1 до 7 атомов углерода включает каждый из С1, С2, С3, С4, С5, С6 и С7. С1-7 гетероалкил, например, включает от 1 до 7 атомов углерода, помимо одного или более гетероатомов. Другие количества атомов и другие типы атомов могут быть указаны таким же способом.
Под «ацилом» подразумевается химическая часть формулы R-C(O)-, где R выбран из С1-7 алкила, С2-7 алкенила, С2-7 алкинила, С2-6 гетероциклила, С6-12 арила, С7-14 алкарила, С3-10 алкгетероциклила или С1-7 гетероалкила.
Под «алкокси» подразумевается химический заместитель формулы -OR, где R выбран из С1-7 алкила, С2-7 алкенила, С2-7 алкинила, С2-6 гетероциклила, С6-12 арила, С7-14 алкарила, С3-10 алкгетероциклила или С1-7 гетероалкила.
Под «арилокси» подразумевается химический заместитель формулы -OR, где R представляет собой С6-12 арильную группу.
Под «С6-12 арилом» подразумевается ароматическая группа, имеющая кольцевую систему, составленную из атомов углерода с конъюгированными π-электронами (например, фенил). Арильная группа имеет от 6 до 12 атомов углерода. Арильные группы могут, необязательно, включать моноциклические, бициклические или трициклические кольца, в которых каждое кольцо, желательно, имеет пять или шесть членов. Арильная группа может быть замещенной или незамещенной. Примеры заместителей включают алкил, гидрокси, алкокси, арилокси, сульфгидрил, алкилтио, арилтио, галогенид, фторалкил, карбоксил, гидроксиалкил, карбоксиалкил, амино, аминоалкил, монозамещенный амино, дизамещенный амино и четвертичные аминогруппы.
Под «амидо» подразумевается химический заместитель формулы -NRR', где атом азота является частью амидной связи (например, -C(O)-NRR') и где R и R' каждый независимо выбран из С1-7 алкила, С2-7 алкенила, С2-7 алкинила, С2-6 гетероциклила, С6-12 арила, С7-14 алкарила, С3-10 алкгетероциклила или С1-7 гетероалкила, или NRR' образует С2-6 гетероциклическое кольцо, как определено выше, но содержащее по меньшей мере один атом азота, такое как, среди прочих, пиперидино, морфолино и азабицикло.
Под «галогенидом» подразумевается бром, хлор, йод или фтор.
Термин «фармацевтически приемлемая соль» представляет такие соли, которые, по медицинским меркам, являются пригодными для использования в контакте с тканями человека и низших животных, без чрезмерной токсичности, раздражения, аллергической реакции и т.п., и имеют соразмерное соотношение пользы и риска. Фармацевтически приемлемые соли хорошо известны специалистам. Соли можно изготавливать in situ во время конечного выделения и очистки соединений по настоящему изобретению или отдельно, путем взаимодействия функции свободного основания и подходящей органической кислоты. Репрезентативные примеры кислотно-аддитивных солей включают ацетат, адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камферсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептонат, глицерофосфат, гемисульфат, гептонат, гексаноат, гидробромид, гидрохлорид, гидройодид, 2-гидроксиэтансульфонат, изетионат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, мезилат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, толуолсульфонат, ундеканоат, соли валерата и т.п. Репрезентативные примеры солей щелочных или щелочно-земельных металлов включают соли натрия, лития, калия, кальция, магния и т.п., а также соли с нетоксичными аммониевыми, четвертичными аммониевыми и аминовыми катионами, включая, без ограничения, аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, этиламин и т.п.
Соединения, пригодные для настоящего изобретения, включают соединения, описанные в настоящем документе, в любой из их фармацевтически приемлемых форм, включая изомеры, такие как диастереомеры и энантиомеры, соли, эфиры, амиды, тиоэфиры, сольваты и полиморфы, а также рацемические смеси и чистые изомеры соединений, описанных в настоящем документе. В качестве примера, под «пароксетином» подразумевается свободное основание, а также любая его фармацевтически приемлемая соль (например, пароксетина малеат, пароксетина гидрохлорида полугидрат и пароксетина мезилат).
Другие признаки и преимущества изобретения будут понятны из следующего подробного описания, а также из формулы изобретения.
Подробное описание
Изобретение относится к способам, композициям и наборам для введения эффективного количества нестероидого иммунофилинзависимого иммунодепрессанта (NsIDI), такого как циклоспорин А, и усилителя нестероидного иммунофилинзависимого иммунодепрессанта (NsIDIE), например селективного ингибитора обратного захвата серотонина, трициклического антидепрессанта, феноксифенола, антигистаминного агента, фенотиазина или агониста мю-опиоидных рецепторов.
Изобретение далее описывается более подробно.
Нестероидные иммунофилинзависимые иммунодепрессанты
В одном варианте осуществления настоящее изобретение относится к способам, композициям и наборам, включающим NsIDI и NsIDIE, необязательно, с кортикостероидом или другим агентом, описанным в настоящем документе.
У здоровых индивидуумов иммунная система использует клеточные эффекторы, такие как В-клетки и Т-клетки, для борьбы с инфекционными микробами и патологическими типами клеток, при этом оставляя нормальные клетки интактными. У индивидуумов с аутоиммунным расстройством или трансплантированным органом активированные Т-клетки повреждают здоровые ткани. Ингибиторы кальциневрина (например, циклоспорины, такролимус, пимекролимус) и рапамицин имеют в качестве мишени многие типы иммунорегулирующих клеток, включая Т-клетки, и подавляют иммунный ответ при трансплантации органов и аутоиммунных заболеваниях.
Циклоспорины
Циклоспорины представляют собой продукты метаболизма грибов, которые включают класс циклических олигопептидов, которые действуют как иммунодепрессанты. Циклоспорин А и его дейтерированный аналог ISAtx247 представляют собой гидрофобный циклический полипептид, состоящий из одиннадцати аминокислот. Циклоспорин А связывается и образует комплекс с внутриклеточным рецептором циклофилином. Комплекс циклоспорин/циклофилин связывается с кальциневрином, Са2+-кальмодулинзависимой серин-треонинспецифичной протеинфосфатазой, и ингибирует его. Кальцинурин опосредует процессы сигнальной трансдукции, которые требуются для активации Т-клеток (см. обзор Schreiber et al., Cell 70:365-368, 1991). Циклоспорины и их функциональные и структурные аналоги подавляют зависящий от Т-клеток иммунный ответ путем ингибирования запускаемой антигеном сигнальной трансдукции. Указанное ингибирование уменьшает экспрессию провоспалительных цитокинов, таких как IL-2.
Многие циклоспорины (например, циклоспорин A, B, C, D, E, F, G, H и I) вырабатываются грибами. Циклоспорин А имеется на рынке под торговым наименованием NEORAL от компании Novartis. Структурные и функциональные аналоги циклоспорина А включают циклоспорины, имеющие один или более фторированных аминокислот (описаны, например, в патенте США №5227467), циклоспорины, имеющие модифицированные аминокислоты (описаны, например, в патентах США №№5122511 и 4798823), и дейтерированные циклоспорины, такие как ISAtx247 (описаны в патентной публикации США № 20020132763). Дополнительные аналоги циклоспорина описаны в патентах США №№6136357, 4384996, 5284826 и 5709797. Аналоги циклоспорина включают, без ограничения, D-Sar (α-SMe)3Val2-DH-Cs (209-825), Allo-Thr-2-Cs, Norvaline-2-Cs, D-Ala (3-ацетиламин)-8-Cs, Thr-2-Cs и D-MeSer-3-Cs, D-Ser (O-CH2CH2-OH)-8-Cs и D-Ser-8-Cs, которые описаны в Cruz et al. (Antimicrob. Agents Chemother. 44:143-149, 2000).
Циклоспорины являются высокогидрофобными и легко выпадают в осадок в присутствии воды (например, при контакте с жидкостями организма). Способы изготовления композиций циклоспорина с улучшенной биодоступностью описаны в патентах США №№4388307, 6468968, 5051402, 5342625, 5977066 и 6022852. Циклоспориновые микроэмульсионные композиции описаны в патентах США №№5866159, 5916589, 5962014, 5962017, 6007840 и 6024978.
Циклоспорины можно вводить как внутривенно, так и перорально, но предпочтительным является пероральное введение. Для противодействия гидрофобности циклоспорин А для внутривенного введения помещают в носитель - этанолполиоксиэтилированное касторовое масло, который необходимо разбавлять перед введением. Циклоспорин А может быть изготовлен, например, в форме микроэмульсии в 25 мг или 100 мг таблетках или в растворе 100 мг/мл для перорального введения (NEORALTM).
Обычно доза перорального циклоспорина для пациента варьирует в зависимости от состояния пациента, но некоторые стандартные рекомендованные дозы, известные ранее для схем лечения, приводятся в настоящем документе. Пациенты с трансплантированными органами обычно получают первоначальную дозу перорального циклоспорина А от 12 до 15 мг/кг в день. Затем постепенно уменьшают на 5% в неделю до достижения поддерживающей дозы 7-12 мг/кг в день. Для большинства пациентов предпочтительной для внутривенного введения является доза 2-6 мг/кг в день. Пациенты с болезнью Крона или язвенным колитом обычно получают 6-8 мг/кг в день. Пациенты с системной красной волчанкой обычно получают 2,2-6,0 мг/кг в день. При псориазе или ревматоидном артрите обычными являются дозы 0,5-4 мг/кг в день. Другие подходящие дозы составляют 0,5-5 мг/кг в день, 5-10 мг/кг в день, 10-15 мг/кг в день, 15-20 мг/кг в день или 20-25 мг/кг в день. Часто циклоспорины вводят в комбинации с другими иммунодепрессантами, такими как глюкокортикоиды. Дополнительная информация представлена в таблице 1.
| ТАБЛИЦА 1 | |||||||
| Соединение | Атопический дерматит | Псориаз | RA | Болезнь Крона | UC | Трансплантат | SLE |
| Cs(NEORAL) | N/A | 0,5-4 мг/кгв день | 0,5-4 мг/кгв день | 6-8 мг/кгв день(перорально-через фистулу) | 6-8 мг/кгв день(перорально) | ˜7-12 мг/кгв день | 2,2-6,0 мг/кг в день |
| Такролимус | 0,03-0,1% крем/дваждыв день (тюбики по 30 и 60 граммов) | 0,05-1,15 мг/кгв день (перорально) | 1-3 мгв день (перорально) | 0,1-0,2 мг/кг в день (перорально) | 0,1-0,2 мг/кг в день (перорально) | 0,1-0,2 мг/кг в день (перорально) | N/A |
| Пимекролимус | 1% крем/дваждыв день (тюбики по 15, 30 и 100 граммов) | 40-60 мгв день (перорально) | 40-60 мгв день (перорально) | 80-160 мгв день (перорально) | 160-240 мгв день (перорально) | 40-120 мгв день (перорально) | 40-120 мгв день (перорально) |
| Обозначения | |||||||
| CsA = циклоспорин А | |||||||
| RA = ревматоидный артрит | |||||||
| UC = язвенный колит | |||||||
| SLE = системная красная волчанка |
Такролимус
Такролимус (PROGRAF, Fujisawa), известный так же как FK506, представляет собой иммунодепрессант, который нацелен на пути внутриклеточной сигнальной трансдукции Т-клеток. Такролимус связывается с белком, связывающим внутриклеточный белок FK506 (FKBP-12), который не является структурно родственным циклофилину (Harding et al. Nature 341:758-7601, 1989; Siekienka et al., Nature 341:755-757, 1989 и Soltoff et al., J. Biol. Chem. 267:17472-17477, 1992). Комплекс FKBP/FK506 связывается с кальциневрином и ингибирует фосфатазную активность кальциневрина. Указанное ингибирование предотвращает дефосфорилирование и ядерную транслокацию NFAT, ядерного компонента, который инициирует транскрипцию гена, требующегося для выработки лимфокина (например, IL-2, гамма-интерферона) и активации Т-клеток. Таким образом такролимус ингибирует активацию Т-клеток.
Такролимус представляет собой макролидный антибиотик, который вырабатывается в Streptomyces tsukubaensis. Он подавляет иммунную систему и пролонгирует выживание трансплантированных органов. В настоящее время он доступен в виде лекарственных форм для перорального и инъекционного введения. Капсулы такролимуса содержат 0,5 мг, 1 мг или 5 мг безводного такролимуса в желатиновой капсульной оболочке. Композиция для инъекций содержит 5 мг безводного такролимуса в касторовом масле и спирте, который перед введением разводят 9% хлоридом натрия или 5% декстрозой. В то время как пероральное введение является предпочтительным, пациенты, не способные принимать пероральные капсулы, могут получать такролимус в инъекционной форме. Первоначальную дозу следует назначать не раньше чем через шесть месяцев после трансплантации посредством продолжительной внутривенной инфузии.
Такролимус и аналоги такролимуса описаны Tanaka et al. (J. Am. Chem. Soc., 109:5031, 1987) и в патентах США №№4894366, 4929611 и 4956352. Родственные FK506 соединения, включая FR-900520, FR-900523 и FR-900525, описаны в патенте США №5254562; О-арил-, О-алкил-, О-алкенил- и О-алкинилмакролиды описаны в патентах США №№5250678, 532248, 5693648; амино-О-арилмакролиды описаны в патенте США №5262533; алкилиденмакролиды описаны в патенте США №5284840; N-гетероарил-, N-алкилгетероарил, N-алкенилгетероарил и N-алкинилгетероарил описаны в патенте США №5208241; аминомакролиды и их производные описаны в патенте США №5208228; фтормакролиды описаны в патенте США №5189042; амино-О-алкил-, О-алкенил- и О-алкинилмикролиды описаны в патенте США №5162334 и галогенмакролиды описаны в патенте США №5143918.
В то время как предложенные дозировки будут варьировать в зависимости от состояния пациента, стандартные рекомендованные дозы, использовавшиеся ранее для схем лечения, приводятся ниже. Пациенты с болезнью Крона или язвенным колитом обычно получают 0,1-0,2 мг/кг в день такролимуса перорально. Пациенты с трансплантированными органами обычно получают дозы перорального такролимуса 0,1-0,2 мг/кг в день. Пациенты с ревматоидным артритом обычно получают 1-3 мг/кг в день перорального такролимуса. Для лечения псориаза пациенту вводят 0,01-0,15 мг/кг в день перорального такролимуса. Атопический дерматит можно лечить нанесением дважды в день на пораженный участок кожи крема, содержащего 0,03-0,1% такролимуса. Пациенты, получающие пероральные капсулы такролимуса, обычно получают первую дозу не раньше шести месяцев после трансплантации, или через восемь-двенадцать часов после окончания внутривенной инфузии такролимуса. Другие предложенные дозировки такролимуса включают 0,005-0,01 мг/кг в день, 0,01-0,03 мг/кг в день, 0,03-0,05 мг/кг в день, 0,05-0,07 мг/кг в день, 0,07-0,10 мг/кг в день, 0,10-0,25 мг/кг в день или 0,25-0,5 мг/кг в день.
Такролимус в значительной степени метаболизируется оксидазной системой смешанной функции, в частности системой цитохрома Р-450. Главным механизмом метаболизма является деметилирование и гидроксилирование. В то время как различные метаболиты такролимуса, вероятно, обладают иммунодепрессантной биологической активностью, соообщается, что 13-диметиловый метаболит обладает такой же активностью, как такролимус.
Производные пимекролимуса и аскомицина
Аскомицин является близким структурным аналогом FK506 и является мощным иммунодепрессантом. Он связывается к FKBP-12 и подавляет его пролин-ротамазную активность. Комплекс аскомицин-FKBP ингибирует кальциневрин, фосфатазу типа 2В.
Пимекролимус (также известный как SDZ ASM-981) представляет собой 33-эпихлорпроизводное аскомицина. Он вырабатывается штаммом Streptomyces hygroscopicus var. ascomyceitus. Подобно такролимусу, пимекролимус (ELIDELTM, Novartis) связывается с FKBP-12, ингибирует фосфатазную активность кальциневрина и ингибирует активацию Т-клеток путем блокирования транскрипции ранних цитокинов. В частности, пимекролимус ингибирует выработку IL-2 и высвобождение других провоспалительных цитокинов.
Структурные и функциональные аналоги пимекролимуса описаны в патенте США №6384073. Пимекролимус является особенно подходящим для лечения атопического дерматита. В настоящее время пимекролимус доступен в форме 1% крема. В то время как индивидуальное дозирование будет варьировать в зависимости от состояния пациента, некоторые стандартные рекомендованные дозы приводятся ниже. Пероральный пимекролимус можно назначать для лечения псориаза или ревматоидного артрита в дозах 40-60 мг в день. Для лечения болезни Крона или язвенного колита можно назначать дозы пимекролимуса 80-160 мг в день. Пациентам с трансплантиро