Электролит, электролитический состав и раствор, конденсатор, вторичный литиевый элемент и способ получения соли четвертичного аммония
Иллюстрации
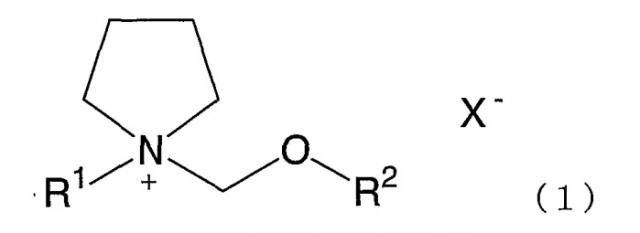
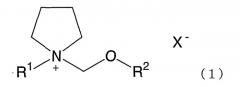
Показать всеДанное изобретение относится к солям четвертичного аммония формулы
где R1 представляет алкил с прямой или разветвленной цепью, имеющий от 1 до 4 атомов углерода, R2 представляет метил или этил и X- представляет фторсодержащий анион, а также электролитам, электролитическим растворам и электрохимическим устройствам. Применение электролитов по настоящему изобретению обеспечивает электролитические растворы, имеющие высокую стойкость при напряжении и высокую электролитическую проводимость. Следовательно, электролитический раствор по изобретению обеспечивает электрохимические устройства, применимые при высоком напряжении, имеющие высокую разрядную емкость и проявляющие способность к разрядке большим током. 95 н. и 56 з.п. ф-лы, 47 табл., 10 ил.
Реферат
Область изобретения
Данное изобретение относится к солям четвертичного аммония, электролитам, электролитическим растворам и электрохимическим устройствам. Более конкретно, изобретение относится к функциональным материалам, которые применимы в качестве электролитов, имеющих высокую растворимость в органических растворителях, высокую стойкость при напряжении и высокую электрическую проводимость.
Уровень техники
В последние годы более высокие удельные мощности и повышенные удельные показатели энергоемкости требуются от электрохимических устройств, включающих элементы питания и конденсаторы. Органические электролитические растворы находят более широкое применение, чем водные электролитические растворы с точки зрения стойкости при напряжении. Примерами органических электролитических растворов являются такие, которые готовят растворением солей щелочных металлов или твердых солей аммония в органическом растворителе, таком как пропиленкарбонат. Электролитические растворы первого типа используют для литиевых ионных элементов, тогда как растворы второго типа используют для конденсаторов с двойным электрическим слоем. Органические электролитические растворы хуже водных растворов по электрической проводимости, и были проведены многочисленные исследования органических растворителей или электролитов для усовершенствования электрической проводимости. Как результат, патентная публикация 1 (JP 1991-58526 A) раскрывает асимметричные соли аммония для применения в качестве электролитов для конденсаторов с двойным электрическим слоем. Ue et al., J. Electrochem. Soc. 141(2989) 1994 показывает подробные исследования разновидностей солей тетраалкиламмония и их электрической проводимости. Широко используются тетрафторборат тетраэтиламмония и тетрафторборат триэтилметиламмония.
Электрическая проводимость неводных электролитических растворов, содержащих такой твердый электролит, растворенный в растворителе, изменяется с концентрацией электролита. С ростом концентрации ионная концентрация раствора растет с увеличением электрической проводимости, которая будет достигать максимума в свое время. Электрическая проводимость, достигшая максимума, начинает уменьшаться предположительно потому, что затрудняется диссоциация электролита и увеличивается его вязкость в то же время по причине усиленного взаимодействия между растворителем и ионами и между ионами, когда число ионов увеличивается в электролитическом растворе. При дальнейшем увеличении концентрации электролит становится далее недиссоциируемым, и концентрация электролита выравнивается. Таким образом, попытка увеличить концентрацию электролита наталкивается на такую проблему, что электролит становится менее растворимым. С другой проблемой сталкиваются, когда электролитические растворы, имеющие электролит, растворенный в них при высокой концентрации, используют в окружающей среде при низкой температуре, соль будет выделяться, ухудшая электрическую проводимость раствора. Растворители высокой диэлектрической проницаемости обычно предпочтительны для диссоциации электролитов до более высокой степени, и пропиленкарбонат, этиленкарбонат, гамма-бутиролактон, и т.д. находят применение. Подходящими для применения в качестве электролитов являются тетрафторборат тетраэтиламмония, тетрафторборат триэтилметиламмония и тому подобное, которые являются относительно растворимыми в растворителях высокой диэлектрической проницаемости, тогда как указанные электролиты лимитируются по растворимости до концентрации около 2 M при комнатной температуре и имеют недостаток, допуская отделение кристаллов, будучи растворенными в более высоких концентрациях или при низких температурах. Указанные электролиты почти нерастворимы в растворителях низкой диэлектрической проницаемости, что не позволяет получать электролитические растворы, которые применимы как таковые.
Когда пропиленкарбонат, этиленкарбонат, гамма-бутиролактон или тому подобное используют в качестве растворителя для применений, нуждающихся в высоком напряжении, выбор электролита определяется напряжением разложения растворителя, даже если электролит имеет высокую стойкость при напряжении, с тем результатом, что обычные конденсаторы ограничиваются по рабочему напряжению до около 2,5 В в качестве наивысшего. Если конденсатор работает при напряжении, превышающем 2,5 В, электролитический раствор (главным образом растворитель) подвергается электрохимическому разложению, значительно ухудшается по эксплуатационным качествам и порождает нежелательное явление, такое как выделение газа. При применении конденсаторов в качестве запасающих энергию устройств для движущихся объектов, таких как гибридные машины и электрические автомобили, требуются усовершенствованные энергетические емкости, и более высокое рабочее напряжение является эффективным средством для получения повышенной удельной энергоотдачи, поскольку невозможно усовершенствовать стойкость при напряжении с использованием обычных электролитических растворов, возникает потребность в электролитах и растворителях более высокой стойкости при напряжении. Хотя цепочечные карбонатные растворители являются растворителями более высокой стойкости при напряжении, обычные электролиты, такие как тетрафторборат тетраэтиламмония и тетрафторборат триэтилметиламмония, имеют низкую растворимость в указанных растворителях, которые имеют низкую диэлектрическую проницаемость, и не применимы в качестве электролитических растворов.
В последние годы найдены соли, имеющие температуру плавления около комнатной температуры, или соли, имеющие температуру плавления не выше, чем комнатная температура (соли, плавящиеся при комнатной температуре). Известно, что даже если они твердые при комнатной температуре, такие соли растворяются в органических растворителях при более высокой концентрации, чем обычные электролиты. Более того, соли, плавящиеся при комнатной температуре, являются смешивающимися со специфическим органическим растворителем в желательном соотношении. Соответственно, указанные соли дают электролитические растворы, имеющие высокую концентрацию, не достижимую при растворении обычных твердых электролитов в органических растворителях, хотя и имеющий высокую концентрацию, их раствор менее пригоден для борьбы с проблемой выделения соли в низкотемпературной среде. Соль, плавящаяся при комнатной температуре, является жидкой и поэтому сама по себе применима в качестве электролита.
Известно также, что соли, плавящиеся при комнатной температуре, хотя и жидкие, имеют низкое давление пара и не являются легко воспламеняющимися, потому что они содержат только ионы. Соответственно, соль, плавящаяся при комнатной температуре, когда растворена в органическом растворителе при высокой концентрации, служит в качестве антипирена для электролитических растворов.
Типичной такой солью, плавящейся при комнатной температуре, является тетрафторборат 1-этил-3-метилимидазолия (EMI·BF4). Соль EMI·BF4 имеет высокую электрическую проводимость, и применение этой соли в электрохимических устройствах, включая литиевые вторичные элементы и конденсаторы с двойным электрическим слоем, исследуется. Однако соль имидазолия имеет электрохимическую стабильность около 4 В, так что когда ее применяют в конденсаторах с двойным электрическим слоем, соль имеет верхний предел рабочего напряжения около 2,5 В и все еще ограничена в применении.
В последние годы было проведено исследование солей, плавящихся при комнатной температуре и стабильных в широком диапазоне потенциала. Например, соли, плавящиеся при комнатной температуре и содержащие катионный компонент с каркасом алифатического аммония, как раскрыто в патентной публикации 2 (Японский патент No. 2981545), имеют стойкость при напряжении по меньшей мере 5,8 В и считаются применимыми для литиевых вторичных элементов. Соли, плавящиеся при комнатной температуре и имеющие каркас алифатического аммония в катионном компоненте, тем не менее, имеют недостаток, будучи очень вязкими и имеющими низкую электрическую проводимость. Хотя электрическая проводимость улучшается, когда их смешивают с органическим растворителем, величина электропроводности все же ниже электропроводности растворов традиционных твердых электролитов в органических растворителях.
Патентная публикация 3 (WO 02/076924) раскрывает, что соли алифатического аммония, имеющие алкоксиалкилгруппу, введенную в них, являются высокорастворимыми в неводном органическом растворителе и менее склонны выделяться при низких температурах, несмотря на это, требуются электролиты с еще более высокой растворимостью в органических растворителях, стойкостью при напряжении и электрической проводимостью.
Даже в случае, когда соли, плавящиеся при комнатной температуре, имеющие диэтилметилметоксиэтиламмоний в качестве катионного компонента и раскрытые в патентной публикации 3, растворяют в органическом растворителе, растворы хуже по электрической проводимости, чем электролитические растворы, приготовленные растворением традиционных твердых электролитов (например, тетрафторбората триэтилметиламмония и т.д.) в органическом растворителе. Раскрытые соли все-таки остаются требующими усовершенствования по растворимости в цепочечном карбонате, и сохраняется потребность в электролитах, которые были бы более совершенными по растворимости в органических растворителях, стойкости при напряжении и электрической проводимости.
Цель данного изобретения - предоставить соль четвертичного аммония, которая улучшена по электрической проводимости и стойкости при напряжении.
Другая цель изобретения - предоставить электролит с высокими характеристиками по растворимости в органических растворителях, стойкости при напряжении и электрической проводимости.
Другая цель изобретения - предоставить электролитический раствор с высокими характеристиками по стойкости при напряжении и электрической проводимости.
Другая цель изобретения - предоставить электролит, который дает высококонцентрированный электролитический раствор при растворении в растворителе и, следовательно, обеспечивает устройство, применимое при высоком напряжении и имеющее высокую разрядную емкость и способность разряда большим током.
Сущность изобретения
Данное изобретение относится к соли четвертичного аммония формулы (1)
где R1 представляет алкил с прямой или разветвленной цепью, имеющий от 1 до 4 атомов углерода, R2 представляет метил или этил, и X- представляет фторсодержащий анион, причем соль является электролитом.
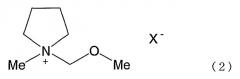
Изобретение также относится к соли четвертичного аммония формулы (2)
где X- представляет фторсодержащий анион, и Me представляет метил, соль является электролитом.
Проведены интенсивные исследования для разработки новых химических веществ для достижения усовершенствованной электрической проводимости, и в результате обнаружено, что катионы, имеющие структуру каркаса N,O-ацеталя формулы (1) в молекуле, имеют высокую электрическую проводимость и что катион аммония, включенный наряду с указанными катионами и имеющий каркас пирролидина и группу N,O-ацеталя, особенно хорош по электрической проводимости, стойкости при напряжении и растворимости в органических растворителях.
Образ действий для осуществления на практике данного изобретения будет описан ниже.
Данное изобретение относится к солям четвертичного аммония формулы (1), которые состоят из катиона четвертичного аммония и фторсодержащего аниона. Примерами катиона четвертичного аммония являются катион N-метил-N-метоксиметилпирролидиния (катион N-метоксиметил-N-метилпирролидиния), катион N-этил-N-метоксиметилпирролидиния, катион N-метоксиметил-N-н-пропилпирролидиния, катион N-метоксиметил-N-изопропилпирролидиния, катион N-н-бутил-N-метоксиметилпирролидиния, катион N-изобутил-N-метоксиметилпирролидиния, катион N-трет-бутил-N-метоксиметилпирролидиния, катион N-этоксиметил-N-метилпирролидиния, катион N-этил-N-этоксиметилпирролидиния (катион N-этоксиметил-N-этилпирролидиния), катион N-этоксиметил-N-н-пропилпирролидиния, катион N-этоксиметил-N-изопропилпирролидиния, катион N-н-бутил-N-этоксиметилпирролидиния, катион N-изобутил-N-этоксиметилпирролидиния и катион N-трет-бутил-N-этоксиметилпирролидиния.
Более предпочтительны катион N-метил-N-метоксиметилпирролидиния (катион N-метоксиметил-N-метилпирролидиния), катион N-этил-N-метоксиметилпирролидиния и катион N-этоксиметил-N-метилпирролидиния. Примерами фторсодержащих анионов являются CF3CO2 -, CF3SO3 -, N(CF3SO2)2 -, N(CF3CF2SO2)2 -, C(CF3SO2)3 -, N(CF3SO2)(CF3CO)-, BF4 - и PF6 -. F- не включен. Предпочтительны CF3SO3 -, N(CF3SO2)2 -, N(CF3CF2SO2)2 - и C(CF3SO2)3 -. Более предпочтительны CF3CO2 -, N(CF3SO2)2 -, BF4 - и PF6 -. Особенно предпочтительны N(CF3SO2)2 - и BF4 -. Особенно предпочтительными солями, которые являются сочетанием указанных катионов и анионов, являются тетрафторборат N-метил-N-метоксиметилпирролидиния (тетрафторборат N-метоксиметил-N-метилпирролидиния), тетрафторборат N-этил-N-метоксиметилпирролидиния, тетрафторборат N-этоксиметил-N-метилпирролидиния, бистрифторметансульфонилимид N-метил-N-метоксиметилпирролидиния (бистрифторметансульфонилимид N-метоксиметил-N-метилпирролидиния), бистрифторметансульфонилимид N-этил-N-метоксиметилпирролидиния, бистрифторметансульфонилимид N-этоксиметил-N-метилпирролидиния, трифторметансульфолат N-метил-N-метоксиметилпирролидиния (N-метоксиметил-N-метилтрифторметансульфолат).
Соли четвертичного аммония по данному изобретению являются солями, плавящимися при комнатной температуре, и соли сами по себе применимы в качестве жидких электролитов. В этом случае применима или только одна из солей, или два вида солей могут быть использованы в смеси.
Когда соль нужно использовать в качестве электролита, соль четвертичного аммония, полученная по изобретению, может быть использована в смеси с подходящим органическим растворителем. Применимые растворители включают циклические сложные эфиры карбоновых кислот, цепочечные сложные эфиры карбоновых кислот, сложные эфиры фосфорной кислоты, циклические простые эфиры, цепочечные простые эфиры, лактонные соединения, цепочечные сложные эфиры, нитрильные соединения, амидные соединения и сульфоновые соединения. Примеры таких соединений даны ниже, хотя растворители, которые могут быть использованы, не ограничиваются указанными соединениями.
Примерами циклических сложных эфиров карбоновых кислот являются этиленкарбонат, пропиленкарбонат, бутиленкарбонат и тому подобное, из которых предпочтителен пропиленкарбонат.
Примерами цепочечных сложных эфиров карбоновых кислот являются диметилкарбонат, этилметилкарбонат, диэтилкарбонат и тому подобное, из которых предпочтителен диметилкарбонат и этилметилкарбонат.
Примерами сложных эфиров фосфорной кислоты являются триметилфосфат, триэтилфосфат, этилдиметилфосфат, диэтилметилфосфат и тому подобное.
Примерами циклических простых эфиров являются тетрагидрофуран, 2-метилтетрагидрофуран и тому подобное.
Примерами цепочечных простых эфиров являются диметоксиэтан и тому подобное.
Примерами лактонных соединений являются γ-бутиролактон и тому подобное.
Примерами цепочечных сложных эфиров являются метилпропионат, метилацетат, этилацетат, метилформиат и тому подобное.
Примерами нитрильных соединений являются ацетонитрил и тому подобное.
Примерами амидных соединений являются диметилформамид и тому подобное.
Примерами сульфоновых соединения являются сульфолан, метилсульфолан и тому подобное.
Предпочтительны циклические сложные эфиры карбоновых кислот, цепочечные сложные эфиры карбоновых кислот, нитрильные соединения и сульфоновые соединения.
Указанные растворители могут быть использованы по одному, или по меньшей мере два вида растворителей могут быть использованы в смеси. Примерами предпочтительных смесей органических растворителей являются смеси циклического сложного эфира карбоновой кислоты и цепочечного сложного эфира карбоновой кислоты, такие как смеси этиленкарбоната и диметилкарбоната, этиленкарбоната и этилметилкарбоната, этиленкарбоната и диэтилкарбоната, пропиленкарбоната и диметилкарбоната, пропиленкарбоната и этилметилкарбоната и пропиленкарбоната и диэтилкарбоната, смеси цепочечных сложных эфиров карбоновых кислот, таких как диметилкарбонат и этилметилкарбонат, и смеси соединений сульфолана, таких как сульфолан и метилсульфолан. Более предпочтительны смеси этиленкарбоната и этилметилкарбоната, пропиленкарбоната и этилметилкарбоната и диметилкарбоната и этилметилкарбоната.
Когда соль четвертичного аммония по изобретению используют в качестве электролита, концентрация электролита предпочтительно по меньшей мере 0,1 M, более предпочтительно по меньшей мере 0,5 M и наиболее предпочтительно по меньшей мере 1 M. Если концентрация менее чем 0,1 M, результатом будет низкая электрическая проводимость, приводящая к электрохимическим устройствам с ухудшенными эксплуатационными характеристиками. Верхним пределом концентрации является концентрация разделения фаз, когда электролит является жидкой солью при комнатной температуре. Когда раствор не разделяется, предельная концентрация 100%. Когда соль является твердой при комнатной температуре, предельной концентрацией является концентрация, при которой раствор насыщается солью.
Электролит по данному изобретению может быть использован в смеси с электролитами, иными, чем электролиты по изобретению. Примерами электролитов для использования в смеси с электролитом по изобретению являются соли щелочных металлов, соли четвертичного аммония, соли четвертичного фосфония и т.д. Эти электролиты могут быть использованы по одному, или по меньшей мере два вида их применимы в сочетании как смешанные с электролитом по изобретению. Применимые соли щелочных металлов включают соли лития, соли натрия и соли калия. Примерами таких солей лития являются гексафторфосфат лития, борфторид лития, перхлорат лития, трифторметансульфонат лития, сульфонилимид лития, сульфонилметид лития и тому подобное, которые однако не являются ограничительными. Примерами применимых солей натрия являются гексафторфосфат натрия, борфторид натрия, перхлорат натрия, трифторметансульфонат натрия, сульфонилимид натрия, сульфонилметид натрия и тому подобное. Примерами применимых солей калия являются гексафторфосфат калия, борфторид калия, перхлорат калия, трифторметансульфонат калия, сульфонилимид калия, сульфонилметид калия и тому подобное, хотя они не являются ограничительными.
Применимые соли четвертичного аммония включают соли тетраалкиламмония, соли имидазолия, соли пиразолия, соли пиридиния, соли триазолия, соли пиридазиния и т.д., которые не являются ограничительными. Примерами применимых солей тетраалкиламмония являются тетрафторборат тетраэтиламмония, тетрафторборат тетраметиламмония, тетрафторборат тетрапропиламмония, тетрафторборат тетрабутиламмония, тетрафторборат триэтилметиламмония, тетрафторборат триметилэтиламмония, тетрафторборат диметилдиэтиламмония, тетрафторборат триметилпропиламмония, тетрафторборат триметилбутиламмония, тетрафторборат диметилэтилпропиламмония, тетрафторборат метилэтилпропилбутиламмония, тетрафторборат N,N-диметилпирролидиния, тетрафторборат N-этил-N-метилпирролидиния, тетрафторборат N-метил-N-пропилпирролидиния, тетрафторборат N-этил-N-пропилпирролидиния, тетрафторборат N,N-диметилпиперидиния, тетрафторборат N-метил-N-этилпиперидиния, тетрафторборат N-метил-N-пропилпиперидиния, тетрафторборат N-этил-N-пропилпиперидиния, тетрафторборат N,N-диметилморфолиния, тетрафторборат N-метил-N-этилморфолиния, тетрафторборат N-метил-N-пропилморфолиния, тетрафторборат N-этил-N-пропилморфолиния и тому подобное, хотя указанные примеры не являются ограничительными.
Примерами солей имидазолия являются тетрафторборат 1,3-диметилимидазолия, тетрафторборат 1-этил-3-метилимидазолия, тетрафторборат 1,3-диэтилимидазолия, тетрафторборат 1,2-диметил-3-этилимидазолия и тетрафторборат 1,2-диметил-3-пропилимидазолия, но без ограничения указанными. Примерами солей пиразолия являются тетрафторборат 1,2-диметилпиразолия, тетрафторборат 1-метил-2-этилпиразолия, тетрафторборат 1-пропил-2-метилпиразолия и тетрафторборат 1-метил-2-бутилпиразолия, но без ограничения указанными. Примерами солей пиридиния являются тетрафторборат N-метилпиридиния, тетрафторборат N-этилпиридиния, тетрафторборат N-пропилпиридиния и тетрафторборат N-бутилпиридиния, но без ограничения указанными. Примерами солей триазолия являются тетрафторборат 1-метилтриазолия, тетрафторборат 1-этилтриазолия, тетрафторборат 1-пропилтриазолия и тетрафторборат 1-бутилтриазолия, но без ограничения указанными. Примерами солей пиридазиния являются тетрафторборат 1-метилпиридазиния, тетрафторборат 1-этилпиридазиния, тетрафторборат 1-пропилпиридазиния и тетрафторборат 1-бутилпиридазиния, но без ограничения указанными. Примерами солей четвертичного фосфония являются тетрафторборат тетраэтилфосфония, тетрафторборат тетраметилфосфония, тетрафторборат тетрапропилфосфония, тетрафторборат тетрабутилфосфония, тетрафторборат триэтилметилфосфония, тетрафторборат триметилэтилфосфония, тетрафторборат диметилдиэтилфосфония, тетрафторборат триметилпропилфосфония, тетрафторборат триметилбутилфосфония, тетрафторборат диметилэтилпропилфосфония, тетрафторборат метилэтилпропилбутилфосфония, но без ограничения указанными. Они применимы по одной или по меньшей мере по две из них.
Применимые примеры включают те, которые приведены выше, в которых тетрафторборат замещен бистрифторметансульфонилимидом, гексафторфосфатом или трифторацетатом.
Когда электролит по изобретению должен быть смешан с вышеупомянутым электролитом для применения в качестве электролита, высшей предельной концентрацией вышеупомянутого электролита, который должен быть использован в смеси, является концентрация, допускающая осаждение или разделение электролита. Низшая предельная концентрация электролита, который должен быть использован в смеси, зависит от вида электрохимического устройства, которое должно быть изготовлено. Например, когда электролит, который должен быть использован в смеси для применения в качестве электролита для конденсаторов с двойным электрическим слоем, его низшая предельная концентрация 0 М, так как соль четвертичного аммония по изобретению применима и одна. Для применения в литиевых элементах по меньшей мере вышеупомянутая соль лития используется в смеси. Концентрация соли лития предпочтительно по меньшей мере от 0,1 M до не более чем 2,0 M, более предпочтительно по меньшей мере от 0,15 M до не более чем 1,5 M, еще более предпочтительно по меньшей мере от 0,2 M до не более чем 1,2 M. Особенно предпочтительна концентрация по меньшей мере от 0,3 M до не более чем 1,0 M.
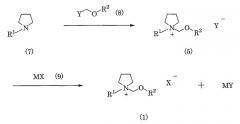
Соль четвертичного аммония (1) по данному изобретению может быть получена различными способами. Типичные из этих способов представлены уравнением 1 и уравнением 2, приведенными ниже.
Способ получения по уравнению 1
Алкилпирролидин формулы (7), где R1 имеет указанные выше значения, подвергают взаимодействию с соединением формулы (8), где R2 имеет указанные выше значения и Y представляет Cl, Br, I или тому подобное, чтобы получить соль четвертичного аммония формулы (5), которую затем подвергают взаимодействию с соединением формулы (9), чтобы получить соль четвертичного аммония формулы (1), где X является иным, чем Y. M в формуле (9) представляет один из атомов, включая атомы водорода, атомы щелочных металлов, таких как Na, K и Li, атомы щелочноземельных металлов, таких как Ca, Mg и Ba, и атомы металлов, таких как Ag. X представляет CF3CO2, CF3SO3, N(CF3SO2)2, N(CF3CF2SO2)2, C(CF3SO2)3, N(CF3SO2)(CF3CO), BF4, PF6 и т.д.
Алкилпирролидин формулы (7) подвергают взаимодействию с соединением формулы (8), посредством чего получают соль четвертичного аммония формулы (5) по изобретению.
Алкилпирролидин формулы (7), служащий в качестве исходного вещества, и соединение формулы (8), оба, являются известными веществами. Примерами алкилпирролидинов формулы (7) являются метилпирролидин, этилпирролидин, N-пропилпирролидин, изопропилпирролидин, н-бутилпирролидин, изобутилпирролидин, трет-бутилпирролидин и т.д. Примерами соединений формулы (8) являются хлорметил-метиловый простой эфир, бромметил-метиловый простой эфир, иодметил-метиловый простой эфир, хлорметил-этиловый простой эфир, бромметил-этиловый простой эфир, иодметил-этиловый простой эфир и т.д. Два соединения подвергают взаимодействию в подходящем растворителе.
Растворителем, который должен быть использован, может быть большое разнообразие известных растворителей, при условии, что они способны растворять алкилпирролидин формулы (7) и соединение формулы (8) и не оказывают вредного влияния на реакцию. Примерами таких растворителей являются бензол, толуол, ксилол и подобные ароматические углеводороды, дихлорметан, хлороформ, тетрахлорид углерода и подобные галогениды углеводородов, метанол, этанол, изопропанол, н-бутанол, трет-бутанол и подобные низшие спирты, ацетон, метилэтилкетон и подобные кетоны, диэтиловый простой эфир, диизопропиловый простой эфир и подобные простые эфиры, н-гексан, н-гептан и подобные алифатические углеводороды, циклогексан и подобные алифатические углеводороды и т.д. Из указанных растворителей предпочтительны толуол и подобные ароматические углеводороды, хлороформ и подобные галогениды углеводородов и ацетон и подобные кетоны. Указанные растворители могут быть использованы по одному, или по меньшей мере два из них применимы в смеси. Особенно предпочтительны для применения растворители, которые свободны от воды (вплоть до содержания воды 1000 м.д.).
Алкилпирролидин формулы (7) и соединение формулы (8) используют в соотношении обычно от 0,5 до 5 моль, предпочтительно от 0,9 до 1,2 моль, последнего на моль первого.
Взаимодействие алкилпирролидина формулы (7) с соединением формулы (8) проводят обычно при -30 до 100°C, более конкретно при -10 до 40°C. Взаимодействие завершается обычно за период от нескольких часов до около 24 часов.
Взаимодействие соли четвертичного аммония формулы (5), полученной выше, с соединением формулы (9) проводят обычно путем реакции обмена соли.
Соединение формулы (9), используемое в качестве исходного вещества, является известным соединением. Его примерами являются CF3CO2H, CF3CO2Li, CF3CO2Na, CF3CO2K, CF3SO3H, CF3SO3Li, CF3SO3Na, CF3SO3K, HN(CF3SO2)2, LiN(CF3SO2)2, NaN(CF3SO2)2, K(CF3SO2)2, HN(CF3CF2SO2)2, LiN(CF3CF2SO2)2, NaN(CF3CF2SO2)2, KN(CF3CF2SO2)2, HC(CF3SO2)3, LiC(CF3SO2)2, NaC(CF3SO2)3, KC(CF3SO2)3, HN(CF3SO2)(CF3CO), LiN(CF3SO2)(CF3CO), NaN(CF3SO2)(CF3CO), KN(CF3SO2)(CF3CO), HBF4, LiBF4, NaBF4, KBF4, AgBF4, HPF6, LiPF6, NaPF6, KPF6 и AgPF6.
Эту реакцию проводят в подходящем растворителе. Растворителем, который должен быть использован, может быть большое разнообразие известных растворителей, при условии, что они способны растворять соль четвертичного аммония формулы (5) и соединение формулы (9) и не оказывают вредного влияния на реакцию. Примерами таких растворителей являются вода, дихлорметан, хлороформ, тетрахлорид углерода и подобные галогениды углеводородов, метанол, этанол, изопропанол, н-бутанол, трет-бутанол и подобные низшие спирты, ацетон, метилэтилкетон и подобные кетоны, этилацетат, бутилацетат и подобные сложные эфиры, диметилсульфоксид, диметилформамид и подобные апротонные полярные растворители. Из них предпочтительны метанол и подобные низшие спирты, хлороформ и подобные галогениды углеводородов и вода. Указанные растворители применимы по одному или по меньшей мере два из них применимы в смеси.
Соль четвертичного аммония формулы (5) и соединение формулы (9) используют в соотношении обычно от 0,3 до 5 моль, предпочтительно от 0,9 до 1,2 моль, последнего на моль первой.
Взаимодействие соли четвертичного аммония формулы (5) с соединением формулы (9) обычно происходит быстро, так что раствор двух реагентов, которые растворены в растворителе, реагирует при 5-150°C в течение от около 10 минут до около 2 часов.
Желательные продукты, полученные в указанных соответствующих реакциях, могут быть легко выделены из реакционной смеси обычными приемами выделения и очистки, такими как центрифугирование, концентрирование, промывание, экстракция органическим растворителем, хроматография и перекристаллизация.
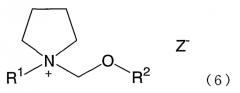
В случае, когда продукт предназначается для такого применения, где присутствие галогена в продукте нежелательно, количество присутствующего галогена может быть уменьшено путем нейтрализации соли галогена или обмена соли, чтобы удалить галоген, и дополнительного превращения продукта в соль в соответствии с предполагаемым применением. Примерами применимых нейтрализующих агентов являются соли щелочных металлов, соли щелочноземельных металлов, органические соли щелочных металлов, соли серебра и т.д. Более конкретными примерами таких агентов являются карбонат натрия, карбонат калия, карбонат лития, карбонат кальция, гидрокарбонат натрия, гидрокарбонат калия, гидрокарбонат лития, гидрокарбонат кальция, гидроксид натрия, гидроксид калия, гидроксид лития, гидроксид кальция, перхлорат натрия, перхлорат калия, перхлорат лития, ацетат натрия, ацетат калия, сульфат серебра, нитрат серебра, перхлорат серебра и т.д. Реакция может быть проведена таким же образом как методика получения соли четвертичного аммония формулы (1). Дегалогенированное промежуточное соединение может быть представлено формулой (6)
где R1 представляет алкил с прямой или разветвленной цепью, имеющий от 1 до 4 атомов углерода, R2 представляет метил или этил, и Z- представляет 1/2CO3 2-, HCO3 -, 1/2SO4 2-, ClO4 -, CH3CO2 - или OH-.
Его примерами являются карбонат 1-метоксиметил-1-метилпирролидиния, гидроксид 1-метоксиметил-1-метилпирролидиния, сульфонат 1-метоксиметил-1-метилпирролидиния, перхлорат 1-метоксиметил-1-метилпирролидиния, ацетат 1-метоксиметил-1-метилпирролидиния, гидрокарбонат 1-метоксиметил-1-метилпирролидиния, карбонат 1-этоксиметил-1-метилпирролидиния, гидроксид 1-этоксиметил-1-метилпирролидиния, сульфонат 1-этоксиметил-1-метилпирролидиния, перхлорат 1-этоксиметил-1-метилпирролидиния, ацетат 1-этоксиметил-1-метилпирролидиния, гидрокарбонат 1-этоксиметил-1-метилпирролидиния, карбонат 1-этил-1-метоксиметилпирролидиния, гидроксид 1-этил-1-метоксиметилпирролидиния, сульфонат 1-этил-1-метоксиметилпирролидиния, перхлорат 1-этил-1-метоксиметилпирролидиния, ацетат 1-этил-1-метоксиметилпирролидиния и гидрокарбонат 1-этил-1-метоксиметилпирролидиния. Методика получения соли четвертичного аммония формулы (1) применима также как следующая методика превращения дегалогенированной соли в соль в соответствии с предполагаемым применением.
Конкретно установлено, соль четвертичного аммония формулы (1), где X представляет BF4, получают из соли четвертичного аммония формулы (5) по реакции, описанной ниже. Соль четвертичного аммония формулы (5) растворяют в одном из низших спиртов, указанных выше, и конкретное количество фторбората, такого как метанол-борфтористая кислота или борфторид серебра (например, вплоть до 70 мас.% в концентрации борфтористой кислоты) добавляют к раствору, чтобы провести реакцию при 5-150°C в течение около 30 минут. Галогенид водорода, образующийся в результате реакции, отгоняют, галогенид серебра или подобную соль галогена отфильтровывают, и фильтрат концентрируют в вакууме и сушат, посредством чего желательное соединение может быть выделено. Галогенид водорода может быть удален, например, центрифугированием, барботированием газообразного N2 при поддерживании системы горячей (например, при 60-150°C) или перегонкой в вакууме. Когда соль четвертичного аммония, полученная по указанной выше методике, должна быть использована в качестве электролита, содержащаяся вода будет вредно влиять на экплуатационные характеристики устройства, поэтому необходимо полностью удалять воду. Воду можно удалить барботированием газообразного N2 через систему, пока система горячая, или перегонкой в вакууме, принимая во внимание, что указанные способы не являются ограничительными. Содержание воды в солевом электролите предпочтительно вплоть до 100 м.д., более предпочтительно вплоть до 50 м.д., еще более предпочтительно вплоть до 30 м.д., наиболее предпочтительно вплоть до 10 м.д.
Соль четвертичного аммония формулы (1), где X представляет N(SO2CF3)2, получают из соли четвертичного аммония формулы (5) путем процедуры реакции, конкретно описанной ниже. Соль четвертичного аммония формулы (5) растворяют в воде, конкретное количество соли щелочного металла бистрифторметансульфонилимида (литиевой соли, натриевой соли, калиевой соли или подобной соли бистрифторметансульфонилимида) добавляют к раствору с последующей реакцией при 0-50°C в течение времени от 30 минут до нескольких часов. Образовавшийся желательный продукт экстрагируют из подходящего растворителя (такого как дихлорметан, хлороформ или этилацетат) и экстракт промывают водой, затем концентрируют в вакууме и сушат, посредством чего желательный продукт может быть выделен. Когда соль четвертичного аммония, полученная по такой методике, предназначается для использования в качестве электролита, содержащаяся вода будет вредно влиять на эксплуатационные характеристики устройства, следовательно, необходимо полностью удалить воду. Воду можно удалить барботированием газообразного N2 через систему, поддерживая систему горячей, или перегонкой в вакууме, причем эти методы не являются ограничительными. Содержание воды в солевом электролите предпочтительно вплоть до 100 м.д., более предпочтительно вплоть до 50 м.д., еще более предпочтительно вплоть до 30 м.д., наиболее предпочтительно вплоть до 10 м.д.
Соль четвертичного аммония формулы (1), предназначенная для применения, где присутствие галогена в продукте нежелательно, получают по реакции, подробно описанной ниже. Соль четвертичного аммония формулы (5) растворяют в метаноле или воде и конкретное количество соли металла, иной, чем соли галогенов, такой как карбонат натрия или сульфат серебра, добавляют к раствору, чтобы осуществить реакцию при 0-50°C в течение около 1 часа. Растворитель затем удаляют или сушат в вакууме, остаток растворяют снова в растворителе, в котором соль металла с галогеном, образовавшаяся при реакции, нерастворима, а соль четвертичного аммония растворима, таком как дихлорметан или подобный галогенсодержащий растворитель, или изопропанол, бутанол или подобный спирт, и соль галогена отфильтровывают. Фильтрат концентрируют в вакууме и сушат, посредством чего может быть получена соль четвертичного аммония, из которой галоген преимущественно удален. Когда желательной солью является, например, соль фторсодержащего аниона, процесс превращения для осуществления на практике будет описан.