Количественный анализ, позволяющий одновременно обнаруживать и идентифицировать бактериальные инфекции
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и биотехнологии и может быть использовано в медицине. Видовой источник эубактерий в клиническом образце выявляют и идентифицируют с помощью ПЦР-анализа, проводимого в реальном масштабе времени. Для этого амплифицируют сегмент гена 16S рРНК эубактерий, содержащий консервативную и дивергентную область, в присутствии по крайней мере двух флуорогенных зондов, содержащих красители-репортеры и красители-гасители. Один из флуорогенных зондов подбирают таким образом, что он гибридизуется с указанной консервативной областью. Другой флуорогенный зонд подбирают таким образом, что он гибридизуется с дивергентной областью гена вида эубактерий, предположительно присутствующего в клиническом образце. В одном из вариантов анализа до добавления образца, содержащего ДНК-матрицу, смесь для ПЦР фильтруют. Для амплификации сегмента гена 16S рРНК разработана пара праймеров, комплементарных участкам указанного гена, консервативным для различных видов эубактерий. Данную пару праймеров и указанные флуорогенные зонды используют в составе набора для выявления и определения видового источника бактериемии в клиническом образце. 4 н. и 48 з.п. ф-лы, 5 ил., 5 табл.
Реферат
Данная заявка заявляет приоритет находящейся одновременно на рассмотрении предварительной заявки № 60,272642 и включает в себя посредством ссылки указанную заявку, поданную 1 марта 2001, раскрытие которой специально включено в описание.
Изобретение выполнено на средства Национальных институтов здоровья по гранту 3М01RR00052-39-5(S1). Поэтому правительство США сохраняет свои права на данное изобретение.
Область изобретения
Изобретение относится к области клинической диагностики. В частности, оно относится к диагностике общих и специфических бактериальных инфекций.
Предпосылки изобретения
В настоящее время стандартный метод диагностики присутствия патогенных бактерий в клинических образцах основывается на культуральных способах. Однако в этом направлении проводятся активные исследования с помощью новых молекулярных методов, для уменьшения времени обнаружения и повышения чувствительности анализа. Для достижения указанных целей была применена полимеразная цепная реакция (PCR, ПЦР) в качестве желаемого молекулярного метода. Пригодность ПЦР и других молекулярных методов подтверждается последними указаниями, исходящими от Национального комитета по клиническим лабораторным стандартам 1999, который поддерживает применение таких методов в клинических лабораториях, осуществляющих анализы по идентификации бактерий [11].
Для выявления какой-либо патогенной бактерии, присутствующей в клиническом образце, исследователи применяли для отжига праймеры к областям ДНК, которые являются консервативными областями для широкого ряда бактериальных геномов. Конструирование таких универсальных праймеров часто сосредоточивалось на гене 16S рРНК [14]. Присутствие множества копий данного гена в геноме бактерий способствует его амплификации посредством ПЦР. Кроме того, достаточная вариабельность последовательностей позволяет извлекать филогенетическую информацию с целью идентификации микроорганизмов. Однако вплоть до настоящего времени, для проведения анализов, осуществляющих как универсальное выявление микроорганизмов, так и идентификацию их видов, требуется вторая стадия обработки после ПЦР, которая может быть технически объемной и увеличивать время.
Загрязнение "портит" универсальные системы обнаружения бактерий, основанные на ПЦР. Высокая консервативность последовательности области ДНК, выбранной для отжига с праймерами в реакциях ПЦР, сопряженная с большой способностью к амплификации, приводит к амплификации очень небольшого бактериального загрязнения, приводящей к ложным положительным результатам. При попытках очистить материалы для ПЦР от загрязнений были привлечены почти все известные способы разрушения ДНК, включая УФ-облучение, обработку посредством 8-МР и инкубацию с различными ферментами, такими как ДНК-азы, рестриктазы или комбинации двух указанных способов [2, 3]. Установлено, что до сих пор ни один из данных способов не был вполне эффективным или воспроизводимым.
Оценка бактериального загрязнения может быть сделана с наибольшей достоверностью путем осуществления в реальном масштабе времени способов обнаружения, которые позволяют охарактеризовать амплификацию в ПЦР-анализе. Кратко, выполняемые в реальном масштабе времени амплификации посредством ПЦР описывают по количеству циклов, в течение которых продукт ПЦР существенно накапливается выше базисной линии, как было установлено с помощью взаимодействия с флуорогенными зондами (СТ) [7]. Помимо выигрыша во времени и затраченной работе, данный способ оказался более объективным и последовательным, чем традиционные методы обнаружения амплификацией и количественного определения матрицы с помощью гель-электрофореза [13]. Однако, используя этот более точный способ, Corless et al. обнаружил, что самые наилучшие способы очистки от загрязнений снижали чувствительность ПЦР. В результате этих исследований было сделано заключение, что эффект очищения от загрязнений, являющийся результатом вышеупомянутых методологий, может быть, по крайней мере, отчасти объяснен снижением чувствительности системы амплификации при ПЦР.
Возможности ПЦР, проводимой в реальном масштабе времени, производить количественную оценку, таким образом, переопределили стандарты, с помощью которых измеряют степень очистки от загрязнений. Для получения отрицательных результатов в отношении контролей требуется не только особый способ, основанный на применении в реальном масштабе времени более точной системы, включающей зонды, но также сохранение чувствительности анализа, выполняемого посредством ПЦР. До сих пор не уменьшается потребность в совершенствовании методов, которые позволят сохранить чувствительность метода и исключить ложные положительные результаты при обнаружении бактериальных инфекций.
Краткое описание изобретения
Один аспект настоящего изобретения относится к способу обнаружения и идентификации видового источника эубактериальной ДНК в образце. ДНК-матрица в образце амплифицируется с помощью полимеразной цепной реакции (PCR, ПЦР), проводимой в реальном масштабе времени. Для осуществления ПЦР применяют праймеры и, по крайней мере, два флуорогенных зонда. Праймеры амплифицируют сегмент гена 16S рРНК S. aureus, содержащий консервативную область и первую дивергентную область в случае, если ген 16S рРНК S. aureus присутствует в реакционной смеси для ПЦР. Консервативная область содержит, по крайней мере, 18 смежных нуклеотидов, которые, по крайней мере, на 80% идентичны, по крайней мере, у 10 видов эубактерий. Первая дивергентная область содержит, по крайней мере, 10 смежных нуклеотидов и отличается, по крайней мере, 3-мя нуклеотидами от второй дивергентной области, найденной в гене 16S рРНК Bradyrhizobium japonicum. Каждый из флуорогенных зондов содержит краситель-репортер и краситель-тушитель. Первый из двух флуорогенных зондов гибридизуется с консервативной областью, a второй из двух флуорогенных зондов гибридизуется с третьей дивергентной областью первого вида эубактерии. Красители-репортеры первого и второго зондов имеют непересекающиеся спектры излучения. Флуоресценцию красителей-репортеров контролируют. Присутствие эубактерий в образце выявляют в случае, если обнаруживают флуоресценцию, характерную для красителя-репортера первого зонда. Присутствие первого вида эубактерий в образце выявляют в случае, если обнаруживают флуоресценцию, характерную для красителя-репортера второго зонда.
Другой аспект изобретения относится к другому способу выявления и идентификации видового источника ДНК эубактерий в образце. Реакционную смесь для ПЦР, проводимой в реальном масштабе времени, фильтруют для удаления загрязнений в виде двухнитевой молекулы ДНК, имеющей длину ≥125 пар оснований, получая фильтрат. Реакционная смесь для ПЦР содержит праймеры и, по крайней мере, два флуорогенных зонда. Праймеры амплифицируют сегмент гена 16S рРНК S. aureus, содержащий консервативную область и первую дивергентную область, в случае, если ген 16S рРНК S. aureus присутствует в реакционной смеси для ПЦР. Консервативная область содержит, по крайней мере, 18 смежных нуклеотидов, которые, по крайней мере, на 80% идентичны, по крайней мере, у 10 видов эубактерий. Первая дивергентная область содержит, по крайней мере, 10 смежных нуклеотидов и отличается, по крайней мере, 3-мя нуклеотидами от второй дивергентной области гена 16S рРНК Bradyrhizobium japonicum. Каждый из зондов содержит краситель-репортер и краситель-тушитель. Первый из двух флуорогенных зондов гибридизуется с консервативной областью, a второй из двух флуорогенных зондов гибридизуется с третьей дивергентной областью первого вида эубактерий. Красители-репортеры первого и второго зондов имеют непересекающиеся спектры излучения. Образец, содержащий ДНК-матрицу, добавляют к фильтрату. ДНК-матрица в фильтрате амплифицируется. Флуоресценцию красителей-репортеров контролируют. Присутствие эубактерий в образце выявляют в случае, если обнаруживают излучения, характерные для красителя-репортера первого зонда. Присутствие первого вида эубактерий в образце выявляют в случае, если обнаруживают излучения, характерные для красителя-репортера второго зонда.
Другим аспектом изобретения является пара праймеров для полимеразной цепной реакции для амплификации сегмента гена 16S рРНК эубактерий, содержащего консервативную область и дивергентную область. Пара представляет собой праймеры р890F и p1033R (SEQ ID NO:1 и 2, соответственно).
Следующим аспектом изобретения является набор для выявления бактериемии. Одним компонентом набора является пара праймеров, которые амплифицируют сегмент гена 16S рРНК S. aureus в случае, если ген 16S рРНК S. aureus присутствует в реакционной смеси для ПЦР. Сегмент содержит консервативную область и первую дивергентную область. Консервативная область является общей, по крайней мере, для 10 видов эубактерий. Первая дивергентная область содержит, по крайней мере, 10 смежных нуклеотидов и отличается, по крайней мере, 3-мя нуклеотидами от второй дивергентной области гена 16S рРНК Bradyrhizobium japonicum. Другим компонентом набора является, по крайней мере, два флуорогенных зонда. Каждый зонд содержит краситель-репортер и краситель-тушитель. Первый из двух флуорогенных зондов гибридизуется с консервативной областью. Второй из двух флуорогенных зондов гибридизуется с третьей дивергентной областью в первом виде эубактерий. Третья дивергентная область содержит, по крайней мере, 10 смежных нуклеотидов и отличается, по крайней мере, 3-мя нуклеотидами от второй дивергентной области. Красители-репортеры первого и второго зондов имеют непересекающиеся спектры излучения.
Таким образом, настоящее изобретение относится к сфере способов и средств, позволяющих установить как присутствие бактерий в образце, в общем, так и отдельные типы бактерий, присутствующих в одной реакционной смеси.
Краткое описание фигур
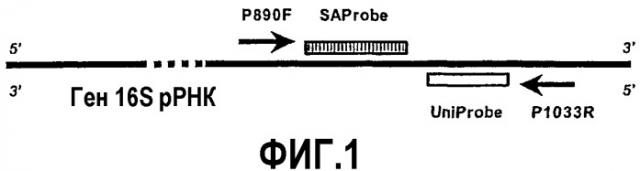
Фиг.1.Конструирование праймеров и зондов. Прямой праймер (P890F) и обратный праймер (P1033R) отжигаются к высококонсервативным областям гена 16S рРНК. Внутреннюю высоконсервативную область выбирали в качестве участка отжига универсального Taqman-зонда (UniProbe), и другая внутренняя область с высокой вариабельностью последовательности была выбрана в качестве участков отжига прототипа видоспецифического зонда для S. aureus (SAProbe).
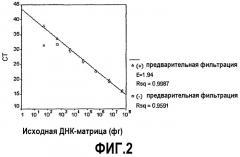
Фиг.2.Обратная линейная зависимость СТ от количества исходной ДНК-матрицы с предварительной фильтрацией и без нее. Величины СТ были получены в результате ПЦР реакций с исходной ДНК-матрицей S. aureus, последовательно разбавленной 1:10 от 50 нг до 5 фг. В случае без предварительной фильтрации (квадрат) на кривой наблюдается нелинейность в области, соответствующей количеству ДНК-матрицы ниже 5 пг, предполагая фоновое загрязнение эубактериальной ДНК данного количества. В случае предварительной фильтрации (треугольник), предел чувствительности простирался до 50 фг.
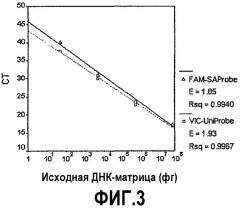
Фиг.3. Сравнение стандартных кривых для ДНК S. aureus с использованием универсального зонда (UniProbe) против S. aureus-специфического зонда(SAProbe). Реакции ПЦР, в результате которых были получены величины СТ для кривых, включали как UniProbe, так и SAProbe, а также исходную ДНК-матрицу S. aureus, которую последовательно разбавляли 1:100 от 50 нг до 50 фг. То, что линии, соответствующие UniProbe (квадрат) и SAProbe (треугольник), почти перекрывают одна другую, указывает на сопоставимые эффективности амплификации и пределы чувствительности для различных зондов, используемых в идентичных реакционных смесях. FAM и VIC относятся к красителям-репортерам.
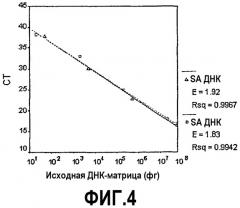
Фиг.4. Сравнение стандартных кривых для ДНК S. aureus против ДНК S. epidermidis, используя универсальный зонд (UniProbe). ПЦР-реакции, в результате которых были получены величины СТ для кривых, включали UniProbe и исходную ДНК-матрицу либо S. aureus, либо S. epidermidis. ДНК S. aureus последовательно разбавляли 1:100 от 50 нг до 50 фг, в то время как ДНК S. epidermidis разбавляли от 20 нг до 20 фг. Равнозначность линий указывает на то, что UniProbe проявляет одинаковую способность к выявлению микроогранизма, независимую от использования ДНК S. aureus (треугольник) или ДНК S. epidermidis (квадрат) в качестве исходной матрицы.
Фиг.5. Конструирование праймеров и зондов для TaqMan ПЦР-анализа.
Подробное описание изобретения
Авторы настоящего изобретения разработали систему, основанную на множестве зондов и включающую ген 16S рРНК, для проводимой в реальном масштабе времени реакции ПЦР, с помощью которой можно одновременно выявлять присутствие ДНК эубактерий и устанавливать ее видовой источник. Кроме того, авторы разработали стадию очистки от загрязнений для данной системы ПЦР, которая позволяет снизить фоновое загрязнение и не влиять на чувствительность определения.
Система основана на применении праймеров для ПЦР, которые отжигаются, в сущности, по всем видам эубактериальных генов 16S рРНК. Ампликон, который праймеры амплифицируют, содержит как консервативную область, так и дивергентную область. Обнаружение консервативной области позволяет определить эубактерии в общем. Обнаружение особой дивергентной области позволяет идентифицировать особый вид эубактерий. См. фиг.5.
Для проведения анализа применяют полимеразную цепную реакцию (ПЦР), выполняемую в реальном масштабе времени. Указанный анализ известен в данной области техники и может быть осуществлен на практике согласно известным методам. Для примера, дана ссылка 8. Кратко, флуорогенные зонды связываются с молекулами-матрицами и деградируются при амплификации матрицы посредством ДНК-полимеразы. Деградация зондов вызывает повышение уровня флуоресценции, которую контролируют во времени. Кинетика повышения уровня флуоресценции указывает на количество матрицы, присутствующей в реакционной смеси.
Праймеры, используемые в анализах настоящего изобретения, способны амплифицировать сегмент гена 16S рРНК S. aureus, который содержит как консервативную область, так и первую дивергентную область, в случае, если ген 16S рРНК S. aureus присутствует в ПЦР. Праймеры являются практически универсальными в своей применимости среди эубактерий. Таким образом, праймеры амплифицируют сегмент генов 16S рРНК других эубактерий, в структуре которых также содержится как высококонсервативная область, так и дивергентная область. Таким образом, применяемые праймеры будут амплифицировать сегмент 16S рРНК S. aureus в присутствии ДНК-матрицы S. aureus. Но они будут амплифицировать практически любой другой ген 16S рРНК эубактерий в присутствии такой ДНК-матрицы эубактерий. Типичные праймеры представлены на фиг.5. Другие праймеры, обладающие подобными функциональными свойствами, также могут быть применены. Их можно легко выявить с помощью анализа известных последовательностей генов 16S рРНК или при использовании компьютерных программ, таких как ClustalW, из Европейского Института биоинформатики (http://www.ebi.ac.uk/clustalw.htm).
Консервативные области генов 16S рРНК содержат, по крайней мере, 18 смежных нуклеотидов, которые, по крайней мере, на 80% идентичны, по крайней мере, у 10 или, по крайней мере, 14 видов эубактерий. Консервативные области могут содержать, по крайней мере, 15, 20, 25 или 30 смежных нуклеотидов. Предпочтительно, области являются идентичными у широкого ряда эубактериальных видов. Однако дивергенция вплоть до 5, 10, 15 или 20% может быть представлена. Дивергентные области содержат, по крайней мере, 10 смежных нуклеотидов и отличаются, по крайней мере, 3, 4, 5 или 6-ю нуклеотидами от дивергентной области, найденной в гене 16S рРНК Bradyrhizobium japonicum. Например, такие области зарегистрированы в банке генов под номерами D12781, X87272 и X71840. Дивергентные области могут содержать между 10 и приблизительно 30 смежными нуклеотидами и могут содержать, по крайней мере, 15, 20 или 25 смежных нуклеотидов.
Флуорогенные зонды содержат краситель-репортер и краситель-тушитель. В каждом анализе согласно изобретению используют один зонд для гибридизации с консервативной областью и, по крайней мере, один зонд используют для гибридизации с дивергентной областью эубактерий. Если какие-либо бактерии присутствуют, независимо от вида, то произойдет гибридизация с консервативной областью. Однако гибридизации может не произойти с дивергентным зондом, если зонд не соответствует виду присутствующей эубактерии. Одновременно может быть использовано множество дивергентных зондов в одной или во множестве реакций ПЦР, проводимых в реальном масштабе времени, для идентификации отдельного вида. Гибридизация, применяемая согласно настоящему изобретению, относится к гибридизации при стандартных условиях, применяемых для ПЦР, проводимой в реальном масштабе времени, с целью достижения амплификации.
Красители, содержащиеся в зондах, используемых в одной реакции, предпочтительно имеют непересекающиеся спектры излучения. Таким образом, их сигналы могут быть интерпретированы однозначно, как отображающие гибридизацию и/или амплификацию отдельного зонда без дальнейшего испытания.
Праймеры согласно настоящему изобретению определяют на основе их связи с геном 16S рРНК S. aureus. Однако, как обсуждалось выше, другие праймеры, обладающие подобными свойствами, также могут быть использованы. Предпочтительный ампликон, который содержит как консервативную, так и дивергентную область, заключенную между двумя консервативными областями для связывания с праймером, предпочтительно содержит, по крайней мере, 100, 125, 150, 160 или 170 пар оснований. Больший по размеру ампликон позволяет идентифицировать больше дивергентных областей, которые могут быть использованы для однозначной идентификации видов эубактерий. Подходящий сегмент гена 16S рРНК S. aureus содержит нуклеотиды от 890 до 1051. Консервативная область гена 16S рРНК S. aureus в данном сегменте, который преимущественно используют, содержит нуклеотиды от 1002 до 1024 гена 16S рРНК S. aureus. Дивергентная область в данном сегменте, который может быть применен для идентификации S. aureus, содержит нуклеотиды от 945 до 978 гена 16S рРНК S. aureus. Особенно предпочтительными праймерами являются р890F и p1033R (SEQ ID NO:1 и 2, соответственно).
Образцами, которые должны быть проверены, являются предпочтительно клинические образцы, которые легко получить и легко хранить. Подходящие образцы включают, без ограничений, кровь, мочу, слюну, слезы, пот, спинномозговую жидкость, лимфу, сыворотку и плазму. Образцы могут быть обработаны способами, известными в данной области, для высвобождения ДНК из клеток в образцах. Особенно предпочтительными образцами являются образцы от больных, у которых на основании клинических результатов предполагается наличие бактериемии.
Один способ удаления бактериальной ДНК, которая может нежелательно загрязнять реагенты или сосуды, заключается в применении стадии фильтрации. Предпочтительно, при фильтровании реагентов будут удаляться двухнитевые молекулы ДНК, имеющие длину ≥125 пар оснований. Альтернативная стадия очистки от загрязнений может включать расщепление нежелательных загрязняющих молекул ДНК с помощью рестрицирующих эндонуклеаз. Следует убедиться в том, что праймеры и зонды не подвержены расщеплению используемыми рестрицирующими эндонуклеазами. Предпочтительно, участок расщепления должен находиться в ампликоне, а не в самих праймерах. Таким образом, все компоненты реакционной смеси, исключая тестируемый образец, могут быть обработаны рестрицирующей эндонуклеазой. Впоследствии рестрицирующую эндонуклеазу инактивируют для предотвращения деструкции исследуемого вещества в тестируемом образце.
Наборы могут включать все или некоторые реагенты, с помощью которых изобретение будет осуществляться на практике. Реагенты могут содержаться в одном контейнере или в различных контейнерах. Реагенты могут быть представлены, например, в лиофилизированном виде или в виде раствора или суспензии. Желательно, чтобы в набор были включены праймеры, поскольку они являются зондами для консервативной области и для одной или более дивергентных областей одной или более одной эубактерий. Другие реагенты, такие как ферменты и нуклеотиды, также могут быть включены. Также могут быть включены фильтры для очистки реагентов от загрязнений. Кроме того, могут быть включены инструкции для выполнения указанных методов. Инструкции могут быть в виде упаковочных вкладышей или этикеток или ссылок к другим источникам, таким как книги, журналы, узел WWW, компакт-диски и т.д.
Все патенты и патентные заявки, процитированные в данном описании, специально включены в него посредством ссылки. Вышеупомянутое описание, в целом, раскрывает настоящее изобретение. Более полное представление может быть получено при обращении к следующим специфическим примерам, которые приведены только с целью иллюстрации и не ограничивают объем изобретения.
ПРИМЕР 1
Материалы и методы
Виды бактерий и выделение ДНК
Пятнадцать обычных патогенных микроорганизмов, все из которых были эубактериями, за исключением микроорганизма Candida albicans, получали из клинической лаборатории (Division of Medical Microbiology, Johns Hopkins School of Medicine, Baltimore, MD). Виды и их штаммы в АТСС перечислены в таблице 1. Микроорганизмы выращивали в стандартных условиях, и ДНК экстрагировали с помощью набора QIAamp DNA (Qiagen Corp., Santa Clarita, Calif.).
Для построения стандартных кривых для количественной оценки исходной ДНК-матрицы, Staphylococcus aureus растили в питательном бульоне Luria-Bertani (LB) при 37°С при постоянном встряхивании до оптической плотности при 600нм, составляющей 0,6. Затем равные аликвоты наносили на пластинку с целью определения колониеобразующих единиц (CFU) и подвергали экстракции для извлечения ДНК посредством набора QIAamp DNA. Выделенную ДНК оценивали количественно на основании оптической плотности при 260 нм и затем последовательно разбавляли. Аналогичные процедуры выполняли для Staphylococcus epidermidis.
Таблица 1
Олигонуклеотидные последовательности праймеров и зондов, используемые в исследовании
| Олигонуклеотиды | Последовательности (5′ →3′)а | Положениеb (пар оснований) | Флуорофоры | Тm c (°С) |
| Прямой праймер (P890F) | TGGAGCATGTGGTTTAATTCGA | 890-912 | - | 59,1 |
| Обратный праймер (P1033R) | TGCGGGACTTAACCCAACA | 1033-1051 | - | 58,6 |
| Универсальный зонд(UniProbe) | CACGAGCTGACGACARCCATGCA | 1002-1024 | VIC, TAMRA | 67,3/69,3 |
| Зонд Staph aureus(SAProbe) | CCTTTGACAACTCTAGAGATAGAGCCTTCCC | 945-978 | FAM, TAMRA | 65,3 |
| aПоследовательности, используемые для сравнительного анализа первичной структуры Staphylococcus aureus (AF015929), Staphylococcus hominis (AY030318), Enterococcus faecalis (AJ276460), Staphylococcus epidermis (L37605), Enterococcus faecalis (AJ276460), Streptococcus pneumoniae (X58312), Mycoplasma pneumoniae (AF132741), Escherichia coli (AF233451), Hemophilus influenzae (AF224306), Legionella pneumophila (M59157), Neisseria meningitides (AF059671), Rickettsia rickettsii (U11021), Borrelia burgdorferi (AF091368), Bacillus anthracis (AF290552), Yersinia pestis (AF366383), Proteus mirabilis (AF008582) и K. pneumoniae (AF228919).b Положение нуклеотидов, основанное на последовательностях Staphylococcus aureus (AF015929)cTm, температура плавления. |
Конструирование праймеров и зондов
Последовательности гена 16S рРНК из ряда видов бактерий получали из банка генов. Данные относительно последовательностей получали, используя программу Entrez (список представлен ниже). Последовательности выравнивали, используя программу ClustalW из Европейского Института биоинформатики (http://www.ebi.ac.uk/clustalw.htm). Две области высококонсервативных последовательностей, разделенные внутренней областью с высокой вариабельностью последовательности, а также другой смежной внутренней областью высококонсервативной последовательности, были выбраны в качестве участков отжига универсального праймера. Внутренние высококонсервативные и высоковариабельные последовательности были использованы в качестве участков отжига консервативных и видоспецифических зондов Taqman, соответственно (фиг.1).
Праймеры и зонды Taqman были сконструированы согласно инструкциям компьютерной программы ABI Primer Express (PE Applied Biosystems, Foster City, CA). Данная программа подбирает наборы зондов и праймеров с оптимизированными температурами плавления, вторичной структурой, составом оснований и длиной ампликона. Прямой праймер (p890F) и обратный праймер (p1033R) амплифицируют фрагмент из 162 пар оснований, охватывающий нуклеотиды от 890 до 1051 гена 16S рРНК S. aureus (таблица 1). Универсальный зонд Taqman, или UniProbe, был помечен красителем-репортером VIC у 5′ конца и красителем-тушителем TAMRA у 3′ конца, и имел последовательность, которая была обратно комплементарна нуклеотидам от 1002 до 1024 гена 16S рРНК (номер доступа в GenBank AF015929) (таблица 1). Специфический по отношению к S. aureus зонд, или SAProbe, был сконструирован как видоспецифический зонд. SAProbe был помечен другим красителем-репортером, FAM, у 5′ конца и таким же красителем-тушителем у 3′ конца, с последовательностью, которая охватывает нуклеотиды от 945 до 978 гена 16S рРНК S. aureus (номер доступа в Genbank AF015929) (таблица 1). Зонды были сконструированы так, чтобы "отжигаться" к противоположным цепям ДНК-матрицы. Праймеры и зонды были изготовлены PE Applied Biosystems.
Основная смесь для ПЦР и ПЦР, основанная на флуорогенных зондах (TaqMan анализ)
Реакции осуществляли в объемах 50 мкл в 0,5-мл оптических пробирках для ПЦР (PE Applied Biosystems). Основную смесь для ПЦР получали из набора Taqman Core Reagent (PE-Applied Biosystems). Основная смесь содержала 200 мкМ (каждая) dATP, dGTP, dUTP, dCTP, 0,5 Е AmpErase UNG, 2,5 мМ MgCl2, 1X Taqman буфер А, 900 нМ каждого праймера и 100 нМ каждого меченного флуоресцирующим красителем зонда (UniProbe и/или SAProbe). ДНК-матрицу, 2Е ДНК-полимеразы AmpliTaq Gold (PE-Applied Biosystems) и воду добавляли для получения конечного объема 50 мкл каждого образца. ПЦР, основанная на флуорогенных зондах, или анализ Taqman, выполняли с помощью системы ABI 7700 Sequence Detection system (P-Applied Biosystems). Условия осуществления циклов были следующие: 50°С в течение 2 мин, 95°С в течение 10 мин, за которыми следует 40 циклов при 95°С в течение 15 сек и 60°С в течение 1 мин каждый цикл. Все реакции ПЦР выполняли трижды.
Истинный размер продукта ПЦР из каждого анализа подтверждали путем выявления амплифицированного образца из каждой реакционной пробирки на агарозном геле, окрашенном этидийбромидом.
Ультрафильтрация реакционной смеси ПЦР
Стадию ультрафильтрации применяли для фильтрования ПЦР-реакционной смеси до добавления ДНК-матрицы, используя центробежное фильтрующее устройство Amicon Microcon YM-100 (Millipore Corporation, Bedford, Mass.). Реакционная смесь для ПЦР, которая подверглась ультрафильтрации, включала основную смесь для ПЦР и ДНК-полимеразу AmpliTaq Gold. Фильтрующее устройство предотвращает прохождение потенциальных загрязняющих двухнитевых молекул ДНК, состоящих из 125 пар оснований или больше. Реакционную смесь для ПЦР центрифугировали при 100×g в течение 30 минут для освобождения от загрязнений.
Анализ после ПЦР
Данные амплификации анализировали с помощью компьютерной программы SDS (PE-Applied Biosystems), которая рассчитывает ΔRn с помощью уравнения Rn(+)-Rn(-). Rn(+) представляет собой интенсивность излучения репортера, разделенную на интенсивность излучения тушителя в любое данное время, в то время как Rn(-) означает величину Rn(+) до амплификации посредством ПЦР. Таким образом, ΔRn указывает на величину произведенного сигнала. Начальный цикл, или СТ, представляет собой цикл, при котором вначале определяется статистически значимое увеличение в ΔRn. СТ обратно пропорциональна исходному количеству ДНК-мишени. Графики амплификации были построены как ΔRn против СТ (5, 15).
Инвентарные номера нуклеотидных последовательностей
Инвентарные номера в банке генов для последовательностей, определяемых в данном исследовании, являются следующими Staphylococcus aureus (AF015929), Staphylococcus hominis (AY030318), Enterococcus faecalis (AJ276460), Staphylococcus epidermis (L37605), Enterococcus faecalis (AJ276460), Streptococcus pneumoniae (X58312), Mycoplasma pneumoniae (AF132741), Escherichia coli (AF233451), Hemophilus influenzae (AF224306), Legionella pneumophila (M59157), Neisseria meningitides (AF059671), Rickettsia rickettsii (U11021), Borrelia burgdorferi (AF091368), Bacillus anthracis (AF290552), Yersinia pestis (AF366383), Proteus mirabilis (AF008582) и Klebsiella pneumoniae (AF228919).
Расщепление рестрицирующей эндонуклеазой
Рестрицирующая эндонуклеаза, MboII, была выбрана для предварительной обработки основной смеси для ПЦР на основе уникального положения ее сайта рестрикции в амплифицированной области 16S РНК при использовании компьютерной программы Sequencher (Gene Codes Corp.). Фермент MboII был выбран в связи с тем, что он имеет сайт узнавания (5′-GAAGA(N)8 v-3′) в амплифицированной области гена 16S рРНК, которая является высококонсервативной у видов, а в последовательностях зонда и праймера такого участка расщепления не имеется. Способность фермента расщеплять ложноположительный продукт была продемонстрирована путем инкубации 0,20 мкл фермента MboII с 20 мкл продукта при 37°С в течение 1 часа, последующей термоинактивации рестрицирующего фермента при 60°С в течение 90 мин и анализа с помощью гель-электрофореза. Для предварительной обработки реагентов для ПЦР, 0,20 мкл фермента MboII инкубировали с основной смесью для ПЦР и водой DEPC при 37°С в течение 1 часа, затем при 60°С в течение 90 мин, до добавления ДНК-полимеразы Low-DNA AmpliTaq (PE-ABI) и ДНК-матрицы.
Пример 2
Специфичность универсального Taqman ПЦР-анализа
Специфичность праймеров и зондов, используемых для универсальной амплификации гена 16S рРНК эубактерий, была вначале определена при использовании экстрактов геномной ДНК из 14 различных видов бактерий вместе с одним изолятом из Candida albicans (таблица 2). В каждом анализе ПЦР использовали 5 нг очищенной ДНК. Позитивность анализа была установлена путем проверки графика амплификации (СТпротив ΔRn), построенного с помощью компьютерной программы Sequence Detection (фиг.1). Все 14 видов бактерий были правильно амплифицированы и определены с помощью величин СТ в области от 19,2 до 21,8. Амплификации не было обнаружено (СТ>40) в случае использования ДНК, выделенной из C. albicans. Далее, результаты анализа были подтверждены при исследовании продуктов реакции посредством гель-электрофореза с визуализацией полос ожидаемого размера (162 пар оснований) (данные не показаны).
| Таблица 2Специфичность анализа Taqman при использовании универсальных праймеров и зондов | ||
| Выделенные микроорганизмы | Штамм (АТСС) | Результаты Taqman-анализа ПЦР |
| Staphylococcus aureus | 29213 | + |
| Staphylococcus hominis | Клинический изолят | + |
| Staphylococcus epidermidis | Клинический изолят | + |
| Streptococcus agalactiae | Клинический изолят | + |
| Streptococcus pneumoniae | 49619 | + |
| Klebsiella pneumoniae | 990603 | + |
| Listeria monocytogenes | Клинический изолят | + |
| Enterococcus faecalis | 29212 | + |
| Escherichia coli | 25922 | + |
| Proteus mirabilis | 25933 | + |
| Chlamydia pneumoniae | Клинический изолят | + |
| Neisseria gonorhoeae | Клинический изолят | + |
| Neisseria meningitidis | Клинический изолят | + |
| Haemophillus influenzae (Тип А) | 49247 | + |
| Candida albicans | Клинический изолят | - |
ПРИМЕР 3
Теоретический предел чувствительности TaqMan-анализа ПЦР
Чувствительность Taqman-анализа оценивали путем последовательных разведений ДНК эубактерии. Минимальный предел чувствительности системы TaqMan определяли как количество ДНК-матрицы, при котором связь между СТ и исходной ДНК-матрицей становится нелинейной. Образцы с последовательно разведенной ДНК S. aureus (от 50 нг до 5 фг) добавляли к реакционным смесям для ПЦР с универсальными праймерами (p890F + p1033R) и зондом (UniProbe). Результаты представлены в таблице 3. Стандартная кривая, на которой величины СТ отложены против исходной ДНК-матрицы, является линейной между 50 нг и 5 пг (фиг.2). При уровне ДНК ниже 5 пг, данная связь становится нелинейной, величины СТ были подобны величинам СТ контроля без матрицы (NTC). Полученные данные указывают на присутствие загрязняющей ДНК эубактерии в NTC. Таким образом, минимальный предел чувствительности анализа составлял 5 пг ДНК S. aureus.
| Таблица 3Чувствительность Taqman-анализа с предварительной фильтрацией или без нее | |||||||||
| Тип образца | СТ для следующихконцентраций ДНК-матрицы (˜эквивалентна КОЕ)* | ||||||||
| NTCa | 50 нг (107) | 5 нг(106) | 500 пг(105) | 50 пг(104) | 5 пг(103) | 500 фг(102) | 50 фг(15) | 5 фг(1) | |
| (-) фильтр | 31,5 | 16,2 | 19,1 | 22,5 | 25,8 | 29,5 | 31,6 | 31,3 | - |
| (+) фильтр | 40 | 16,8 | 19,6 | 22,8 | 26,2 | 30,0 | 33,7 | 37,8 | >40 |
| * Средние величины, основанные на трех параллельных образцаха Контроль без матрицы |
С целью улучшения предела чувствительности анализа, авторы включали стадию фильтрации реакционной смеси для ПЦР до добавления ДНК-матрицы, кроме обычных превентивных измерений, применяемых для уменьшения загрязняющей ДНК или переносимой ДНК, присутствующей в реагентах для ПЦР. Фильтрующее устройство удерживает загрязняющую ДНК, но позволяет прохождению всех компонентов реакционной смеси для ПЦР, включая праймеры, зонды, Taq-полимеразу и UNG. Применение указанной стадии фильтрации привело к повышению величины СТ контроля без матрицы до 40, при этом эффективно уменьшилось содержание загрязняющей ДНК (таблица 3). Величины СТ при уровнях ДНК (от 50 нг до 5 пг) оставались соизмеримыми в случаях с применением стадии фильтрации или без нее. Кроме того, величины СТ исходной ДНК-матрицы ниже 5 пг и выше 5 пг находились на одной линии с R2=0,998 (фиг.2).
Эффективность (Е) амплификации в случае предварительной фильтрации реакционной смеси для ПЦР рассчитывали, и она составила 1,94 (максимум = 2) на основании уравнения:
Эффективность = е(-1/наклон)
Минимальный предел чувствительности анализа в случае предварительной фильтрации реакционной смеси составил 50 фг ДНК S. aureus (таблица 3). На основании размера генома S. aureus, который приблизительно составляет 2750 тысяч пар оснований, рассчитали, что 50 фг ДНК S. aureus эквивалентны приблизительно 15 геномам или КОЕ. Данный расчет производили следующим образом: 2750 тысяч пар оснований равны 1,8×106 г/моль; деление данной величины на число Авогадро, 6×1023, дает 3 фг на геном S. aureus. Сопоставимые результаты были получены эмпирически на основании подсчета КОЕ на пластинах.
Затем амплифицированные продукты подвергали гель-электрофорезу. Визуализация полос под УФ-лучами подтвердила ожидаемый размер ампликона (данные не показаны).
Пример 4
Анализ с использованием множества зондов
Для того, чтобы продемонстрировать возможность анализа произвести одновременно выявление присутствия любой эубактериальной ДНК и одного или более интересующих видов в одной реакционной пробирке, был разработан опытный образец видоспецифического зонда для S. aureus (SAProbe). Зонд SAProbe метили особым репортерным флуорофором, чтобы его сигнал можно было отличить от универсального зонда. Анализы ПЦР выполняли в реальном масштабе времени с универсальным набором праймера, UniProbe, и зонда SAProbe в одной реакционной смеси. Образцы ДНК-матрицы от одного из трех тесно связанных видов Staphylococcus, S. aureus, S. epidermidis, S. hominis исследовали в трех различных реакциях. Анализ позволил точно установить присутствие ДНК эубактерии во всех трех образцах с помощью красителя VIC. Когда систему для обнаружения ДНК эубактерий перестраивали таким образом, чтобы определить краситель FAM в одних и тех же пробирках с реакционной смесью, только в одной реакционной смеси, содержащей ДНК S. aureus, возникал положительный сигнал (таблица 4).
| Таблица 4Специфичность ПЦР при использовании множества зондов | ||||
| NTCa | S. aureus | S. epidermidis | S. hominis | |
| VIC-UniP |