Микрочастицы, включающие углеводные сферы, ковалентно связанные с аллергеном
Иллюстрации
Показать всеНастоящее изобретение относится к области медицины и касается микрочастиц, включающих сферу, главным образом состоящую из поперечно связанного углевода агарозы и аллергена, ковалентно связанного со сферой, для лечения нарушений иммунной системы. Используют аллерген, полученный из растительной пыльцы, в частности пыльцы тимофеевки луговой. Применение данных микрочастиц позволяет эффективно лечить пациентов с аллергией, уменьшить побочные эффекты при парентеральном применении. 2 н. и 7 з.п. ф-лы, 4 ил., 1 табл.
Реферат
Настоящее изобретение относится к области иммунотерапии и особенно к лечению пациентов, страдающих от аллергических реакций на аллергены, в особенности на аллергены, происходящие из растительной пыльцы.
Аллерген-специфическая иммунотерапия, которая проводится главным образом с помощью инъекций экстрактов аллергенов пациентам с аллергией, была введена много лет тому назад. Проявление тяжелых анафилактических побочных эффектов, вызванных инъекцией водных экстрактов аллергенов, и необходимость вводить большое число инъекций в течение длительных периодов времени побудили к созданию безопасных и эффективных композиций аллергенов. Более шестидесяти лет тому назад экстракты аллергенов, адсорбированные на гидроксиде алюминия, вводили для депо-вакцинации, демонстрируя улучшенные иммуностимулирующие, а также ослабленные анафилактические свойства. Даже в настоящее время гидроксид алюминия является, безусловно, самым распространенным адъювантом, применяемым для инъекционной иммунотерапии.
Аллерген-специфическая иммунотерапия является одной из немногих известных терапий, направленных на причину заболевания, опосредованной IgE аллергии, и многочисленные клинические исследования подтверждают ее клиническую эффективность. Общеизвестная клиническая практика включает подкожную инъекцию экстрактов аллергенов, адсорбированных на гидроксиде алюминия, при постепенно увеличивающихся дозах для поддержания уровня и периоды лечения до 5 лет или более. Гидроксид алюминия предпочитается другим адъювантам (например, масляным эмульсиям, липосомным лекарственным формам) для инъекционной иммунотерапии у людей, т.к. он вызывает сравнительно слабые тканевые реакции. Тем не менее, гидроксид алюминия может вызвать образование местной гранулемы в местах инъекций. Другими основными недостатками гидроксида алюминия являются непредсказуемая эффективность адсорбции некоторых антигенов/экстрактов антигенов, непредсказуемая стабильность адсорбентов, возможность того, что аллергены изменяются в ходе адсорбции, и трудности в оценке качества и количества аллергенов, которые однажды адсорбировались на гидроксиде алюминия.
Объектом настоящего изобретения является обеспечение усовершенствованных форм антигенов, которые могут применяться в особенности для лечения пациентов, страдающих от аллергических реакций.
Настоящее изобретение раскрывает микрочастицы, включающие: (а) сферу, по существу состоящую из углевода, и (б) аллерген, который ковалентно привязан к сфере. Углеводная сфера состоит главным образом из трехмерно связанного полимера, который может быть полиариламидом, виниловым полимером, декстраном или предпочтительно агарозой. Могут также использоваться смеси полимеров. Углеводсодержащая частица состоит из соответствующих полимерных углеводов, предпочтительно агарозы, которая связана в трех направлениях. Соответствующие сферы коммерчески доступны, например, под торговой маркой сефароза. Сферы являются малыми частицами, состоящими из гелеподобного углевода, который образует подложку для антигена. Микрочастица состоит из углеводсодержащей сферы, которая ковалентно связана с антигеном при высокой плотности без разительного изменения его иммунологических свойств.
Микрочастицы по настоящему изобретению имеют определенный размер, который изменяется в диапазоне от 0,1 мкм до 10 мкм и предпочтительно от 0,5 мкм до 5 мкм. Размер микрочастиц является существенным. Распределение размеров означает, что наибольший процент, обычно по меньшей мере 80% всех сфер, находится в данном диапазоне. Конечно, есть некоторое количество сфер за пределами данного диапазона, поскольку распределение диаметров происходит статистически. Однако, применяя специальную технику, можно быть уверенным, что более чем 99% сфер находятся в данном диапазоне.
Микрочастицы по настоящему изобретению содержат по меньшей мере один антиген, который ковалентно присоединен к углеводной сфере. Антиген является соединением, против которого иммунная система животного или человека, будучи иммунизированной, образует антитела. Антигеном может быть любая структура, которая образует эпитоп. Антиген может быть полипептидом, углеводом, подобным, например, гликозильным остаткам, присоединенным к полипептиду или нуклеиновым кислотам. В предпочтительном варианте воплощения изобретения антиген является аллергеном, который происходит из растительной пыльцы. Поверхностные структуры растительной пыльцы являются причинными агентами аллергических реакций. В предпочтительных вариантах по настоящему изобретению аллергены являются структурами, полученными из травяной пыльцы. В особенно предпочтительном варианте по настоящему изобретению аллерген получают из пыльцы тимофеевки луговой Phleumpratense.
Конденсация полученных из углевода сфер с антигеном основана на принципе образования ковалентной связи между углеводным скелетом сферы и реакционноспособной группой антигена. Ковалентная связь может быть образована, например, активацией с помощью бромциана, приводящей к стабильному образованию амидных связей, которая с высокой эффективностью может быть применена к большинству белков и пептидов. Альтернативные способы связывания, которые хорошо известны специалистам, могут также применяться в зависимости от антигена, который должен быть связан со сферой.
В экспериментах по настоящей заявке исследуемый антиген был очищенным рекомбинантным Phi p 5b, основным аллергеном пыльцы тимофеевки луговой, который конденсировали с полученными из углевода частицами (СВР). В примерах тот же самый антиген был только смешан с СВР (в качестве сравнительной пробы), и в другой сравнительной пробе антиген был абсорбирован на гидроксиде алюминия.
В примерах использовали композиции Phi p 5b для иммунизации мышей и анализировали уровни, кинетику и профили образования антител.
В другой серии экспериментов исследовали продукцию цитокинов в культурах клеток мышиной селезенки и инъекционные сайты далее анализировали с помощью гистопатологии. Индуцированные антигеном СВР-rPhl p 5b мышиные антитела исследовали также на перекрестную реакционную способность к природной группе 5 аллергенов из различных трав и их способность подавлять связывание IgE с изучаемым аллергеном у пациентов с аллергией на травяную пыльцу.
Было найдено, что микрочастицы по настоящему изобретению вызывают сопоставимые иммунные реакции, но более слабые реакции гранулематозной ткани, чем гидроксид алюминия. Следовательно, микрочастицы должны иметь меньше побочных эффектов. Кроме того, антитела, индуцированные микрочастицами по настоящему изобретению, блокировали у пациентов с аллергией связывание IgE с rPhl p 5b, что показывает, что микрочастицы могут успешно применяться для лечения пациентов с аллергией.
Настоящее изобретение раскрывает также лекарственное средство для терапии иммунной системы, которое включает микрочастицы по настоящему изобретению. Такое лекарственное средство может быть введено назально, ректально или предпочтительно парентерально. Микрочастицы могут быть включены в соответствующие фармацевтические композиции, как растворы для инъекций, ректальные пены или назальные аэрозоли. Можно также приготовить соответствующие мази или пластыри. Настоящее изобретение обеспечивает также диагностические тест-системы для измерения высвобожденных клеточных медиаторов, которые включают микрочастицы по настоящему изобретению.
Одна система описана в деталях в примере 2 и методике 6.
Результаты настоящих экспериментов показывают, что микрочастицы могут представлять подходящий носитель и адъювант для аллерген-специфичной иммунотерапии, приводя к сопоставимым с гидроксидом алюминия иммунным реакциям. Эксперименты показывают, что очищенный аллерген rPhl p 5b, который ковалентно связан с полученной из углевода сферой, индуцирует у мышей интенсивное образование антител IgGI, IgG2a/b и IgG3. Эти антитела перекрестно реагируют с природной группой 5 аллергенов из всех 5 видов травы, содержащих группу 5 аллергенов, и, возможно, более важные конкурируют со связыванием антител к IgE с Phi p 5b у пациентов с аллергией к травяной пыльце. Эта находка предполагает, что антитела, индуцированные микрочастицами, имеют требуемые характеристики блокирующих антител. Такие блокирующие антитела, которые возникают в ходе иммунотерапии, оказывают благоприятные воздействия, т.к. они могут подавлять индуцированный аллергеном эффект клеточной активации и опосредованную IgE презентацию аллергенов в Т-клетках.
Микрочастицы по настоящему изобретению проявляют некоторые преимущества по сравнению с альтернативно применяемыми формами иммунотерапии, как, например, применение гидроксида алюминия.
Поскольку конденсация антигена со сферами использует подробно описанные и воспроизводимые методики, то точно предсказуемо, какое количество антигена загружается на сферы. Следовательно, сферы покрываются антигеном при высокой плотности, с высоким выходом и в воспроизводимом количестве.
Другое преимущество может быть замечено в том факте, что антигены, которые ковалентно конъюгированы со сферами, представлены очень эффективным путем с помощью антиген-презентирующих клеток в вовлеченных клетках иммунной системы. Можно сделать вывод из экспериментов, которые показывают, что цитокиновый ответ намного более сильный в группе, обработанной микрочастицами по настоящему изобретению, по сравнению с контрольной группой, где антиген был абсорбирован на алюминии, что клеточный иммунный ответ стимулируется.
Другое преимущество состоит в том, что углеводные сферы, в особенности сефарозные, обладают высокой биосовместимостью. Поэтому лекарственные формы для вакцинации могут быть введены различными путями, вследствие чего предпочтительным является парентеральный путь введения. Однако можно также вводить лекарственные средства по настоящему изобретению пероральным, назальным, ректальным или внутривенным способом. Однако предпочтительным является подкожное или внутримышечное применение.
Следующие эксперименты показывают, что данные микрочастицы вполне толерантны при воздействии различных типов клеток в культуре ткани и в качестве одностолбцовой матрицы в клинических исследованиях ex vivo. Это особенно подтверждается экспериментами, которые показывают, что иммунизация мышей микрочастицами по настоящему изобретению индуцирует меньше гранулематозных реакций, чем применение гидроксида алюминия при сравнительной обработке.
Методики 1. Сыворотки пациентов.
Девять пациентов с подтвержденной историей болезни - аллергией на пыльцу тимофеевки луговой, сенсибилизированные к rPhl p 5b и пыльце тимофеевки луговой со значением класса 2 или выше по радиоаллергосорбентному тесту (RAST), были включены в исследование наряду с контрольными сыворотками.
2. Рекомбинантный аллерген
кДНК, кодирующую основной аллерген rPhl p 5b, получали полимеразной цепной реакцией (ПЦР) в соответствии с опубликованной последовательностью rPhl p 5b (Bufe и др. "Major allergen Phi p 5b in timothy grass is novel pollen Rnase". FEBS Lett., 1995; 363:6-12). Субклонировали Phi p 5b кДНК в плазмиде рЕТ 17b (Novagen, Madison, WI), экспрессировали в E. coli BL-21 (DE3) и очищали до гомогенного состояния, как описано (Vrtala и др. "Immunologic characterization of purified recombinant timothy grass pollen (Phleum pratense) allergens (Phi p 1, Phi p 2, Phi p 5)". J. Allergy Clin. Immunol. 1996; 97:781-787).
3) Получение конъюгатов и адсорбируемых веществ.
Сферические частицы сефарозы, активированные бромцианом (СВР), т.е. сферическая агароза со средним диаметром 2,1 мкм предоставлена фирмой Pharmacia Diagnostics, Uppsala, Sweden. Сферы были активированы бромцианом, как описано ранее (Ахеп и др. "Chemical coupling ofpeptides and proteins to polysaccharides by means ofcyano halides". Nature, 1967; 214:1302-1304). Перед конъюгацией 4 мг лиофилизованного rPhl p 5b растворяли в 8 мл 0,1 M карбонатного буфера, рН 8,0 и прибавляли к 110 мг активированных частиц в 2,0 мл 0,1 М карбонатного буфера, рН 8,0. Аллерген конъюгировали с частицами путем перешивания "с донышка на крышку" в течение 1 ч при комнатной температуре. Частицы СВР-rPhl р 5b центрифугировали при 1000 g в течение 5 мин. Было установлено, что эффективность конденсации составляет >95% при измерении концентрации белка путем УФ-поглощения при 280 нм в супернатанте до и после конъюгации. Оставшиеся активные группы блокировали путем повторного суспендирования частиц в 5 объемах 0,1 М глицина с рН 8,5 и инкубировали путем перешивания "с донышка на крышку" в течение 1 ч. Далее гель промывали 0,1 М ацетатом натрия, 1,0 М NaCl, рН 4,0 и 0,1 М трис-буфером, 1,0 М NaCl, рН 8,0 путем чередования 5 объемов каждого. В конце СВР-rPhl р 5b переносили в 50 мМ фосфатный буфер, 0,15 М NaCl, 10 мМ этилендиаминтетрауксусную кислоту (EDTA), 0,02% NaN3, 0,05% твин 20, рН 7,5 и хранили при +4°С до использования. Стабильность ковалентной связи между rPhl p 5b и СВР подтверждали после трех месяцев хранения при +4°С с помощью анализа rPhl p 5b в супернатанте. Адсорбирующие вещества на основе гидроксида алюминия (Alum) получали для сравнительных примеров непосредственно перед инъекцией, как описано (Vrtala и др. "Т cell epitope-containing hypoallergenic recombinant fragments of the major birch pollen allergen, Bet v.1, induce blocking antibodies". J. Immunol., 2000; 165:6653-6659). Вкратце, гидроксид алюминия, AluGel-S (Serva, Heidelberg; Germany) разбавляли 1:1 в ЗФР и смешивали с rPhl p 5b, получая 5 мкг на 100 мкл геля.
Иммунизация мышей
Три группы, каждая состоящая из пяти мышей-самок линии BALB/c в возрасте 6-8 недель (Charles River, Kissleg, Germany), иммунизировали с ковалентно связанными CBP-rPhI p 5b (группа I), rPhl p 5b-Alum (группа II) в качестве контроля и в качестве второго контроля rPhl p 5b был смешан с СВР (группа III).
Группы, обработка и время иммунизации даны в следующей таблице.
| Группа | Обработка | Дни иммунизации |
| Группа I | СВР-rPhl р 5b | 0, 28, 63, 121, 128 |
| Группа II | Alum-rPhl p 5b | 0, 28, 63, 121, 128 |
| Группа III | CBP+rPhl p 5b | 0, 28, 63, 121, 128 |
Мышей иммунизировали подкожно в шею с 5 мкг rPhl p 5b в 100 мкл суспензий от каждого из трех препаратов. Иммунизация была произведена, и 30 кровь отбирали в дни 0, 28 и 63. В день 121 проводили повторную инъекцию и через 7 дней животных забивали и клетки селезенки препарировали для измерения цитокинов. Животных держали в виварии отдела патофизиологии Университета Вены в соответствии с местными нормами ухода за животными.
5) Определение твердофазным иммуноферментным анализом (ELISA) специфичных к аллергену антител
Все 15 мышей были обескровлены, и антитела IgGI, 2a/b, 3 и IgE, специфичные к rPhl p 5b, анализировали отдельно в тесте ELISA, как описано Vrtala и др. "Immunization with purified natural and recombinant allergens induces mouse IgGI antibodies that recognize similar epitopes as human IgE, inhibit the human IgE-allergen interaction and allergen-induced basophil degranulation". J. Immunol, 1998; 160:6137-6140. Покрывали 96 луночные планшеты для микротитрования (Nunc, Roskilde, Denmark) слоем из 100 мкл, 5 мкг/мл rPhl p 5b в ЗФР, в течение ночи при +4°С. Планшеты промывали 2 раза с 0,05% твина 20 в ЗФР (промывочный буфер (WB)). Для уменьшения неспецифического связывания прибавляли 200 мкл смеси WB-1% бычий сывороточный альбумин (BSA) в течение 2,5 ч при комнатной температуре. В каждую ячейку прибавляли 100 мкл мышиной сыворотки, разбавленной в WB-0,5% BSA 1:1000 для IgGI, 1:100 для IgG2a/b и 3 и 1:20 для IgE, соответственно, и инкубировали в течение ночи при +4°С с последующим промыванием 5×250 мкл WB. Инкубировали 100 мкл крысиных антимышиных IgGI, 2a/b, 3 и IgE (PharMingen, San Diego, CA), соответственно, разбавленных 1:1000 в WB-0,5% BSA, в течение ночи при +4°С с последующим промыванием. Инкубировали 100 мл меченого пероксидазой хрена овечьего антикрысиного IgG, разбавленного 1:1000 в WB-0,5% BSA, в течение 2 ч при комнатной температуре с последующим промыванием 5×250 мл WB. Использовали 2,2-азино-бис(3-этилбензтиазолин-6-сульфоновую кислоту) (ABTS) в качестве субстрата, и цветную реакцию считывали при 405 нм с аппаратом для чтения микропланшетов Dynateck (Denkendorf, Germany).
Аллергены группы 5 различных видов травяной пыльцы определяли с помощью анализа ELISA. Экстракты аллергенов пыльцы в ЗФР из Phleum pratense, Lolium perenne, Poa pratensis, Anthoxantum odoratum, Triticum sativum, Avena sativa, Cynodon dactylon, Zea mays и Phragmites antralis (Allergon AB, Valinge, Sweden) помещали в 96-луночные планшеты ELISA (Nunc). После блокирования и промывания связанный с планшетом экстракт подвергали воздействию мышиного сывороточного пула из группы I, разбавленного 1:100 в ЗФР, 0,5% BSA и 0,05% твина 20. Для контрольных целей использовали предиммунный сывороточный пул. Связанные антитела к IgG определяли с меченой пероксидазой хрена овечьей антимышиной антисывороткой IgG (Amersham, Buckinghamshire, UK), разбавленной 1:1000 в смеси 0,05% твин 20 - ЗФР.
6) Измерение продукции цитокинов в культурах клеток селезенки
Для измерения продукции IL-4, IL-5 и INF-γ суспензии клеток селезенки иммунизированных мышей культивировали в 48-луночных планшетах (Costar, Cambridge, MA) с экстрактом пыльцы тимофеевки луговой (25 мкг/лунку) или без него при концентрации 5×106 клеток/лунку. Супернатанты отбирали через 24 ч для IL-4 и IL-5 и через 48 ч для INF-γ после стимуляции антигеном и хранили при -20°С до анализа. Уровни IL-4 и IL-5 измеряли с помощью анализа ELISA (Endogen, Cambridge; Mass). Чувствительность измерений составила <5 пг/мл. Уровни INF-γ измеряли в 96-луночных планшетах (Nunc, Maxisorp), покрытых слоем крысиного антимышиного INF-γ (Endogen, Woburn, MA) при концентрации 0,5 мкг/мл карбонатного буфера, рН 9,6, в течение 6 ч при комнатной температуре. После этого меченые биотином крысиные антимышиные антитела к INF-γ (Endogen) применяли при концентрации 0,1 мкг/мл с последующей обработкой конъюгированным пероксидазой стрептавидином (1:10000 в ЗФР/4% BSA; Endogen) в течение 30 мин. Для получения окраски использовали в качестве субстрата тетраметилбензидин (ТМВ) (Chemicon, Temecula, СА), и измеряли поглощение при 450 нм. Чувствительность анализа составила <15 пг/мл. Результаты отражают измеренные уровни цитокинов в пг/мл после вычитания базисных уровней нестимулированных культур.
7) Гистопатологический анализ кожных срезов
Кожу иссекали из инъекционных областей (1,5 см2), разрезали на полоски толщиной 4 мм, фиксировали с 7,5% формалином, рН 7,5 и заливали парафином. Пятимикронные срезы окрашивали смесью гематоксилин-эозин или Giemsa.
8) Конкурентный анализ ELISA
Планшеты для анализа ELISA соединяли с rPhl р 5b (0,1 мкг/лунку), блокировали и промывали, как описано выше для анализа ELISA. Планшеты подвергали воздействию объединенных сывороток мышей, иммунизированных или СВР-rPhl р 5b (группа I), или Alum-rPhl p 5b (группа II), или для контрольных целей - с пулами соответствующей предиммунной сыворотки, разбавленными 1:100, в течение ночи при 4°С. После промывки планшеты инкубировали с сыворотками от пациентов с аллергией на травяную пыльцу, разбавленными 1:5. Связанные человеческие антитела детектировали с конъюгированным щелочной фосфатазой мышиным моноклональным антителом (PharMingen). Ингибирование связывания IgE пациентов с аллергией с rPhl р 5b с помощью мышиных иммунных сывороток рассчитывали, используя формулу 100-(OD второго спуска крови/OD предиммунной сыворотки)×100.
9) Статистический анализ
Непараметрический тест Крускала-Уоллиса дисперсионного анализа ANOVA использовали для оценки ответов специфичного к аллергену антитела и перекрестной реактивности аллергена группы 5 между травяными видами. Использовали U-тест Манна-Уитни для оценки блокирования мышиной сывороткой связывания человеческого IgE. Доверительный интервал p<0,05 считался статистически значимым.
Пример 1
СВР-связанный rPhl р 5b индуцирует сильные реакции специфичного к аллергену антитела
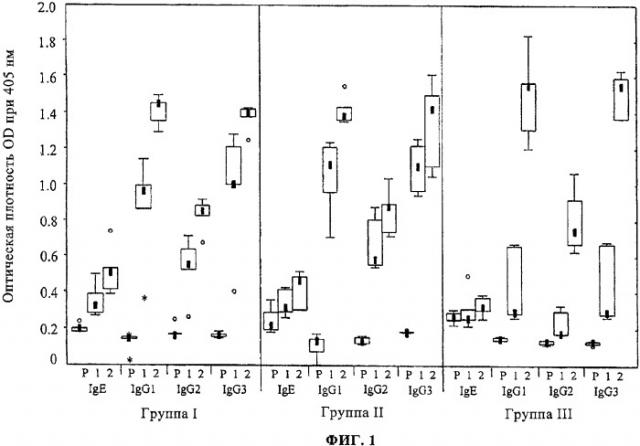
Для того чтобы сравнить уровни и кинетику реакций специфичного к rPhl р 5b антитела, сыворотки от всех групп мышей и сборы крови анализировали отдельно на IgE и каждый подкласс IgG на одном планшете ELISA. Все три группы показали усиление реакций специфичного к rPhl р 5b антитела в ходе иммунизации, которое достигло максимального значения после второй иммунизации. Результаты примера 1 приведены на фиг.1. Фиг.1 показывает ответы мышей в виде IgE и подкласса IgG на связанный с планшетом ELISA rPhl р 5b. Значения оптической плотности (OD 405 нм), изображенные на оси Y, соответствуют уровням rPhl р 5b-специфичным антителам к IgE, IgGi, IgG2 и IgGa в сыворотке трех мышиных групп (группа I: СВР-rPhl р 5b; группа II: Alum-rPhl р 5b; группа III: СРВ+rPhl р 5b). В группе III rPhl р 5b был только смешан с СВР. Результаты изображены для предыммунной сыворотки (Р), первого (1) и второго (2) спуска крови в виде прямоугольных диаграмм, где 50% значений находятся внутри прямоугольников и не аномальные значения - между столбиками. Заполненные квадраты означают средние значения, открытые кружки - аномальные значения и звездочки - предельные значения каждой группы, соответственно.
Мыши, получавшие вводимые совместно rPhl р 5Ь и СВР без ковалентной привязки (группа III), показали значительно более низкие уровни антител после первой иммунизации, чем мыши, получавшие СВР - или Alum-связанный аллерген. Как уровни, так и особенности ответов rPhl р 5b-специфичных антител были подобными у мышей, обработанных СВР-rPhl р 5b (группа I) и Alum-rPhl р 5b (группа II), демонстрируя продукцию специфических антител к IgE, но также специфические ответы на IgG2 и IgG3. Кинетика и значения rPhl р 5b - специфичных ответов на IgGi были подобны в группах I и II.
Пример 2
Мыши, иммунизированные СВР-связанным rPhl р 5b, демонстрируют сильные цитокиновые реакции на экстракт пыльцы тимофеевки луговой
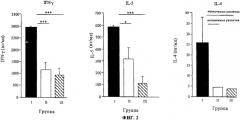
Профиль INF-γ, IL-5 и IL-4, секретированных клетками селезенки мышей из трех групп иммунизации, культивированными в присутствии экстракта природной пыльцы тимофеевки луговой, был одинаковым у всех трех групп. Фиг.2 показывает продукцию цитокинов in vitro в культуре клеток селезенки. Уровни INF-γ, IL-5 и IL-4 измеряли в супернатантах стимулированных антигеном клеток селезенки мышей, которые были иммунизированы с СВР-rPhl р 5b - группа I (черные столбики), Alum-rPhl p 5b - группа II (белые столбики) или с СВР+rPhl р 5b - группа III (заштрихованные столбики). Столбики означают среднее значение из 5 отдельных величин, величина ошибки означает среднеквадратичную ошибку среднего значения. U-тест Манна-Уитни, *p<0,05; ***р< 0,001.
На основании данных можно заключить, что клетки селезенки мышей, которые получали СВР-конъюгированный rPhl р 5b, демонстрируют значительно более высокую продукцию цитокинов (INF-γ, IL-5), чем клетки селезенки мышей, обработанных с Alum-адсорбированным rPhl р 5b. Самый низкий уровень высвобождения цитокинов был найден в культурах клеток селезенки мышей, которые получали совместное введение rPhl р 5b и СВР.
Пример 3
СВР-связанный rPhl p 5b индуцирует более слабую реакцию гранулематозной ткани, чем Alum-адсорбированный аллерген
Для анализа тканевых реакций в участках инъекций брали кожные срезы у мышей группы I и группы II и обрабатывали их для гистологического исследования. Затем исследовали репрезентативные кожные срезы мышей, иммунизированных с СВР-rPhl р 5b и Alum-rPhl p 5b. Участки инъекций у мышей, иммунизированных с СВР-rPhl р 5b и Alum-rPhl p 5b, анализировали гистопатологически.
У мышей, получавших Alum, можно было видеть общую, более выраженную воспалительную реакцию и дополнительные гранулематозные реакции с преимущественно ксантомными клетками на внешней оболочке и гранулярными осколками в центре гранулемы. Воспалительные тканевые реакции мышей, иммунизированных СВР-rPhl р 5b, имели тенденцию к ослаблению и содержали меньше гранулярных осколков, чем у мышей, обработанных Alum. Далее анализировали гистограммы срезов тканей мышей, иммунизированных СВР - и Alum-связанным rPhl p 5b. Они содержали смешанный клеточный воспалительный инфильтрат, включающий макрофаги и лимфоциты с редкими тучными клетками и эозинофилами в участках инъекций в глубине кожи, частично с гранулематозными изменениями.
Пример 4
Мыши, иммунизированные СВР-связанным rPhl p 5b, обладают перекрестной реактивностью IgG с экстрактами природной пыльцы из трав, содержащих аллергены группы 5
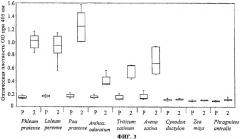
Для того чтобы изучить, индуцирует ли иммунизация с СВР антитела к IgG, которые перекрестно реагируют с аллергенами группы 5 из пыльцы других видов трав, эксперименты с использованием ELISA проводили с предыммунным сывороточным пулом и сывороточным пулом, содержащим сыворотки от второго спуска крови. Результаты показаны на фиг.3. Фиг.3 демонстрирует 30 перекрестную реактивность антител к IgG от мышей, иммунизированных с СВР-rPhl р 5b, с природными аллергенами группы 5 из 9 видов трав. Значения оптической плотности (OD 405 нм), соответствующие уровням сывороточных антител к IgG для экстрактов пыльцы из 9 видов трав (ось Y). Phleum pratense, Lolium perenne, Poa pratensis, Anthoxantum odoratum, Triticum sativum, Avena sativa, Cynodon dactylon, Zed mays, Phragmites antralis отображают сывороточный пул, собранный до иммунизации (Р) и в ходе второго спуска крови (2), на оси X.
Специфичные к аллергену rPhl p 5b антитела к IgG реагируют с группой 5 природных аллергенов из тимофеевки луговой (Phleum pratense) и из пяти видов трав (Lolium perenne, Poa pratensis, Anthoxantum odoratum, Triticum sativum, Avena sativa). Самые высокие уровни были зарегистрированы для Poa pratensis. Никакой реактивности IgG к экстрактам пыльцы из трав (Cynodon dactylon, Zea mays, Phragmites antralis), недостающим аллергенам, связанным с группой 5, не было обнаружено. Предыммунный сывороточный пул не показал значительной реактивности IgG к какому-либо из 9 экстрактов травяной пыльцы.
Пример 5
Сыворотки мышей, иммунизированных СВР-связанным rPhl p 5b, ингибируют связывание IgE с аллергеном у пациентов с аллергией
Могут ли сыворотки мышей, иммунизированных с CBP-rPhl p 5b, или Alum-rPhl p 5b, ингибировать связывание IgE пациентов с аллергией на травяную пыльцу с аллергеном rPhl p 5b исследовали с помощью конкурентных экспериментов ELISA. Связанный с планшетом для микротитрования rPhl р 5b предварительно инкубировали сывороточным пулом, взятым в день 63, полученным от мышей, иммунизированных с CBP-rPhl p 5b или Alum-rPhl p 5b и для контрольных целей - с соответствующим пулом сывороток предварительной иммунизации, и затем подвергали их воздействию сывороточного IgE от пациентов с аллергией на девять видов травяной пыльцы.
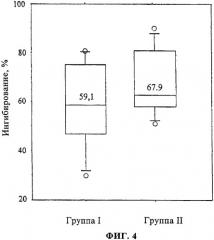
Результаты показаны на фиг.4. Фиг.4 демонстрирует ингибирование связывания IgE пациентов с аллергией на травяную пыльцу с rPhl p 5b с помощью мышиной сыворотки. Аллерген rPhl p 5b, связанный с планшетом ELISA, предварительно инкубировали с сывороточным пулом мышей, иммунизированных с CBP-rPhI р 5b (группа I) или Alum-rPhl p 5b (группа II). Процент ингибирования IgE, определенный для сывороток пациентов с аллергией на девять видов травяной пыльцы, показан на оси Y. Прямоугольники и горизонтальные линии обозначают 50% значений и не аномальный диапазон, соответственно. Указаны средние значения, и открытые кружки означают аномальные значения.
Сыворотки мышей из группы I, иммунизированных с CBP-rPhl p 5b, ингибировали связывание IgE пациентов с аллергией (n=9) с rPhl p 5b от 37 до 80% (среднее значение 59,1%), тогда как ингибирование между 51 и 90% (среднее значение 67,9%) наблюдали для сывороток от группы II (Alum-rPhl p 5b). Хотя ингибирование связывания IgE, полученное с сыворотками мышей, обработанных Alum-связанным Phl p 5b, было несколько выше, чем полученное с сыворотками мышей группы I, никакого значимого различия между группой I и группой II в отношении блокирующей способности не наблюдалось (р=0,31, U-тест Манна-Уитни).
1. Микрочастица для парентерального применения, включающая
(а) сферу, по существу состоящую из трехмерного поперечно связанного углевода, и
(б) аллерген, который ковалентно привязан к сфере и получен из растительной пыльцы, причем указанная углеводная сфера состоит главным образом из агарозы.
2. Микрочастица по п.1, где аллерген получают из травяной пыльцы.
3. Микрочастица по п.2, где аллерген получают из пыльцы тимофеевки луговой.
4. Микрочастица по п.1, где размер частицы находится в диапазоне 0,1-10 мкм.
5. Микрочастица по п.4, где размер частицы находится в диапазоне 0,5-5 мкм.
6. Микрочастица по любому из пп.1-5, отличающаяся тем, что микрочастица применяется для вакцинации.
7. Микрочастица по любому из пп.1-5, отличающаяся тем, что микрочастица применяется для лечения аллергии.
8. Лекарственное средство для лечения иммунной системы, отличающееся тем, что оно включает микрочастицы по любому из пп.1-7.
9. Лекарственное средство по п.8, отличающееся тем, что оно приготавливается для парентерального применения.