Ингибиторы нуклеозидфосфорилаз и нуклеозидаз
Иллюстрации
Показать всеИзобретение относится к новым нуклеозидным аналогам, которые обладают свойствами ингибиторов пуринфосфорибозилтрансферазы, пуриннуклеозидфосфорилазы, 5'-метилтиоаденозинфосфорилазы, 5'-метилтиоаденозиннуклеозидазы и/или нуклеозидгидролазы и могут быть использованы для лечения злокачественных новообразований, бактериальных инфекций, протозойных инфекций, заболеваний, опосредованных Т-клетками. В формуле (I)
V выбран из СН2 и NH и W выбран из NR1 и NR2; Х выбран из СН2 и СНОН в R или S-конфигурации; Y выбран из водорода и гидрокси; Z выбран из водорода, галогена и гидрокси, SQ и Q, где Q представляет собой необязательно замещенную галогеном С1-С6алкильную или бензильную группу; R1 представляет собой радикал формулы (II); R2 представляет собой радикал формулы (III); А выбран из N, СН; В выбран из ОН, NH2 и галогена; D выбран из NH2 и водорода; Е означает N; G выбран из СН2 или G отсутствует. Изобретение также относится к фармкомпозиции на основе соединений изобретения, к способам лечения заболевания или состояния, при котором желательно ингибировать пуринфосфорибозилтрансферазу, пуриннуклеозидфосфорилазу, 5'-метилтиоаденозинфосфорилазу, 5'-метил-тиоаденозиннуклеозидазу и/или нуклеозидгидролазу, и к применению соединений изобретения для приготовления лекарственного препрата. 8 н. и 22 з.п. ф-лы, 6 табл., 2 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к некоторым нуклеозидным аналогам, которые представляют собой ингибиторы PNP, PPRT, МТАР, MTAN и/или NH, применению данных соединений в качестве фармацевтических препаратов и фармацевтических композиций, содержащих данные соединения. Данное изобретение также относится к способам лечения заболеваний.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Патенты США № 5985848, 6066722 и 6228741 относятся к нуклеозидным аналогам, которые представляют собой ингибиторы пуриннуклеозидфосфорилазы (PNP) и пуринфосфорибозилтрансферазы (PPRT). Данные аналоги могут использоваться при лечении паразитарных инфекций, злокачественных перерождений Т-клеток, аутоиммунных заболеваний и воспалительных заболеваний. Данные аналоги также могут использоваться для иммуносуппрессии при трансплантации органов.
В PCT/NZ00/00048 описан способ получения некоторых ингибиторных соединений PNP. В данной заявке описаны соединения, которые являются ингибиторами PNP и указывается необходимость в более простых способах их получения. В PCT/NZ01/00174 также представлены дополнительные аналоги нуклеозидов, которые являются ингибиторами PNP и PPRT.
Некоторые аналоги нуклеозидов также были идентифицированы как сильнодействующие ингибиторы 5'-метилтиоаденозинфосфорилазы (МТАР) и 5'-метилтиоаденозиннуклеозидазы (MTAN). Данные соединения являются объектом PCT/NZ03/00050.
Заявители настоящего изобретения также разработали способ получения метиленсвязанных циклических аминодеазапуринов, который заключается во взаимодействии формальдегида или эквивалента формальдегида с циклическим амином и гетероароматическим соединением. Данный способ является объектом патентной заявки Новой Зеландии № 523970.
PNP катализирует фосфоролитическое расщепление рибо- и дезоксирибонуклеозидов, например, производных гуанина и гипоксантина, с получением соответствующего сахар-1-фосфата и гуанина, гипоксантина или других пуриновых оснований.
Люди с дефицитом пуриннуклеозидфосфорилазы (PNP) страдают от специфического Т-клеточного иммунодефицита вследствие накопления dGTP, который предотвращает пролиферацию стимулированных Т-лимфоцитов. Следовательно, ингибиторы PNP являются иммуносуппрессивными и активны против малигнизаций Т-клеток и пролиферативных нарушений Т-клеток.
Нуклеозидгидролазы (NH) катализируют гидролиз нуклеозидов. Данные ферменты не обнаружены у млекопитающих, но необходимы для реутилизации нуклеозидов у некоторых простейших паразитов. Некоторые простейшие паразиты для этой цели используют нуклеозидфосфорилазы либо вместо, либо в дополнение к нуклеозидгидролазам. Можно ожидать, что ингибиторы нуклеозидгидролаз и фосфорилаз влияют на метаболизм паразита и следовательно могут использоваться против простейших паразитов.
МТАР и MTAN задействованы в пути биосинтеза полиаминов, реутилизации пуринов у млекопитающих и в путях "quorum sensing" у бактерий. МТАР катализирует обратимый фосфоролиз 5'-метилтиоаденозина (МТА) до аденина и 5-метилтио-α-D-рибоза-1-фосфата (MTR-1P). MTAN катализирует обратимый гидролиз МТА до аденина и 5-метилтио-α-D-рибозы и обратимый гидролиз S-аденозил-L-гомоцистеина (SAH) до аденина и S-рибозил-гомоцистеина (SRH). Образующийся впоследствии аденин рециклизуется и преобразутся в нуклеотиды. По существу единственный источник свободного аденина в клетках человека является результатом действия данных ферментов. МТР-1Р последовательно преобразуется в метионин посредством последовательных ферментативных действий.
МТА представляет собой побочный продукт реакции, включающей перенос аминопропильной группы от декарбоксилированного 3-аденозилметионина к путресцину в процессе образования спермидина. Реакция катализируется спермидинсинтазой. Спермидинсинтаза очень чувствительна к ингибированию продуктом посредством аккумуляции МТА. Следовательно, ингибирование МТАР или MTAN жестко лимитирует биосинтез полиаминов и путь реутилизации аденина в клетках. Аналогично, МТА представляет собой побочный продукт бактериального синтеза ацилированных лактонов гомосерина из S-аденозилметионина (SAM) и ацил-ацил переносящих белков, в которых последующая лактонизация вызывает высвобождение МТА и ацилированного лактона гомосерина. Ацилированный лактон гомосерина представляет собой бактериальную молекулу "quorum sensing", которая вовлечена в бактериальную вирулентность против тканей человека. В последних исследованиях была идентифицирована вторая коммуникационная система (аутоиндуктор 2, AI-2), которая является общей как для грамположительных, так и грамотрицательных бактерий, и таким образом, предполагается в качестве "универсального сигнала" в межвидовой коммуникации "клетка-клетка". И опять, MTAN генерирует S-рибозил-гомоцистеин (SRH), который является предшественником AI-2. Ингибирование MTAN или МТАР у микробов будет предотвращать удаление МТА и обеспечивать ингибирование пути продуктом, таким образом снижая продукцию пути "quorum sensing" и уменьшая вирулентность микробных инфекций. Ингибирование MTAN у микробов будет предотвращать образование SRH, уменьшая продукцию второго пути "quorum sensing".
Во многих случаях малигнизации сообщалось о дефиците МТАР в результате генетического выброса. Известно, что потеря ферментативной функции МТАР в этих клетках происходит в результате гомозиготных делений в хромосоме 9, непосредственно связанной МТАР, и суппрессорного гена опухоли p16/MTS1. Отсутствие pl6/MTS1 вероятно ответственно за опухоль, недостаток активности МТАР является следствием генетического деления и не является причиной рака. Однако отсутствие МТАР изменяет метаболизм пуринов в этих клетках так, что он в основном зависит от пути de novo для обеспечения пуринами. Это придает этим клеткам необычную чувствительность к ингибиторам, таким как метотрексат, аланозин и азасерин, который блокируют путь de novo. Следовательно, комбинационная терапия метотрексатом, аланозином или азасерином вместе с ингибитором МТАР будет обладать необычно эффективными противоопухолевыми свойствами.
Ингибиторы МТАР также могут быть очень эффективными в отношении паразитарной инфекции, такой как малярия, при которой инфицируются красные кровяные клетки (RBC), так как у них отсутствует путь биосинтеза пуринов de novo. Простейшие паразиты полностью зависят от пуринов, продуцируемых посредством пути реутилизации для их роста и размножения. Ингибиторы МТАР следовательно будут уничтожать этих паразитов, не оказывая какое-либо отрицательное действие на RBC хозяина, так как RBC являются терминально дифференцированными клетками и они не синтезируют пурины, продуцируют полиамины или размножаются.
Иминосахарная часть соединений, описанных в большинстве описаний патентов, относящихся к вышеуказанной теме, имеет атом азота, расположенный между С-1 и С-4 таким образом, что образует соединения 1,4-дидезокси-1,4-имино-D-рибита. Расположение атома азота в цикле рибита может быть ключевым для связывания ферментов. Кроме того, расположение связи между сахарной частью и основанием нуклеозидного аналога может быть особо важным для ингибиторной активности фермента. Известные соединения имеют такую связь при С-1 цикла сахара.
При поиске новых и улучшенных ингибиторов нуклеозидфосфорилазы и нуклеозидазы заявители исследовали синтез и биоактивность соединений, в которых расположение атома азота в цикле сахара изменяется и, дополнительно, в которых два атома азота образуют часть сахарного кольца. Также были исследованы альтернативные способы связывания сахарной части и аналога основания.
Заявители неожиданно обнаружили, что некоторые новые соединения проявляют высокую ингибиторную активность в отношении одного или нескольких из PNP, PPRT, МТАР и нуклеозидгидролазы MTAN.
Следовательно, целью настоящего изобретения является соединение, которое является ингибитором PNP, PPRT, МТАР, MTAN и/или NH или, по крайней мере, является препаратом выбора.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В первом аспекте данного изобретения предоставлено соединение формулы (I):
в котором:
V выбран из СН2 и NH, a W выбран из NR1 и NR2; или
V выбран из NR1 и NR2, a W выбран из СН2 и NH;
Х выбран из CH2 и СНОН в R или S-конфигурации;
Y выбран из водорода, галогена и гидрокси, исключая тот случай, когда V выбрано из NH, NR1 и NR2, тогда Y представляет собой водород;
Z выбран из водорода, галогена и гидрокси, SQ, OQ и Q,
где Q представляет собой необязательно замещенную алкильную, аралкильную или арильную группу;
R1 представляет собой радикал формулы (II)
R2 представляет собой радикал формулы (III)
А выбран из N, СН и CR, где R выбран из галогена, необязательно замещенных алкила, аралкила или арила, ОН, NH2, NHR3, NR3R4 и SR5, где каждый из R3, R4 и R5 представляет собой необязательно замещенные алкильную, аралкильную или арильную группы;
В выбран из ОН, NH2, NHR6, SH, водорода и галогена, где
R6 представляет собой необязательно замещенную алкильную, аралкильную или арильную группу;
D выбран из ОН, NH2, NHR7, водорода, галогена и SCH3, где
R7 представляет собой необязательно замещенную алкильную, аралкильную или арильную группу;
Е выбран из N и СН;
G выбран из СН2 и NH или G отсутствует, при условии, что когда W представляет собой NR1 или NR2, и G представляет собой NH, тогда V представляет собой СН2, и, при условии, что когда V представляет собой NR1 или NR2 и G представляет собой NH, тогда W представляет собой CH2;
или его таутомер, или его фармацевтически приемлемая соль, или сложный эфир, или пролекарство.
Предпочтительно, Z выбран из водорода, галогена, гидрокси, SQ и OQ. Более предпочтительно, Z представляет собой ОН. Альтернативно, предпочтительно, Z представляет собой SQ. В еще одном предпочтительном варианте осуществления Z представляет собой Q.
Также предпочтительно V представляет собой СН2. Еще более предпочтительно Х представляет собой СН2. Дополнительно, предпочтительно, G представляет собой СН2.
Предпочтительно W представляет собой NR1. Альтернативно, предпочтительно, W представляет собой NR2. Также предпочтительно, если W выбран из NH, NR1 или NR2, то Х представляет собой СН2.
Предпочтительные соединения изобретения включают соединения, где V, Х и G все представляют собой СН2, Z представляет собой ОН и W представляет собой NR1.
Другие предпочтительные соединения изобретения включают соединения, где V, Х и G все представляют собой СН2, Z представляет собой SQ и W представляет собой NR1.
Предпочтительно, Y представляет собой водород. Альтернативно, предпочтительно, Y представляет собой гидрокси.
Предпочтительно, В представляет собой гидрокси. Альтернативно, предпочтительно, В представляет собой NH2.
Предпочтительно, А представляет собой СН. Альтернативно, предпочтительно, А представляет собой N.
Предпочтительно, D представляет собой Н. Альтернативно, предпочтительно, D представляет собой NH2.
Также предпочтительно Е представляет собой N.
Предпочтительные соединения данного изобретения включают:
(3R,4R)-1-[(9-деазагипоксантин-9-ил)метил]-3-гидрокси-4-(гидроксиметил)пирролидин;
(3R,4R)-1-[(9-деазааденин-9-ил)метил]-3-гидрокси-4-(гидроксиметил)пирролидин;
(3R,4R)-1-[(8-аза-9-деазагипоксантин-9-ил)метил]-3-гидрокси-4-(гидроксиметил)пирролидин;
(3R,4R)-1-[(8-аза-9-деазааденин-9-ил)метил]-3-гидрокси-4-(гидроксиметил)пирролидин;
(3R,4S)-1-[(9-деазааденин-9-ил)метил]-3-гидрокси-4-(2-фенилэтил)пирролидин;
(3S,4R)-1-[(9-деазагипоксантин-9-ил)метил]-3,4-дигидрокси-4-метилтиометилпирролидин;
(3R,4S)-1-[(9-деазагипоксантин-9-ил)метил]-3-гидрокси-4-(метилтиометил)пирролидин;
N-(9-деазагипоксантин-9-ил)-1,4-дидезокси-1,4-имино-D-рибит;
N-(9-деазагипоксантин-9-ил)метил-1,4-дидезокси-1,4-имино-D-рибит;
(3R,4R)-3-гидрокси-4-гидроксиметил-1-(гипоксантин-9-ил)пирролидин;
(3R,4S)-1-[(9-деазааденин-9-ил)метил]-3-гидрокси-4-(метилтиометил)пирролидин;
(3R,4S)-1-[(9-деазааденин-9-ил)метил]-3-гидрокси-4-(бензилтиометил)пирролидин;
(3R,4S)-1-[(8-аза-9-деазааденин-9-ил)метил]-3-гидрокси-4-(бензилтиометил)пирролидин;
(3R,4R)-1-[(9-деазагуанин-9-ил)метил]-3-гидрокси-4-(гидроксиметил)пирролидин;
(3R,4S)-1-[(9-деазааденин-9-ил)метил]-3-гидрокси-4-(4-[хлорфенилтиометил)пирролидин;
(3R,4R)-1-[(6-хлор-9-деазапурин-9-ил)метил]-3-гидрокси-4-(гидроксиметил)пирролидин;
(3R,4R)-1-[(6-азидо-9-деазапурин-9-ил)метил]-3-гидрокси-4-(гидроксиметил)пирролидин; или
(3R,4R)-1-[(9-деазааденин-9-ил)метил]-3-ацетокси-4-(ацетоксиметил)пирролидин.
В еще одном аспекте, данное изобретение относится к фармацевтической композиции, включающей фармацевтически эффективное количество соединения формулы (I), как определено выше.
В еще одном аспекте, данное изобретение относится к способу лечения заболевания или состояния, при котором желательно ингибировать пуринфосфорибозилтрансферазу, пуриннуклеозидфосфорилазу, 5'-метилтиоаденозинфосфорилазу, 5'-метилтиоаденозиннуклеозидазу и/или нуклеозидгидролазу, который заключается во введении пациенту, нуждающемуся в таком лечении, фармацевтически эффективного количества соединения формулы (I), как определено выше.
Заболевание или состояние представляет собой злокачественное новообразование, бактериальную инфекцию, протозойную инфекцию или заболевание, опосредованное Т-клетками. Заболевание, опосредованное Т-клетками, представляет собой псориаз, артрит или отторжение трансплантата.
В еще одном аспекте изобретение относится к применению соединения формулы (I), как определено выше, для производства лекарственного средства для лечения заболевания или состояния, при котором желательно ингибировать пуринфосфорибозилтрансферазу, пуриннуклеозидфосфорилазу, 5'-метилтиоаденозинфосфорилазу, 5'-метилтиоаденозиннуклеозидазу и/или нуклеозидгидролазу.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Необходимо принять во внимание, что изображение соединения формулы (I), где В и/или D представляет собой гидроксигруппу, является энольным типом таутомерной формы соответствующего амида, и эта форма будет преимущественно существовать в амидной форме. Применение энольного типа таутомерного изображения дано лишь для представления соединений данного изобретения несколькими структурными формулами.
Аналогично, следует учитывать, что изображение соединения формулы (I), где В и/или D представляет собой тиольную группу, является таутомерной формой тиоенольного типа соответствующего тиоамида, и данная форма будет преимущественно существовать в тиоамидной форме. Применение таутомерного изображения тиоенольного типа дано лишь для простого представления соединений данного изобретения несколькими структурными формулами.
Соединения данного изобретения могут быть получены любым подходящим способом. Один подходящий способ включает в себя независимый синтез сахарной части и части основания и затем связывание основной части с атомом азота в сахарной части кольца.
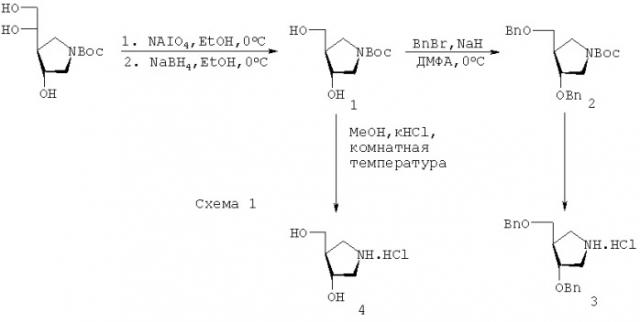
Например, на схеме 1, приведенной ниже, показано получение 1-N-иминосахарной части соединения данного изобретения, где атом азота аналога сахара расположен в таком же положении, как и С-1 аномерной атому углерода в молекуле сахара. Исходное соединение, используемое в синтезе 1-N-иминосахара, представляет собой N-трет-бутоксикарбонил-(3R,4S)-3-гидрокси-4-[(1S)-1,2-дигидроксиэтил]пирролидин. Это исходное соединение может быть получено с помощью способа Filichev et al. (Carbohydrate Res., 2001, 333, 115-122) изменяя только то, что в качестве защитной группы азота используют т-бутоксикарбонильный фрагмент, а не N-(9-флуоренилметоксикарбонильную) группу. Окислительное расщепление диольной группы с последующим восстановлением in situ дает N-защищенный 3-гидрокси-4-гидроксиметилпирролидин (1). Удаление N-защитной группы дает (3R,4R)-3-гидрокси-4-гидроксиметилпирролидин (4). Рацемический 3-гидрокси-4-гидроксиметилпирролидин первоначально был получен Jaeger et al. (J. Org. Chem., 1965, 30, 740-744) и использован для получения 1'-аза карбациклических аналогов тимидина (Lee, Y.H., Kirn, H.K., Youn, I.К., Chae, Y.B., Bioorg. Med. Chem. Lett. 1991, 1, 287-290) и аза-С-пиримидинов (Sorensen M.D., Khalifa, N.M., Pedersen, E.B.m Synthesis, 1999, 1937-1943).
Также описаны два других способа синтеза (3R,4R)-3-гидрокси-4-гидроксиметилпирролидина. В один из способов, Bols et al. [Bols, M., Hansen, S.U., Acta Chem. Scand., 1998, 52, 1214-1222], включена ферментативная очистка энантиомеров. Другой способ, Ichikawa et al. [Ichikawa, Y., Makino, K., Tetrahedron Lett., 1998, 39, 8245-8248], представляет собой мультиграммовый асимметрический синтез (3R,4R)-3-гидрокси-4-гидроксиметилпирролидина через моноэтиловый эфир фумаровой кислоты. Ichikawa et al. оценили ингибиторную активность (3R,4R)-3-гидрокси-4-гидроксиметилпирролидина против PNP человека и получили IC50, равное 160 мкМ.
Бензилирование гидроксильных групп соединения (1) перед удалением N-защитной группы может быть желательным для получения гидрохлорида (3R,4R)-3-бензилокси-4-бензилоксиметилпирролидина (3) как эффективного соединения, готового к связыванию с подходящим аналогом основания.
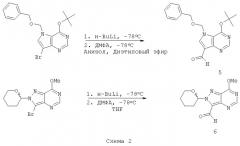
Присоединение сахарной части может осуществляться путем восстановительного аминирования соответсвующего альдегида. Примеры подходящих альдегидов, полученных из их соответствующих бромсодержащих предшественников, представлены на схеме 2.
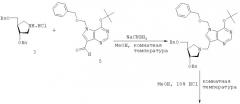
Взаимодействие аналога альдегидного основания с защищенным аналогом сахара (3) показано на схеме 3. Удаление защитной группы дает ингибиторное соединение данного изобретения (3S,4S)-1-[(9-деазагипоксантин-9-ил) метил]-3,4-дигидрокси-4-(гидроксиметил)пирролидин (8).
Необходимо отметить, что любой аналог сахара, имеющий атом азота в любом положении своего цикла, может связываться с любым аналогом основания таким образом. Следует также учитывать, что могут применяться способы, отличные от взаимодействия путем восстановительного аминирования альдегида.
Как показано на схемы 4, приведенной ниже, из промежуточного соединения (7) может быть получено соединение (10)
Другие примеры взаимодействия аналогов основания с аналогом сахара (4) показаны на схеме 5. Данный способ может использоваться для получения соединений (3R,4S)-1-[(8-аза-9-деазагипоксантин-9-ил)метил]-3-гидрокси-4-(гидроксиметил)пирролидина; (12) и (3R,4S)-1-[(8-аза-9-деазааденин-9-ил)метил]-3-гидрокси-4-(гидроксиметил)пирролидина (13).
Получали промежуточный аналог сахара, содержащий два атома азота в своем кольце. (3R,4S)-4-гидрокси-3-гидроксиметилпиразолидин (21) может быть получен в соответствии с путем, показанным на схеме 6. Кетон (14) получали из D-ксилозы, используя хорошо известную химию (Lin, T-S., Zhu, J-L., Dutschman, G.E., Cheng, Y-C., Prusoff, W.H., J. Med. Chem. 1993, 36, 353-362). Аминирование с последующим восстановлением имина и ацетилирование полученного в результате вторичного амина давало соединение (17). В ключевой стадии кислотного гидролиза с сопутствующей рециклизацией получали иминоцикл (18). Гидрирование с последующим отщеплением диольной группы и удалением ацетата давало требуемый пиразолидин (21).
Пиразолидин (21) или N-ацетатный предшественник (20) могут взаимодействовать с разнообразными аналогами оснований с получением возможных ингибиторов формулы (I) данного изобретения.
Альтернативный способ взаимодействия аналога основания с аналогом сахара показан на схеме 7. Альдегид N-трет-бутоксикарбонил-(3R,4S)-3-гидрокси-4-формилпирролидин (22) использовали в реакции Виттига с получением 5' С-С связанного промежуточного соединения N-трет-бутоксикарбонил-(3R,4R)-3-гидрокси-4-(2-фенилэтенил)пирролидина (23). Последующее гидрирование и отщепление Вос-групп давало гидрохлоридную соль (25), которая может использоваться в реакции Манниха для получения (3R,4R)-1-[(6-хлор-9-деазапурин-9-ил)метил]-3-гидрокси-4-(2-фенилэтил)пирролидина (26). Обработка с 7н. аммиаком в метаноле при 130°С в герметично закрытой пробирке с последующим преобразованием в гидрохлоридную соль с помощью 3н. водного раствора HCl получали гидрохлорид (3R,4S)-1-[(9-деазааденин-9-ил)метил]-3-гидрокси-4-(2-фенилэтил)пирролидина (27).
Необходимо заметить, что путь, приведенный в качестве примера на схеме 7, может быть использован для взаимодействия разнообразных аналогов 25, изменяющихся по С-4 заместителю, с различными аналогами 9-деазапурина.
На схеме 8 показан еще один альтернативный путь получения некоторых соединений данного изобретения. В этом способе используют исходное соединение D-арабинит, а не N-трет-бутоксикарбонил-(3R,4S)-3-гидрокси-4-[(1S)-1,2-дигидроксиэтил]пирролидин.
Соединения данного изобретения представляют собой сильнодействующие ингибиторы PNP, МТАР и/или MTAN.
В таблице 1 представлены константы ингибирования некоторых соединений данного изобретения PNP человека. В таблице 2 представлены константы ингибирования некоторых соединений против MTAN E. Coli. В таблице 3 представлены константы ингибирования некоторых соединений МТАР человека. В таблице 4 представлены константы ингибирования некоторых соединений против PNP Mycoba ctenuia tuberculosis. В таблице 5 представлены константы ингибирования некоторых соединений против PNP Plasmod.lum falciparum.
| Таблица 1 | |||
| Константы ингибирования против PNP человека | |||
| Соединение № | Структура | Ki | Ki* |
| 61 | 163±25 пМ | 6,8±1,2 пМ | |
| 8 | 1100±120 пМ | 16,0±1,4 пМ |
| 12 | 2000±50 пМ | Медленное начало отсутствует | |
| 33 | 433±13 нМ | Медленное начало отсутствует | |
| 37 | 19,6±3,5 пМ | Медленное начало отсутствует | |
| 31 | 14±3 нМ | Медленное начало отсутствует | |
| 41 | 2,8 нМ | Медленное начало отсутствует | |
| 40 | 12,7 мкМ | Медленное начало отсутствует |
| Таблица 2 | |||
| Константы ингибирования против MTAN E.Coli | |||
| Соединение № | Структура | Ki | Ki* |
| 52 | 17±2 пМ | 160±14 фМ | |
| 57 | 9,0±1 пМ | 42±5 фМ | |
| 58 | 190 фМ | ||
| 62 | 4,0±0,4 пМ | 91±2,0 фМ | |
| 27 | 47,0±8,0 нМ | 1,0±0,3 нМ |
| Таблица 3 | |||
| Константы ингибирования против МТАР человека | |||
| Соединение № | Структура | Ki | Ki* |
| 52 | 870±110 пМ | 22±3 пМ | |
| 62 | 46,0±8,0 пМ | <3 пМ | |
| 27 | Ингибирование при 10 мкМ отсутствует | ||
| 57 | 280±50 пМ | 3,0±0,3 пМ | |
| 58 | 51 нМ | Медленное начало отсутствует |
| Таблица 4 | |||
| Константы ингибирования против PNP Mycobacterlum tuberculosis | |||
| Соединение № | Структура | Ki | Ki* |
| 8 | 1,3±0,1 нМ | 42,2±2 пМ | |
| 61 | 540±40 пМ | 24±1 пМ | |
| 12 | 2,1±0,2 нМ | Медленное начало отсутствует | |
| 41 | 7±0,2 нМ | Медленное начало отсутствует |
| Таблица 5 | |||
| Константы ингибирования против PNP Plasmodium falclparum | |||
| Соединение № | Структура | Ki | Ki* |
| 37 | 20,4±1,8 нМ | Медленное начало отсутствует | |
| 33 | 45±3 мкМ | Медленное начало отсутствует | |
| 8 | 500 пМ | Медленное начало отсутствует | |
| 31 | 4,3 мкМ | Медленное начало отсутствует |
Ki, как показано в таблицах 1, 2, 3, 4 и 5, представляет собой константу первоначального ингибирования образованного комплекса фермент-ингибитор, и Ki* представляет собой равновесную константу диссоциации ингибирования, которое наблюдают после периода медленного начала, ингибирования с прочным связыванием. Ki* представляет собой биологически эффективную константу.
Дополнительные аспекты
Соединения данного изобретения являются эффективными как в форме свободного основания, так и в форме солей. Под термином "фармацевтически приемлемые соли" понимают нетоксичные соли, которые являются производными неорганических или органических кислот, включая, например, следующие кислоты: хлористоводородную, серную, фосфорную, уксусную, молочную, фумаровую, янтарную, винную, глюконовую, лимонную, метансульфоновую и п-толуолсульфоновую кислоты.
Активные соединения могут вводиться пациенту различными путями, включая, пероральное введение, инъекцию или местное нанесение. Количество вводимого соединения будет сильно изменяться в зависимости от особенностей пацента и природы и степени расстройств, на которое направлено лечение. Обычно дозировка для взрослого человека будет находиться в диапазоне, меньшем 1-1000 миллиграмм, предпочтительно, 0,1-100 миллиграмм.
Для перорального введения с соединениями могут быть получены твердые или жидкие препараты, например, таблетки, капсулы, порошки, растворы, суспензии и дисперсии. Такие препараты, хорошо известные в данной области, как и другие пероральные режимы введения дозы, которые не перечислены здесь. В форме таблетки соединения могут быть получены вместе с общепринятыми основаниями для таблеток, такими как лактоза, сахароза и кукурузный крахмал, со связующим агентом, дезинтегратором и смазкой. Связующий агент может представлять собой, например, кукурузный крахмал или желатин, дезинтегратором может быть картофельный крахмал или альгиновая кислота, а смазкой может являться стеарат магния. Могут быть добавлены другие компоненты, такие как красители или отдушки.
Жидкие формы содержат носители, такие как вода и этанол, вместе с другими агентами, такими как фармацевтически приемлемое поверхностно-активное вещество или суспендирующий агент, или без этих агентов.
Данные соединения могут также вводиться инъекцией в физиологически приемлемом разбавителе, таком как вода или физиологический раствор. Разбавитель может включать один или несколько ингредиентов, таких как этанол, пропиленгликоль, масло или фармацевтически приемлемое поверхностно-активное вещество.
Соединения могут быть ингредиентами в кремах, для местного введения на кожу или мембраны слизистых оболочек. Предпочтительно, кремы включают фармацевтически приемлемый растворитель для способствования прохождения через кожу или мембраны слизистых оболочек. Подходящие кремы являются хорошо известными специалистам в данной области.
Соединения могут затем вводиться посредством систем с отсроченным высвобождением. Например, они могут быть введены в медленно растворяющуюся таблетку или капсулу.
КРАТКОЕ ОПИСАНИЕ ЧУРТЕЖЕЙ
На фиг.1 показаны кинетические кривые для PNP человека, ингибируемого соединением (8).
На фиг.2 показано ингибирование мышиной МТАР in vivo.
ПРИМЕРЫ
Следующие далее примеры дополнительно иллюстрируют изобретение. Следует учитывать, что изобретение не ограничивается данными примерами.
Пример 1
N-трет-Бутоксикарбонил-(3R,4R)-3-гидрокси-4-(гидроксиметил)пирролидин (1). К перемешиваемому раствору периодата натрия (3,4 г, 16 ммоль) в воде (25 мл) по каплям добавляют N-трет-бутоксикарбонил-(3R,4S)-3-гидрокси-4-[(1S)]-1,2-дигидроксиэтил)пирролидин (3,4 г, 13,7 ммоль) в этаноле (50 мл), поддерживая температуру реакции при 0°С. Реакционную смесь оставляют на дополнительные 20 мин, после чего по частям добавляют боргидрид натрия (2,0 г, избыток), снова поддерживая температуру реакции при 0°С. После добавления твердое вещество отфильтровывают, промывают этанолом (50 мл) и концентрируют в вакууме с получением сиропа. Хроматография давала соединение 1 (2,74 г, 92%) в виде сиропа.
Пример 2
N-трет-Бутоксикарбонил-(3R,4R)-3-бензилокси-4-(бензилоксиметил)пирролидин (2). К перемешиваемому раствору бензилбромида (300 мкл, 2,8 ммоль) и соединения 1 (200 мг, 0,92 ммоль) в ДМФА (10 мл) по частям добавляют гидрид натрия (140 мг, 60% масляной дисперсии, 3,7 ммоль) при 0°С. После добавления полученную суспензию оставляли нагреваться до комнатной температуры, разбавляют толуолом (100 мл), промывают водой (50 мл), насыщенным солевым раствором (50 мл), сушат (MgSO4) и концентрируют в вакууме с получением сиропа. Хроматография давала соединение 2 (350 мг, 96%) в виде масла, которое использовали в следующей стадии без очистки.
Пример 3
Гидрохлорид (3R,4R)-3-бензилокси-4-(бензилоксиметил)пирролидина (3). К раствору соединения 2
(500 мг, 1,3 ммоль) в метаноле (2 мл) добавляют хлористоводородную кислоту (2 мл, 1М) и полученную смесь перемешивают в течение 1 час при 40°С. После завершения реакционную смесь концентрируют в вакууме с получением соединения 3 в виде гидрохлоридной соли (330 мг, 90%). 1Н ЯМР δ 7,35-7,21 (м, 10Н), 4,48 (м, 4Н), 4,08 (д, J=2,9 Гц, 1Н), 3,53 (м, 1Н), 3,44 (м, 3Н), 3,24 (м, 1Н), 2,65 (м, 1Н). 13С ЯМР δ 138,0, 137,6, 128,9, 128,8, 128,3, 128,2, 79,3, 73,7, 71,9, 68,7, 49,6, 46,4, 44,8.
Пример 4
(3R,4R)-3-Гидрокси-4-(гидроксиметил)пирролидин (4). К перемешиваемому раствору соединения 1 (2,3 г, 10,6 ммоль) в метаноле (5 мл) по каплям добавляют хлористоводородную кислоту
(5 мл, 12М) при комнатной температуре. Через 1 час реакционную смесь концентрируют в вакууме с получением соединения 4 (1,63 г, 100%) в виде масла. 13С ЯМР δ 71,9, 60,9, 52,1, 47,9, 46,6.
Пример 5
7-N-Бензилоксиметил-6-трет-бутокси-9-деазапурин-9-карбальдегид (5). 5-Бензилоксиметил-7-бром-4-трет-бутоксипирроло[3,2-d]пиримидин (400 мг, 1,02 ммоль) растворяют в диэтиловом эфире (10 мл) и анизоле (5 мл) и охлаждают до -78°С. Затем по каплям добавляют н-бутиллитий (600 мкл, 2,5 М) с такой скоростью, чтобы поддерживать температуру реакции ниже -70°С, и полученный раствор оставляют на 30 мин при -78°С. Затем добавляют диметилформамид (100 мкл) и реакционную смесь оставляют перемешиваться еще 30 мин и затем гасят водой и оставляют нагреваться до комнатной температуры. Реакционную смесь затем разбавляют этилацетатом (100 мл), промывают водой (30 мл), насыщенным солевым раствором (30 мл), сушат (MgSO4) и концентрируют в вакууме с получением сиропа. Очисткой хроматографией получают соединение 5 (270 мг, 78%). 1H ЯМР δ 10,29 (с, 1Н), 8,62 (с, 1Н), 7,98 (с, 1Н), 7,34-7,22 (м, 5Н), 5,79 (с, 2Н), 4,53 (с, 2Н), 1,71 (с, 9Н). 13С ЯМР δ 184,8, 156,63, 152,6, 150,0, 136,7, 136,6, 128,9, 128,5, 127,8, 118,4, 84,4, 78,3, 71,0, 29,0.
Пример 6
8-Аза-9-деаза-6-метокси-7-N-(тетрагидропиран-2-ил)пурин-9-карбальдегид (6). К перемешиваемому раствору 8-аза-9-бром-9-деаза-6-метокси-7-N-(тетрагидропиран-2-ил)пурина (530 мг, 1,7 ммоль) в ТГФ (20 мл) по каплям добавляли н-BuLi (0,7 мл, 2,4 М) при -78°С в инертной атмосфере. Реакционную смесь перемешивают еще 30 мин -78°С и затем добавляют ДМФ (1,0 мл) и реакционную смесь оставляют нагреваться до комнатной температуры. Реакцию гасят водой (50 мл), экстрагируют толуолом (2×100 мл), органические слои объединяют, промывают насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме с получением твердого остатка. Хроматографией получают соединение 6 в виде твердого вещества. 1Н ЯМР δ 10,43 (с, 1Н), 8,71 (с, 1Н), 6,55 (дд, J=10,0, 2,7 Гц, 1Н), 4,25 (с, 3Н), 4,13 (м, 1Н), 3,83 (дт, J=10,8, 2,8 Гц), 2,53-1,65 (м, 7Н). 13С ЯМР 5 177,0, 161,5, 154,5, 143,9, 130,2, 128,9, 87,0, 67,4, 53,5, 28,7, 23,7, 21,2.
Пример 7
7-[(3R,4R)]-(3-бензилокси-4-бензилоксиметилпирролидин-1-ил)метил]-5-бензилоксиметил-3Н-пирроло[3,2-d]пиримидин-4-он(3S,4S)-1-[(9-деаза-7-бензилоксиметил-гипоксантин-9-ил)метил]-3-бензилокси-4-(бензилоксиметил)пирролидин (7). К перемешиваемому раствору соединения 5 (220 мг, 0,64 ммоль) и соединения 3.HCl (190 мг, 0,57 ммоль) в метаноле (5 мл) добавляют цианоборгидрид натрия (100 мг, 1,59 ммоль) и перемешивают в течение ночи при комнатной температуре. Реакционную смесь затем концентрируют в вакууме и перерастворяют в метаноле (2 мл) и HCl (2 мл), перемешивая в течение 1 ч, и затем концентрируют в вакууме с получением твердого осадка. Хроматография полученного осадка дает соединение 7 (202 мг, 63%) в виде твердого вещества. 1H ЯМР δ 7,87 (1H, с), 7,32 (1H, с), 7,31-7,23 (м, 5Н), 5,89 (с, 2Н), 4,56 (с, 2Н), 4,50 (с, 2Н), 4,48 (с, 2Н), 4,47 (с, 2Н), 3,87 (м, 2Н), 3,81 (кв, J=13,4 Гц, 2Н), 3,43 (д, J=7,1 Гц, 2Н), 3,01 (т, J=8,1 Гц, 1H), 2,79 (д, J=4,7 Гц, 1H), 2,55 (м, 1H), 2,36 (м, 1H). 13С ЯМР δ 156,2, 145,8, 141,8, 138,9, 138,8, 137,6, 131,4, 128,8, 128,7, 128,7, 128,3, 128,2, 128,1, 128,0, 128,8, 117,9, 115,7, 81,3, 77,1, 73,5, 72,1, 71,4, 70,8, 60,0, 56,4, 48,6, 45,9.
Пример 8
(3R,4R)-1-[(9-деазагипоксантин-9-ил)метил]-3-гидрокси-4-(гидроксиметил)пирролидин (8). Соединение 7 (120 мг, 0,21 ммоль) и катализатор Пирлмана (120 мг) суспендируют в этаноле (3 мл) и уксусной кислоте (1 мл) и интенсивно перемешивают в атмосфере газообразного водорода в течение 24 час при комнатной температуре. Реакционную смесь затем фильтруют через целит и концентрируют в вакууме с получением твердого вещества. Хроматография и ионный обмен твердого вещества дает соединение 8 (38 мг, 68%) в виде белого твердого вещества с т.пл. 248-250°С. 1H ЯМР δ 7,81 (1H, с), 7,34 (1H, с), 3,97 (1H, ушир.с), 3,65 (2Н, с), 3,53 (1H, м), 3,44 (1H, м), 2,93 (1H, т, J=9,0 Гц), 2,77 (1H, м), 2,60 (1H, м), 2,33 (1H, т, J=7,1 Гц), 2,12 (1H, ушир.с). 13С ЯМР δ 155,8, 144,1, 142,8, 130,0, 117,3, 111,1, 72,9, 62,7, 60,2, 54,8, 48,9, 47,3. HRMC (MH+) вычислено для C12H16N4O3: 265,1301. Найдено: 265,1302. Анализ для С12Н16N4О3·SH2О С, 52,7; Н, 6,2; N, 20,5. Найдено: С, 53,0; Н, 5,9; N, 20,4.
Пример 9.1
(3R,4R)-1-[(9-Деаза-7-бензилоксиметиладенин-9-ил)метил]-3-бензилокси-4-(бензилоксиметил)пирролидин (9). Соединение 7 (1,2 г, 2,12 ммоль) добавляют к фосфорилхлориду (20 мл) и полученную суспензию нагревают при кипячении с обратным холодильником. Через 1 час реакционную смесь концентрируют в вакууме, разбавляют хлороформом, промывают насыщенным водным NaHCO3, насыщенным солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Полученный остаток перерастворяют в 7н. NH3 в метаноле и полученный раствор нагревают при 120°С в герметично закрытой пробирке в течение ночи. Реакционную смесь концентрируют в вакууме и очищают хроматографией с получением соединения 9 (0,83 г, 69%). 1H ЯМР δ 8,38 (с, 1Н), 7,76 (ушир.с, 1Н), 7,32-7,25 (м, 15Н), 6,01 (ушир.с, 2Н), 5,51 (д, J=2,3 Гц, 2Н), 4,55 (с, 2Н), 4,51 (с, 2Н), 4,48 (с, 2Н), 4,25 (д, J=2, 9 Гц, 2Н), 4,05 (м, 1Н), 3,50 (д, J=6,5 Гц, 2Н), 3,42 (м, 1Н), 3,31 (м, 1Н), 3,20 (м, 1Н), 3,01 (м, 1Н), 2,71 (м, 1Н). 13С ЯМР δ 152,3, 151,5, 150,1, 138,3, 138,0, 135,7, 134,6, 129,2, 129,0, 128,8, 128,2, 128,1, 115,18, 107,94, 79,7, 77,6, 73,6, 71,9, 70,7, 69,8, 58,6, 58,1, 55,22, 54,9, 48,8, 45,3.
Пример 9.2
(3R,4R)-1-[(9-Деазааденин-9-ил)метил]-3-гидрокси-4-(гидроксилметил)пирролидин (10). Соединение 9 (100 мг, 0,18 ммоль) и Pd/C (50 мг, 10% общ. масс.) суспендируют в этаноле (4 мл) и интенсивно перемешивают в атмосфере водорода в течение 24 час при комнатной температуре. Реакционную смесь затем фильтруют через целит и концентрируют в вакууме с получением сиропа. Хроматография на силикагеле