Лекарственный препарат и способ лечения ревматических заболеваний
Иллюстрации
Показать всеИзобретение относится к медицине, в частности, к лекарственному препарату для внутрисуставного введения при лечении ревматических заболеваний. Препарат включает 0,1-3,0 мас.% метотрексата в составе фосфолипидных наночастиц. Наночастицы состоят из фосфолипидов, глицирризиновой кислоты или ее соли и вспомогательных веществ. Суммарное содержание фосфолипидов и глицирризиновой кислоты и ее соли составляет 2-80 мас.%. Массовое соотношение фосфолипидов и глицирризиновой кислоты или ее соли составляет не более 4:1. Изобретение также относится к способу лечения ревматических заболеваний с помощью указанного препарата. Согласно изобретению разработана новая лекарственная форма метотрексата, которая позволяет снизить побочные эффекты препарата при сохранении его терапевтического потенциала при лечении ревматических заболеваний. 2 н. и 2 з.п. ф-лы, 3 ил., 1 табл.
Реферат
Изобретение относится к медицине, в частности к лекарственному препарату для лечения воспалительных заболеваний суставов, содержащему метотрексат диспергированный в фосфолипидные наночастицы, а также к способу лечения ревматических заболеваний с помощью заявленного препарата.
Наиболее распространенными ревматическими заболеваниями являются ревматоидный артрит (РА) и псориатический артрит (ПсА), которые регистрируются во всех странах мира с частотой от 0,6 до 1,3%. РА и ПсА - хронические системные соединительнотканные заболевания с прогрессирующим поражением периферических (синовиальных) суставов по типу эрозивно-деструктивного полиартрита, чаще болеют женщины, нередко молодого репродуктивного возраста. РА и ПсА являются причиной ранней инвалидизации пациентов не только из-за поражений кожи (ПсА), но и из-за повреждения крупных и опорных суставов, в частности, коленных. Частые обострения артрита коленных суставов сопровождаются производством большого количества синовиальной жидкости и пролиферацией синовии. Это затрудняет самостоятельное передвижение больных и требует внутрисуставных инъекций различных лекарственных средств. Наиболее часто используют стероидные гормоны, однако их применение бывает ограничено или невозможно из-за серьезных побочных реакций (повышение артериального давления, гипергликемия) или сопутствующих заболеваний (ишемический некроз суставных поверхностей). Практикующие ревматологи некоторое время назад возлагали большие надежды на локальную инъекционную терапию метотрексатом именно в тех случаях, когда стероидные гормоны неэффективны или неприемлемы. Однако в конце 90-х годов эти работы прекратились из-за короткого времени экспозиции метотрексата в полости сустава (ускоренная резорбция). Применение метотрексата в лечение больных воспалительными заболеваниями суставов связано с тем, что поражение соединительной ткани (преимущественно суставов) при РА и ПсА является следствием развивающихся иммунопатологических реакций (аутоагрессия), что имеет некоторое сходство с заболеваниями онкологической природы. В основе этих реакций лежит дисбаланс функции Т- и В-лимфоцитов, а именно иммунодефицит системы Т-лимфоцитов, что приводит к неконтролируемому синтезу В-лимфоцитами антител, в частности IgG. В результате этого при повреждении в синовии возникает местная иммунная реакция с образованием измененных IgG, обладающих аутореактивностью и способностью вступать в реакцию по типу антиген-антитело. В конечном счете в синовии запускаются сложные воспалительные реакции, которые приводят к разрушению тканей сустава, сосудов и внутренних органов. Эти механизмы оправдывают применение препаратов, в частности, метотрексата, с иммунодепрессивным и антипролиферативным действием.
Метотрексат представляет собой N-[4-[[(2,4-диамино-6-птеридинил)метил]метиламине]бензоил]-L-глутаминовой кислоты и
относится к фармакологической группе антиметаболитов. Он является структурным аналогом фолиевой кислоты и в качестве такового ингибирует дигидрофолатредуктазу, играющую важную роль в синтезе пуриновых нуклеотидов и тимидилата, необходимых для синтеза ДНК, и соответственно подавляет синтез и репарацию ДНК. Обладает противоопухолевым (цитотоксическим) и иммунодепрессивным действием, тормозит пролиферативные и репаративные процессы. Основное преимущество метотрексата перед другими НПВС заключается в его выраженной способности (при применении в малых дозах) нормализовать измененный метаболизм костной ткани и костного мозга и тем самым устранять одно из самых тяжелых последствий прогрессирования РА. Однако при длительном применении в больших и средних терапевтических дозах метотрексат, как все цитостатики, проявляет значительную токсичность, что ограничивает его использование в клинике.
Терапия больных с ревматическими заболеваниями обычно проводится с использованием системного назначения большого числа разнообразных лекарственных средств. В связи с этим возникают проблемы их взаимодействия, переносимости, противопоказаний к применению. В клинической практике часто приходится отказываться от применения базисной и/или противовоспалительной терапии из-за сопутствующих заболеваний или из-за появления серьезных побочных эффектов. Это делает актуальной местную или локальную терапию, которая способна уменьшить дозу НПВП или базисного препарата, а также снизить общую стоимость лечения. К такой локальной противовоспалительной терапии относят внутрисуставные инъекции глюкокортикостероидов и метотрексата и доставку их к месту воспаления с помощью физиотерапевтических методик (фонорез или ультразвук с гидрокортизоном). Однако эти препараты обладают высокой скоростью резорбции, что значительно снижает эффективность их применения, а многократное введение стероидных препаратов в сустав приводит к развитию нежелательных побочных эффектов. Поэтому снижение скорости резорбции таких препаратов, повышение их эффективности и биодоступности являются актуальными научными проблемами.
Разработка фосфолипидных наноформ внутрисуставных препаратов представляет существенный научный и практический интерес, т.к. применяемая технология позволит значительно повысить эффективность препарата за счет повышения его биодоступности, снижения возможных побочных эффектов и назначаемой дозы.
В RU 2223749 С2, 20.02.2004, описаны композиции и способы доставки аэрозолей с малым размером частиц путем ингаляции водных дисперсий фосфолипидных наночастиц, несущих противораковые лекарственные препараты, к дыхательным путям субъекта, нуждающегося в таком лечении.
В GB 2143433 А, 13.02.1985, описана дерматологическая мазь для лечения кожных заболеваний, например псориаза, включающая фосфолипидные наночастицы, содержащие «захваченный» метотрексат и дерматологически приемлемый носитель.
Однако такие формы препаратов не могут быть использованы для локального лечения ревматических заболеваний.
Целью изобретения является разработка новых лекарственных форм метотрексата, которые позволили бы снизить побочные эффекты препарата при сохранении его терапевтического потенциала при лечении ревматических заболеваний.
Поставленная цель достигается путем создания лекарственного препарата для внутрисуставного введения при лечении ревматических заболеваний на основе натуральных фосфолипидов - препарата «Фосфоглив» и метотрексата.
Таким образом, описывается лекарственный препарат для внутрисуставного введения при лечении ревматических заболеваний, включающий включающий 35-90 мас.% метотрексата, фиксированного на фосфолипидные наночастицы, причем наночастицы состоят из фосфолипидов, глицирризиновой кислоты или ее соли и вспомогательных веществ при суммарном содержании фосфолипидов и глицирризиновой кислоты или ее соли 2-80 мас.% и массовом соотношении фосфолипидов и глицирризиновой кислоты или ее соли не более 4:1.
Использование фосфолипидных наноформ лекарственных препаратов имеет целый ряд преимуществ. Наиболее важные из них заключаются в том, что лекарственные вещества, включенные в наночастицы, значительно дольше циркулируют в крови, практически не взаимодействуют с компонентами крови и способны накапливаться в значительных концентрациях в опухолевых клетках. Все эти преимущества связаны с тем, что лекарственные вещества, включенные в наночастицу, не имеют непосредственного контакта с окружающими наночастицу компонентами крови и высвобождаются из наночастиц при разрушении последних. Это в значительной степени снижает отрицательное побочное действие лекарственных веществ. Возможно и значительное снижение концентрации лекарственных веществ, используемых при лечении того или иного заболевания.
В качестве основы для получения фосфолипидных наночастиц используют препарат "Фосфоглив", который содержит фосфолипиды, глицирризиновую кислоту или ее соли и вспомогательные вещества, при этом суммарное содержание фосфолипидов и глицирризиновой кислоты или ее соли составляет 2-80 мас.% при массовом соотношении фосфолипидов и глицирризиновой кислоты или ее соли не более 4:1. «Фосфоглив» обладает свойством репарировать биологические мембраны и используется для лечения острых и хронических заболеваний печени, нарушения липидного обмена при атеросклерозе и сопутствующих заболеваниях, а также восстановления функции печени при интоксикации (RU 2133122 C1, 20.07.1999). Также "Фосфоглив" применяется в качестве средства для комплексного лечения хронических дерматозов: псориаза, атонического дерматита, экземы и кератодермий (RU 2196585 C1, 20.01.2003).
В качестве фосфолипидов "Фосфоглив" содержит фосфатидилхолин растительного или животного происхождения при содержании основного вещества в фосфатидилхолине 70-90 мас.%.
Метотрексат содержит в своей молекуле как аминогруппы, так и карбоксильные группы. Отрицательно заряженные в слабощелочной среде карбоксильные группы метотрексата способны к взаимодействию с положительно заряженным азотом фосфатидилхолина. В результате в щелочной среде происходит направленное связывание метотрексата с гидрофильными поверхностями фосфолипидных наночастиц. Проведенные эксперименты по использованию полученных нами наноформ лекарственных препаратов в сравнении с лекарственными препаратами, не включенными в наночастицы, в экспериментах на животных показали, что фосфолипидные наноформы препаратов циркулируют в крови более длительный промежуток времени.
Заявленный лекарственный препарат не имеет аналогов в практике зарубежного и отечественного здравоохранения и представляет собой лиофилизированный порошок стабильный при хранении. При растворении препарата в воде образуются стабильные фосфолипидные наночастицы размером 50-65 нм «нагруженные» метотрексатом.
Применение метотрексата, диспергированного в фосфолипидные наночастицы, способствует увеличению лечебной эффективности внутрисуставных инъекций за счет биодоступности препарата и снижению резорбтивного эффекта препарата при внутрисуставном введении. Кроме того, введение таких компонентов наночастиц как фосфолипиды и глицирризиновая кислота в сустав также способствует снижению воспалительных процессов и ускоряет восстановление тканей, поскольку эти компоненты обладают уже доказанной биологической активностью. Как показали исследования на животных, заявленный лекарственный препарат оказывает выраженное противоревматическое действие. Причем антиревматический эффект разработанного препарата был более значительным и превосходил антиревматический эффект свободного метотрексата.
Изобретение относится также к способу лечения ревматических заболеваний путем назначения пациенту, нуждающемуся в этом, внутрисуставных инъекций лекарственного препарата, включающего терапевтически эффективное количество метотрексата, фиксированного на наночастицах, состоящих из фосфолипидов, глицирризиновой кислоты или ее соли и вспомогательных веществ при суммарном содержании фосфолипидов и глицирризиновой кислоты или ее соли 2-80 мас.% и массовом соотношении фосфолипидов и глицирризиновой кислоты или ее соли не более 4:1.
Специалист (врач-ревматолог) в области лечения ревматических заболеваний легко определит эффективную дозу по результатам испытаний, представленных в настоящем описании, и в соответствии с другой информацией. Как правило, предполагается, что терапевтически эффективная доза будет составлять от 0,7 мг/кг до 2,1 мг/кг массы тела. Может оказаться подходящим введение терапевтически эффективной дозы, разделенной на две, три, четыре или более субдозы через подходящие интервалы во времени. Точная дозировка и частота введения зависят от активности синовита (артрита), возраста, общего физического состояния конкретного пациента, а также других лекарственных препаратов, которые принимает пациент, и хорошо известны врачу-ревматологу. Кроме того, является очевидным, что указанная эффективная доза может быть понижена или повышена в зависимости от реакции пациента, принимающего лечение и/или в зависимости от мнения врача, назначающего лекарственный препарат, являющегося предметом настоящего изобретения.
Препарат предназначен для использования в больницах, поликлиниках, санитарно-курортных и лечебно-профилактических учреждений.
Следующий пример иллюстрирует изобретение без ограничения его объема.
Пример.
Приготовление лекарственной формы препарата метотрексат, фиксированный на липосомах.
1. Приготовление раствора.
Раствор А: 6,9 г динатриевой соли глицирризиновой кислоты растворяют в воде для инъекций и доводят объем до 90 мл. При интенсивном перемешивании в токе азота добавляют 2,25 мл 1 н. NaOH и 16,5 г измельченного фосфолипида.
Раствор Б: 59,4 г мальтозы растворяют в 90-100 мл воды для инъекций при интенсивном перемешивании до тех пор, пока раствор не станет прозрачным. Доводят конечный объем до 150 мл.
Раствор В: 150 мг метотрексата (из расчета 10 мг на флакон) растворяют 10 мл 0.01М NaHCO3.
Смешивают растворы А, Б и В и доводят водой для инъекций общий объем до 300 мл.
2. Гомогенизация раствора.
Объединенный раствор гомогенизируют на гомогенизаторе (Mini-Lab 7/30 VH, Rannie, Дания) в течение 60 мин при давлении 800 барр. Охлаждение осуществляют через обратный холодильник. Светопропускание (прозрачность) раствора при 660 нм не менее 60-65%, что соответствует размеру липосом 40-60 нм.
3. Предфильтрация.
Гомогенизированный раствор отфильтровывают под давлением азота 2 атм через мембрану «Владипор» 3-4 мкм. Прозрачность раствора при 660 нм должна быть не менее 65%.
4. Стерилизующая фильтрация.
Стерилизующую фильтрацию проводят в стерильной комнате под ламинаром (Ламинарбокс ЛБ-Г, Россия) на приборе напорного фильтрования ЗАО «Мембраны», Россия через фильтр «Владипор» диаметром 0,2 мкм под давлением 3 атм.
5. Стерильный розлив во флаконы.
Дозатором под ламинаром разливают раствор в темные флаконы по 10 мл, предукупоривают пробками и замораживают при температуре -25°С.
6. Лиофилизация раствора.
Лиофилизируют замороженные образцы в сублимационной сушке LSL SECFROID, LYOLAB F, Германия в течение 21 часа до получения однородной таблетки с плотной консистенцией.
Флаконы закупоривают и закатывают алюминиевыми колпачками. Хранят при температуре не выше 20°С.
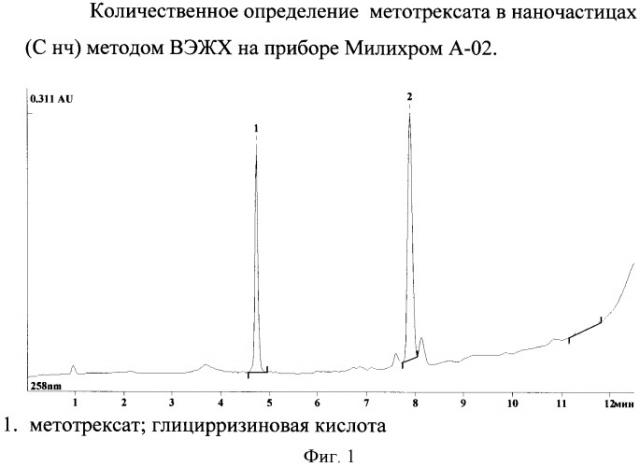
Количественное определение включения метотрексата в липосомы.
Принцип определения % включения метотрексата в фосфолипидные наночастицы заключается в определении общей концентрации метотрексата в препарате (С общ.), затем отделении фосфолипидных наночастиц, нагруженных метотрексатом от метотрексата, не включенного в наночастицы, методом гельфильтрации и дальнейшем анализе концентрации метотрексата в наночастицах (С лип.) методом ВЭЖХ на аппаратуре Милихром А-02. Для определения С общ. метотрексата из раствора с этим веществом отбирали 10 мкл и добавляли метанол. Из полученного раствора с разрушенными наночастицами отбирали аликвоту и определяли концентрацию метотрексата методом ВЭЖХ на аппаратуре Милихром А-02. Разделение наночастиц, нагруженных метотрексатом, от метотрексата, не включенного в наночастицы, проводили в хроматографической системе с использованием сефадекса G-25 уровновешенного 0.2% ацетатом аммония, рН 8 М. Собранный материал пика лиофилизировали, экстрагировали фосфолипиды хлороформом. К высушенному остатку добавляли 100 мкл буфера «А» для ВЭЖХ и тщательно перемешивали на вибрационном смесителе. Аликвоты этого раствора (1-10 мкл) анализировали на содержание метотрексата с помощью метода ВЭЖХ на аппаратуре Милихром А-02. Регистрацию (качественное и количественное определение) метотрексата проводили с помощью элюции в течение 12,5 мин градиентом ацетонитрила от 1% до 90% в 0,1% растворе трифторуксусной кислоте со скоростью 200 мкл/мин, детектирование в УФ при 258 нм. Разделение и время удерживание на колонке представлены на фиг.1. Вычисление % включения метотрексата в липосомы проводили по формуле:
(С лип.×100):С общ. = % включения.
Определение метотрексата в сыворотке крови экспериментальных животных.
К образцам сыворотки крови по 100 мкл добавляли 3 мл метанола и тщательно перемешивали раствор на вибрационном смесителе. Полученную смесь центрифугировали при 5000 об/мин. Супернатант собирали в коническую колбу и высушивали досуха на роторном испарителе под вакуумом. К высушенному материалу добавляли 200 мкл стартового буфера для определения лекарственного препарата. Анализ проводили методом ВЭЖХ в условиях описанных выше.
Сравнительный анализ циркуляции в крови экспериментальных животных наноформы метотрексата и свободного метотрексата
Для определения времени циркуляции различных форм лекарственного препарата метотрексата проводили эксперименты на крысах. Препараты вводили внутривенно из расчета 6 мг на кг веса животного. Образцы крови получали через 5 мин, 15 мин, 30 мин, 60 мин, 120 мин. Определение концентрации метотрексата в сыворотке крови проводили так, как это описано выше. Было обнаружено, что концентрация препарата метотрексата, не включенного в фосфолипидные наночастицы, падает в 5 раз от 5 минуты к 15 минуте. Если измерение на 5 минуте условно принять за 100%, то к 15 минуте концентрация лекарственного препарата в крови падает до 20%, а через 60 минут падает до 10%. В случае введения животным фосфолипидной наноформы метотрексата падение концентрации до 20% происходит не к 15 минуте, а только через 60 минут. Таким образом, метотрексат, включенный в фосфолипидные наночастицы, циркулирует в крови более длительное время.
Сравнительное изучение острой токсичности новой лекарственной формы препарата - «Фосфоглив»-метотрексат и свободного метотрексата, применяемого в медицинской практике, в эксперименте на животных.
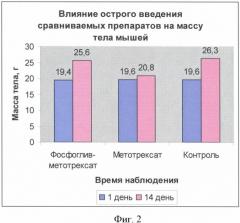
Изучение острой токсичности фосфоглив-метотрексата и свободного метотрексата проводилось в экспериментах на белых нелинейных мышах самцах массой тела 18-20 г.
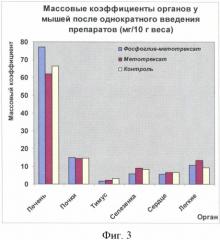
Сравниваемые препараты вводили внутрибрюшинно. Для исследования каждой дозы препарата использовались группы по 6 животных, наблюдение за ними ввелось в течение двух недель. В течение указанного срока ежедневно наблюдали за общим состоянием и поведением животных, потреблением корма и воды; регистрировали летальность, время гибели животных, симптоматику отравления, макро- и микроскопическое описание погибших и всех выживших животных в конце исследования, гистологическое исследование почек, отличавшихся по окраске от почек контрольных животных; определение массовых коэффициентов внутренних органов. Полученные результаты представлены на фиг.2 и 3.
Вскрытие животных спустя 14 дней после острого введения обоих препаратов не показало наличия остаточных явлений, связанных с перенесенной интоксикацией, кроме изменений в почках, в которых степень выраженности патологического процесса идентична.
ЛД50 для свободного метотрексата составила 60,95, для фосфоглив-метотрексата - 57,35.
На основании полученных данных можно сделать вывод об отсутствии значимых различий по показателям острой токсичности между сравниваемыми препаратами: фосфоглив-метотрексат и свободный метотрексат.
Сравнительное изучение противовоспалительной активности метотрексата, фиксированного на липосомах (MTX-LIPO), и свободного метотрексата (МТХ).
Изучение противовоспалительной активности наноформы метотрексата (метотрексат, фиксированный на фосфолипидных наночастицах - MTX-LIPO) и свободного метотрексата проводилось в экспериментах на крысах Wistar самцах массой 200-220 г.
Адъювантный артрит у крыс моделировали с помощью живых микобактерий вакцинного штампа БЦЖ в группах животных: 1) интактный контроль, 2) плацебо 0,1 мл, 3) MTX-LIPO 3.6 мг/0,1 мл, 4) MTX-LIPO 0,72 мг/0.1 мл 5) МТХ-3.6 мг/0,1 мл. Лечение крыс начинали на фоне развившегося артрита, т.е. через 14-15 суток после введения БЦЖ, при наличии признаков полиартрита, т.е. кроме выраженного отека правой лапы увеличивался объем левой лапы, выявлялись утолщение хвоста, ушей и т.д. Контроль был представлен 2 группами: одна группа крыс после инъекции БЦЖ не получала никакого вещества, другая получала плацебо. Воспалительную реакцию на введение БЦЖ оценивали по степени увеличения объема правой и левой лап и голеностопных суставов, изменению массы тела животных, общему виду животных, состоянию волосяного покрова, хвоста и ушей.
Эффект терапевтического воздействия метотрексата оценивали по разнице в объемах лап у леченых (сравнение с исходным уровнем) и контрольных (нелеченых) животных, кроме того, оценивали процесс торможения адъювантного артрита в %, что и отражено в таблице 1.
После забоя животных проводили морфологическое исследование голеностопных суставов. В результате было установлено, что внутрисуставное еженедельное введение метотрексата, фиксированного на фосфолипидных наночастицах, оказывает значительное подавление воспалительной реакции голеностопных суставов крыс, и в последующий период наблюдения (14-30 сутки) под действием препарата происходит заметное улучшение состояния патологически измененных голеностопных суставов, причем эффект был выявлен в обеих использованных дозах, но наиболее отчетливо он был выражен при использовании дозы 3,6 мг/0,1 мл.
Таким образом, изучение на модели адъювантного артрита у крыс наноформы метотрексата, вводимого внутрь сустава, показало его эффективность в отношении воспалительных изменений голеностопных суставов, индуцированных введением БЦЖ. Терапевтическое действие МТХ-LIPO выражалось в существенном торможении артрического процесса у крыс. При этом антиартрический эффект MTX-LIPO был более значительным при использовании большей дозы -3,6 мг/0,1 мл и превосходил противовоспалительный эффект свободного метотрексата.
| Таблица 1 | ||||||
| Сравнительное изучение противовоспалительной активности метотрексата, фиксированного на наночастицах (MTX-LIPO), и свободного метотрексата (МТХ) | ||||||
| 5 сутки | 10 сутки | 15 сутки | ||||
| Группы | Правая лапа | Левая лапа | Правая лапа | Левая лапа | Правая лапа | Левая лапа |
| MTX-LIPO 3,6 мг/0,1 мл | 58,3% | 39,5% | 79% | 64,14% | 83,2% | 78,35% |
| MTX-LIPO 0,72 мг/0,1 мл | 0% | 0% | 52,4% | 48,6% | 57% | 62,4% |
| МТХ3,6 мг/0,1 мл | 22,8% | (-11)% | 62% | 45,6% | 75,3% | 66,8% |
1. Лекарственный препарат для внутрисуставного введения при лечении ревматических заболеваний, включающий 0,1-3,0 мас.% метотрексата в составе фосфолипидных наночастиц, причем наночастицы состоят из фосфолипидов, глицирризиновой кислоты или ее соли и вспомогательных веществ при суммарном содержании фосфолипидов и глицирризиновой кислоты и ее соли 2-80 мас.% и массовом соотношении фосфолипидов и глицирризиновой кислоты или ее соли не более 4:1.
2. Препарат по п.1, отличающийся тем, что он включает фосфолипиды растительного или животного происхождения с содержанием фосфатидилхолина 70-90 мас.%.
3. Способ лечения ревматических заболеваний путем назначения пациенту, нуждающемуся в этом, внутрисуставных инъекций лекарственного препарата по п.1 или 2.
4. Способ по п.3, отличающийся тем, что ревматическим заболеванием является ревматоидный артрит и псориатический артрит.