Применение римексолона для лечения синдрома сухого глаза
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к офтальмологии, и касается лечения синдрома "сухого глаза". Для этого используют композиции, содержащие кортикостероид римексолон в концентрации от 0,001 до 0,1% мас./об. Использование римексолона в таких низких дозах обеспечивает эффективное лечение синдрома "сухого глаза" при минимальных побочных эффектах за счет ограниченной способности препарата проникать внутрь глаза, оказывая при этом избирательное действие на поверхность роговицы. 2 н. и 17 з.п. ф-лы, 4 ил., 2 табл.
Реферат
Уровень техники
Настоящее изобретение относится к композициям и способам, применяемым для лечения состояний, связанных с синдромом «сухого глаза». Точнее, изобретение относится к использованию избирательного относительно поверхности роговицы глаза глюкокортикоида, имеющего ограниченную глазную биодоступность для лечения синдрома сухого глаза.
Состояния, связанные с синдромом сухого глаза, могут быть вызваны рядом факторов. Например, воспаление слезной железы и денервация роговицы могут сдерживать образование слез, и дисфункция мейбомиевых желез и неполное смыкание век часто являются причиной быстрого «высыхания» слез. Состояния также могут быть отнесены к факторам, оказывающим влияние на состояние здоровья (например, синдром Шегрена, другие коллагеново-сосудистые заболевания или аллергии), лекарственным препаратам (например, антигистаминам) или факторам окружающей среды (например, пыли или дыму). Следующую публикацию можно привести для рассмотрения данных относительно диагноза состояний, связанных с синдромом сухого глаза, и различных подходов предыдущего уровня техники к лечению указанных состояний: "The Once and Future Treatment of Dry Eye", Review of Optometry Online, (February 15, 2000); "Attacking the Root Causes of Ocular Surface Disease", Review of Optometry Online, (June, 1998); and "Dry Eye Syndrome", The EyeSite, (August, 1999).
Синдром "сухого глаза", или сухой кератоконъюнктивит, является общим офтальмологическим заболеванием, которым поражается значительная часть населения всего мира. Некоторые из индивидуумов испытывают синдром Шегрена. Женщины, находящиеся в периоде после менопаузы, составляют другую часть населения, страдающего сухим кератоконъюнктивитом. Сухой кератоконъюнктивит может поражать индивидуумов в различной степени выраженности заболевания. При средней степени выраженности заболевания больной может испытывать жжение, ощущение сухости и другие симптомы поражения глаза. В тяжелых случаях зрение может быть ослаблено в значительной степени.
Хотя сухой кератоконъюнктивит может возникать вследствие несвязанных друг с другом патогенных ситуаций, все они проявляются в виде общего эффекта разрыва слезной пленки глаза с обезвоживанием и последующим повреждением уязвимых наружных поверхностей глаза. К настоящему времени накоплены данные, свидетельствующие о том, что воспаление может являться важным фактором в патогенезе сухого кератоконъюнктивита, таким как выявление повышенных уровней провоспалительных медиаторов, включающих IL-1, в эпителии конъюнктивы у больных с синдромом Шегрена.
Индивидуумы, пораженные системным аутоиммунным заболеванием, известным как синдром Шегрена, обычно страдают от тяжело протекающего сухого кератоконъюнктивита. При данном заболевании воспаление слезной железы ослабляет процессы секреции, что приводит к дефектам в слезной пленке. Изменения, происходящие на поверхности глаза, включают в себя образование и накопление ряда медиаторов воспаления. Эти продукты провоспаления могут быть произведены из поврежденных клеток роговицы и эпителиальных клеток конъюнктивы, а также воспаленной слезной железы.
Терапия сухого кератоконъюнктивита, используемая в предшествующем уровне техники, включала в себя паллиативные реагенты, такие как композиции, являющиеся слезозаменителями, и лекарственные средства, такие как местные стероиды, местные ретиноиды (например, витамин А), пероральный пилокарпин и местный циклоспорин. Вообще, паллиативная терапия способна обеспечить кратковременное ослабление некоторых из симптомов сухого кератоконъюнктивита, однако для поддержания указанного ослабления требуется частое применение для глаза паллиативных продуктов, поскольку эти продукты, в основном, не исключают физиологические источники состояний, связанных с сухим кератоконъюнктивитом. Лекарственная терапия, которая известна из предшествующего уровня техники, имела ограниченный успех в лечении состояний, связанных с сухим кератоконъюнктивитом. Ограниченную эффективность предшествующей лекарственной терапии относили, в основном, к неспособности лекарственного средства устранять или снижать коренные причины состояний, связанных с сухим кератоконъюнктивитом, к побочным эффектам, возникающим от приема лекарственных средств, которые представляют угрозу общему здоровью глаз больного, или к неудовлетворительному соблюдению больным приема лекарств или комбинации указанных факторов.
Использование половых гормонов и глюкокортикоидов в лечении сухого кератоконъюнктивита широко обсуждалось в предыдущих научных статьях и патентных публикациях. В этой связи, следующие публикации могут быть приведены для дальнейшего развития в этой области: Marsh and Pflugfelder, "Topical Nonpreserved Methyprednisolone Therapy for Keratoconjunctivitis Sicca in Sjögren Syndrome", Ophthalmology, Volume 106, number 4, pages 881-816 (April, 1999); патент США No. Re. 34578 (Lubkin); патент США No.5620921 (Sullivan); и патент США No.6153607 (Pflugfelder, et al.).
Известно, что некоторые глюкокортикоиды обладают более высокой способностью повышать внутриглазное давление ("IOP"), чем другие соединения этого класса. Например, известно, что преднизолон, который является очень мощным глазным противовоспалительным средством, проявляет более существенную тенденцию повышать IOP, чем фторметолон, который обладает умеренной противовоспалительной активностью для глаз.
Также известно, что риск повышений IOP, связанных с местным применением глюкокортикоидов при воспалительном поражении глаза, повышается со временем. Другими словами, хроническое (т.е. продолжительное) использование указанных средств повышает риск значительных увеличений IOP.
В отличие от бактериальных инфекций или острого воспаления глаз, связанного с физической травмой, для устранения которых требуется кратковременная терапия в течение нескольких недель, состояния, связанные с сухим кератоконъюнктивитом, требуют лечения в течение продолжительных периодов времени, обычно нескольких месяцев или более. Такое хроническое использование кортикостероидов в значительной степени увеличивает риск повышений IOP. Также известно, что продолжительное использование кортикостероидов повышает риск образования катаракты.
Было предположено, что упомянутые выше проблемы, связанные с хронической терапией кортикостероидами, могут быть решены посредством применения «пульсирующего» режима лечения, при котором больного лечат только эффективными кортикостероидами (например, преднизолоном) в течение относительно коротких, прерывистых периодов (см. статью Marsh and Pflugfelder, 1999, цитированную выше). Однако принимая во внимание практические ограничения, связанные с получением согласия больного с предписанным режимом, особенно у пожилых людей, для решения указанных выше проблем необходимо более подходящее решение. Настоящее изобретение направлено на решение указанной задачи посредством использования очень низких концентраций избирательного относительно поверхности роговицы глаза глюкокортикоида, римексолона.
Использование римексолона для лечения воспалительного поражения глаза описано в патенте США No.4686214 (Boltralik). Коммерческий продукт, содержащий 1% римексолона, продавался компанией Alcon Laboratories, Inc. в течение нескольких лет под названием "VEXOL® 1% (Rimexolone) Ophthalmic Suspension".
Сущность изобретения
Настоящее изобретение основывается на данных, указывающих на то, что глюкокортикоид римексолон является наиболее подходящим для использования его в лечении состояний, связанных с сухим кератоконъюнктивитом, особенно для хронической терапии (т.е. ежедневное введение в течение продолжительных периодов времени, таких как несколько месяцев или более).
Большинство глюкокортикоидов, включая римексолон, являются относительно нерастворимыми в воде. Однако прямой корреляции между растворимостью в воде и способностью указанных лекарственных средств проникать через роговицу и распространяться во внутриглазных жидкостях и тканях не наблюдается. Два глюкокортикоида, которые обычно рассматривают как эффективные противовоспалительные средства для глаз, преднизолон и дексаметазон, способны проникать через роговицу в большей степени, чем римексолон, и поэтому достигают более высокого уровня внутриглазной биодоступности, но являются также относительно нерастворимыми в воде.
Настоящее изобретение основывается на данных, указывающих на то, что ограниченная внутриглазная биодоступность римексолона в значительной степени способствует лечению состояний, связанных с синдромом «сухого глаза», особенно это касается хронической терапии. Преимущества ограниченной биодоступности являются двукратными. Во-первых, в результате ограниченного проникновения римексолона через роговицу риск повышения IOP, ускорения образования катаракты или появления других существенных побочных эффектов значительно уменьшается. Как указано выше, это уменьшение риска представляется особенно важным в случаях хронической терапии. Во-вторых, тот факт, что римексолон проникает через роговицу лишь в ограниченной степени, означает, что большая часть лекарственного средства остается на поверхности роговицы и склеры. Это свойство римексолона называют в тексте как «избирательность относительно поверхности глаза».
Избирательность римексолона, проявляющаяся в том, что он остается на поверхности глаза, а не распространяется по всему глазу, является отличительным преимуществом у больных с сухим кератоконъюнктивитом, поскольку ткани-мишени у таких больных (т.е. ткани, которые поражены в первую очередь) находятся на поверхности глаза. Было обнаружено, что как результат указанной избирательности относительно поверхности глаза римексолон представляется эффективным средством в лечении состояний, связанных с синдромом «сухого глаза», даже при очень низких концентрациях. Эффективность римексолона при таких низких концентрациях также снижает риск повышений IOP, образования катаракты и других возможных глазных побочных эффектов.
Настоящее изобретение также основывается на данных, указывающих на то, что глазные суспензии, содержащие очень низкие концентрации римексолона, могут быть приготовлены в виде консервированных многодозовых продуктов, чем в виде продуктов в форме стандартной дозы без консервирующих средств. Применение консервированных продуктов в виде множества доз для лечения состояний, связанных с синдромом «сухого глаза», не было описано в предшествующем уровне техники (смотри статью Marsh and Pflugfelder, 1999, цитированную выше).
Предложенные в предшествующем уровне техники рекомендации, указывающие на необходимость избегать использования противомикробных консервантов в глазных продуктах вообще и, в частности, в глазных глюкокортикоидных продуктах, применяющихся для лечения сухого кератоконъюнктивита, основываются на том факте, что обычно используемое для консервации таких продуктов противомикробное средство, бензалконийхлорид, вызывает раздражение глаз и обострение воспалительных состояний глаз, таких как сухой кератоконъюнктивит.
Поэтому данные, полученные в предшествующем уровне техники, свидетельствуют о том, что такие противомикробные консерванты должны быть полностью удалены. Поскольку стерильность глазных продуктов должна быть сохранена, для удаления противомикробных консервантов требуется, чтобы продукты были упакованы в виде стандартной дозы, т.е. каждую дозу стерилизованного раствора упаковывают в небольшом, герметично закрытом пластиковом пузырьке. Такой подход является предпочтительным для полного исключения противомикробных консервантов, однако он имеет некоторые недостатки, такие как риск микробного заражения продуктов, неудобство, неэкономичное использование упаковочных материалов и дороговизна.
Настоящее изобретение преодолевает препятствия, возникшие при решении обсуждаемых выше проблем, посредством замены обычного консерванта бензалконийхлорида ("BAC") консервирующей системой, которая является очень мягкой относительно ВАС, но эффективной в предотвращении микробного загрязнения содержащих римексолон глазных композиций, представленных в виде множества доз. Консервирующая система включает буферную систему, проявляющую противомикробную активность, и предпочтительно также противомикробное средство в очень низкой концентрации, которое не вызывает раздражение или другое физическое недомогание у больных сухим кератоконъюнктивитом, которые прикладывают к глазам указанную систему. Предпочтительным противомикробным средством является поликватерний-1 в концентрации пять частей на миллион (т.е. 0,0005% мас./об.). Также было показано, что использование негидрофильного суспендирующего агента, предпочтительно поливинилпирролидона, является предпочтительным, чтобы эффективно суспендировать римексолон и способствовать применению таких низких концентраций поликватерния-1.
Краткое описание чертежей
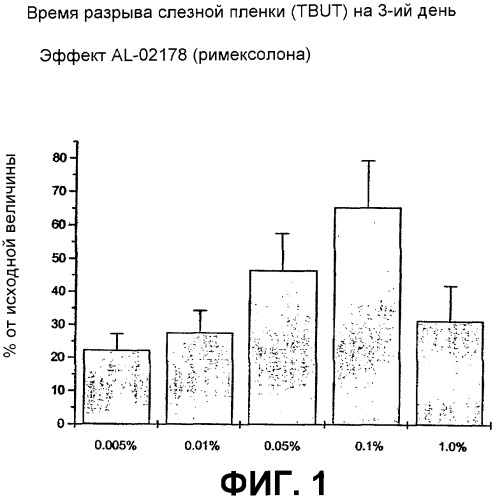
Фиг.1 является графическим изображением данных TBUT, обсуждаемых в примере 2.
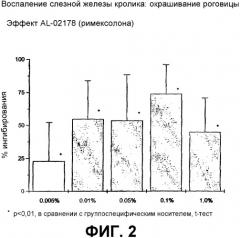
Фиг.2 является графическим изображением данных относительно защиты роговицы, обсуждаемых в примере 2.
Фиг.3 является графическим изображением данных TBUT, обсуждаемых в примере 3 и
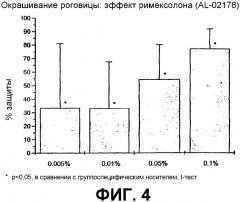
Фиг.4 является графическим изображением данных относительно защиты роговицы, обсуждаемых в примере 3.
Подробное описание изобретения
Настоящее изобретение основывается на данных, свидетельствующих о том, что римексолон представляется эффективным средством в лечении состояний, связанных с синдромом «сухого глаза», при концентрациях, которые являются значительно меньше концентрации, которую обычно используют для лечения глазного воспаления. Концентрации римексолона, которые используют в настоящем изобретении, составляют 0,1% мас./об. или меньше, в то время как концентрация, которую обычно используют в препарате VEXOL®, составляет 1%. Таким образом, разница в концентрациях составляет, по крайней мере, десять раз.
Диапазон концентраций римексолона для композиций согласно настоящему изобретению составляет от 0,001 до 0,1% мас./об., предпочтительно от 0,05 до 0,075% мас./об. Самой предпочтительной концентрацией является 0,075%.
Композиции согласно настоящему изобретению содержат буферную систему, которая способствует поддержанию рН композиций на физиологически совместимых уровнях или около этих уровней и обеспечению низкого уровня противомикробной активности. Противомикробная активность, находящаяся на низком уровне, способствует предотвращению заражения бактериями, грибами или другими микроорганизмами. Указанную функцию называют в тексте как «противомикробная защита».
Уровень противомикробной активности, требуемый для создания противомикробной защиты глазных фармацевтических продуктов, представленных в виде множества доз, описан в Фармакопее США ("USP"), Европейской Фармакопее ("EP") и соответствующих формулярах других стран, включающих в себя стандарты эффективности защиты. Буферные системы, используемые в настоящем изобретении, создают противомикробную активность, достаточную для того, чтобы удовлетворять стандартам без включения каких-либо обычных противомикробных средств, либо для того, чтобы концентрация обычного противомикробного средства была снижена в значительной степени. Количество буферной системы, требуемое для достижения указанных выше целей, называют в тексте как «количество, повышающее противомикробное действие».
Композиции согласно настоящему изобретению имеют рН от 6 до 8, наиболее предпочтительно около 7,4. рН композиций можно регулировать во время производства композиций путем добавления небольших количеств гидроокиси натрия и/или соляной кислоты. Однако для того, чтобы поддержать рН композиций в пределах вышеуказанного диапазона в течение продолжительных периодов от одного года до двух лет или дольше, требуется буферная система.
Предпочтительная буферная система представляет собой комбинацию одного или более боратных компонентов и одного или более многоатомных спиртов, которые взаимодействуют с образованием комплексов борат/многоатомный спирт. Применение комплексов борат/многоатомный спирт для повышения противомикробной активности глазных композиций описано в патенте США No.6143799 (Chowhan, et al.), полное содержание которого включено в настоящее описание посредством ссылки.
Употребляемый в данном тексте термин «борат» относится к борной кислоте, солям борной кислоты и другим фармацевтически приемлемым боратам или к их комбинациям, и термин «многоатомный спирт» относится к любому соединению, имеющему, по крайней мере, одну гидроксильную группу у каждого из двух соседних углеродов, причем гидроксильные группы не находятся в транс-конфигурации относительно друг друга. Наиболее подходящими боратами являются: борная кислота, борат натрия, борат калия, борат кальция, борат магния, борат марганца и другие боратные соли. Многоатомные спирты могут быть линейными или циклическими, замещенными или незамещенными или их смесями при условии, что полученный комплекс борат/многоатомный спирт является водорастворимым и фармацевтически приемлемым. Такие соединения включают в себя сахара, сахарные спирты, сахарные кислоты и уроновые кислоты. Предпочтительными многоатомными спиртами являются сахара, сахарные спирты и сахарные кислоты, включающие, но не ограничивающие: маннит, глицерин, пропиленгликоль и сорбит. Особенно предпочтительными многоатомными спиртами являются маннит и глицерин; наиболее предпочтительным является маннит. Молярное отношение бората к многоатомному спирту обычно составляет приблизительно между 1:0,1 и 1:10 и предпочтительно приблизительно между 1:0,25 и 1:2,5.
Комплексы бората и многоатомного спирта используют в композициях согласно настоящему изобретению в количестве приблизительно между 0,5 и 6,0 процентами масс. (мас.%), предпочтительно приблизительно между 1,0 и 2,5% мас. Однако оптимальное количество будет зависеть от сложности продукта, поскольку возможные взаимодействия могут происходить с другими компонентами композиции. Такое оптимальное количество сможет легко определить квалифицированный специалист в области приготовления лекарственных форм.
В другом предпочтительном аспекте изобретения буферная система представляет собой комбинацию трометамина и борной кислоты. Концентрация борной кислоты будет варьировать, в основном, от 0,1 до 1,5% мас./об., предпочтительно 0,6% мас./об. Концентрация трометамина будет варьировать, в основном, от 0,05 до 0,6% мас./об., предпочтительно 0,25% мас./об.
Защищающая система, используемая в композициях согласно настоящему изобретению, также включает в себя небольшое количество противомикробного средства, которое не раздражает глаза у больных сухим кератоконъюнктивитом при неоднократном применении композиций к глазам в течение продолжительных периодов времени. Такое средство называют в тексте как «нераздражающее, приемлемое для глаз противомикробное средство». Его используют в количестве, достаточном для дальнейшего повышения противомикробной защитной эффективности композиций относительно уровня противомикробной активности, достигаемого одной буферной системой. Предпочтительным противомикробным средством является поликватерний-1. Концентрация поликватерния-1 будет составлять, в основном, приблизительно от 0,0001 до 0,001% мас./об., предпочтительно приблизительно 0,0005% мас./об. Композиции согласно настоящему изобретению не содержат бензалконийхлорид и поэтому могут быть названы как «ВАС-свободные».
Как указано выше, римексолон является относительно нерастворимым в воде. Поэтому, водные композиции согласно настоящему изобретению предпочтительно приготовляют в виде суспензий.
Римексолон является чрезвычайно гидрофобной молекулой и, следовательно, его трудно сохранять в суспендированном состоянии. Если римексолон не сохраняется в суспендированном виде, он выпадает в осадок, который не может быть вновь суспендирован при встряхивании контейнера. Эта проблема образования осадка часто встречается при использовании целлюлозных реагентов, таких как НРМС или НЕС, для суспендирования римексолона. Однако было показано, что образования осадка можно избежать путем использования поливинилпирролидона ("PVP") в качестве суспендирующего реагента. Полагают, что PVP взаимодействует с поверхностями частиц римексолона с образованием защитного слоя. Такое взаимодействие приводит к стерической стабилизации частиц в суспензии.
Было показано, что PVP не оказывает вредного воздействия на противомикробную активность поликватерния-1, который является полимерным четвертичным аммониевым основанием. Такая совместимость между PVP и поликватернием-1 позволяет использовать очень низкую концентрацию поликватерния-1 в защищающих композициях в виде множества доз согласно настоящему изобретению (например, предпочтительно 0,0005% мас./об.).
Учитывая описанные выше благоприятные свойства PVP, использование его как суспендирующего реагента является предпочтительным.
Требуемое количество суспендирующего реагента могут легко определить квалифицированные специалисты в данной области, но, в основном, это количество будет находиться в диапазоне приблизительно от 0,1 до 2,0% мас./об.
Композиции согласно настоящему изобретению предпочтительно также содержат неионное поверхностно-активное вещество в количестве от 0,01 до 0,2% мас./об. Многие из известных неионных поверхностно-активных веществ являются приемлемыми для местных глазных препаративных форм. Такие поверхностно-активные вещества включают: тилоксапол; полиэтиленгликолевые эфиры сорбита, такие как полисорбат 80, полисорбат 60 и полисорбат 20; полиэтоксилированные касторовые масла, такие как Кремофор EL; полиэтоксилированные гидрированные касторовые масла, такие как НСО-40; и полоксамеры. Предпочтительным поверхностно-активным веществом является тилоксапол при концентрации в области от 0,01 до 0,1%, предпочтительно 0,008%.
Композиции согласно настоящему изобретению изготавливают такими, чтобы они были изотоническими относительно природных слезных жидкостей. Поэтому изготавливают композиции такими, чтобы они имели осмотическое давление приблизительно от 280 до 320 миллиосмоль на килограмм воды (мОсм/кг). Если необходимо, композиции могут содержать приемлемые для глазных композиций реагенты, регулирующие изотоничность, такие как хлорид натрия, хлорид калия, глицерин, сорбит или маннит. Предпочтительным реагентом, регулирующим изотоничнисть, является хлорид натрия при концентрации в области от 0,4 до 0,6%, предпочтительно 0,6%.
Настоящее изобретение также направлено на предоставление способов лечения состояний, связанных с синдромом «сухого глаза». Способы включают местное нанесение глазной композиции типа, описанного выше, на пораженный глаз. Частота нанесения может несколько изменяться в зависимости от степени выраженности синдрома «сухого глаза», который подвергается лечению, но, в основном, будет составлять от двух до четырех раз в день (т.е. 24 часа).
Продолжительность терапии также может несколько изменяться от больного к больному, однако терапия будет продолжаться, в основном, в течение периода от нескольких недель (например, шесть или более недель) до нескольких месяцев (например, шесть или более месяцев). Вследствие ограниченного проникновения римексолона через роговицу и крайне низких концентраций римексолона, используемых в композициях согласно настоящему изобретению, представляется возможным использовать композиции согласно настоящему изобретению для хронического лечения синдрома «сухого глаза» с очень небольшим риском повышения внутриглазного давления, подавления глазного иммунного ответа или других побочных эффектов, которые ранее часто возникали при использовании кортикостероидов для глаз.
Композиции и способы согласно настоящему изобретению далее иллюстрированы следующими примерами.
Пример 1
Следующая композиция является образцом предпочтительных глазных композиций для местного применения согласно настоящему изобретению:
| Компонент | Сокращенное обозначение руководств регистрированных лекарственных форм | Концентрация (% мас./об.) |
| Римексолон | Незарегистрированный в руководстве лекарственных форм | 0,005-0,1 |
| Поликватерний-1 | Незарегистрированный в руководстве лекарственных форм | 0,0005 |
| Борная кислота | NF | 0,6 |
| Поливидон К90 | USP | 1,5 |
| Тилоксапол | USP | 0,008 |
| Хлорид натрия | USP | 0,5 |
| Маннит | USP | 0,2 |
| Трометамин | USP | 0,25 |
| Гидроокись натрия и/или соляная кислота | NFNF | рН доведен до 7,4±0,2 |
| Очищенная вода | USP | 100 |
Представленные выше композиции могут быть приготовлены, как описано ниже.
Отмеренное количество римексолона тонко измельчали, используя порцию определенного количества тилоксапола в качестве увлажняющего реагента и очищенную воду в качестве носителя в соответствующей шаровой мельнице или соответствующем оборудовании для тонкого измельчения.
В отдельный сосуд, содержащий очищенную воду (от 60 до 80°С), добавляли поливинилпирролидон и растворяли. Борную кислоту, маннит, хлорид натрия, трометамин и остаток раствора тилоксапола добавляли и растворяли в этом растворе. Полученный раствор охлаждали до комнатной температуры и рН доводили до 7,4, используя HCl и/или NaOH. К указанному раствору затем добавляли взвесь тонкоизмельченного римексолона, тилоксапол и очищенную воду. Полученную суспензию доводили до конечного веса и затем подвергали стерилизации паром, используя соответствующий цикл стерилизации. Суспензию охлаждали до комнатной температуры с последующим асептическим добавлением рассчитанного количества предварительно стерилизованного раствора поликватерния-1. В конце концов, вес суспензии доводили до определенной величины путем добавления очищенной воды.
Описанную выше консервированную композицию, состоящую из множества доз, оценивали относительно способности данной композиции соответствовать стандартам эффективности консервирования, приведенным в Фармакопее Соединенных Штатов ("USP") и Европейской Фармакопее ("EP"), и подобным стандартам. Было показано, что композиция удовлетворяет требованиям эффективности защиты USP и EP.
Пример 2
Оценивали способность римексолона в низких дозах облегчать состояния, связанные с синдромом «сухого глаза». Тестируемые композиции были такими же, как композиция, описанная в примере 1 выше, с концентрациями римексолона 0,005%, 0,01%, 0,05 и 0,1% соответственно. Экспериментальная процедура описана ниже.
Сухой кератоконъюнктивит вызывали у новозеландских белых кроликов (приблизительно 2 кг) путем создания билатерального воспаления слезных желез. Слезопродукцию оценивали путем измерения времени разрыва слезной пленки ("TBUT") ежедневно в течение трех дней после индукции сухого кератоконъюнктивита. Время TBUT определяли посредством вливания по каплям 5 мкл раствора флуоресцеина натрия в мешочек и закрытия вручную век для распределения флуоресцеина в слезной пленке. Наблюдения проводили с помощью щелевой лампы, глаз поддерживали открытым и время разрыва слезной пленки записывали. Эффективность определяли путем сравнения TBUT относительно исходных величин воспалительного состояния у животных, обработанных лекарственным средством и носителем.
В отдельной группе животных чувствительность к повреждению роговицы, вызванному обезвоживанием, оценивали после индукции воспаления слезной железы. Обезвоживание инициировали путем помещения кроликов в среду с низкой влажностью непрерывно вплоть до трех дней. Повреждение роговицы оценивали путем определения поглощения жизнеспособного красителя, метиленового голубого. В условиях обычной анестезии поверхность глаза обрабатывали 1% раствором метиленового голубого в течение пяти минут и затем промывали. Животных умерщвляли, глаза высекали и срезы роговицы 8 мм диаметром изолировали и экстрагировали в течение ночи. Концентрацию экстрагированного красителя определяли спектрофотометрически (А660). Защита роговицы выражается в меньшем поглощении красителя у животных, обработанных лекарственным средством, по сравнению с животными, обработанными носителем. Относительно определений TBUT и повреждения роговицы дозирование (QID) начинали за 24 часа до индуцирования воспаления и продолжали в течение периода исследования.
Результаты описанных выше исследований суммированы на фиг.1 и 2 соответственно. Композиции, содержащие низкие дозы римексолона, согласно настоящему изобретению оказались очень эффективными при каждой тестируемой концентрации. Максимально эффективная концентрация для восстановления TBUT, а также для предотвращения индуцированного высыханием окрашивания роговицы, составила 0,1%. Фиг.2 иллюстрирует влияние римексолона на чувствительность к индуцированному высыханием повреждению роговицы после воспаления слезной железы. Колоколообразную кривую зависимости доза-ответ наблюдали с максимальной эффективностью 74% ингибирования при концентрации 0,1%. Когда данные TBUT выражали в виде процента от исходной величины на третий день (фиг.1), зависимость доза-ответ для римексолона имела колоколообразный характер с максимумом (66% от исходной величины) при концентрации 0,1%. Полученные результаты указывают на то, что концентрация 0,1% является максимальной эффективной концентрацией.
Пример 3
Второй эксперимент по изучению зависимости доза-ответ осуществляли способами, описанными выше в примере 2. Результаты изучения суммированы на фиг.3 и 4.
Содержащие римексолон композиции примера 1 были весьма эффективными при каждой испытуемой концентрации. Максимально эффективная концентрация для восстановления TBUT, а также для предотвращения индуцированного обезвоживанием окрашивания роговицы, составила 0,1%. При концентрации 0,1%, римексолон тормозил окрашивание роговицы на 77% (фиг.4) и восстанавливал TBUT до 71% от исходной величины на третий день (фиг.3).
Пример 4
Клиническое исследование у больных людей проводили, чтобы оценить эффективность и безопасность применения римексолона для ослабления признаков и симптомов «сухого глаза» у больных с аутоиммунным диффузным заболеванием соединительной ткани. В данном исследовании использовали композицию, описанную в примере 1 выше. Три различные суспензии, содержащие римексолон при концентрациях 0,005%, 0,05% и 0,1% соответственно, использовали в данном изучении. Четвертая композиция, которая была идентична трем суспензиям с римексолоном за исключением удаленного римексолона, была использована в качестве контроля (т.е. плацебо). Количество больных, обрабатываемых каждой из композиций, было следующим:
| Композиция | Больные |
| 0,005% римексолона0,05% римексолона0,1% римексолонаНоситель/плацебо | 30262723 |
Больным в каждой группе вводили одну каплю соответствующей композиции в каждый глаз четыре раза в день в течение шести недель. В конце шестинедельного периода введения лекарственного средства оценивали симптомы у больного.
Результаты исследования показали, что у больных, которых обрабатывали содержащими римексолон суспензиями, было меньше симптомов «сухого глаза» (т.е. дискомфорта), чем у больных, обрабатываемых носителем/плацебо. Кроме того, у больных, которых обрабатывали суспензиями с римексолоном, не наблюдали существенных повышений внутриглазного давления.
1. Способ лечения хронических состояний, связанных с синдромом «сухого глаза», включающий нанесение терапевтически эффективного количества местной глазной композиции на роговицу пораженного глаза ежедневно в течение периода от нескольких недель до нескольких месяцев или более, содержащей глюкокортикоид римексолон, в концентрации от 0,001 до 0,1% мас./об.
2. Способ по п.1, в котором композиция содержит римексолон в концентрации менее чем 0,1% мас./об.
3. Способ по п.2, в котором композиция содержит римексолон в концентрации от 0,05 до 0,075% мас./об.
4. Способ по п.1, где композиция является консервированной композицией в виде множества доз.
5. Способ по п.4, в котором композиция является водной суспензией и дополнительно содержит количество поливинилпирролидона, достаточное для суспендирования римексолона.
6. Способ по п.5, в котором композиция также содержит эффективное количество консервирующего средства поликватерния-1.
7. Способ по п.6, в котором композиция содержит поликватерний-1 в концентрации от 0,0001 до 0,001% мас./об.
8. Способ по п.7, в котором композиция содержит поликватерний-1 в концентрации 0,0005% мас./об.
9. Способ по п.8, в котором композиция дополнительно содержит количество буферной системы, обладающей противомикробной активностью, которое усиливает противомикробное действие.
10. Способ по п.9, где буферная система содержит комплекс борат/многоатомный спирт.
11. Местная глазная композиция для лечения синдрома "сухого глаза", содержащая от 0,005 до 0,1% мас./об. римексолона и офтальмически приемлемый носитель.
12. Местная глазная композиция по п.11, которая представляет собой многодозовую суспензию и дополнительно содержит эффективное количество противомикробного консервирующего средства и количество поливинилпирролидона, достаточное для суспендирования римексолона в композиции.
13. Местная глазная композиция по п.11, которая содержит римексолон при концентрации от 0,05 до 0,075% мас./об.
14. Местная глазная композиция по п.13, которая содержит римексолон при концентрации 0,075% мас./об.
15. Местная глазная композиция по п.11, которая содержит римексолон в концентрации 0,1 мас./об.
16. Местная глазная композиция по п.12, в которой противомикробное консервирующее средство представляет собой поликватерний-1.
17. Местная глазная композиция по п.16, в которой концентрация поликватерния-1 в композиции составляет менее чем 0,001% мас./об.
18. Местная глазная композиция по п.17, в которой концентрация поликватерния-1 составляет 0,0005% мас./об.
19. Местная глазная композиция по п.18, которая дополнительно содержит количество буферной системы, обладающей противомикробной активностью, которое усиливает противомикробное действие.