Стабильный кристалл 4-оксохинолинового соединения
Иллюстрации
Показать всеНастоящее изобретение предоставляет кристалл 6-(3-хлор-2-фторбензил)-1-[(S)-1-гидроксиметил-2-метилпропил]-7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты, который имеет специфический рентгенодифракционный спектр с характеристическими дифракционными пиками при углах дифракции 2θ(°), что измерено на рентгенодифрактометре. Также описываются фармацевтическая композиция, обладающая активностью как ингибитор интегразы, ингибитор интегразы, антивирусное средство и анти-ВИЧ средство. Технический результат - кристалл настоящего изобретения является превосходным по физической и химической стабильности. 9 н. и 1 з.п. ф-лы, 8 табл., 2 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
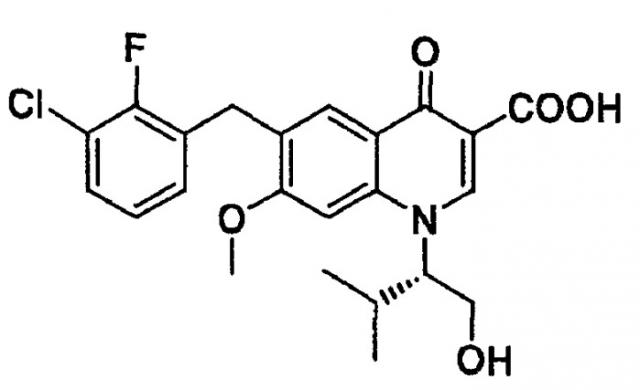
Настоящее изобретение относится к стабильному кристаллу 6-(3-хлор-2-фторбензил)-1-[(S)-1-гидроксиметил-2-метилпропил]-7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты
(в дальнейшем в этом документе это соединение обозначается иногда как соединение А) и смешанному кристаллу этого соединения. Настоящее изобретение также относится к фармацевтической композиции, включающей в свой состав кристалл или смешанный кристалл.
УРОВЕНЬ ТЕХНИКИ
Заявитель предоставил информацию в патенте № WO 2004/046115 (PCT/UP 2003/014773), зарегистрированном на того же самого Заявителя, о том, что вышеупомянутое соединение А обладает ингибирующим действием на интегразу, являющуюся внутренним необходимым ферментом для роста ВИЧ (вируса иммунодифицита человека), который вызывает вирусное заболевание СПИД (синдром приобретенного иммунодефицита), и проявляет анти-ВИЧ воздействие (в частности пример 4-32 и экспериментальный пример).
В общем, в том случае, если соединение применяется как фармацевтический продукт, то требуется его химическая и физическая стабильность, поскольку это обеспечивает качество и/или способствует сохранности. По этим же причинам требуется химическая и физическая стабильность не только для итоговой фармацевтической композиции, но также и для соединения, являющегося синтетическим исходным веществом.
Поэтому такое соединение предпочтительно должно быть кристаллом и особенно предпочтительно стабильным кристаллом. В том случае, если для соединения характерен кристаллический полиморфизм, то обычно выбирается наиболее стабильный кристалл.
Несмотря на то, что в случае вышеупомянутого применения описывалось соединение А, не было найдено определенного описания, имеющего отношение к кристаллической форме соединения А.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Таким образом, в настоящем изобретении изучены различные кристаллические формы соединения А. В результате установлено, что соединение А обладает кристаллическим полиморфизмом и изучен кристалл соединения А, имеющий специфическую кристаллическую форму стабильного кристалла, и на основе этого открытия сделано настоящее изобретение.
Таким образом, настоящее изобретение предоставляет следующее.
[1] кристалл (кристаллическая форма II) 6-(3-хлор-2-фторбензил)-1-[(S)-1-гидроксиметил-2-метилпропил]-7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты, для которого в рентгенодифракционном спектре имеются следующие характеристические дифракционные пики при углах дифракции 2θ (°) 6,56, 13,20, 19,86, 20,84, 21,22, 25,22°, что измерено на рентгенодифрактометре;
[2] кристалл (кристаллическая форма III) 6-(3-хлор-2-фторбензил)-1-[(S)-1-гидроксиметил-2-метилпропил]-7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты, для которого в рентгенодифракционном спектре имеются следующие характеристические дифракционные пики при углах дифракции 2θ (°) 8,54, 14,02, 15,68, 17,06, 17,24, 24,16, 25,74°, что измерено на рентгенодифрактометре;
[3] кристалл (кристаллическая форма III) 6-(3-хлор-2-фторбензил)-1-[(S)-1-гидроксиметил-2-метилпропил]-7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты, имеющий экстраполированную начальную температуру при 162,1±5,0°С;
[4] кристалл, относящийся к одному из вышеупомянутых с [1] по [3], для которого степень чистоты кристалла составляет не менее чем 70%;
[5] смешанный кристалл, включающий в свой состав кристалл, вышеупомянутый как [1], и кристалл, вышеупомянутый как [2] или [3];
[6] смешанный кристалл, вышеупомянутый как [5], в котором степень чистоты кристалла составляет не менее чем 70%;
[7] фармацевтическая композиция, включающая в свой состав какой-либо из вышеупомянутых кристаллов с [1] по [4] или смешанный кристалл из вышеупомянутых [5] или [6], и фармацевтически приемлемый носитель;
[8] ингибитор интегразы, включающий в свой состав какой-либо кристалл из вышеупомянутых с [1] по [4] или смешанный кристалл из вышеупомянутых [5] или [6] в качестве активного ингредиента;
[9] антивирусное средство, включающее в свой состав какой-либо кристалл из вышеупомянутых с [1] по [4] или смешанный кристалл из вышеупомянутых [5] или [6] в качестве активного ингредиента;
[10] анти-ВИЧ средство, включающее в свой состав какой-либо кристалл из вышеупомянутых с [1] по [4] или смешанный кристалл из вышеупомянутых [5] или [6] в качестве активного ингредиента;
[11] анти-ВИЧ средство, включающее в свой состав какой-либо кристалл из вышеупомянутых с [1] по [4] или смешанный кристалл из вышеупомянутых [5] или [6] и одно или несколько видов других анти-ВИЧ активных веществ в качестве активного ингредиента; и
[12] анти-ВИЧ средство для комплексной лекарственной терапии с другими анти-ВИЧ средствами, включающее в свой состав какой-либо кристалл из вышеупомянутых с [1] по [4] или смешанный кристалл из вышеупомянутых [5] или [6] в качестве активного ингредиента.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1 представляет собой комплексные данные спектров рентгенодифракции, где верхняя линия показывает спектр дифракции кристаллической формы III, средняя линия показывает спектр дифракции кристаллической формы I, нижняя линия показывает спектр дифракции кристаллической формы II, на вертикальной оси показана интенсивность дифракции (cps: counts per second - подсчет за секунду, интервалы на шкале составляют 2500 cps) и на перпендикулярной оси показаны углы дифракции 2θ (°).
Фиг.2 представляет собой комплексные данные спектров рентгенодифракции, полученные после хранения образца в течение 3 дней при тестировании на стабильность кристаллической формы I. Для сравнения самая верхняя линия показывает спектр дифракции (начальные условия) для кристаллической формы II, и самая нижняя линия показывает спектр дифракции (начальные условия) для кристаллической формы I. Вторая сверху линия и последующие показывают спектры дифракции образцов после хранения в условиях #6 (60°С/75% относительная влажность, открытый контейнер, хранение в течение 3 недель), после хранения в условиях #4 (60°С, контейнер с пробкой, хранение в течение 3 недель), после хранения в условиях #5 (60°С, открытый контейнер, хранение в течение 3 недель), после хранения в условиях #3 (80°С, открытый контейнер, хранение в течение 3 недель) и после хранения в условиях #2 (80°С, контейнер с пробкой, хранение в течение 3 недель). На вертикальной оси показана интенсивность дифракции (cps: counts per second - подсчет за секунду, интервалы на шкале составляют 2500 cps) и на перпендикулярной оси показаны углы дифракции 2θ (°).
ЭФФЕКТ ИЗОБРЕТЕНИЯ
Кристалл или смешанный кристалл соединения А настоящего изобретения имеет особую вышеупомянутую кристаллическую форму и является превосходным по физической и химической стабильности, что приводит к такому преимуществу, которое заключается в возможности сохранении качества соединения А в течение длительного времени, что и обеспечивает сохранность. В дополнение ко всему они имеют преимущество в том, что выдерживают технологическую обработку в процессе производства различных фармацевтических композиций и нерасфасованных лекарственных средств, что снижает стоимость продукции.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение детально объясняется ниже.
В настоящем изобретении «кристаллическая форма II» соединения А обозначает кристалл соединения А, в рентгенодифракционном спектре которого имеются характеристические пики следующих углов дифракции 2θ (°) 6,56, 13,20, 19,86, 20,84, 21,22, 25,22°, что измерено на рентгенодифрактометре.
В настоящем изобретении «кристаллическая форма III» соединения А обозначает кристалл соединения А, в рентгенодифракционном спектре которого имеются характеристические пики следующих углов дифракции 2θ (°) 8,54, 14,02, 15,68, 17,06, 17,24, 24,16, 25,74°, что измерено на рентгенодифрактометре.
Величина дифракционных пиков при вышеупомянутых дифракционных углах 2θ (°) может иметь небольшую ошибку измерений, обусловленную погрешностями измерительных приборов или условий измерения, или им подобными факторами. Конкретно ошибка измерений может быть в пределах ±0,2, предпочтительно ±0,1, более предпочтительно ±0,06.
Кристалл соединения А настоящего изобретения также охарактеризован термическим анализом. Например, в случае, когда кристаллическая форма III соединения А настоящего изобретения подвергается дифференциальной сканирующей калориметрии (ДСК), энтальпия эндотермического пика составляет 81 Дж/г, и имеет экстраполированную начальную температуру 162,1±5,0°С, предпочтительно 162,1±3,0°С, более предпочтительно 162,1±1,0°С, где «экстраполированная начальная температура» истолковывается как определено в JIS K 7121 (метод измерения температурного перехода пластмасс), температура на пересечении экстраполированной базовой линии, построенной от положения низшей температуры до положения с максимальной температурой, с касательной линией, проведенной в точке с наибольшим тангенсом угла наклона на подъемной стороне пика плавления при низшем температурном положении кривой ДСК. Когда энтальпия и экстраполированная начальная температура эндотермического пика находятся в пределах вышеупомянутого интервала, кристалл соединения А является стабильным.
Кристалл соединения А настоящего изобретения может быть либо в кристаллической форме II либо в кристаллической форме III, либо смешанным кристаллом кристаллической формы II и кристаллической формы III. Для использования в фармацевтическом продукте соединения А и в подобных продуктах кристаллическая форма II и кристаллическая форма III предпочтительны, потому что они являются стабильными кристаллами, и кристаллическая форма III наиболее предпочтительна, потому что она является наиболее стабильным кристаллом. Кроме того, кристаллическая форма II является предпочтительной с точки зрения абсорбционной способности живыми организмами при ее назначении для приема в качестве фармацевтической композиции.
В настоящем изобретении «чистота кристалла» обозначает чистоту кристаллической формы II или кристаллической формы III соединения А. В случае смешанного кристалла из кристаллической формы II и кристаллической формы III этот термин обозначает соотношение кристалла к общему количеству вещества кристаллической формы II и кристаллической формы III. Чистота кристалла настоящего изобретения может быть определена известными методами, например, такими как рентгенодифрактометрия, термический анализ и им подобными. Для чистоты кристалла или смешанного кристалла настоящего изобретения не требуется достижения величины 100%, она может быть не менее чем 70%, предпочтительно не менее чем 80%, более предпочтительно не менее чем 90%, еще более предпочтительно не менее чем 95%, и наиболее предпочтительно не менее чем 98%. Чистота в пределах этого интервала является предпочтительной для обеспечения качества.
Кристалл или смешанный кристалл соединения А настоящего изобретения может назначаться для приема млекопитающим (человек, мышь, крыса, хомяк, кролик, кот, собака, бык, овца, обезьяна и др.) и им подобным в виде различных фармацевтических композиций, таких как анти-ВИЧ средства, ингибиторы ВИЧ-интегразы, противовирусные средства и им подобные, используемые, например, для профилактики и/или лечения СПИДа.
В случае, если кристалл или смешанный кристалл соединения А настоящего изобретения применяется как фармацевтическая композиция, он смешивается с фармацевтически приемлемыми носителями, формообразующими наполнителями, разбавителями, увеличивающими объем, разжижающими средствами, дезинтегрирующими средствами, стабилизаторами, консервирующими веществами, буферными растворами, эмульгаторами, вкусовыми ароматизирующими веществами, окрашивающими веществами, подсластителями, загустителями, нейтрализующими средствами, разбавленными кислотами и другими добавками, которые в основном известны сами по себе, это вода, растительное масло, спирт (например, этанол или бензиловый спирт и др.), полиэтиленгликоль, триацетат глицерина, желатин, углеводы (например, лактоза, крахмал и т.п.), стеарат магния, тальк, ланолин, вазелин и им подобные, формируются таблетки, пилюли, порошки, гранулы, суппозитории, инъекционные формы, глазные капли, жидкие формы, капсулы, пастилки, аэрозоли, эликсиры, суспензии, эмульсии, сиропы и им подобные с использованием стандартного способа, и назначаются для общего или местного приема перорально или парентерально.
Поскольку доза изменяется в зависимости от возраста, массы тела, симптомов, лечебного эффекта, способа приема и им подобных факторов, она обычно составляет 0,01 мг на 1 г при назначении взрослым, и вводится за один или несколько раз в день перорально или в дозированной форме для инъекций, таких как внутривенные инъекции и им подобные.
От анти-ВИЧ средства обычно требуется поддерживание его действия в течение длительного времени, чтобы оно было эффективным не только для временного подавления вирусного роста, но также и для предотвращения возобновления роста вируса. Это означает, что пролонгированный прием необходим и что высокая однократная доза может часто быть обязательной для поддержания воздействия в течение длительного периода времени, в течение ночи или подобного периода. Такой пролонгированный прием лекарства в высоких дозах повышает риск побочных эффектов.
С этой точки зрения, одним из предпочтительных способов по настоящему изобретению является такой, когда обеспечивается высокая абсорбция при пероральном приеме, и такое соединение способно поддержать свою концентрацию в крови в течение длительного времени.
Для «профилактики СПИДа» подразумевается, например, назначение приема фармацевтического средства тому пациенту, у которого выявлен положительный ВИЧ-тест, но еще не развилось состояние болезни СПИД, назначение приема фармацевтического средства тому пациенту, у которого наблюдается улучшение состояния при заболевании СПИД после лечения, но который все еще является носителем ВИЧ и для которого существует риск вторичного заболевания СПИДом, и назначение приема фармацевтического средства при возможности инфицирования.
Анти-ВИЧ композиция настоящего изобретения применяется, например, для комплексной лекарственной комбинированной терапии СПИДа. Примеры «других анти-ВИЧ активных веществ», пригодных к применению для анти-ВИЧ композиции, включают анти-ВИЧ антитела, ВИЧ вакцину, такие иммуностимуляторы, как интерферон и ему подобные, ВИЧ рибозим, ВИЧ антисмысловое лекарство, ингибитор обратной транскриптазы ВИЧ, ингибитор протеазы ВИЧ, ингибиторы связывания между вирусом и рецепторами связывания (CD4, CXCR4, CCR5 и им подобными), распознаваемыми вирусом на заражаемой клетке (клетка-хозяин), и им подобные.
Конкретные примеры ингибитора обратной транскриптазы ВИЧ включают Ретровир(R) (зидовудин), Эпивир(R) (ламивудин), Зерит(R) (санилвудин), Видекс(R) (диданозин), Хивид(R) (зальцитабин), Зиаген(R) (абакавир сульфат), Вирамун(R) (невирапин), Стокрин(R) (эфавиренз), Рескриптор(R) (делавирдин мезилат), Комбивир(R) (зидовудин+ламивудин), Тризивир(R) (абакавир сульфат+ламивидин+зидовудин), Коактинон(R) (эмивирин), Фосфоновир(R), Ковирацил(R), аловудин (3'-фтор-3'-деокситимидин), Тиовир (тиофосфономуравьиная кислота), Каправирин (5-[(3,5-дихлорфенил)тио]-4-изопропил-1-(4-пиридилметил)имидазол-2-метанол карбаминовая кислота), Тенофовир дизопроксил фумарат ((R)-[[2-(6-амино-9Н-пурин-9-ил)-1-метилтэтокси]метил]фосфоновая кислота, сложный эфир бис(изопропоксикарбонилоксиметил)а фумаровой кислоты), DPC-083 ((4S)-6-хлор-4-[(1Е)-циклопропилэтенил]-3,4-дигидро-4-трифторметил-2(1Н)-хиназолинон), DPC-961 ((4S)-6-хлор-4-(циклопропилэтинил)-3,4-дигидро-4-(трифторметил)-2(1Н)-хиназолинон), DAPD ((-)-β-D-2,6-диаминопурин диоксолан), Иммунокал, MSK-055, MSA-254, MSH-143, NV-01, TMC-120, DPC-817, GS-7340, TMC-125, SPD-754, D-A4FC, каправирин, UC-781, эмтрицитабин, аловудин, Фосфазид, UC-781, BCH-10618, DPC-083, Этравирин, BCH-13520, MIV-210, Абакавир сульфат/ламивудин, GS-7340, GW-5634, GW-695634 и им подобные, где (R) обозначает зарегистрированную торговую марку (в дальнейшем в этом документе то же самое обозначение) и наименования других фармацевтических средств являются общепринятыми наименованиями.
Конкретные примеры ингибитора протеазы ВИЧ включают Криксиван(R) (индинавир сульфат этанолат), сахинавир, Инвирас(R) (сахинавир мезилат), Норвир(R) (ритонавир), Вирасепт(R) (нелфинавир мезилат), лопинавир, Прозей(R) (ампренавир), Калетра(R) (ритонавир+лопинавир), мозенавир димезилат ([4R-(4α,5α,6β)]-1,3-бис[(3-аминофенил)метил]-гексагидро-5,6-дигидрокси-4,7-бис(фенилметил)-2Н-1,3-диазепин-2-он диметансульфонат), типранавир (3'-[(1R)-1-[(6R)-5,6-дигидро-4-гидрокси-2-оксо-6-фенилэтил-6-пропил-2Н-пиран-3-ил]пропил]-5-(трифторметил)-2-пиридинсульфонамид), лазинавир (2-метоксиэтиленамид-N-[5(S)-(трет-бутоксикарбониламино)-4(S)-гидрокси-6-фенил-2(R)-(2,3,4-триметоксибензил)гексаноил]-L-валина), KNI-272 ((R)-N-трет-бутил-3-[(2S,3S)-2-гидрокси-3-N-[(R)-2-N-(изохинолин-5-илоксиацетил)амино-3-метилтиопропаноил]амино-4-фенилбутаноил]-5,5-диметил-1,3-тиазолидин-4-карбоксамид), GW-433908, TMC-126, DPC-681, бакминстерфуллерен, МК-944A (MK944 (N-(2(R)-гидрокси-1(S)-инданил)-2(R)-фенилметил-4(S)-гидрокси-5-[4-(2-бензо[b]фуранилметил)-2(S)-(трет-бутилкарбамоил)пиперазин-1-ил]пентанамид)+индинавир сульфат), JE-2147 ([2(S)-оксо-4-фенилметил-3(S)-[(2-метил-3-окси)фенилкарбониламино]-1-оксабутил]-4-[(2-метилфенил)метиламино]карбонил-4(R)-5,5-диметил-1,3-тиазол), BMS-232632 (диметиловый эфир (3S,8S,9S,12S)-3,12-бис(1,1-диметилэтил)-8-гидрокси-4,11-диоксо-9-(фенилметил)-6-[[4-(2-пиридинил)фенил]метил]-2,5,6,10,13-пентаазатетрадекандикарбоновой кислоты), DMP-850 ((4R,5S,6S,7R)-1-(3-амино-1Н-индазол-5-илметил)-4,7-дибензил-3-бутил-5,6-дигидроксипергидро-1,3-диазепин-2-он), DMP-851, RO-0334649, Nar-DG-35, R-944, VX-385, TMC-114, Типранавир, Фозампренавир натрий, Фозампренавир кальций, Дарунавир, GM-0385, R-944, RO-033-4649, AG-1859 и им подобные.
Ингибитор интегразы ВИЧ представлен примерами S-1360, L-870810 и им подобными, ингибитор ДНК полимеразы или ингибитор синтеза ДНК представлен примерами Фоскавир(R), ACH-126443 (L-2',3'-дидегидро-дидеокси-5-фторцитидин), энтекавир ((1S,3S,4S)-9-[4-гидрокси-3-(гидроксиметил)-2-метиленциклопентил]гуанин), каланолид А ([10R(10α,11β,12α)]-11,12-дигидро-12-гидрокси-6,6,10,11-тетраметил-4-пропил-2Н,6Н,10Н-бензо[1,2-b:3,4-b':5,6-b'']трипиран-2-он), каланолид В, NSC-674447 (1,1'-азобисформамид), Искадор (экстракт viscum alubm), Рубитекан и им подобными, анти-ВИЧ антисмысловое лекарство представлено примерами HGTV-43, GEM-92 и им подобными, противовирусные антитела к ВИЧ или другие антитела представлены примерами NM-01, PRO-367, KD-247, Цитолин(R), TNX-355 (антитело к CD4), AGT-1, PRO-140 (антитело к CCR5), Анти-CTLA-4Mab и им подобными, ВИЧ вакцина или другая вакцина представлены примерами ALVAC(R), AIDSVAX(R), Ремун(R), вакцина HIVgp41, вакцина HIVgp120, вакцина HIVgp140, вакцина HIVgp160, вакцина HIVp17, вакцина HIVp24, вакцина HIVp55, Альфавакс Вектор-Система, вакцина канапирокс gp160, АнтиТат, вакцина MVA-F6 Nef, вакцина HIVrev, C4-V3 пептид, p2249f, VIR-201, HGP-30W, TBC-3B, PARTICLE-3B и им подобными, Антиферон (вакцина интерферон-α) и им подобными, интерферон или агонист интерферона представлены примерами Сумиферон(R), МультиФерон(R), интерферон-τ, Ретикулоза, человеческий лейкоцитарный интерферон-α и им подобные, антагонист CCR5 представлен примерами SCH-351125 и ему подобными, фармацевтические средства, действующие на p24 ВИЧ представлены примерами GPG-NH2 (глицил-пролил-глицинамид) и ему подобными, ингибитор ВИЧ фузии представлен примерами FP-21399 (1,4-бис[3-[(2,4-дихлорфенил)карбониламино]-2-оксо-5,8-динатрийсульфонил]нафтил-2,5-диметоксифенил-1,4-дигидразон), Т-1249, Синтетическая Полимерная Конструкция No3, пентафузид, FP-21399, PRO-542, Энфувиртид и им подобными, IL-2 агонист или антагонист представлены примерами интерлейкин-2, Имунас(R), Пролейкин(R), Мультикин(R), Онтак(R) и им подобные, антагонист TNF-б представлен примерами Таломид(R) (талидомид), Ремикад(R) (инфликсимаб), курдлан сульфат, ингибитор α-гликозидазы представлен примерами Букаст(R) и ему подобными, ингибитор пуриннуклеозидфосфорилазы представлен примерами пелдецин (2-амино-4-оксо-3Н,5Н-7-[(3-пиридил)метил]пиррол[3,2-d]пиримидин) и ему подобными, агонист или ингибитор апоптоза представлен примерами Аркин Z(R), Панавир(R), Коэнзим Q10 (2-дека(3-метил-2-бутенилен)-5,6-диметокси-3-метил-пара-бензохинон) и им подобными, ингибитор холинэстеразы представлен примерами Когнекс(R) и ему подобными, и иммуномодулятор представлен примерами Имунокс(R), Прокин(R), Мет-энкефалин (6-де-L-аргинин-7-де-L-аргинин-8-де-L-валинамид-адренорфин), WF-10 (10 кратно разбавленный раствор тетрахлордекаоксида), Пертон, PRO-542, SCH-D, UK-427857, AMD-070, AK-602 и им подобными.
Кроме того, в качестве примеров представлены Нейротропин(R), Лидакол(R), Ансер 20(R), Амплиген(R), Антикорт(R), Инактивин(R) и им подобные, PRO-2000, ген Rev M10, специфичные к ВИЧ цитотоксические Т-клетки (CTL иммунотерапия, протокол ACTG 080 терапия, CD4-ζ генотерапия), SCA связывающий белок, RBC-CD4 комплекс, Мотексафин гадолиниум, GEM-92, CNI-1493, (±)-FTC, Ушерселл, D2S, БуферГель(R), ВиваГель(R), вагинальный гель Глиминокс, лаурилсульфат натрия, 2F5, 2F5/2G12, VRX-496, Ad5gag2, BG-777, IGIV-C, BILR-255 и им подобные.
Что касается «других веществ с анти-ВИЧ активностью», применяемых для анти-ВИЧ композиций настоящего изобретения в комплексной лекарственной комбинационной терапии, предпочтительным является ингибитор обратной транскриптазы ВИЧ и ингибитор протеазы ВИЧ. Два, три или большее число фармацевтических средств могут применяться в комбинации, в которой сочетание фармацевтических средств, имеющих различные механизмы действия, представляет собой предпочтительный пример осуществления изобретения. Кроме того, предпочтителен выбор фармацевтических средств без однотипного побочного эффекта.
Конкретные примеры комбинации фармацевтических средств включают комбинирование группы средств, содержащих в своем составе эфавиренз, тенофовир, эмтрицитабин, индинавир, нелфинавир, атазанавир, ритонавир+индинавир, ритонавир+лопинавир и ритонавир+сахинавир, диданозин+ламивудин, зидовудин+диданозин, ставудин+диданозин, зидовудин+ламивудин, ставудин+ламивудин и эмтрива, и кристалла или смешанного кристалла настоящего изобретения (Guidelines for the Use of Antiretroviral Agents in HIV-Infected Adults and Adolescents. August 13, 2001). Особенно предпочтительным является совместное применение двух средств: кристалла или смешанного кристалла настоящего изобретения с эфавирензом, индинавиром, нелфинавиром, тенофовиром, эмтрицитабином, зидовудином или ламивудином, или совместное применение трех средств: кристалла или смешанного кристалла настоящего изобретения с зидовудин + ламивудин, тенофовир + ламивудин, тенофовир + зидовудин, тенофовир + эфавиренз, тенофовир + нелфинавир, тенофовир + индинавир, тенофовир + эмтрицитабин, эмтрицитабин + ламивудин, эмтрицитабин + зидовудин, эмтрицитабин + эфавиренз, эмтрицитабин + нелфинавир, эмтрицитабин + индинавир, нелфинавир + ламивудин, нелфинавир + зидовудин, нелфинавир + эфавиренз, нелфинавир + индинавир, эфавиренз + ламивудин, эфавиренз + зидовудин или эфавиренз + индинавир.
Способ получения кристалла или смешанного кристалла соединения А настоящего изобретения не связан с особыми ограничениями, и кристалл может быть получен, по существу, известным способом или способами, представленными в нижеследующих примерах и им подобными.
ПРИМЕРЫ
Несмотря на то, что способ получения кристалла соединения А настоящего изобретения объясняется нижеследующими примерами, они носят рекомендательный характер и никоим образом не ограничивают настоящего изобретения.
Справочный пример 1: Получение кристаллической формы I соединения А
Стадия 1
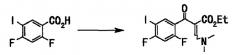
2,4-Дифторбензойную кислоту (50 г, 316 ммоль) растворяли в концентрированной серной кислоте (200 мл) и порциями добавляли N-иодсукцинимид (68 г, 300 ммоль) при температуре, не превышающей 5°С. После завершения добавления смесь перемешивали при той же температуре 4,5 часа. Реакционную смесь выливали в ледяную воду (приблизительно 600 мл), затем добавляли 10% водный раствор сульфита натрия, и смесь перемешивали. Выпавший твердый осадок отделяли фильтрованием, промывали водой и сушили в вакууме с получением неочищенных кристаллов (85 г). Неочищенные кристаллы, полученные подобным образом, объединяли (получали их общее количество 205 г) и перекристаллизовывали из 50% водного этанола (820 мл) с получением 2,4-дифтор-5-иодбензойной кислоты (148 г, выход 73%) в виде твердого вещества белого цвета.
1Н-ЯМР (CDCl3, 300 МГц) (σ) ммд: 6,94 (1Н, дд, J=10,3, 10,3 Гц), 8,46 (1Н, д, J=7,5 Гц).
Стадия 2
Соединение (148 г, 521 ммоль), полученное на стадии 1, растворяли в толуоле (750 мл), добавляли тионилхлорид (76 мл, 1,04 моль) и диметилформамид (каталитические количества), смесь нагревали с обратным холодильником в течение 2 часов. Нерастворившееся вещество отфильтровывали при 60°С, и фильтрат концентрировали при пониженном давлении и отгоняли азеотроп с толуолом (330 мл). Остаток растворяли в тетрагидрофуране (400 мл), и этот раствор по каплям добавляли к раствору этил-3,3-диметиламиноакрилата (82 г, 573 ммоль) и триэтиламина (87 мл, 625 ммоль) в тетрагидрофуране (400 мл), и смесь нагревали с обратным холодильником в течение 7 часов. Реакционную смесь оставляли для остывания до комнатной температуры и концентрировали при пониженном давлении. Добавляли воду (700 мл) и этилацетат (800 мл) для разделения. Органический слой последовательно промывали насыщенным водным раствором гидрокарбоната натрия (250 мл × 2), водой (300 мл) и насыщенным солевым раствором (300 мл) и сушили над сульфатом натрия. После отфильтровывания нерастворимого вещества фильтрат концентрировали при пониженном давлении с получением неочищенного вещества (210 г), этилового эфира 2-(2,4-дифтор-5-иодбензоил)-3-диметиламиноакриловой кислоты в виде твердого вещества коричневого цвета.
Стадия 3
Неочищенный продукт (210 г) со стадии 2 растворяли в тетрагидрофуране (500 мл), добавляли (S)-(+)-валинол (54 г, 521 ммоль), и смесь перемешивали при комнатной температуре 30 минут. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в диметилформамиде (600 мл). Добавляли карбонат калия (144 г, 1,04 моль) и смесь перемешивали при нагревании до 70°С в течение 2 часов. Реакционную смесь оставляли для остывания, добавляли к воде (1500 мл) и перемешивали. Выпавшее в осадок твердое вещество отделяли фильтрованием и полученное твердое вещество последовательно промывали 30% водным этанолом (500 мл) и смесью растворителей: диэтилового эфира (150 мл) и гексана (150 мл) и сушили в вакууме, получали этиловый эфир 7-фтор-1-((S)-1-гидроксиметил-2-метилпропил)-6-иод-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (178 г, выход 76%) в виде твердого вещества бежевого цвета.
1H ЯМР (ДМСО-d6 300 МГц) (δ) ммд: 0,72 (3H, д, J=6,6 Гц), 1,10 (3H, д, J=6,6 Гц), 1,28 (3H, т, J=7,0 Гц), 2,27 (1H, ушир.), 3,77 (1H, ушир.), 3,86 (1H, ушир.), 4,23 (2H, кв, J=7,0 Гц), 4,56 (1H, ушир.), 5,12 (1H, т, J=4,9 Гц), 8,09 (1H, д, J=11,1 Гц), 8,62 (1H, д, J=7,5 Гц), 8,68 (1H, с).
МС (ESI): M+ 448.
Стадия 4
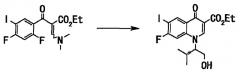
где TBDMS - трет-бутилдиметилсилильная группа.
Соединение (80 г, 179 ммоль), полученное на стадии 3, растворяли в диметилформамиде (320 мл), добавляли имидазол (16 г, 233 ммоль) и трет-бутилдиметилсилилхлорид (30 г, 197 ммоль), и смесь перемешивали при комнатной температуре в течение 1,5 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой последовательно промывали насыщенным водным раствором хлорида аммония и насыщенным солевым раствором и сушили над сульфатом натрия. Органический слой отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (этилацетат:гексан = 1:3 до 1:2) с получением этилового эфира 1-((S)-1-трет-бутилдиметилсилилоксиметил-2-метилпропил)-7-фтор-6-иод-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (77 г, выход 77%) в виде бесцветного вещества в аморфной форме.
1H ЯМР (CDCl3 400 МГц) (δ) ммд: -0,07 (3H, с), -0,05 (3H, с), 0,77 (9H, с), 0,84 (3H, д, J=6,5 Гц), 1,18 (3H, д, J=6,5 Гц), 1,40 (3H, т, J=7,2 Гц), 2,35-2,50 (1H, м), 3,85-3,95 (1H, м), 3,98-4,10 (2H, м), 4,30-4,40 (2H, м), 7,26 (1H,с), 8,64 (1H, с), 8,94 (1H, д, J=7,2 Гц).
МС (ESI): M+ 562.
Стадия 5
(Приготовление раствора 3-хлор-2-фторбензилцинкбромида в тетрагидрофуране)
В токе аргона цинковый порошок (11 г, 267 ммоль) суспендировали в тетрагидрофуране (30 мл), добавляли 1,2-дибромэтан (0,15 мл, 1,8 ммоль) и триметилсилилхлорид (0,45 мл, 3,6 ммоль) при 65°С, и смесь перемешивали при нагревании в течение 30 минут. По каплям добавляли раствор 3-хлор-2-фторбензилбромида (41 г, 178 ммоль) в тетрагидрофуране (100 мл) при 65°С, и смесь перемешивали при нагревании 2 часа, и оставляли для охлаждения до комнатной температуры, получали 1М раствор 3-хлор-2-фторбензилцинкбромида в тетрагидрофуране. Этот раствор применяли на последующей основной стадии.
(Основная стадия)
Соединение (76 г, 136 ммоль), полученное на стадии 4, растворяли в тетрагидрофуране (600 мл), и в токе аргона добавляли дибензилиденацетонпалладий (II) (3,2 г, 5,5 ммоль) и трифурилфосфин (2,6 г, 11,0 ммоль), и по каплям добавляли вышеупомянутый раствор 1М 3-хлор-2-фторбензилцинкбромид в тетрагидрофуране (178 мл, 178 ммоль) при 60°С. После завершения прикапывания смесь перемешивали с нагреванием до той же температуры в течение 2 часов. Реакционную смесь оставляли для охлаждения до комнатной температуры, добавляли насыщенный водный раствор хлорида амммония, и фильтровали смесь через целит. Фильтрат дважды экстрагировали этилацетатом. Органический слой последовательно промывали водой (дважды) и насыщенным солевым раствором и сушили над сульфатом магния. Органический слой отфильтровывали и фильтрат концентрировали при пониженном давлении, и полученный остаток очищали хроматографией на силикагеле (хлороформ:ацетон = 40:1) с получением этилового эфира 1-((S)-1-трет-бутилдиметилсилилоксиметил-2-метилпропил)-6-(3-хлор-2-фторбензил)-7-фтор-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (68 г, выход 84%) в виде бесцветного вещества в аморфной форме.
1H ЯМР (CDCl3 400 МГц) (δ) ммд: -0,09 (3H, с), -0,05 (3H, с), 0,75 (9H, с), 0,85 (3H, д, J=6,7 Гц), 1,18 (3H, д, 6,7 Гц), 1,39 (3H, т, J=7,1 Гц), 2,45 (1H, ушир.), 3,89-3,92 (1H, м), 3,98-4,02 (1H, м), 4,07-4,12 (1H, м), 4,12 (2H, с), 4,34-4,41 (2H, м), 6,96-7,00 (1H, м), 7,03-7,05 (1H, м), 7,21-7,24 (1H, м), 7,26-7,29 (1H, м), 8,39 (1H, д, J=8,8 Гц), 8,63 (1H, с).
Стадия 6
Соединение (48 г, 86 ммоль), полученное на стадии 5, растворяли в метаноле (300 мл), добавляли воду (5 мл) и 28% метанольный раствор метоксида натрия (176 мл, 862 ммоль), и смесь нагревали с обратным холодильником в течение 24 часов. Реакционную смесь оставляли для охлаждения до комнатной температуры, и смесь нейтрализовали добавлением 6 н. соляной кислоты. Метанол упаривали при пониженном давлении. К полученному раствору добавляли воду и смесь перемешивали. Выпавшее в осадок твердое вещество отделяли фильтрованием, полученное твердое вещество растворяли в этилацетате. Смесь промывали водой, сушили над сульфатом натрия. Раствор фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток перекристаллизовывали из смеси растворителей этилацетат-гексан с получением соединения (32 г, выход 86%) в виде твердого вещества белого цвета. Полученное соединение (32 г) растворяли в бутилацетате (160 мл) при нагревании с обратным холодильником, и кристаллическая форма II была введена как затравка при 75°С. Смесь перемешивали 3,5 часа по мере того, как она остывала. Выпавший осадок отделяли фильтрованием, промывали бутилацетатом (25 мл) и сушили в вакууме с получением соединения (25 г, выход 77%) в виде твердого вещества белого цвета. Полученное соединение (4,0 г) растворяли в метаноле (40 мл) при нагревании с обратным холодильником до 50°С и добавляли по каплям в воду (40 мл) комнатной температуры. Смесь перемешивали при комнатной температуре 16 часов, отфильтровывали, и оставшееся твердое вещество промывали 66% водным метанолом, сушили в вакууме, получали кристалл соединения А (кристаллическая форма I) (3,9 г, выход 97%) в виде твердого вещества белого цвета.
Т.пл. 151-152°С
1H ЯМР (ДМСО-d6 300 МГц) (δ) ммд: 0,72 (3H, д, J=6,5 Гц), 1,16 (3H, д, J=6,5 Гц), 2,30-2,50 (1H, м), 3,70-3,90 (1H, м), 3,90-4,00 (1H, м), 4,03 (3H, с), 4,12 (2H,с), 4,80-4,90 (1H, м), 5,19 (1H, т), 7,19-7,25 (2H, м), 7,46-7,51 (2H, м), 8,04 (1H, с), 8,88 (1H, с), 15,44 (1H, с).
МС (ESI): M+ 448.
Пример 1: Получение кристаллической формы II соединения А
Стадия 1
2,4-Дифторбензойную кислоту (50 г, 316 ммоль) растворяли в концентрированной серной кислоте (200 мл), и порциями добавляли N-иодсукцинимид (68 г, 300 ммоль) при температуре, не превышающей 5°С. После завершения добавления смесь перемешивали при той же температуре 4,5 часа. Реакционную смесь выливали в ледяную воду (приблизительно 600 мл), затем добавляли 10% водный раствор сульфита натрия, и смесь перемешивали. Выпавший твердый осадок отделяли фильтрованием, промывали водой и сушили в вакууме с получением неочищенных кристаллов (85 г). Неочищенные кристаллы, полученные подобным образом, объединяли (получали их общее количество 205 г) и перекристаллизовывали из 50% водного этанола (820 мл) с получением 2,4-дифтор-5-иодбензойной кислоты (148 г, выход 73%) в виде твердого вещества белого цвета.
1H ЯМР (CDCl3 300 МГц) (σ) ммд: 6,94 (1H, дд, J=10,3, 10,3 Гц), 8,46 (1H, д, J=7,5 Гц).
Стадия 2
Соединение (148 г, 521 ммоль), полученное на стадии 1, растворяли в толуоле (750 мл), добавляли тионилхлорид (76 мл, 1,04 моль) и диметилформамид (каталитические количества), смесь нагревали с обратным холодильником в течение 2 часов. Нерастворившееся вещество отфильтровывали при 60°С, и фильтрат концентрировали при пониженном давлении, и отгоняли азеотроп с толуолом (330 мл). Остаток растворяли в тетрагидрофуране (400 мл), и этот раствор по каплям добавляли к раствору этил-3,3-диметиламиноакрилата (82 г, 573 ммоль) и триэтиламина (87 мл, 625 ммоль) в тетрагидрофуране (400 мл), и смесь нагревали с обратным холодильником в течение 7 часов. Реакционную смесь оставляли для остывания до комнатной температуры и концентрировали при пониженном давлении. Добавляли воду (700 мл) и этилацетат (800 мл) оставляли для разделения. Органический слой последовательно промывали дважды насыщенным водным раствором гидрокарбоната натрия (250 мл), водой (300 мл) и насыщенным солевым раствором (300 мл) и сушили над сульфатом натрия. Смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного вещества (210 г), этилового эфира 2-(2,4-дифтор-5-иодбензоил)-3-диметиламиноакриловой кислоты в виде твердого вещества коричневого цвета.
Стадия 3
Неочищенный продукт (210 г), полученный на стадии 2, растворяли в тетрагидрофуране (500 мл), добавляли (S)-(+)-валинол (54 г, 521 ммоль), и смесь перемешивали при комнатной температуре 30 минут. Реакционную смесь концентрировали при пониженном давлении, и остаток растворяли в диметилформамиде (600 мл). Добавляли карбонат калия (144 г, 1,04 моль), и смесь перемешивали при нагревании до 70°С в течение 2 часов. Реакционную смесь оставляли для охлаждения до комнатной температуры, добавляли к воде (1500 мл), и смесь перемешивали. Выпавшее в осадок твердое вещество отделяли фильтрованием. Полученное твердое вещество последовательно промывали 30% водным этанолом (500 мл) и смесью растворителей: диэтилового эфира (150 мл) и гексана (150 мл) и сушили в вакууме, получали этиловый эфир 7-фтор-1-((S)-1-гидроксиметил-2-метилпропил)-6-иод-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (178 г, выход 76% (относительно стадии 2)) в виде твердого вещества бежевого цвета.
1H ЯМР (ДМСО-d6 300 МГц) (δ) ммд: 0,72 (3H, д, J=6,6 Гц), 1,10 (3H, д, J=6,6 Гц), 1,28 (3H, т, J=7,0 Гц), 2,27 (1H, ушир.), 3,77 (1H, ушир.), 3,86 (1H, ушир.), 4,23 (2H, кв, J=7,0 Гц), 4,56 (1H, ушир.), 5,12 (1H, т, J=4,9 Гц), 8,09 (1H, д, J=11,1 Гц), 8,62 (1H, д, J=7,5 Гц), 8,68 (1H, с).
МС (ESI): M+ 448.
Стадия 4
Соединение (150 г, 335 ммоль), полученное на стадии 3, растворяли в диметилформамиде (500 мл), добавляли имидазол (30 г, 436 ммоль) и трет-бутилдиметилсилилхлорид (56 г, 369 ммоль), и смесь перемешивали при комнатной температуре в течение 1,5 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой последовательно промывали насыщенным водным раствором хлорида аммония и насыщенным солевым раствором и сушили над сульфатом натрия. Органический слой отфильтровывали и фильтрат концентрировали при пониженном давлении, и полученный остаток очищали хроматографией на силикагеле (этилацетат:гексан = 1:3