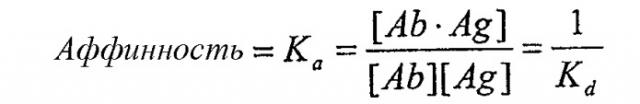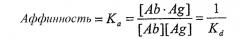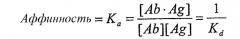Антитела к ростовому фактору соединительной ткани
Иллюстрации
Показать всеИзобретение относится к антителам, которые связываются с CTGF. Антитела, в частности, направлены на области CTGF, участвующие в различных видах биологической активности, связанной с фиброзом. Изобретение также относится к способам применения антител в составе фармацевтических композиций для лечения расстройств, связанных с CTGF, включая локализованные и системные фибротические расстройства, в том числе расстройства легких, печени, сердца, кожи и почек, для осуществления способа нейтрализации биологической активности CTGF и способа лечения или профилактики заболеваний, связанных с CTGF. Изобретение охватывает полинуклеотидную последовательность и ее варианты, кодирующую указанное антитело, а также клетку-хозяин и клеточную линию №РТА-6006 (АТСС), продуцирующие указанное антитело. Использование изобретения обеспечит новыми специфическими средствами - антителами, которые эффективно нейтрализуют конкретные виды активности CTGF при патологии и обеспечивают специфичность и фармакинетический профиль, подходящий для терапевтического средства. 12 н. и 69 з.п. ф-лы, 12 ил., 4 табл.
Реферат
Эта заявка испрашивает приоритет предварительной заявки на патент США № 60/475598, поданной 4 июня 2003 г., приведенной здесь в качестве ссылки в полном объеме.
Область, к которой относится изобретение
Настоящее изобретение относится к антителам, которые связываются с фактором роста соединительной ткани (CTGF). Эти антитела в частности направлены на области CTGF, вовлеченные в биологическую активность, связанную с различными заболеваниями.
Предпосылки изобретения
Фактор роста соединительной ткани (CTGF)
CTGF представляет собой богатый цистеином связывающий гепарин, секретируемый гликопротеид с молекулярной массой 36 кДа, первоначально выделенный из культуральной среды эндотелиальных клеток пупочной вены человека (см. например, Bradham et al. (1991) J Cell Biol 114:1285-1294; Grotendorst and Bradham, патент США № 5408040). CTGF относится к семейству белков CCN (CTGF, Cyr61, Nov) (секретируемых гликопротеидов), к которому относится индуцируемый сывороткой ранний генный продукт Cyr61, предполагаемый онкоген Nov, связанный с ECM белок FISP-12, src-индуцибельный ген CEF-10, Wnt-индуцибельный секретируемый белок WISP-3 и антипролиферативный белок HICP/rCOP (Brigstock (1999) Endocr. Rev. 20: 189-206; O'Brian et al. (1990) Mol. Cell Biol., 10: 3569-3577; Joliot et al. (1992) Mol Cell Biol., 12: 10-21; Ryseck et al. (1990) Cell Growth and Diff., 2: 225-233; Simmons et al. (1989) Proc. Natl. Acad. Sci. USA, 86: 1178-1182; Pennica et al. (1998) Proc. Natl. Acad. Sci. USA, 95: 14717-14722; и Zhang et al. (1998) Mol. Cell Biol., 18: 6131-61416). Белки CCN отличаются тем, что у них консервативны 38 цистеиновых остатков, которые составляют более 10% общего содержания аминокислот и обеспечивают возникновение модулярной структуры с N- и C-концевыми доменами. Модулярная структура CTGF включает консервативные мотивы для белка, связывающего подобный инсулину фактор роста (IGF-BP), и фактора фон Виллебранда (VWC) в N-концевом домене и тромбоспондин (TSP1) и мотив цистеинового узла в С-концевом домене.
Экспрессия CTGF индуцируется членами суперсемейства трансформирующего фактора роста бета (TGFβ), которое включает TGFβ-1, -2 и -3, костный морфогенетический белок (ВМР)-2 и активин, а также различными другими регуляторными модуляторами, включая дексаметазон, тромбин, сосудистый эндотелиальный фактор роста (VEGF) и ангиотензин II; и стимулами окружающей среды, включая гипергликемию и гипертонию (см. например, Franklin (1997) Int. J. Biochem. Cell Biol., 29: 79-89; Wunderlich (2000) Graefes Arch. Clin. Exp. Ophthalmol, 238: 910-915; Denton and Abraham (2001) Curr. Opin. Rheumatol, 13: 505-511 и Riewald (2001) Blood, 97: 3109-3116; Riser et al. (2000) J. Am. Soc. Nephrol, 11: 25-38 и международную публикацию WO 00/13706). Стимуляция экспрессии CTGF под действием TGFβ является быстрой и длительной и не требует продолжительного применения (Igarashi et al. (1993) Mol. Biol. Cell, 4:637-645). Усиленная экспрессия CTGF TGFβ включает транскрипционную активацию посредством регуляторных элементов ДНК, присутствующих в промотере CTGF (Grotendorst et al. (1996) Cell Growth Differ, 7: 469-480; Grotendorst and Bradham, патент США №6069006; Holmes et al. (2001) J. Biol. Chem., 276: 10594-10601).
Было показано, что CTGF увеличивает стационарную транскрипцию коллагена α1 (I), интегрина α5 и мРНК фибронектина, а также промотирует клеточные процессы, включая пролиферацию и хемотаксис различных типов клеток в культуре (см. например, Frazier et al. (1996) J. Invest. Dermatol., 107: 406-411; Shi-wen et al. (2000) Exp. Cell Res., 259: 213-224; Klagsburn (1997) Exp. Cell Res., 105: 99-108; Gupta et al. (2000) J. Kidney Int., 58: 1389-1399; Wahab et al. (2001) Biochem. J., 359 (Pt 1): 77-87; Uzel et al (2001) J. Periodontol., 72: 921-931 и Riser and Cortes (2001) Ren. Fail., 23: 459-470). Подкожная инъекция CTGF новорожденным мышам приводит к местному отложению грануляционной ткани. Аналогичным образом подкожная инъекция TGFβ генерирует формирование грануляционной ткани и вызывает высокие уровни мРНК CTGF в местных фибробластах. Более того, комбинированное или последовательное лечение TGFβ и CTGF приводит к развитию более стойкой гранулемы (Mori et al. (1999) J. Cell Physiol., 181: 153-159). Таким образом, представляется, что CTGF опосредует подгруппу эффектов, вызываемых TGFβ, в частности, продукцию и отложение внеклеточного матрикса (ЕСМ). Кроме того, способность реагировать на CTGF или степень реакции на CTGF может зависеть от стимула примирования, обеспечиваемого обработкой TGFβ, что обеспечивает возможность клеточной "компетентности" (Международная публикация WO 96/08140).
Хотя было охарактеризовано множество взаимодействующих факторов, которые модулируют тканевую организацию, в настоящее время появляется согласие в отношении роли CTGF в регуляции развития скелета, заживлении ран и перестройке внеклеточного матрикса (ЕСМ), фиброзе, развитии опухолей и ангиогенезе. Например, повышенная экспрессия CTGF наблюдалась в печени при циррозе, при пневмосклерозе, воспалительных кишечных заболеваниях, в склеротической коже и келоидах, при десмоплазии и атеросклеротических бляшках (Abraham et al. (2000) J. Biol. Chem., 275: 15220-15225; Dammeier et al. (1998) Ind. J. Biochem. Cell Biol., 30: 909-922; diMola et al. (1999) Ann. Surg. 230(1): 63-71; Igarashi et al. (1996) J. Invest. Dermatol., 106: 729-733; Ito et al. (1998) Kedney Int., 53: 853-861; Williams et al. (2000) J. Hepatol., 32: 754-761; Clarkson et al (1999) Curr. Opin. Nephrol. Hypertens, 8: 543-548; Hinton et al. (2002) Eye, 16: 422-428; Gupta et al. (2000) Kidney Int., 58: 1389-1399; Riser et al. (2000) J. Am. Soc. Nephrol., 11: 25-38).
Стимулирующая регуляция CTGF также происходит при гломерулонефрите, нефропатии, вызванной IgA, очаговом и сегментарном гломерулосклерозе и диабетической нефропатии (см. например, Riser et al. (2000) J. Am. Soc. Nephrol., 11: 25-38). Увеличение количества клеток, экспрессирующих CTGF, также наблюдается в участках хронического канальцево-интерстициального повреждения, и уровни CTGF коррелируют со степенью повреждения (Ito et al. (1998) Kidney Int., 53: 853-861). Кроме того, экспрессия CTGF увеличивается в клубочках и интерстиции канальцев при различных почечных заболеваниях в связи с рубцеванием и склерозом почечной паренхимы. Повышенные уровни CTGF также связаны с фиброзом печени, инфарктом миокарда и пневмосклерозом. Например, у пациентов с идиопатическим пневмосклерозом (IPF) наблюдается сильная стимулирующая регуляция CTGF в биопсиях и клетках жидкости бронхоальвеолярного лаважа (Ujike et al. (2000) Biochem. Biophys. Res. Commun., 277: 448-454; Abou-Shady et al. (2000) Liver, 20: 296-304; Williams et al. (2000) J. Hepatol., 32: 754-761; Ohnishi et al. (1998) J. Mol. Cell Cardiol., 30: 2411-22; Lasky et al. (1998) Am. J. Physiol., 275: L365-371; Pan et al. (2001) Eur. Respir. J., 17: 1220-1227 и Allen et al. (1999) Am. J. Respir. Cell Mol. Biol., 21: 693-700). Таким образом, CTGF является обоснованной мишенью при лечении расстройств, таких как описанные выше.
Была установлена связь CTGF с различными аспектами этих расстройств, и были описаны способы лечения расстройств посредством модуляции CTGF (см. например, Grotendorst and Bradham, патент США № 5783187; Международная публикация № WO 00/13706; и Международная публикация № WO 03/049773). Модуляцию факторов роста, цитокинов и рецепторов клеточной поверхности можно осуществить, используя моноклональные антитела, и несколько терапевтических антител были разрешены к применению или находятся в процессе разработки (см. например, Infliximab (Remicade; Maini et al. (1998) Arthritis Rheum., 41: 1552-1563; Targan et al. (1997) N. Engl. J. Med., 337: 1029-1035); Basiliximab (Simulect) and Daclizumab (Zenapax) (Bumgardner et al. (2001) Transplantation, 72: 839-845; Kovarik et al. (1999) Transplantation, 68: 1288-1294); и Transtuzumab (Herceptin; Baselga (2001) Ann. Oncol., 12 Suppl. 1: S49-55)).
Были генерированы антитела против CTGF, и они оказались эффективными in vivo, например, ингибируя ангиогенез (см. например, Grotendorst and Bradham, патент США № 5408040; международная публикация WO 99/07407 и Shimo et al. (2001) Oncology 61:315-322). Кроме того, оказалось, что модулярная природа CTGF различает домены, участвующие в специфических видах биологической активности. Например, было показано, что N-концевая половина CTGF стимулирует клеточную дифференциацию и продукцию ЕСМ, тогда как С-концевая половина стимулирует клеточную пролиферацию (см. например, Международные публикации WO 00/35936 и WO 00/35939; Brigstock and Harding, патент США № 587670). Это демонстрирует, что антитела, направленные на различные области молекулы CTGF, проявляют различные эффекты в отношении модулирования видов биологической активности CTGF (см. например, Международные публикации WO 00/35936 и WO 00/35939). К настоящему времени не было установлено четкого различия между антителами против CTGF, которые продуцируют желательный эффект, и антителами, которые или продуцируют множественные эффекты, или являются ненейтрализующими (см. например, Международную публикацию WO 99/33878).
Существует явная необходимость в данной области в средствах, которые эффективно нейтрализуют активность CTGF при патологии. Антитела, в частности моноклональные антитела, обеспечивают специфичность и фармакокинетический профиль, подходящий для терапевтического средства, и нейтрализующие антитела, нацеленные на конкретные виды активности CTGF, удовлетворили бы потребность в данной области и могли бы найти применение в терапевтическом лечении связанных с CTGF расстройств, включая легочные расстройства, такие как идиопатический пневмосклероз (IPF) и т.д.; почечные расстройства, такие как диабетическая нефропатия, гломерулосклероз и т.д.; и глазные расстройства, такие как ретинопатия, дегенерация желтого пятна и т.д.
Краткое изложение сущности изобретения
Настоящее изобретение относится к антителам, в частности к моноклональным антителам, и их частям, которые специфически связываются с областью на N-концевом фрагменте полипептида CTGF.
В одном из аспектов антитело по изобретению специфически связывается с областью человеческого CTGF (SEQ ID NO:2), что соответствует аминокислотам от примерно 103 до примерно 164 (SEQ ID NO:21); более конкретно, от аминокислоты примерно 135 до примерно аминокислоты 157 (SEQ ID NO:22) и, еще более конкретно, от примерно аминокислоты 142 до примерно аминокислоты 154 (SEQ ID NO:25); или ортологичной областью CTGF, полученного от другого вида. В определенных вариантах осуществления изобретения антитело имеет такую же специфичность, что и антитело, продуцируемое клеточной линией, обозначенной номером доступа в АТСС (Американской коллекции типовых культур) РТА-6006 (депонирована в АТСС 20 мая 2004 г.). В определенных вариантах осуществления изобретения антитело по существу идентично mAb1, как описано ниже. Предпочтительнее антитело по существу аналогично CLN1, как описано ниже. В еще одном варианте осуществления антитело по изобретению конкурентно связывается с любым из указанных выше антител к полипептиду CTGF.
В одном варианте осуществления настоящее изобретение относится к моноклональному антителу или его части, содержащим по меньшей мере один член группы, состоящей из последовательности тяжелой цепи иммуноглобулина, включающей SEQ ID NO:14, последовательности тяжелой цепи иммуноглобулина, включающей вариабельный домен SEQ ID NO:14, последовательности легкой цепи иммуноглобулина, включающей SEQ ID NO:20, последовательности легкой цепи иммуноглобулина, включающей вариабельный домен SEQ ID NO:20, или их консервативных вариантов. В определенном варианте осуществления антитело содержит вариабельный домен тяжелой цепи иммуноглобулина от аминокислотного остатка 1 до аминокислотного остатка 167 SEQ ID NO:14. В другом определенном варианте осуществления антитело содержит вариабельный домен легкой цепи иммуноглобулина от аминокислотного остатка 1 до аминокислотного остатка 136 SEQ ID NO:20. В конкретном варианте осуществления антитело содержит последовательность тяжелой цепи иммуноглобулина SEQ ID NO:14 и последовательность легкой цепи иммуноглобулина SEQ ID NO:20. В пределах этого варианта осуществления настоящее изобретение, в частности, относится к антителу CLN1 или его части, содержащей по меньшей мере остатки связывающей антиген области CLN1.
В определенных аспектах антитело по изобретению представляет собой поликлональное антитело. В других аспектах антитело представляет собой моноклональное антитело. В определенных вариантах осуществления изобретения антитело представляет собой гуманизированное моноклональное антитело, более предпочтительно человеческое моноклональное антитело. Любое из указанных выше антител может дополнительно иметь различную степень гликозилирования, что осуществляется клеткой, продуцирующей антитело, или применяется и/или модифицируется синтетически; или антитело может быть лишено гликозилирования. Антитело может быть необязательно пегилировано и/или модифицировано аналогичным образом для увеличения периода полувыведения из плазмы и т.д. В различных вариантах осуществления изобретение относится к фрагментам антитела, особенно когда фрагмент представляет собой фрагмент Fab, F(ab)2 или Fv.
В определенных аспектах антитело или его часть продуцируется клонированной клеточной линией. Клеточная линия может быть получена из любой модели на животных, используемой для продукции моноклонального антитела, включая, но не ограничиваясь этим, мышей, коз, кур и т.д. В частности клеточная линия может быть получена у мышей. Мыши могут являться стандартными мышами, используемыми для продукции антител, например, BALB/C, или модифицированной, например, трансгенной мышиной линии, оптимизированной или разработанной для продукции специфического изотипа, идиотипа или видоспецифических моноклональных антител. В одном варианте осуществления изобретения клеточная линия является линией клеток гибридомы, которая продуцирует и секретирует mAb1. В других вариантах осуществления линия клеток продуцирует и секретирует антитело или его часть, которые имеют свойство, по существу эквивалентное mAb1. В еще одних вариантах осуществления линия клеток продуцирует и секретирует антитело или его часть, которые имеют свойство, по существу эквивалентное CLN1. В конкретном варианте осуществления изобретение относится к линии клеток, обозначенной номером доступа в АТСС РТА-6006 (депонирована 20 мая 2004 г.).
В соответствии с другим аспектом изобретения антитело или его часть получены у трансгенного животного, отличного от человека, в частности трансгенного млекопитающего, отличного от человека, способного продуцировать человеческое антитело. Животное может быть любого вида, включая, но не ограничиваясь этим, мышь, курицу, корову, козу и т.д. В частности животное может представлять собой мышь. Такие антитела могут быть получены иммунизацией трансгенного млекопитающего, отличного от человека, фрагментом человеческого CTGF, например, SEQ ID NO:21 или, более конкретно, SEQ ID NO:22, или к ортологичной области CTGF, полученного от видов, отличных от человека. В определенных вариантах осуществления изобретения антитела получают иммунизацией трансгенного млекопитающего, отличного от человека, фрагментом CTGF, выбранным из группы, состоящей из последовательностей с SEQ ID NO:23 по SEQ ID NO:26, или к ортологичной области CTGF, полученного от видов, отличных от человека. В определенных вариантах осуществления антитела получены иммунизацией трансгенной мыши любым из указанных выше фрагментов. В других вариантах осуществления антитела получены иммунизацией трансгенной мыши функциональными эквивалентами любого из указанных выше фрагментов CTGF.
Термин "специфически связывается с областью CTGF" подразумевает, что антитела имеют специфичность связывания к определенной области CTGF, которая может быть определена первичной аминокислотной последовательностью или третичной, т.е. трехмерной, конформацией части полипептида CTGF. Специфичность связывания означает, что аффинность антител к части CTGF по существу больше, чем их аффинность к другим родственным полипептидам. Под термином "по существу большей аффинностью" заявители подразумевают, что имеется измеримое увеличение аффинности к части CTGF по сравнению с аффинностью к другим родственным полипептидам. Предпочтительно аффинность по меньшей мере в 1,5 раз, 2 раза, 5 раз, 10 раз, 100 раз, 103 раз, 104 раз, 105 раз, 106 раз больше к определенной части CTGF, чем к другим белкам. Предпочтительно специфичность связывания определяется с помощью аффинной хроматографии, иммунопреципитации или анализа связывания in vitro, такого как радиоиммуноанализ (RIA) или иммуноферментный анализ (ELISA), или анализ сортировки клеток с активацией флуоресценции (FASC). Более предпочтительно специфичность связывания определяется с помощью RIA или аффинной хроматографии, как описано ниже.
В предпочтительных вариантах осуществления изобретения антитела имеют аффинность, которая равна или больше, чем аффинность mAb1, описанная ниже, как определено, например, анализом Скэтчарда Munson and Pollard (1980, Anal Biochem 107:220). Аффинность антитела определяется как сила всех нековалентных взаимодействий между одним антигенсвязывающим сайтом антитела и одним эпитопом антигена. Аффинность рассчитывается путем измерения константы ассоциации (Ka), так что
где [Ab] представляет собой концентрацию свободного антигенсвязывающего сайта антитела, [Ag] представляет собой концентрацию свободного антигена, [Ab·Ag] представляет собой концентрацию антигенсвязывающего сайта антитела, занятого антигеном, и Kd представляет собой константу диссоциации комплекса антитело-антиген. Предпочтительно антитела по изобретению имеют аффинность к CTGF, которая больше чем Kd=10-8, предпочтительно больше чем 10-9, предпочтительно больше чем 10-10, особенно для терапевтического применения. Преимущественно антитело в соответствии с изобретением имеет аффинность, аналогичную или большую, чем аффинность mAb1 (то есть Kd-9). Однако антитела, разделяющие эпитоп, связывающийся с mAb1, но имеющие более низкую аффинность (т.е. более высокое значение Kd), чем mAb1, также входят в объем изобретения и могут потенциально использоваться в различных анализах и диагностических видах применения, как описано в настоящем описании. Такие антитела могут дополнительно использоваться в терапевтических видах применения, особенно если они обладают высокой авидностью к антигену, как описано ниже.
Антитела в соответствии с изобретением могут быть одновалентными, двухвалентными или они могут быть многовалентными. В определенных вариантах осуществления изобретения предпочтительно, чтобы антитела по изобретению были двухвалентными или многовалентными. Любыми антителами по изобретению можно манипулировать для улучшения авидности, например, объединением связывающих эпитоп сайтов в один конструкт антитела, например, тритело, и т.д. Антитела в соответствии с изобретением могут представлять собой одноцепочечные антитела.
В некоторых случаях может быть полезно, чтобы антитела по изобретению проявляли подходящую аффинность к CTGF от других видов, например, для лечения и предотвращения расстройств у этих видов. Например, антитело по изобретению, которое проявляет подходящий Kd к собачьему CTGF, можно использовать для лечения связанного с CTGF расстройства у собак. Антитела по изобретению, которые проявляют перекрестно-видовую аффинность, такие как mAb1, также можно использовать в качестве инструментов исследования для изучения связанных с CTGF расстройств на различных моделях у животных. В другом аспекте антитело или его часть кодируется генетическим материалом, первоначально полученным у человека. Антитело может быть генерировано клетками в культуре, например, с использованием техники фагового дисплея, или оно может продуцироваться у животного, например, трансгенного животного, отличного от человека, содержащего гены иммуноглобулина, полученные у человека.
Кроме того, изобретение относится к рекомбинантным конструктам, содержащим части любых антител по изобретению, как описано выше, и белок, полученный из другого источника. Конкретно предусмотрены варианты осуществления, охватывающие химерные антитела, содержащие вариабельную область, полученную из моноклонального антитела, которое специфически связывается с областью на N-концевом фрагменте CTGF, и константную область, полученную из другого источника. Вариабельная область может быть получена из любого антитела, определенного изобретением, и, в частности, охватываются антитела, которые связываются с областью человеческого CTGF от примерно аминокислоты 97 до примерно аминокислоты 180 SEQ ID NO:2, или, более конкретно, от примерно аминокислоты 103 до примерно аминокислоты 164 SEQ ID NO:2, или, более конкретно, от примерно аминокислоты 134 до примерно аминокислоты 158 SEQ ID NO:2, или, еще более конкретно, от примерно аминокислоты 143 до примерно аминокислоты 154 SEQ ID NO:2, или к ортологичной области CTGF, полученного от другого вида. Константная область может быть получена из любого источника. В некоторых вариантах осуществления константную область получают из константной области человеческого иммуноглобулина.
Настоящее изобретение также относится к любому из описанных выше антител, где антитело дополнительно включает метку, способную обеспечить выявляемый сигнал, одно или вместе с другими веществами. Такие средства, осуществляющие мечение, могут быть выбраны из группы, состоящей из фермента, флуоресцентного вещества, хемилюминесцентого вещества, биотина, авидина и радиоактивного изотопа, но не ограничиваются ими. Настоящее изобретение также относится к любому из описанных выше антител, где антитело дополнительно включает цитотоксическое средство или фермент.
В других вариантах осуществления изобретения описанные выше антитела по изобретению дополнительно нейтрализуют по меньшей мере одну активность, связанную с CTGF. Такие виды активности, связанные с CTGF, включают, но не ограничиваются этим, стимуляцию клеточной миграции, продукцию внеклеточного матрикса клеткой in vivo или ex vivo и/или уменьшение фиброза у индивидуума. В конкретных вариантах осуществления биологическая активность выбрана из группы, состоящей из клеточного роста, дифференциации фибробластов и/или эндотелиальных клеток и индукции экспрессии белков, участвующих в формировании и перестройке внеклеточного матрикса, включая, например, коллагены, включающие, но не ограничивающиеся ими, типы I, II, III и IV, и фибронектин.
В определенных вариантах осуществления изобретения антитела специфически ингибируют миграцию клеток в анализах ex vivo. Предпочтительно антитела ингибируют стимулированную CTGF миграцию гладкомышечных клеток в анализе в камере Boyden. Например, в анализе миграции клеток, описанном ниже, антитела по изобретению повторно и воспроизводимо ингибируют вызванную CTGF миграцию. В различных вариантах осуществления антитела специфически уменьшают фиброз в случае моделей на животных. Предпочтительно антитела ингибируют развитие в случае моделей на животных пневмосклероза и фиброза почек. Например, антитела ослабляют вызванный блеомицином пневмосклероз у мышей на 60-70%, как было определено путем ингибирования легочного накопления гидроксипролина (коллагена) и/или гистологического исследования препаратов ткани, описанных ниже. Кроме того, антитела уменьшают накопление коллагена в случае модели остатка почки крысы (т.е. после нефрэктомии на 5/6) и у мышей после односторонней обструкции мочеточника (UUO), как описано ниже.
В других вариантах осуществления антитела по изобретению модулируют взаимодействие между полипептидом CTGF и секретируемым или ассоциированным с мембраной кофактором, нейтрализуя посредством этого биологическую активность CTGF. Кофактор может представлять собой любой белок, углеводород и/или липид; в определенных вариантах осуществления кофактором является член семейства ростовых факторов TGF-β, ВМР-4 и т.д.
В другом аспекте антитело уменьшает фиброз у субстанции. В различных вариантах осуществления субстанция представляет собой ткань или орган. В другом варианте осуществления субстанцией является животное, предпочтительно млекопитающее, наиболее предпочтительно человек. Когда субстанция представляет собой ткань, изобретение, в частности, предусматривает как эндогенные ткани, так и ткани ex vivo, например ткани трансплантата, ткань, выращенную в культуре и т.д. В различных вариантах осуществления ткань выбрана из группы, состоящей из эпителиальной, эндотелиальной и соединительной ткани. Когда субстанция представляет собой орган, изобретение, в частности, предусматривает органы, выбранные из группы, включающей почку, легкое, печень, глаз, сердце и кожу. В предпочтительных вариантах осуществления субстанцией является животное, в частности животное вида млекопитающих, включая вид крыс, кроликов, коров, овец, свиней, мышей, лошадей и приматов. В самом предпочтительном варианте осуществления субстанцией является человек.
В определенных вариантах осуществления изобретения антитело используется для лечения или профилактики связанного с CTGF расстройства у субъекта, у которого есть связанное с CTGF расстройство или риск его развития. Такие расстройства включают, но не ограничиваются этим, различные виды рака, включая острый лимфобластический лейкоз, дерматофибромы, рак молочной железы, глиому и глиобластому, рабдомиосаркому и фибросаркому, десмоплазию, ангиолипому, ангиолейомиому, десмопластические формы рака и рост и метастазы рака предстательной железы, яичников, толстой и прямой кишки, поджелудочной железы, желудочно-кишечного тракта и печени и других опухолей. Связанные с CTGF расстройства также включают различные фибротические расстройства, включая, но не ограничиваясь этим, идиопатический пневмосклероз, фиброз почек, гломерулосклероз, глазной фиброз, остеоартрит, склеродермию, сердечный фиброз и фиброз печени. Фиброз может возникнуть в любом органе или ткани, включая орган, выбранный из почки, легкого, печени, сердца и кожи, но не ограничиваясь ими; или в ткани, выбранной из эпителиальной, эндотелиальной и соединительной ткани, но не ограничиваясь ими. В других вариантах осуществления связанное с CTGF расстройство может быть вызвано любым инициирующим фактором, включая, но не ограничиваясь этим, контакт с химическими веществами или биологическими агентами, воспалительную реакцию, аутоиммунную реакцию, травму, хирургические процедуры и т.д. Связанные с CTGF расстройства также включают, но не ограничиваются этим, расстройства вследствие гипергликемии и гипертонии. Такие расстройства могут возникнуть, например, вследствие сахарного диабета, ожирения и т.д., и включают диабетическую нефропатию, ретинопатию и сердечно-сосудистые заболевания.
Поэтому в различных вариантах осуществления изобретение относится к антителам, которые могут использоваться для лечения или профилактики связанных с CTGF расстройств у индивидуума. Настоящее изобретение также относится к применению таких антител при изготовлении лекарственного средства для лечения связанных с CTGF расстройств.
В другом аспекте изобретение относится к способу нейтрализации активности, связанной с CTGF, включающему контактирование антитела по изобретению и полипептида CTGF, нейтрализуя посредством этого биологическую активность CTGF, такую как виды активности, описанные выше. Биологическая активность может представлять собой любую активность CTGF, включая, но не ограничиваясь этим, стимуляцию миграции клеток и продукцию внеклеточного матрикса. В различных вариантах осуществления нейтрализация происходит in vitro. В других вариантах осуществления нейтрализация происходит у индивидуума in vivo.
В еще одном аспекте изобретение относится к способам применения антитела, как описано выше, для лечения связанного с CTGF расстройства у нуждающегося в нем пациента, где способ включает введение антитела или его фармацевтической композиции пациенту, осуществляя посредством этого лечение расстройства. Индивидуум может представлять собой пациента с диагностированным или предполагаемым связанным с CTGF расстройством, включая, например, расстройство, возникающее в результате избыточной продукции внеклеточного матрикса. В определенных аспектах связанное с CTGF расстройство выбрано из рака или фибротического расстройства. Виды рака включают, но не ограничиваются этим, острый лимфобластический лейкоз, дерматофибромы, рак молочной железы, карциному молочной железы, глиому и глиобластому, рабдомиосаркому и фибросаркому, десмоплазию, ангиолипому, ангиолейомиому, десмопластические формы рака и рак предстательной железы, яичников, толстой и прямой кишки, поджелудочной железы, желудочно-кишечного тракта и печени, и фибротические расстройства включают, но не ограничиваются этим, идиопатический пневмосклероз, фиброз почек, гломерулосклероз, глазной фиброз, дегенерацию желтого пятна, остеоартрит, склеродермию, хроническую сердечную недостаточность, сердечный фиброз и фиброз печени. В других вариантах осуществления связанное с CTGF расстройство может быть вызвано любым инициирующим фактором, включая, но не ограничиваясь этим, контакт с химическими веществами или биологическими агентами, воспалительную реакцию, аутоиммунную реакцию, травму, хирургические процедуры и т.д. Связанные с CTGF расстройства также включают, но не ограничиваются этим, расстройства вследствие гипергликемии и гипертонии. Такие расстройства могут возникнуть, например, вследствие сахарного диабета, ожирения и т.д., и включают диабетическую нефропатию, ретинопатию и сердечно-сосудистые заболевания.
В другом аспекте настоящее изобретение относится к композиции, содержащей антитело, как описано выше, и по меньшей мере один другой компонент. Компоненты могут включать любое соединение, молекулу или вещество, включая, например, белки, нуклеиновые кислоты, углеводороды, липиды и т.д. Кроме того, компоненты могут включать различные растворители, соли и другие носители и/или эксципиенты. В некоторых вариантах осуществления композиция представляет собой фармацевтическую композицию, содержащую антитело, как описано выше, и по меньшей мере один дополнительный компонент, выбранный из растворителя, стабилизатора или эксципиента. В определенном варианте осуществления фармацевтическая композиция включает антитело в смеси с фармацевтически приемлемым носителем. Фармацевтическая композиция может дополнительно содержать второе терапевтическое средство, например ингибитор ангиотензин-превращающего фермента (АСЕ), средство для расщепления или ингибирования конечного продукта гликирования и т.д. Изобретение, кроме того, относится к лекарственным средствам, содержащим антитело, как определено выше, для лечения индивидуума, имеющего связанное с CTGF расстройство. Такие расстройства включают, но не ограничиваются этим, различные формы рака и фибротические расстройства; расстройства, возникающие в результате таких состояний, как инфаркт миокарда, артрит и воспаление; и расстройства вследствие сахарного диабета, ожирения и им подобных, которые могут включать диабетическую нефропатию, ретинопатию и сердечно-сосудистые заболевания.
В другом варианте осуществления изобретение относится к полипептидной последовательности, выбранной из группы, состоящей из SEQ ID NO:14, аминокислот 1-167 SEQ ID NO:14, SEQ ID NO:20, и аминокислот 1-136 SEQ ID NO:20. Изобретение также охватывает консервативные варианты полипептидов. В другом варианте осуществления изобретение относится к специфическим фрагментам CTGF человека, выбранным из группы, состоящей из последовательностей от SEQ ID NO:21 до SEQ ID NO:26, и ортологичным фрагментам CTGF, полученным от видов, отличных от человека.
Указанные выше полипептиды могут представлять собой "измененные" полипептиды, как определено ниже.
В другом варианте осуществления изобретение относится к полинуклеотидной последовательности, кодирующей антитело по изобретению, или его часть. В определенных вариантах осуществления изобретения полинуклеотидная последовательность выбрана из группы, состоящей из полинуклеотидной последовательности, кодирующей SEQ ID NO:14, полинуклеотидной последовательности, кодирующей аминокислоты 1-167 SEQ ID NO:14, полинуклеотидной последовательности SEQ ID NO:13, и полинуклеотида, включающего нуклеотиды 1-501 SEQ ID NO:13. В другом варианте осуществления полинуклеотидная последовательность выбрана из группы, состоящей из полинуклеотидной последовательности, кодирующей SEQ ID NO:20, полинуклеотидной последовательности, кодирующей аминокислоты 1-136 SEQ ID NO:20, полинуклеотида SEQ ID NO:19, и полинуклеотида, включающего нуклеотиды 1-408 SEQ ID NO:19.
Указанные выше полинуклеотиды могут представлять собой "измененные" полинуклеотиды, как определено ниже.
Изобретение, кроме того, относится к рекомбинантным полинуклеотидам, содержащим любую из полинуклеотидных последовательностей, описанных выше, операбельно связанных с последовательностью вектора, которая содержит последовательности регулировки репликации и траскрипции. В одном из аспектов рекомбинантный полинуклеотид кодирует аминокислотную последовательность SEQ ID NO:14 или вариабельный домен в ней. В другом аспекте рекомбинантный полинуклеотид включает SEQ ID NO:13. В еще одном аспекте рекомбинантный полинуклеотид кодирует аминокислотную последовательность SEQ ID NO:20 или вариабельный домен в ней. В еще одном аспекте рекомбинантный полинуклеотид включает SEQ ID NO:19.
Изобретение также относится к клеткам-хозяевам, трансфецированным по меньшей мере одним из описанных выше рекомбинантных полинуклеотидов. Клетки-хозяева включают любую прокариотическую и эукариотическую клетку-хозяина, включая, например, клонированные клеточные линии, поддерживаемые способами культивирования, известными специалистам в данной области. Клетки-хозяева также включают трансгенные растения и животных, полученных из трансформированных клеток, например, стволовых клеток. В одном варианте осуществления клетка-хозяин включает клетку, совместно трансфецированную полинуклеотидом, кодирующим SEQ ID NO:14, и полинуклеотидом, кодирующим SEQ ID NO:20, и которая продуцирует функциональное антитело с характеристиками, по существу такими же как у mAb1. В определенных вариантах осуществления изобретения антитело представляет собой CLN1. В другом конкретном варианте осуществления клетка-хозяин обозначена номером доступа в АТСС РТА-6006 (депонирована 20 мая 2004 г.).
Эти и другие варианты осуществления настоящего изобретения будут легко понятны специалистам в данной области в свете представленного описания, и все такие варианты осуществления конкретно предусмотрены настоящим изобретением.
Краткое описание чертежей
На фиг.1А и 1В показано, что структура и последовательности фактора роста соединительной ткани сохраняются. На фиг.1А показана модулярная структура домена CTGF, который включает консервативные мотивы для белка, связывающего подобный инсулину фактор роста (IGF-BP), и фактора фон Виллебранда (VWC) в N-концевом фрагменте и мотив тромбоспондина (TSP1) и узла цистеина (СТ) в С-концевом фрагменте. На фиг.1В показано упорядочение множественных последовательностей между N-концевыми фрагментами ортологов человеческого (hCTGF), коровьего (bCTGF), свиного (pCTGF), крысиного (rCTGF) и мышиного (FIPS12)CTGF. Упорядочение было создано с использованием программы CLUSTAL W (версия 1.74; Thompson et al. (1994) Nucleic Acids Res., 22: 4673-4680) с использованием параметров по умолчанию. На чертеже звездочка (*) показывает полное сохранение аминокислотного остатка среди представленных видов.
На фиг.2А и 2В показаны графики Скэтчарда конкурентного связывания между меченым и немеченым человеческим CTGF соответственно с антителами против CTGF, mAb2 и mAb1. mAb1 представляет собой иллюстративное антитело по настоящему изобретению.
На фиг.3А показан фрагмент антитела Fab (Mr 45 кДа), полученный после расщепления папаином соответствующего IgG антитела mAb1 и последующей аффинной хроматографии на белке А-сефарозе (полоса 2), что было показано с помощью SDS-PAGE (электрофореза в полиакриламидном геле с додецилсульфатом натрия). На фиг.3В показано связывание фрагмента Fab и соответствующего IgG с CTGF в зависимости от увеличивающейся концентрации хаотропного агента (тиоцианата).
На фиг.4А и 4В показаны графики Скэтчарда конкурентного связывания между меченым рекомбинантным человеческим CTGF и немеченым крысиным CTGF соответственно с антителами против CTGF, mAb2 и mAb1.
На фиг.5А, 5В и 5С представлены терапевтические благоприятные эффекты антитела по изобретению в случае модели интерстициального фиброза в легком. На фиг.5А показан эффект лечения антителом в случае вызванного блеомицином увеличения содержания гидроксипролина в легких мышей. Количество животных в каждой группе показано в скобках под каждым столбцом, а группы лечения указаны по оси х. SA: солевой раствор; BL: блеомицин; AbsJ: пул из 3 моноклональных антител по изобретению; mAb1, иллюстративное антитело по изобретению. Величины выражены в виде средней величины ± SE (стандартная ошибка). На фиг.5В и 5С показаны окрашенные гематоксилином и эозином парафиновые срезы легочных проксимальных ацинусов от мышей, подвергнутых воздействию блеомицина при внутритрахеальной инъекции, и последующему лечению соответственно солевым раствором или антителами по изобретению. На фиг.5В тонкие межальвеолярные перегородки аци